Перейти к:
ПРОИЗВОДСТВО КРИОПРЕЦИПИТАТА В РОССИИ: ПРОШЛОЕ, НАСТОЯЩЕЕ И БУДУЩЕЕ
https://doi.org/10.35754/0234-5730-2019-64-1-16-20
Аннотация
Цель: определить динамику выпуска криопреципитата организациями службы крови России и сравнить ее с практикой службы крови других стран.
Материалы и методы. Изучены отчеты служб крови России с 1997 по 2017 годы, европейские нормативы заготовки и переливания крови. Результаты. В 1997–2004 гг. количество выпущенных ежегодно доз криопреципитата колебалось от 263 897 (2000 год) до 297 890 (2002 год) доз. В течение 8 последующих лет количество выпущенных ежегодно доз криопреципитата сокращалось, достигнув исторического минимума в 2012 году — 23 663 дозы. С 2012 по 2017 г. количество ежегодно выдаваемых доз криопреципитата выросло на 80,0 % (до 42 589 доз). Определены причины волнообразной динамики производства криопреципитата в России, а также пути расширения использования этого основного средства коррекции гипофибриногенемии.
Заключение. Необходимо вернуть криопреципитат в арсенал производственной и клинической трансфузиологии, создать российские клинические рекомендации по применению криопреципитата. До разработки национальных рекомендаций оптимально создать правила назначения криопреципитата в каждой организации.
Ключевые слова
Для цитирования:
Жибурт Е.Б., Чемоданов И.Г., Шестаков Е.А. ПРОИЗВОДСТВО КРИОПРЕЦИПИТАТА В РОССИИ: ПРОШЛОЕ, НАСТОЯЩЕЕ И БУДУЩЕЕ. Гематология и трансфузиология. 2019;64(1):16-20. https://doi.org/10.35754/0234-5730-2019-64-1-16-20
For citation:
Zhiburt E.B., Chemodanov I.G., Shestakov E.A. CRYOPRECIPITATE PRODUCTION IN RUSSIA: PAST, PRESENT AND FUTURE. Russian journal of hematology and transfusiology. 2019;64(1):16-20. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-16-20
Введение
Криопреципитат получают, размораживая свежезамороженную плазму (СЗП) при температуре от 1 до 6 °С, которую затем центрифугируют, ресуспендируют осажденные белки в плазме и повторно замораживают. Эта составляющая плазмы содержит основное количество фактора VIII и фибриногена. Также криопреципитат содержит фактор Виллебранда, фактор XIII и фибронектин [1].
Криопреципитат был предложен J.G Pool в 1965 г. для лечения больных гемофилией А [2]. С появлением препаратов фактора VIII криопреципитат все реже применяют для больных гемофилией. Основное современное направление использования криопреципитата — в качестве источника фибриногена. Также криопреципитат используют для коррекции дефицита фактора Виллебранда и дефицита фактора XIII.
Цель: определить динамику выпуска криопреципитата организациями службы крови России, сопоставить ее с практикой службы крови других развитых стран.
Материалы и методы
Изучены отчеты служб крови России [2—12] и США [13], европейские нормативы заготовки и переливания крови [14, 15].
Результаты и обсуждение
В 1997—2004 гг. количество выпущенных ежегодно доз криопреципитата колебалось от 263 897 (2000 год) до 297 890 (2002 год) доз. В течение 8 последующих лет количество выпущенных ежегодно доз криопреципитата сокращалось, достигнув исторического минимума в 2012 году — 23 663 дозы (рис. 1).
С 2012 по 2017 г. количество ежегодно выдаваемых доз криопреципитата выросло на 80,0 % (до 42 589 доз) (рис. 1).
Обсуждение
Можно выделить несколько причин снижения выпуска и потребления криопреципитата:
- 1991—2009 гг. криопреципитат в России ошибочно классифицировали как лекарственный препарат, требующий соответствующей лицензии на производство лекарственных средств (что практически невозможно для организации, лицензированной только для медицинской деятельности) [16];
- с 2005 г. все российские больные гемофилией обеспечены лекарственными концентратами факторов свертывания крови [17, 18];
- в нормативных документах дозу криопреципитата рекомендовано рассчитывать по концентрации фактора VIII [19, 20], не принимая в расчет концентрацию фибриногена.
С 2012 по 2017 г. количество ежегодно выдаваемых доз криопреципитата выросло на 80,0 % (до 42 589 доз) (рис. 1). Можно выделить несколько причин увеличения выпуска и потребления криопреципитата:
- в 2010 г. криопреципитат реквалифицирован как компонент крови [21], который могут выпускать все организации, имеющие лицензию на медицинскую деятельность по заготовке крови;
- появляется все больше данных о ключевой роли фибриногена в патогенезе коагулопатии у больных с массивной кровопотерей [22];
- в отсутствие концентрата фибриногена криопреципитат является средством выбора коррекции гипофибриногенемии [23].
В Национальном медико-хирургическом центре имени Н.И. Пирогова больным с кровотечением и концентрацией фибриногена менее 1 г/л вводят 5 доз крио - преципитата с последующим клинико-лабораторным мониторингом [1].
Согласно Европейским рекомендациям по лечению массивных кровотечений и коагулопатий при травме [24], пострадавшим с массивным кровотечением и доказанным снижением концентрации фибриногена плазмы менее 1,5-2,0 г/л или дефицитом функциональ - ного фибриногена, подтвержденным с помощью вискоэластичных методов (тромбоэластометрии, тромбоэла- стографии), рекомендуется вводить 3-4 г концентрата фибриногена или 15-20 доз криопреципитата.
Столь множественное донорское воздействие на реципиента побудило службу крови Великобритании [15] внедрить в практику пулированный патогенреду- цированный лейкодеплецированный криопреципитат. Его готовят из 6 доз лейкодеплецированной плазмы, патогенредуцированной метиленовым синим. Конечный его объем составляет от 100 до 300 мл, содержание фибриногена — более 700 мг. При этом донор должен жить в государстве, где не зарегистрирована болезнь Крейтцфельдта — Якоба, быть мужчиной либо женщиной, в крови которых отсутствуют HLA/HNA-антитела.
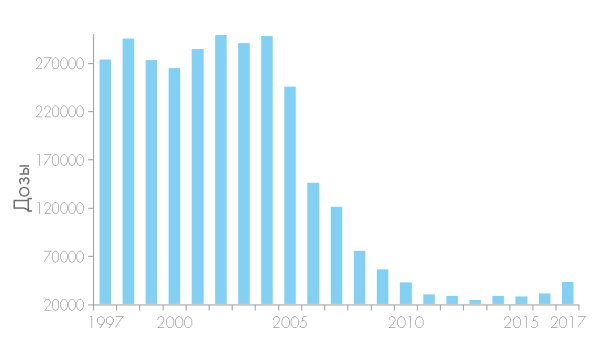
Рисунок 1. Ежегодная выдача криопреципитата Службой крови России
Figure 1. Annual production of cryoprecipitate by Russian blood service institutions
В Европе допустимо выделять криопреципитат как из патогенредуцированной, так и из необработанной плазмы. При этом отмечают, что инактивация патогенов обычно снижает риск передачи оболочечных вирусов, например ВИЧ, вирусов гепатитов В и С, в десять тысяч раз [14].
С 2013 по 2015 гг. количество выданных в клиники США доз криопреципитата выросло на 89,9 % (с 978 до 1857 тысяч доз). В этот же период количество выданных доз плазмы сократилось на 14,4 % (с 4338 до 3714 тысяч доз) [13].
Качество российского криопреципитата высокое: регламентированное минимальное содержание фибриногена в дозе криопреципитата составляет 140 мг, а реально среднее содержание — более 300 мг [25].
Затрудняют переливание криопреципитата два регламентированных условия: а) выполнения трехэтапной биологической пробы и б) оставления в гемоконтейнере 5 мл трансфузионной среды, что может составить до 50 % объема криопреципитата. В отношении последнего следует отметить, что авторам статьи за несколько десятилетий практической трансфузио- логии эти 5 мл не пригодились ни разу.
Эти проблемы легко решаются внедрением мировой практики: а) биологическая проба — трансфузия первых 15 мл со скоростью 2 мл в минуту, без перерывов [26]; б) пулированный патогенредуцированный криопреципитат.
Таким образом, необходимо вернуть криопреципитат в арсенал производственной и клинической трансфузиологии, создать российские клинические рекомендации по применению криопреципитата.
Для широкого использования криопреципитата необходима модернизация технологий его получения, воля и интеллектуальное сопровождение его клинического применения. До разработки национальных рекомендаций оптимально создать правила назначения криопреципитата в каждой организации.
Список литературы
1. Жибурт Е.Б. Гемокомпонентная терапия. М.: Национальный медико-хирургический центр имени Н.И. Пирогова, 2017. 62 с.
2. Pool J.G. Cryoprecipitated factor VIII concentrate. Thromb Diath Haemorrh Suppl. 1968; 35: 35–40.
3. Степанова И.П., Белов Е.В., Селиванов Е.А., Данилова Т.Н. Производственная трансфузиология России на современном этапе. Трансфузиология. 2000; 1(1): 6–27.
4. Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Служба крови России в 2001 году. Трансфузиология. 2002; 3(4): 7–30.
5. Селиванов Е.А., Данилова Т.Н., Быстров М.В. Служба крови России в 2003 году. Трансфузиология. 2004; 5(4): 7–36.
6. Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Служба крови России в 2005 году. Трансфузиология. 2006; 7(3): 4–43.
7. Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Характеристика деятельности учреждений службы крови России в 2007 году. Трансфузиология. 2008; 9(3): 4–27.
8. Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Служба крови России: современное состояние и перспективы развития. Трансфузиология. 2010; 11(3): 4–31.
9. Селиванов Е.А., Чечеткин А.В., Григорьян М.Ш. Современное состояние донорства крови и ее компонентов в Российской Федерации. Трансфузиология. 2012; 12(3): 4–13.
10. Чечеткин А.В., Григорьян М.Ш., Макеев А.Б. Служба крови России в 2012 году. Трансфузиология. 2013; 14(3): 4–15.
11. Чечеткин А.В., Данильченко В.В., Григорьян М.Ш. Основные итоги деятельности службы крови Российской Федерации в 2015 году. Трансфузиология. 2016; 17(3): 4–13.
12. Чечеткин А.В., Данильченко В.В., Григорьян М.Ш. и др. Основные показатели деятельности службы крови Российской Федерации в 2017 году. Трансфузиология. 2018; 19(3): 4–14.
13. Жибурт Е.Б., Губанова М.Н., Гайворонская В.В. и др. Развитие службы крови США. Трансфузиология. 2017; 18(3): 86–91.
14. Guide to the preparation, use and quality assurance of blood components, 19th edn. Council of Europe Publishing, Strasbourg. 2017. 545 p.
15. Guidelines for the blood transfusion services in the United Kingdom. 8th edition, 2013. Available at: http://www.transfusionguidelines.org/red-book/publication-information
16. Жибурт Е.Б. Обращение компонентов и препаратов крови. Ремедиум. 2004; 11: 56–7.
17. Программное лечение заболеваний системы крови: сборник алгоритмов диагностики и протоколов лечения заболеваний системы крови. Под ред. В.Г. Савченко. М.: Практика; 2006. 515 с.
18. Постникова Н.С. Правовые аспекты лечения орфанных заболеваний по программе «Семь нозологий». Правовые вопросы в здравоохранении. 2013; 6: 14–25.
19. Приказ Минздрава России от 25.11.2002 № 363 «Об утверждении Инструкции по применению компонентов крови».
20. Приказ Минздрава России от 02.04.2013 № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
21. Постановление Правительства РФ от 26.01.2010 № 29 «Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии».
22. Lunde J., Stensballe J., Wikkels A., Johansen M., Afshari A. Fibrinogen concentrate for bleeding — a systematic review. Acta Anaesthesiol Scand. 2014; 58(9): 1061–74.
23. Галстян Г.М., Берковский А.Л., Журавлев В.В. и др. Нужны ли в России препараты фибриногена? Анестезиология и реаниматология. 2014; 3: 49–59.
24. Rossaint R., Bouillon B., Cerny V., et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit. Care. 2016; 20: 100.
25. Султанбаев У.С., Аюпова Р.Ф., Салихова А.К., Жибурт Е.Б. Об адекватности контроля качества криопреципитата. Трансфузиология. 2016; 17(3): 41–6.
26. Губанова М.Н., Шихмирзаев Т.А., Жибурт Е.Б. Особенности национальной биологической пробы при переливании крови. Менеджер здравоохранения. 2016; 6: 53–9.
Об авторах
Е. Б. ЖибуртРоссия
Жибурт Евгений Борисович, профессор, доктор медицинских наук, заведующий кафедрой трансфузиологии
тел.: +7 (495) 211-79-51; 105203, г. Москва, ул. Нижняя Первомайская, 70
И. Г. Чемоданов
Россия
Чемоданов Игорь Геннадьевич, главный врач
тел.: +7 (3652) 27-87-45; 295017, г. Симферополь, ул. Киевская, 37/2
Е. А. Шестаков
Россия
Шестаков Евгений Андреевич, доцент, доктор медицинских наук, профессор кафедры трансфузиологии
тел.: +7 (499) 464-46-63; 105203, г. Москва, ул. Нижняя Первомайская, 70
Рецензия
Для цитирования:
Жибурт Е.Б., Чемоданов И.Г., Шестаков Е.А. ПРОИЗВОДСТВО КРИОПРЕЦИПИТАТА В РОССИИ: ПРОШЛОЕ, НАСТОЯЩЕЕ И БУДУЩЕЕ. Гематология и трансфузиология. 2019;64(1):16-20. https://doi.org/10.35754/0234-5730-2019-64-1-16-20
For citation:
Zhiburt E.B., Chemodanov I.G., Shestakov E.A. CRYOPRECIPITATE PRODUCTION IN RUSSIA: PAST, PRESENT AND FUTURE. Russian journal of hematology and transfusiology. 2019;64(1):16-20. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-16-20











































