Перейти к:
ДИФФЕРЕНЦИАЦИЯ ПОДГРУПП А1 И А2 АНТИГЕНА А СИСТЕМЫ АВ0: БИОЛОГИЧЕСКАЯ ОСНОВА И СЕРОЛОГИЧЕСКАЯ СТРАТЕГИЯ
https://doi.org/10.35754/0234-5730-2019-64-4-504-515
Аннотация
Введение. Определение слабых вариантов антигена А и их дифференциация необходимы для правильного подбора эритроцитсодержащих сред при гемотрансфузиях. Для этого в сочетании с реактивами анти-А, которые одинаково реагируют с антигенами А1 и А2, применяются селективные реактивы анти-А1, реагирующие только с антигеном А1 . Поскольку внутри самих подгрупп наблюдается вариабельность экспрессии антигена А, а установленного стандарта для реагентов и методик не существует, трактовка полученных результатов зачастую вызывает затруднения.
Цель: создать стратегию определения вариантов антигена А с применением доступных реагентов в реакции агглютинации.
Методы. Сравнение эффективности четырех анти-А1 - и двух анти-Н-реагентов проведено на 23 образцах крови с группой А2 и А2В и контрольных образцах А1 и А1 В. Использовались два типа анти-А1 -реагентов: лектин Dolychos biflorus и моноклональные антитела. Все реагенты предназначались для реакции прямой агглютинации. Принадлежность эритроцитов к подгруппе А2 была подтверждена генетическим анализом.
Результаты. Показано, что анти-А1 -реагенты не взаимодействовали с эритроцитами А2В, но часто реагировали с эритроцитами А2. Сила реакции с эритроцитами А2 сильно варьировала и была слабее, чем с А1 -эритроцитами, однако вызывала затруднения в установлении подгруппы. Одновременное тестирование с реагентом анти-Н позволяло сделать однозначный вывод о принадлежности крови к подгруппе: сильная реакция указывала на А2, отрицательная или слабая — на А1 . У двух доноров было отмечено расхождение результатов серологических и молекулярных методов исследования: серологически была определена подгруппа А3, генотипирование выявило аллель АВ0*А1 . В обоих случаях прямое секвенирование показало комбинацию мутантных аллелей, которая дает фенотип А3. При использовании коммерческих наборов для генотипирования методом полимеразной цепной реакции следует учитывать, что праймеры подобраны к наиболее часто встречающимся вариантам и не могут выявить все мутации гена АВ0.
Заключение. Надежная диагностика подгруппы А2 серологическими методами возможна с использованием лектина или моноклональных антител анти-А1 в сочетании с анти-H моноклональным реагентом.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Финансирование: исследование не имело спонсорской поддержки.
Ключевые слова
Для цитирования:
Головкина Л.Л., Каландаров Р.С., Стремоухова А.Г., Калмыкова О.С., Пушкина Т.Д., Сурин В.Л., Пшеничникова О.С., Николаева Т.Л., Оловникова Н.И. ДИФФЕРЕНЦИАЦИЯ ПОДГРУПП А1 И А2 АНТИГЕНА А СИСТЕМЫ АВ0: БИОЛОГИЧЕСКАЯ ОСНОВА И СЕРОЛОГИЧЕСКАЯ СТРАТЕГИЯ. Гематология и трансфузиология. 2019;64(4):504–515. https://doi.org/10.35754/0234-5730-2019-64-4-504-515
For citation:
Golovkina L.L., Kalandarov R.S., Stremoukhova A.G., Kalmykova O.S., Pushkina T.D., Surin V.L., Pshenichnikova O.S., Nikolaeva T.L., Olovnikova N.I. DIFFERENTIATION OF THE A1 AND A2 SUBGROUPS OF THE AB0 SYSTEM: BIOLOGICAL BACKGROUND AND SEROLOGICAL STRATEGY. Russian journal of hematology and transfusiology. 2019;64(4):504–515. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-504-515
Введение
Современная концепция безопасности предполагает, что лицам со слабыми вариантами антигена А (А2, А3 и др.), нуждающимся в частых трансфузиях эритроцитсодержащих компонентов, следует переливать донорские эритроциты, не содержащие антиген А1. Подобный подход обусловлен тем, что при трансфузии эритроцитов А больным с антигеном А или другими слабыми вариантами возможно образование аллоиммунных анти-А -антител, а если такие антитела уже присутствуют, то существует риск развития посттрансфузионных реакций и осложнений [1-3]. У лиц с ослабленной экспрессией антигена А в крови могут присутствовать природные анти-А -антитела (экстраагглютинины). Анти-А-экстраагглютинины имеют 1-2 % лиц с подгруппой А2 и 25 % лиц с подгруппой А2В [4]. Иногда анти-А1 можно обнаружить в сыворотке лиц с другими слабыми подгруппами антигена А. Экстраагглютинины анти-А могут вызывать расхождения в результатах АВ0 тестирования и пробы на индивидуальную совместимость. Реципиентам с иррегулярными анти-А1-аантителами рекомендуется переливать эритроциты, не несущие антиген А1 [5]. На практике это правило часто распространяют на всех реципиентов с подгруппой А2 , особенно нуждающихся в частых трансфузиях эритроцитсодержащих компонентов. Экстраагглютинины анти-А имеют, как правило, низкие титр и авидность, поэтому их не всегда можно обнаружить при исследовании сыворотки со стандартными эритроцитами в процессе перекрестного АВ0-тестирования. В связи с этим проблема своевременного выявления больных со слабыми вариантами антигена А остается актуальной.
Антиген А характеризуется высоким полиморфизмом, т.е. представлен различными вариантами (подгруппами), которые кодируются разными аллелями гена АВ0*А. Генетические основы системы АВ0, а также молекулярно-генетические события, приводящие к формированию разнообразных аллельных вариантов гена АВ0':А, подробно освещены в обзорах [6-10]. Две основные подгруппы антигена А — это А и А . Частота встречаемости подгрупп А1 и А2 различна в разных популяциях. У лиц европеоидной расы среди групп А и АВ около 80-88 % принадлежат к А или А В, а остальные 12-20 % — к А2 или А2В [11, 12]. Частота встречаемости антигена Асреди лиц группы А составляет 14,7-17,8 %; частота фенотипа А В среди лиц группы АВ составляет 23,5-26,2 % [13]. Выраженный дисбаланс существует и в других популяциях [14]. Одной из причин такого дисбаланса может быть разное фенотипическое проявление аллеля А(К101) в группах А и АВ: гетерозиготный генотип A(R101)/0 экспрессируется как А:-фенотип, а гетерозиготный генотип A(R101)/В — как А2В-фенотип, что приводит к возрастанию частоты А2В по сравнению с А2 [15].
Важнейшим различием между А и А фенотипами является существенная разница в количестве экспрессируемых на эритроците эпитопов антигена А. На эритроцитах А их около 106, что примерно в четыре раза больше, чем на эритроцитах А2 [16]. Подгруппы слабее А2 (A3, Ax, Am, Ael) встречаются редко и характеризуются дальнейшим уменьшением числа сайтов антигена А на эритроцитах. Подгруппы часто обнаруживают либо по очень слабой агглютинации, либо по расхождению между результатами прямого и обратного тестирования эритроцитов при перекрестном определении группы АВ0.
Помимо количественных, у эритроцитов А и А есть качественные различия. У лиц с группами крови А или А В могут вырабатываться анти-А -антитела, однако никогда не бывает наоборот. Это означает, что эритроциты А отличаются от А отсутствием какой-то структуры. Серологическое разделение было подтверждено генетически, когда было показано существование двух различных ферментов [17]. Фермент А2-гликозилтрансфераза обладает более низкой активностью и имеет болееузкую субстратную специфичность по сравнению с ферментом А1-гликозилтрансферазой.
Эритроциты А1 и А2 одинаково сильно реагируют с современными реагентами анти-А в методе прямой агглютинации. Различие между А - и А2-эритроцитами может быть установлено путем тестирования с анти-А1 лектином и моноклональными антителами анти-А . Эти реагенты вызывают агглютинацию эритроцитов А1 и А1В, не реагируют с эритроцитами А2В, но могут вызывать слабую агглютинацию эритроцитов А2. Установленного стандарта для реагентов и метода не существует, поэтому нередки несоответствия в результатах, полученных с применением различных реагентов и в разных лабораториях [20].
Целью настоящей работы было создать стратегию определения вариантов антигена А с применением доступных реагентов в реакции агглютинации.
Материалы и методы
В исследовании использовали образцы крови доноров, полученные в отделении заготовки крови ФГБУ «НМИЦ гематологии» МЗ РФ после получения информированного согласия; все тесты проводили после завершения иммуносерологического тестирования и исследования на патогены. Материалом исследований были образцы крови 23 человек со слабым вариантом антигена А, из которых у 16 человек была группа крови А2, у 5 — группа A2B, у 2 — серологически была определена группа A3, а также 12 образцов крови с антигеном А в качестве контроля (из них у 6 человек была группа крови А и у 6 — группа AB).
Применяли следующие методы.
Перекрестное определение группы крови системы АВ0 в реакции агглютинации на плоскости с использованием Эритротест Цоликлонов анти-А (сер. 423R и 433F) и анти-В (сер 424R) (ООО «Гематолог», Москва) и стандартных эритроцитов групп А1, В, 0 (BioRad, США). Активными компонентами Цоликлонов являются моноклональные антитела класса IgM мыши: клоны А-90/16 и Birma (Цоликлон анти-А вариант R), клоны А-90/16, А-86/3 и 9113D10 (Цоликлон анти-А вариант F), клон В-85/2-В8 (Цоликлон анти-В вариант R).
Определение подгруппы антигена А в реакции агглютинации на плоскости с использованием моноклонального реагента Цоликлона анти-А1 (сер. 261) (клоны 1Е3 и 5Е6), Эритротест анти-А: лектина (сер. 259), Цоликлона анти-Нкра (сер. 735) (клон Н-89/8) (ООО «Гематолог», Москва); анти-А1 лектина (сер. 020317В), анти-Н (А2) (сер. 080517С) (клон 10934C11) (ImuMed Antitoxin, Германия); анти-А1-лектина (сер. 118100201) (Bio-Rad, США). Силу реакции оценивали по 4-крестовой системе через 5 мин после смешивания эритроцитов с реагентом в соответствии с таблицей 1.
Таблица 1. Оценка силы реакции гемагглютинации
Table 1. Strength of haemagglutination reaction
Сила реакции Strength of agglutination | Вид агглютинации Agglutination type |
|---|---|
4+ | Полная агглютинация, т.е. один плотный агглютинат Complete agglutination, i.e. one solid agglutinate |
3+ | Смесь нескольких крупных и средних агглютинатов Several large and medium agglutinates |
2+ | Смесь средних и мелких агглютинатов А mixture of medium-sized and small agglutinates |
1 + | Мелкие агглютинаты Small agglutinates |
+/- | Очень мелкая агглютинация на фоне свободных эритроцитов (смешанная агглютинация) Weak granularity in the red cell suspension (mixed-field) |
- | Отсутствие агглютинации No agglutination |
ДНК-анализ генаАВ0*А выполняли двумя методами: полимеразной цепной реакцией (ПЦР) и прямым сек- венированием. Геномную ДНК выделяли с помощью реактивов фирмы BAG (Германия) по методике производителя и по стандартной методике депротеинизации фенолом после лизиса с протеиназой К. Концентрацию и чистоту ДНК определяли на спектрофотометре. Одна оптическая единица (OD) соответствовала концентрации ДНК 50 нг/мкл. Чистота ДНК, определяемая по отношению показателей при 260 и 280 нм (OD 260/280), составляла 1,6-1,8, концентрация конечной ДНК - 50-100 нг/мкл.
ПЦР проводили с помощью праймеров для выявления вариантов генов системы АВ0 (AB0-variant kit) фирмы BAG (Германия). Детекцию полученных результатов осуществляли посредством электрофореза продуктов амплификации в 2%-ном агарозном геле, содержащем бромистый этидий (1мкг/мл) в TBE-буфере. Результаты визуализировали в ультрафиолетовом свете (λ = 310 нм) при помощи транс-иллюминатора в виде полос ярко-оранжевого цвета. Наличие полос амплификации внутреннего положительного контроля свидетельствовало о корректности проведенной ПЦР Прямое секвенирование проводили по методу Сэнгера с помощью набора реактивов ABIPRISM®BigDyeTMT erminatorv.3.1. У всех образцов секвенировали экзоны 6 и 7 гена АВ0*А.
Результаты
В работе представлены результаты исследования образцов эритроцитов со слабыми вариантами антигена А с помощью различных реагентов — анти-А -лектина, анти-А1-моноклональных антител и дополнительного реагента — анти-Н-моноклональных антител для демонстрации возможности дифференцирования подгрупп антигена А серологическими методами. Принадлежность эритроцитов к той или иной подгруппе была подтверждена генетическим тестированием.
Детальные результаты исследований показаны в таблице 2. Результаты реакции с Цоликлонами анти-А и анти-В приведены для демонстрации групповой принадлежности (столбцы 1-3). Группу АВ0 подтверждали перекрестным тестированием, то есть реакцией сыворотки со стандартными эритроцитами А, В, 0 (данные не приведены). Цоликлоны анти-А с индексами R и F отличались по составу и содержали продукты различных клонов. Оба реагента одинаково активно реагировали с подгруппами А1, А2 и А3 (столбцы 1-2), что соответствовало требованиям к реагентам для рутинного тестирования.
В таблице 2 приведено сравнение четырех различных анти-А -реагентов, три из которых представляли собой раствор лектина DoLichos biflorus (столбцы 5-7) и один реагент, Цоликлон анти-А , был смесью двух моноклональных антител (столбец 4). Результаты эксперимента и лабораторная практика показали, что все анти-А -реагенты не взаимодействовали с эритроцитами A2B, но часто реагировали с эритроцитами A2. Лектины анти-А1 производства фирм BioRad и ImuMed (Antitoxin) вызывали крупную агглютинацию А - и АВ-эритроцитов, но также явно реагировали (на 1+ — 2+) с большинством образцов эритроцитов А2. Эта реакция была существенно слабее, чем с A -эритроцитами, однако могла ввести в заблуждение, особенно при отсутствии положительных (A) и отрицательных (А) контрольных образцов (эритроцитов A нет в доступных панелях стандартных эритроцитов). Моноклональный реагент анти-А1 реагировал с А2-эритроцитами более избирательно: сила реакции с эритроцитами A2 было слабой (на 1+), но он менее активно реагировал и с эритроцитами А1 и A1B — агглютинация начинала формироваться позднее, и сила реакции была не выше 3+.
Таблица 2. Результаты серологического и генетического определения подгруппы антигена А; сравнение эффективности и специфичности анти-Al реагентов
Table 2. The results of the serological and genetic determination of the subgroup of antigen A; comparison of the efficacy and specificity of anfi-AI reagents
Эритроциты донора/больного Red blood cells of donor/patient (№) | Результаты анализа (сила агглютинации) Test results (agglutination strength) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
I | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | АВО-группа ABO blood group | |
Эритротест Цоликлон анти-А (R) Erythrotest Zoliclone Anti-A (R) | Эритротест Цоликлон анти-А (F) Erythrotest Zoliclone Anti-A (F) | Эритротест Цоликлон анти-В Erythrotest Zoliclone Anti-B | Эритротест Цоликлон анти-Al моно Erythrotest Zoliclone Anti-A I mono | Эритротест анти-Al лектин Erythrotest Anti-A I lectin | Bio-Rad Anti-Al Lectin | ImuMed Anti-Al Lectin | Эритротест Цоликлон анти-Нкра Erythrotest Zoliclone Anti-H) | ImuMed Anti-H | ДНК- анализ генов ABO DN А analysis of ABO genes | ||
110742 | 4+ | 4+ | - | 1 + | 3+ | 2+ | 2+ | 4+ | 4+ | A2O2 | А2 |
110812 | 4+ | 4+ | - | - | - | 2+ | 2+ | 4+ | 4+ | A2O1 | А2 |
111338 | 4+ | 4+ | - | - | 1-2+ | 1 + | 1 + | 4+ | 4+ | A2O1 | А2 |
111271 | 4+ | 4+ | - | 1 + | 2+ | 3+ | 3+ | 4+ | 4+ | A2O1 | А2 |
111293 | 4+ | 4+ | - | - | ± | 2+ | 2+ | 4+ | 4+ | A2O1 | А2 |
111655 | 4+ | 4+ | - | - | - | 1 + | 1 + | 4+ | 4+ | A2O1 | А2 |
111675 | 4+ | 4+ | - | ± | - | 2+ | 2+ | 4+ | 4+ | A2O1 | А2 |
111564 | 4+ | 4+ | - | ± | 2+ | 3+ | 3+ | 4+ | 4+ | A2O1 | А2 |
111370 | 4+ | 4+ | - | - | ± | 2-3+ | 2-3+ | 4+ | 4+ | A2O1v | А2 |
111349 | 4+ | 4+ | - | - | ± | 2-3+ | 2-3+ | 4+ | 4+ | A2O1v | А2 |
111372 | 4+ | 4+ | - | ± | ± | 3+ | 2+ | 4+ | 4+ | A2O1v | А2 |
111620 | 4+ | 4+ | - | ± | ± | 2+ | 2+ | 4+ | 4+ | A2O1v | А2 |
111912 | 4+ | 4+ | - | - | ± | 1-2+ | 1-2+ | 4+ | 4+ | A2O1v | А2 |
111878 | 4+ | 4+ | - | - | 1 + | 2+ | 2+ | 4+ | 4+ | A2O1v | А2 |
112155 | 4+ | 4+ | - | ± | 1 + | 1-2+ | 1-2+ | 4+ | 4+ | A2O1v | А2 |
112126 | 4+ | 4+ | - | - | 1 + | 1-2+ | 1-2+ | 4+ | 4+ | A2O1v | А2 |
110718 | 4+ | 4+ | 4+ | - | - | - | - | 1 + | 1 + | A2B1 | A2B |
110828 | 4+ | 4+ | 4+ | - | - | - | - | 1 + | 1 + | A2B1 | A2B |
111625 | 3+ | 3+ | 4+ | - | - | - | - | ± | - | A2B1 | A2B |
111378 | 4+ медленно | 4+ медленно | 4+ | - | - | - | - | 1 + | - | A2B1 | A2B |
111595 | 4+ | 4+ | 4+ | - | - | 1 + | - | ± | ± | нд np | A2B |
112067 | +2 | +2 | - | - | - | - | - | 4+ | 4+ | A1O1 | Аз |
111800 | +2 | +2 | - | - | - | - | - | 4+ | 4+ | A1O1 | Аз |
| Результаты анализа (сила агглютинации) Test results (agglutination strength) | ||||||||||
Эритроциты донора/больного Red blood cells of donor/patient (№) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | АВО-группа ABO blood group |
Эритротест Цоликлон анти-А (R) Erythrotest Zoliclone Anti-A (R) | Эритротест Цоликлон анти-А (F) Erythrotest Zoliclone Anti-A (F) | Эритротест Цоликлон анти-В Erythrotest Zoliclone Anti-B | Эритротест Цоликлон анти-Al моно Erythrotest Zoliclone Anti-A I mono | Эритротест анти-А1 лектин Erythrotest Anti-A I lectin | Bio-Rad Anti-Al Lectin | ImuMed Anti-Al Lectin | Эритротест Цоликлон анти-Нкра Erythrotest Zoliclone Anti-H) | ImuMed Anti-H | ДНК- анализ генов ABO DNА analysis of ABO genes | ||
111668 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | ± | - | нд пр | A1 |
111617 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | ± | - | нд пр | A1 |
111607 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | ± | - | нд пр | A1 |
111667 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | 1 + | - | нд пр | A1 |
111586 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | 1 + | - | нд пр | A1 |
111616 | 4+ | 4+ | - | 3+ | 4+ | 4+ | 4+ | 1 + | - | нд пр | A1 |
112033 | 4+ | 4+ | 4+ | 2+ | 3+ | 4+ | 4+ | - | - | нд пр | A1B |
112164 | 4+ | 4+ | 4+ | 2+ | 3+ | 4+ | 4+ | - | - | нд пр | A1B |
112117 | 4+ | 4+ | 4+ | 3+ | 3+ | 4+ | 4+ | - | - | нд пр | A1B |
111649 | 4+ | 4+ | 4+ | 2+ | 3+ | 4+ | 4+ | ± | - | нд пр | A1B |
111659 | 4+ | 4+ | 4+ | 2+ | 3+ | 4+ | 4+ | ± | - | нд пр | A1B |
111350 | 4+ | 4+ | 4+ | 3+ | 3+ | 4+ | 4+ | - | - | A1B1 | A1B |
Примечание: нд — генотипирование не проводили; О1, О1v, О2 — аллельные варианты гена О.
Note: пр — genotyping not performed; O1; Olv, O2 — allelic variants of the O gene.
Реакция с двумя анти-Н-моноклональными реагентами разных производителей была идентичной (столбцы 8—9): отрицательной или слабой с эритроцитами А1 и ярко выраженной со всеми образцами А2.
На рисунке 3 показано на примере четырех образцов эритроцитов А, А, АВ и АВ, как выглядит реакция на плоскости с набором реагентов, необходимых для установления подгруппы антигена А.
В серологическое исследование были включены образцы крови доноров, которым был проведен АВ0 (столбец 10) ДНК-анализ с использованием праймеров фирмы BAG для выявления вариантных антигенов А, который подтвердил наличие аллеля АВ0*А2 у 21 донора эритроцитов. В двух случаях серологически была определена подгруппа А3 (на плоскости наблюдалась замедленная агглютинация на 2+ на фоне свободных эритроцитов, в гелевом методе отмечали расслоение эритроцитов в пробирке), однако генотипирование выявило аллель АВ0*Аг Прямым секвенированием ДНК доноров этих образцов эритроцитов были идентифицированы аллели АВ0*А2.05 и АВ0*А2.06.
Обсуждение
Антигены групп крови систем АВ0 являются углеводами (карбогидратами), то есть структурами, которые формируются в результате биохимических процессов с участием гликозилтрансфераз. Гены всех углеводных антигенов, в том числе А и В, кодируют гликозилтрансферазы — ферменты, которые переносят конкретные сахара на углеводную цепь-предшественник и формируют соответствующий антиген [21]. Предшественником для синтеза антигенов А и В является антиген Н, к которому А-гликозилтрансфераза присоединяет N-ацетилгалактозамин (GalNAc), а В-гликозилтрансфераза присоединяет галактозу (Gal) (рис. 1). На эритроцитах группы 0 присутствует большое количество антигена Н, неконвертированного в А- и/или B-антигены. Синтез А- и/или В-антигенов приводит к снижению количество антигена Н на поверхности эритроцита. Таким образом, экспрессия антигенов A и/или B и экспрессия антигена H обратно пропорциональны.

Рисунок 1. Структура антигенов А и В, типы олигосахаридных Н-цепей предшественников. GlNAc — N-ацетилглюкозамин; Gal — галактоза; Fuc — фукоза; GalNAc — N-ацетилгалактозамин. Типы цепей 2-4 являются эндогенными, тип 1 (не показан) может адсорбироваться на эритроциты из плазмы. Типы цепей различаются не только составом, но и положением гликозидной связи между сахарами (а или β; 1-3, 1-4). Полисахаридные цепи соединены с протеинами (P) или сфинголипидами (S) мембраны эритроцита
Figure 1. Structure of the A and B antigens; types of oligosaccharide precursor H-chains/ GlNAc — N-acetylglucosamine; Gal — galactose; Fuc — fucose; GalNAc — N-acetyl- galactosamine. Chain types 2-4 are endogenous, type 1 (not shown) can be adsorbed onto red blood cells from plasma. The types of chains differ in composition, as well as in the position of the glycosidic bond between sugars (a or β; 1-3, 1-4). Polysaccharide chains are linked to the proteins (P) or sphingolipids (S) of the erythrocyte membrane
Углеводные Н-цепи имеют различное биохимическое строение. На эритроцитах могут присутствовать четыре типа Н-цепей, на которых формируются соответственно 4 типа антигена А [22—24] (рис. 1). Нумерация подгрупп антигена А (А1, А2, А3) и цифровые обозначения типов углеводной цепи (типы 1, 2, 3, 4) не связаны между собой. Тип 1 Н-цепей синтезируется эпителиальными клетками и является предшественником растворимых антигенов, которые обнаруживаются в слюне или плазме у лиц-«секреторов». На эритроциты такие антигены адсорбируются из плазмы. Эндогенные эритроцитарные типы Н-цепей — это типы 2, 3 и 4. На эритроцитах А экспрессируются все типы антигена А. На А - и А2В-эритроцитах присутствует антиген А, представленный на Н-цепях типа 2. Показано, что ключевым отличием фенотипов А1 и А2 является различная экспрессия антигена А типов 3 и 4: тип 3 отсутствует на эритроцитах А2В и слабо выражен на эритроцитах А , тип 4 полностью отсутствует на эритроцитах А и А В [25] (рис 2). Эти отличия связаны с тем, что активная А -гликозилтрансфераза эффективно конвертирует H вещество в А антиген и переносит GalNAc на Н-цепь любого типа, в то время как А2-гликозилтрансфераза имеет субстратные ограничения и не способна прикреплять иммунодоминант- ные сахара на Н-цепи типа 3 и 4.
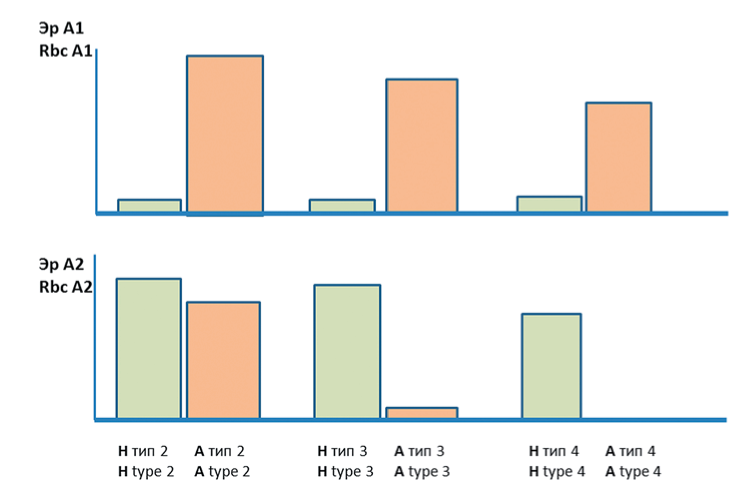
Рисунок 2. Количественные и качественные различия A1- и А2-эритроцитов.
Высота столбцов демонстрирует относительное количество H- и А-антигенных детерминант на мембранах эритроцитов. Сильная А1 трансфераза активно утилизирует молекулы Н-антигена (верхняя панель), превращая их в антиген А1, в то время как трансфераза А2 оставляет существенное количество антигена Н, не конвертированного в антиген А (нижняя панель). Эр — эритроциты
Figure 2. Quanfifafive and qualitative differences between A1 and A2 red blood cells. The height of the columns denotes the relative amount of H and A antigenic determinants on the membranes of red blood cells. The strong A1 transferase actively utilizes the molecules of the H antigen (upper panel) turning them into the A antigen, while the A2 transferase leaves a significant amount of the H antigen not converted to the A antigen (bottom panel). RBCs — red blood cells
Основным реагентом, используемым для дифференциации подгрупп, является анти-А1-лектин. Он представляет собой экстракт из семян бобового растения DoLichos biflorus. Экстракт реагирует с обеими подгруппами А эритроцитов, но при нужном разведении проявляет преимущественно анти-А1-активность. Другой анти-А1 диагностикум, Цоликлон анти-А1, представляет собой комбинацию двух моноклональных анти-А1-антител. Как показывают данные, представленные в таблице 2, и лектины, и моноклональные антитела могут вызывать агглютинацию некоторых образцов эритроцитов А2, причем сила агглютинации варьирует. Было установлено, что анти-А1 моноклональные антитела, входящие в состав Цоликлона, реагируют с антигеном А, экспрессированном на Н-цепях типа 3 и 4 [25]. Эти структуры присутствуют на эритроцитах А1, а на эритроцитах А2 их либо очень мало, либо они не обнаруживаются вообще (рис. 2). Зная эпитопную специфичность анти-А1-моноклональных антител, можно предполагать, что Цоликлон анти-А1 выявляет на эритроцитах А2 слабо экспрессированные детерминанты антигена А типа 3, создавая видимость неспецифической реакции. Такая проблема не возникает при тестировании эритроцитов группы А2В, поскольку сильная В-трансфераза конкурирует со слабой А2-трансферазой и утилизирует общие Н-предшественники.
Полезным реагентом для подтверждения подгруппы является анти-Н-реагент. Активная А -глико- зилтрансфераза превращает в антиген А существенно больше молекул Н, чем А2-гликозилтрансфераза. Таким образом, содержание антигена Н на эритроцитах А ниже, чем на эритроцитах А , и поэтому анти-Н-реа- генты практически не агглютинируют А -эритроциты, но дают сильную реакцию с А2-эритроцитами. В таблице 2 и на рисунке 3 видно, как четко различают подгруппы антигена А все анти-Н-реагенты. Реагент компании ImuMed называется анти-Н (А2), однако мишенью антител является антиген Н, а дополнительная подпись в скобках (А2) — это скорее указание к применению. В настоящей работе были использованы только моноклональные анти-Н-реагенты. Экстракт из ULex europaeus также выявляет антиген Н и может применяться с той же целью.

Рисунок 3. Реакция агглютинации на плоскости эритроцитов A1 Α1B, А2 и А2В с реагентами анти-А, анти-В, анти-А1 и анти-Н (фото). В рядах 1-4 показана реакция агглютинации эритроцитов с различными анти-А1 реагентами. Отчетливо видно, что анти-А1 лектины агглютинируют эритроциты А2, однако сила агглютинации заметно слабее, чем с эритроцитами А1. Ряды 5-6 демонстрируют, что анти-Н реагенты сильно реагируют с эритроцитами А2 и практически не реагируют с эритроцитами А1. Ряды 7-8, агглютинация с цоликлонами анти-А и анти-В1 приведена для подтверждения группы крови
Figure 3. Slide agglutination of A1 Α1B, A2 and A2B red blood cells using anti-A, anti-B, Onti-A1 and anti-H reagents (photo). Rows 1-4 show the agglutination of red blood cells using various anti-Ai reagents. The figure clearly shows that Mnti-A1 lectins agglutinate A2 red blood cells; however, the strength of agglutination is noticeably weaker than with A1 red blood cells. Rows 5-6 demonstrate that anti-H reagents strongly react with A2 red blood cells and practically do not react with Ai red blood cells. In rows 7-8, the agglutination reaction using anti-A and anti-B Zoliclons is given to confirm the blood group
Таким образом, в рутинной практике для дифференциации подгрупп А1 и А2 в большинстве случаев достаточно двух реагентов: анти-А и анти-А1. Моноклональные реагенты анти-А одинаково надежно выявляют А и А и четко реагируют с эритроцитами А , а реагенты анти-А при необходимости позволят дифференцировать А1 от А2 и более слабых подгрупп. Моноклональный реагент Цоликлон анти-А: является адекватной заменой лектину анти-А . В случае сомнительного результата реакции эритроцитов с анти-А -реагентом следует провести тестирование с реагентом анти-Н: сильная реакция укажет на А , отрицательная или слабая — на А1.
У двух доноров в настоящем исследовании было отмечено расхождение результатов серологических и молекулярных методов: серологически была определена подгруппа А3, генотипирование методом ПЦР выявило аллель АВ0*А. Прямое секвенирование ДНК показало сочетание мутантных аллелей, которое проявляет себя как фенотип А [26]. Праймеры наборов А-variant Type (фирмы BAG) подобраны к наиболее часто встречающимся вариантам и не могут выявить все мутации гена АВ0. За очевидными результатами генотипирования могут маскироваться мутантные аллели, что и наблюдалось в двух образцах.
Очевидно, что поиск генетических разновидностей антигена А представляет интерес для исследования эволюции гена, описания новых или редких вариантов [27], но в практической трансфузиологии генетическое типирование каждого реципиента со слабым антигеном А затруднительно и нерационально. Кроме того, результаты генетического анализа позволяют лишь предсказать наличие антигена; окончательное решение принимается на основе данных серологического исследования, как в приведенном выше случае. Тем не менее в литературе предлагается использовать ДНК-анализ как подтверждающий тест в тех случаях, когда у здоровых доноров со слабой подгруппой антигена А не совпадают результаты перекрестного AB0-типирования, и компонент крови при этом бракуют. Авторы считают, что уточнение группы с помощью ДНК-анализа позволит избежать нерациональной отбраковки таких компонентов [28].
Список литературы
1. Дашкова Н.Г., Рагимов А.А., Асоскова Т.К. Значение изоантигена А2 и имунных анти-А1 антител в трансфузиологии. Анестезиология и реаниматология. 2009; 6: 62–4.
2. Helmich F., Baas I., Ligthart P. et al. Acute hemolytic transfusion reaction due to a warm reactive anti-A1. Transfusion. 2018; 58: 1163–70. DOI: 10.1111/trf.14537
3. Jaben E.A., Jacob E.K., Tauscher C. et al. Clinically signifi cant anti-A(1) in a presumed АВ0-identical hematopoietic stem cell transplant recipient: a case report. Transfusion. 2013; 53: 202–5. DOI: 10.1111/j.1537-2995.2012.03696.x
4. Reid M.E., Lomas-Francis C. The blood group antigen factsbook. 2nd ed. Academic Press, 2004.; DOI: 10.1016/B978-0-12-586585-2.X5000-8
5. Order of the Ministry of Health of the Russian Federation (Ministry of Health of Russia) April 2, 2013, N 183n, Moscow: “On approval of the rules for the clinical use of donated blood and (or) its components”.
6. Yamamoto F. Molecular genetics of АВ0. Vox Sang. 2000; 78: 91–103.
7. Seltsam A., Hallensleben M., Kollmann A., Blasczyk R. The nature of diversity and diversifi cation at the АВ0 locus. Blood. 2003; 102: 3035–42. DOI: 10.1182/blood-2003-03-0955
8. Prager M. Molecular genetic blood group typing by the use of PCR-SSP technique. Transfusion. 2007;47:54–9. DOI: 10.1111/j.1537-2995.2007.01311.x
9. Olsson M.L., Chester M.A. Polymorphism and recombination events at the АВ0 locus: a major challenge for genomic АВ0 blood grouping strategies. Transfus Med. 2001; 11: 295–313.
10. Chen D.P., Sun C.F., Ning H.C. et al. Genetic and mechanistic evaluation for the weak A phenotype in Ael blood type with, IVS6 + 5G>A АВ0 gene mutation. Vox Sang. 2015; 108: 64–71. DOI: 10.1111/vox.12196
11. Technical manual. Ed. Mark E. Brecher. 15th ed., Bethesda, AABB, 2005. 12. Донсков С.И., Мороков В.А. Группы крови человека. Руководство по иммуносерологии. М.: Бином; 2014.
12. Трансфузиология. Национальное руководство. Под ред. А.А. Рагимова, 2-е изд. М.: ГЭОТАР-Медиа; 2018.
13. Shastry S., Bhat S. Imbalance in A(2) and A(2)B phenotype frequency of АВ0 group in South India. Blood Transfus. 2010; 8: 267–70. DOI: 10.2450/2010.0147-09
14. Ogasawara K., Yabe R., Uchikawa M. et al. Different alleles cause an imbalance in A2 and A2B phenotypes of the АВ0 blood group. Vox Sang. 1998; 74: 242–7.
15. Economidou J., Hughes-Jones N.C., Gardner B. Quantitative measurements concerning A and B antigen sites. Vox Sang. 1967; 12: 321–8.
16. Schachter H., Michaels M.A., Tilley C.A., Crookston M.C., Crookston J.H. Qualitative differences in the N-acetyl-D-galactosaminyltransferases produced by human A1 and A2 genes. Proc Natl Acad Sci U S A. 1973; 70: 220–4. DOI: 10.1073/pnas.70.1.220
17. Storry J.R., Olsson M.L. Genetic basis of blood group diversity. Br J Haematol. 2004; 126: 759–71. DOI: 10.1111/j.1365-2141.2004.05065.x
18. Yamamoto F., McNeill P.D., Hakomori S. Human histo-blood group A2 transferase coded by A2 allele, one of the A subtypes, is characterized by a single base deletion in the coding sequence, which results in an additional domain at the carboxyl terminal. Biochem Biophys Res Commun. 1992; 187: 366–74. DOI: 10.1016/s0006-291x(05)81502-5
19. Yoshida A., Dave V., Prchal J. Uncertainty in identifi cation of blood group A subtypes by agglutination test. Hum. Hered. 1985; 35: 1–6. DOI: 10.1159/000153505
20. Watkins W.M. Genetic regulation of the structure of blood-group-specifi c glycoproteins. Biochem Soc Symp. 1974; 40: 125–46.
21. Clausen H., Hakomori S. ABH and related histo-blood group antigens; immunochemical differences in carrier isotypes and their distribution. Vox Sang. 1989; 56: 1–20.
22. Zhang Wei, Zhu Zi-yan. Structural modifi cation of H histo-blood group antigen. Blood Transfus. 2015; 13: 143–9. DOI: 10.2450/2014.0033-14
23. Luiz Carlos de Mattos. Structural diversity and biological importance of АВ0, H, Lewis and secretor histo-blood group carbohydrates. Rev Bras Hematol Hemoter. 2016; 38(4): 331–40. DOI: 10.1016/j.bjhh.2016.07.005
24. Svensson L., Rydberg L., de Mattos L.C., Henry S.M. Blood group A(1) and A(2) revisited: an immunochemical analysis. Vox Sang. 2009; 96: 56–61. DOI: 10.1111/j.1423-0410.2008.01112.x
25. Barjas-Castro M.L., Carvalho M.H., Locatelli M.F., Bordin S., Saad S.T. Molecular heterogeneity of the A3 subgroup. Clin. Lab. Haematol. 2000; 22: 73–8.
26. Головкина Л.Л., Стремоухова А.Г., Пушкина Т.Д. Выявление редкого аллеля антигена А системы АВ0 Аel у женщины из Дагестана. Интермедикал. 2015; 1(7): 25–8.
27. Westhoff C.M. Blood group genotyping. Blood. 2019; 133: 1814–20. DOI: 10.1182/blood-2018-11-833954
Об авторах
Л. Л. ГоловкинаРоссия
Головкина Лариса Леонидовна, доктор медицинских наук, заведующая лабораторией трансфузиологической иммуногематологии
Р. С. Каландаров
Россия
Каландаров Рахман Самиевич, кандидат медицинских наук, старший научный сотрудник лаборатории трансфузиологической иммуногематологии
А. Г. Стремоухова
Россия
Стремоухова Алла Геннадьевна, врач клинической лабораторной диагностики лаборатории трансфузиологической иммуногематологии
О. С. Калмыкова
Россия
Калмыкова Ольга Сергеевна, заведующая лабораторией контроля качества и безопасности гемотрансфузий
Т. Д. Пушкина
Россия
Пушкина Татьяна Дмитриевна, биолог лаборатории трансфузиологической иммуногематологии
В. Л. Сурин
Россия
Сурин Вадим Леонидович, старший научный сотрудник лаборатории генной инженерии
О. С. Пшеничникова
Россия
Пшеничникова Олеся Сергеевна, старший научный сотрудник лаборатории генной инженерии
Т. Л. Николаева
Россия
Николаева Татьяна Леонидовна, кандидат биологических наук, старший научный сотрудник лаборатории физиологии кроветворения
Н. И. Оловникова
Россия
Оловникова Наталья Ивановна, кандидат биологических наук, ведущий научный сотрудник лаборатории физиологии кроветворения
тел.: +7 (916) 915-25-01
Рецензия
Для цитирования:
Головкина Л.Л., Каландаров Р.С., Стремоухова А.Г., Калмыкова О.С., Пушкина Т.Д., Сурин В.Л., Пшеничникова О.С., Николаева Т.Л., Оловникова Н.И. ДИФФЕРЕНЦИАЦИЯ ПОДГРУПП А1 И А2 АНТИГЕНА А СИСТЕМЫ АВ0: БИОЛОГИЧЕСКАЯ ОСНОВА И СЕРОЛОГИЧЕСКАЯ СТРАТЕГИЯ. Гематология и трансфузиология. 2019;64(4):504–515. https://doi.org/10.35754/0234-5730-2019-64-4-504-515
For citation:
Golovkina L.L., Kalandarov R.S., Stremoukhova A.G., Kalmykova O.S., Pushkina T.D., Surin V.L., Pshenichnikova O.S., Nikolaeva T.L., Olovnikova N.I. DIFFERENTIATION OF THE A1 AND A2 SUBGROUPS OF THE AB0 SYSTEM: BIOLOGICAL BACKGROUND AND SEROLOGICAL STRATEGY. Russian journal of hematology and transfusiology. 2019;64(4):504–515. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-504-515











































