Перейти к:
ПЛЕЙОТРОПНЫЕ ЭФФЕКТЫ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ
https://doi.org/10.35754/0234-5730-2019-64-1-90-98
Аннотация
Ключевые слова
Для цитирования:
Галяутдинов Г.С., Фейсханова Л.И., Абдуллаев Ш.П. ПЛЕЙОТРОПНЫЕ ЭФФЕКТЫ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ. Гематология и трансфузиология. 2019;64(1):90-98. https://doi.org/10.35754/0234-5730-2019-64-1-90-98
For citation:
Galyautdinov G.S., Feiskhanova L.I., Abdullaev Sh.P. PLEIOTROPIC EFFECTS OF ORAL ANTICOAGULANTS. Russian journal of hematology and transfusiology. 2019;64(1):90-98. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-90-98
Введение
Сердечно-сосудистые заболевания в настоящее время вносят существенный вклад в общую структуру заболеваемости населения. Одной из наиболее частых причин смертности от сердечно-сосудистых заболеваний являются тромбоэмболические осложнения. Для их профилактики и лечения применяется антикоагулянтная терапия. Длительное время одним из основных препаратов антикоагулянтной терапии был антагонист витамина К — варфарин [1]. Этот препарат был изучен вплоть до его влияния на гены [2]. Однако с появлением новых антикоагулянтов и их использованием в лечении и профилактике фибрилляции предсердий [3, 4], венозной тромбоэмболии [5], острого коронарного синдрома [6], инсульта [3] перспективными стали работы по изучению их плейотропного эффекта, что особенно актуально в связи с интересом к развитию персонализированной медицины [7].
Плейотропные эффекты антикоагулянтов и пути их реализации
Плейотропностью (от греч. pleio — множественный и tropos — действие) препарата называют множественность его эффектов. Наряду с влиянием на гемостаз обнаруживаются иные свойства антикоагулянтов, основными из которых при использовании прямых антикоагулянтов, в частности варфарина, являются воздействие на ангиогенез, противовоспалительное [8-10], антиатеросклеротическое [8, 9], противоопухолевое [11, 12] действия, угнетение процессов ремоделирования предсердий [8, 9] и влияние на почки [13, 14]. В настоящее время изучен далеко не весь спектр плейотропных эффектов антикоагулянтов.

Рисунок 1. Схема активации различных типов PAR [60]
Figure 1. The scheme of activation of vatious PAR types [60]
Активированный фактор Стюарта — Прауэра — фактор Xa (FXa) и тромбин (FIIa) являются основными мишенями при лечении больных прямыми пероральными антикоагулянтами. FXa представляет собой сериновую протеазу, играющую ключевую роль в каскаде реакций коагуляции крови, превращая протромбин в тромбин и способствуя образованию тромба. Кроме участия в коагуляционном каскаде FXa и тромбин играют большую роль в различных процессах, взаимодействуя с протеаза-активированными рецепторами (Protease-activated receptors — PAR) -1, -2 (PAR-1, -2). Эффект FXa зависит от количественной экспрессии этих рецепторов на клетках-мишенях. PAR-2 активируется непосредственным влиянием FXa, тогда как PAR-1 — комплексом «тканевой фактор — FVIIa — FXa» [15—17]. PAR-1, -2 экспрессируются на многих клетках организма, вследствие этого влияние FXa охватывает эндотелиальные, эпителиальные, гладкомышечные клетки, лейкоциты, фибробласты и т. д. (рис. 1).
Всего известно четыре типа PAR (PAR-1—4), все они сопряжены с G-белком [18]. После активации рецепторов FXa инициируется гидролиз фосфатидилинозитола, который приводит к изменению содержания внутриклеточного кальция. FXa также инициирует фосфорилирование митоген-активированных протеинкиназ [8], что приводит к запуску различных транскрипционных программ. Эти программы способствуют росту и дифференцировке клеток, а также индукции генов, кодирующих цитокины (интерлейкин (ИЛ)-6, ИЛ-8, моноцитарный хемотаксический фактор-1, тканевой фактор, молекулы межклеточной адгезии-1) и белки внеклеточного матрикса (фактор роста соединительной ткани, коллаген, фибронектин). Сигнализация FXa высокоспецифична и зависит от типа клеток. FXa индуцирует пролиферацию фибробластов, гладкомышечных клеток сосудов или мезангиальных клеток почек, но не эндотелиальных клеток или лейкоцитов [16].
Первые эксперименты по исследованию негемостатических функций FXa, в которых проводилась делеция экспрессирующих FX генов у подопытных животных, приводили к их гибели при внутриутробном развитии либо сразу после рождения [19], что свидетельствовало не только о участии FXa в коагуляционном каскаде реакций, но и о его сигнальных функциях [17].
Однако плейотропные эффекты наблюдались и у антикоагулянта раннего поколения — варфарина.
Варфарин блокирует K-зависимое γ-карбоксилирование глутаминовых кислот [20] и богатый γ-карбок- сиглутаминовой кислотой домен growth arrest-specific 6 gene (Gas 6), необходимый для индуцирования активности тирозинкиназы Axl [21].
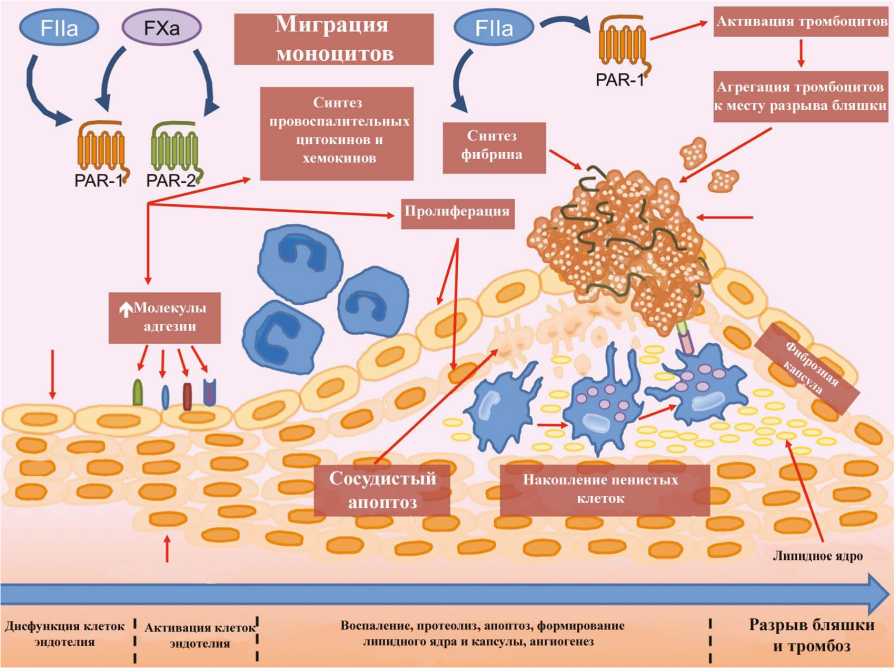
Рисунок 2. Патофизиология атеротромбоза, роль FXa и тромбина [61]
Figure 2. Pathophysiology of atherothrombosis, the role of FXa and thrombin [61]
Белок гена Gas6 представляет собой протеин, имеющий последовательность аминокислот, на 46—48 % идентичную с белком S — сывороточным белком, который отрицательно воздействует на свертывание крови [22]. Однако биологическая функция белка гена Gas6 оставалась неизвестной в течение нескольких лет, пока не было установлено, что данный белок является лигандом для рецепторов цитокинов Axl [23]. Axl представляет собой рецепторную тирозинкиназу с внеклеточными доменами, состоящими из двух доменов иммуноглобулина и двух доменов фибронекти- на типа III, который напоминает молекулы клеточной адгезии [24, 25]. Axl относится к семейству рецепторных тирозинкиназ TAM (Tyro3, Axl и Mer). Все три члена семьи имеют сходные структуры и имеют ряд лигандов, включая белок, кодируемый геном Gas6, и белок S. В тканях человека рецепторы тирозинкиназы ТАМ способствуют регуляции иммунного ответа, включая клиренс апоптотических клеток и ингибирование цитотоксической иммунной активации в ответ на апоптоз. Тирозинкиназные рецепторы ТАМ также участвуют в активации тромбоцитов и стабилизации сгустка крови [12].
Подобно белку S и другим К-зависимым белкам, таким как факторы свертывания, белок гена Gas6 содержит кластер из 11—12 остатков глутаминовой кислоты на его N-конце, который посттрансляционно модифицируется γ-карбоксилазой в γ-карбоксиглутаматы в присутствии витамина K [12]. Эта модификация избирательно ингибируется варфарином [26].
Прямые антикоагулянты и атеросклероз
Ключевыми игроками процесса развития атеросклероза сосудистой стенки являются макрофагальные клетки [27]. FXa способствует экспрессии воспалительных молекул в клетках эндотелия сосудов, что ведет к вовлечению моноцитов/макрофагов в реакцию воспаления в сосудистой стенке (рис. 2). Именно эта реакция является триггером развития атеросклероза [28] и его прогрессии [15]. FX поддерживает прокоагулянтное состояние и воспаление сосудистой стенки при атеросклеротическом поражении [29] (рис. 3).
В основе антиатеросклеротического действия перо- ральных антикоагулянтов прямого действия лежит
ремоделирование внеклеточного матрикса липидных бляшек [30]. Блокада взаимодействия FXa с PAR с целью уменьшения воспаления может стать новой мишенью при терапии атеросклеротических поражений сосудистой стенки.
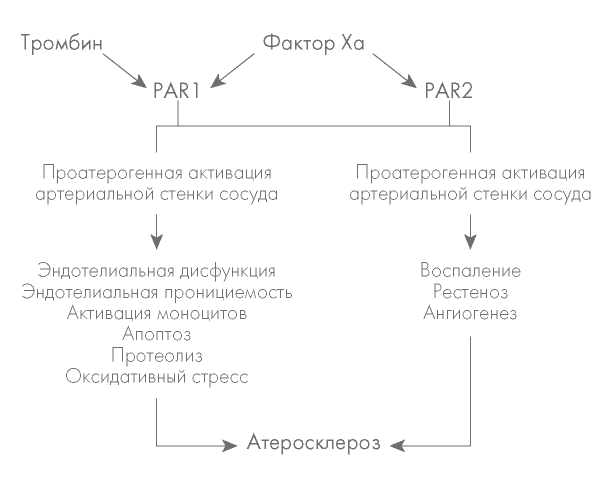
Рисунок 3. Участие PAR-1 и PAR-2 в развитии атеросклероза [62]
Figure 3. Participation of PAR-I and PAR-2 in the development of atherosclerosis [62]
Hara T. и соавт. [31] в своем исследовании подтвердили антиатеросклеротическое действие ривароксабана — прямого ингибитора FXa. Малые дозы ривароксабана, при которых он не влияет на систему свертывания крови, оказывают атеропротективное действие.
Kadoglou N.P.E. и соавт. [32] исследовали влияние дабигатрана, ингибитора тромбина, на атеросклеротические поражения у мышей. Применение дабигатра- на в течение 12 недель заметно уменьшало развитие атеросклероза. Стабилизация бляшки проявлялась в виде уменьшения площади атеросклеротического поражения, прочности капсулы, степени стеноза сосуда, содержания липидов внутри бляшки, а также количества макрофагов и воспалительных цитокинов, что косвенно свидетельствовало и об ослаблении воспалительной реакции.
Похожие результаты были получены и в исследовании Bea F. и соавт. [33]. Увеличение количества гладкомышечных клеток, образование более толстых фиброзных колпачков, замедление эрозии, обнаруженные при длительном применении мелагатрана, демонстрируют стабилизирующий эффект ингибирования FXa. Мелагатран снижает активность связывания ДНК c нуклеарным фактором kB (nuclear factor kB — NF-kB) и белком-активатором-1 (Activator protein — AP-1) и таким образом приводит к снижению синтеза матриксной металлопротеиназы-9, что обусловливает вышеперечисленные эффекты. NF-kB и AP-1 являются важными регуляторами транскрипции матриксной металлопротеиназы-9 [34].
Zhou Q. и соавт. [35] выявили у мышей утолщения фиброзной покрышки, уменьшение количества эрозий атеросклеротических бляшек в результате длительной терапии ривароксабаном.
Вышеприведенные исследования прямых перораль- ных антикоагулянтов были проведены на животных и требуют дальнейшего клинического изучения.
Katoh H. и соавт. [36] изучили плейотропные эффекты ингибиторов FXa у больных с фибрилляцией предсердий. Об антиатеросклеротическом и противовоспалительном действиях ингибиторов FXa свидетельствовало снижение концентраций таких медиаторов, как пентраксинзависимый протеин-3, D-димер, тромбомодулин, ИЛ-6 в крови.
Таким образом, новые антикоагулянты прямого действия способны ослаблять прогрессию и дестабилизацию атеросклеротического поражения.
Прямые антикоагулянты и ремоделирование сердца
Фибрилляция предсердий нередко сопровождается ремоделированием предсердий, которое характеризуется их увеличением, гипертрофией кардиомио- цитов и развитием периваскулярного фиброза. Этот вид аритмии часто наблюдается у больных, страдающих синдромом ночного апноэ. Гипоксия, которая наблюдается при ночном апноэ, в свою очередь, также способствует ремоделированию сердца с развитием как систолической, так и диастолической дисфункции, возникающей вследствие повышения экспрессии PAR-1,2 и NF-kB в предсердиях [37— 39].
Плейотропный эффект новых пероральных антикоагулянтов относится и к процессам ремоделирования сердца. В работе Azuma M. и соавт. [38] отмечается, что терапия ривароксабаном влияет на экспрессию мРНК PAR-1, -2, внеклеточной сигналрегулирующей киназы, NF-kB и на дегенерацию мелких артерий.
В другом исследовании Mitsuishi R. и соавт. [39] использовался иной подход, при котором воздействовали ривароксабаном на оба рецептора, а также дискретно антагонистом PAR-1 и антагонистом PAR-2. Во всех трех группах отмечалось предотвращение процессов ремоделирования миокарда предсердий. В группе с антагонистом PAR-1 наблюдался наиболее значительный эффект, что свидетельствует о немаловажной роли PAR-1 в процессе ремоделирования предсердий.
PAR-2, активируемые тромбином, вносят вклад в патогенез развития хронической сердечной недостаточности и гипертрофии стенок сердца [40]. Активация PAR-2 индуцирует гипертрофический рост кардиомиоцитов и увеличивает экспрессию моноцитарного хемотаксического фактора-1. В свою очередь, дефицит PAR-2 ослабляет процессы ремоделирования сердца и улучшает его функцию после ишемического события [40].
Goto M. и соавт. [41] оценивали вторичную профилактику сердечно-сосудистых осложнений после ишемии миокарда у мышей. В исследовании участвовали группы животных, которые получали высокие или низкие дозы ривароксабана. В обеих исследуемых группах наблюдалось снижение экспрессий мРНК ИЛ-6 и мРНК фиброзных факторов, включая коллагены 1a2 и 3a1. Таким образом, ингибиторы FXa препятствуют быстрой прогрессии ремоделирования сердца путем ослабления процессов воспаления и фиброза, связанного со снижением экспрессии PAR в сердце независимо от его антикоагулянтного эффекта.
Антикоагулянты и ангиогенез
Рост и восстановление сосудов зависят от многих факторов. Одним из них является пролиферация эндотелиальных клеток-предшественников, известных как предикторы эндотелиального восстановления. Ингибиторы FXa усиливают экспрессию факторов роста сосудов, стимулируют миграцию клеток-предшественников и улучшают их функцию, что указывает на их ангиогенный плейотропный эффект [42].
Wu T.C. и соавт. [43] доказали, что ривароксабан усиливает экспрессию фактора роста эндотелия сосудов и эндотелиальной синтазы оксида азота, улучшает функцию клеток-предшественников на модели экспериментально индуцированного диабета у животных.
FХа способен ингибировать ангиогенез посредством воздействия на PAR-1 [44, 45]. Yavuz C. и соавт. [46] подтвердили, что ривароксабан дозозависимо оказывает влияние на ангиогенез.
Axl также экспрессируется на эндотелиальных клетках сосудов и играет роль в ангиогенезе [47]. Варфа- рин, в свою очередь, также влияет на процессы ангиогенеза посредством уменьшения активации Axl тирозинкиназ. Axl является ключевым регулятором многих патологических ангиогенных процессов, таких как миграция и пролиферация эндотелиальных клеток, образование сосудов. Ингибирование Axl изменяет ангиогенный баланс, приводя эндотелиальные клетки в более спокойное, стабильное, дифференцированное состояние [12].
Антикоагулянты и воспаление
Воспаление имеет особое значение в развитии атеросклеротического поражения. Признаки локального неспецифического воспалительного процесса при атеросклерозе прослеживаются с самых ранних стадий поражения стенки сосуда и до момента дестабилизации и повреждения атеросклеротической бляшки [48]. Атеросклероз связан не только с образованием и прогрессированием атеросклеротических бляшек, но также считается системным воспалительным заболеванием, которое модулируется генетическими и экологическими факторами риска. Длительное воспаление атеросклеротического поражения способствует разрыву бляшки и образованию тромба, который участвует в развитии ишемии и последующего инфаркта миокарда [30, 49]. Было установлено, что FXa вызывает острые воспалительные реакции in vivo [50] и in vitro [51—53]. FXa активирует тромбин, который участвует в воспалительных процессах, образуя комплексы с тромбомодулином и активированным протеином C, которые уменьшают адгезию лейкоцитов, инфильтрацию эндотелия сосудов моноцитами и вызывают высвобождение цитокинов [54].
В инициации процесса атеросклероза большое значение имеют такие медиаторы воспаления, как моноцитарный хемотаксический фактор-1, фактор некроза опухолей-α (ФНО-α), ИЛ-1, ИЛ-6, ИЛ-8 [55]. Коагуляция тесно связана с воспалительными сигнальными путями. Показано, что антикоагулянтное лечение не только уменьшает активацию коагуляции, но также ингибирует воспаление, указывая на общность этих процессов [56].
В работе Zhou Q. и соавт. [35] отмечено уменьшение прогрессирования атеросклеротической бляшки за счет снижения воспаления у мышей, получавших ривароксабан. Долгосрочное применение риварокса- бана значительно уменьшало экспрессию мРНК IL-6, ФНО-α и моноцитарного хемотаксического фактора-1, что демонстрирует противовоспалительные свойства ингибитора FXa. Однако в исследовании Hara T. и соавт. [31] было отмечено, что только в группе мышей, получавших низкую дозу ривароксабана, наблюдался значительный противовоспалительный эффект.
Terry C.M. и соавт. [57] также наблюдали снижение концентрации воспалительного медиатора, моноцитарного хемотаксического фактора-1, в крови исследованных мышей.
Варфарин также играет роль в регуляции взаимодействующих цитокинов, таких как ИЛ-6 и циклооксигеназа-2 (ЦОГ-2). Эти цитокины являются взаимодействующими, потому что внутриклеточный механизм действия ЦОГ-2 стимулирует транскрипцию гена, кодирующего ИЛ-6 [58].
В исследовании Shafiq и соавт. [10] была отмечена корреляция концентраций ИЛ-6 и ЦОГ-2 у больных, принимавших варфарин. Концентрации ИЛ-6 и ЦОГ-2 значительно снижались при низкой дозе препарата и заметно увеличивались при высокой дозе. На основании результатов исследования можно сказать, что варфарин оказывает противовоспалительное действие, уменьшая экспрессию ЦОГ-2, что ведет к снижению продукции ИЛ-6.
Таким образом, прямые ингибиторы FXa обладают не только антикоагулянтным, но и противовоспалительным э фф ектом.
Варфарин и опухолевый рост
Экспрессия и активность Axl имеют решающее значение для выживаемости, эпителиально-мезенхимального перехода, метастатического потенциала многих типов злокачественных клеток [11].
Противоопухолевая активность варфарина связана с ингибированием Gas6-опосредованной активации Axl на опухолевых клетках. Варфарин ингибирует активацию Axl, опосредованную Gas6, в концентрациях, при которых препарат не влияет на процессы свертывания крови. Нарушается передача сигнала Gas6-Axl, требуемая для жизнедеятельности опухолевой клетки. Также ингибирование передачи сигналов Axl связано с потерей признака злокачественной опухолевой клетки — метастазирования [12].
Варфарин и гломерулярная патология
Yanagita Ж. и соавт. [14] продемонстрировали, что белок гена Gas6 является аутокринным фактором роста для мезангиальных клеток и то, что варфарин ингибирует пролиферацию мезангиальных клеток путем уменьшения продукции белка гена Gas6, препятствуя К-витамин-зависимому γ-карбоксилированию его домена Gla. Антипролиферативный эффект варфарина был достигнут при концентрациях ниже терапевтических.
В другом исследовании Yanagita Ж. и соавт. [13] показали, что путь Gas6/Axl играет ключевую роль в пролиферации мезангиальных клеток.
В работе Nagai K. и соавт. [59] у крыс с индуцированным стрептозотоцином диабетом такие признаки ранней фазы диабетической нефропатии, как гломерулярная гипертрофия, повышенная скорость клубочковой фильтрации и альбуминурия, наблюдались через 12 недель после инъекции стрептозотоцина. В клубочках почек этих крыс была увеличена экспрессия Gas6 и Axl. Введение варфарина крысам со стрептозотоцин-индуцированным диабетом уменьшало альбуминурию, гломерулярную гипертрофию и скорость клубочковой фильтрации. Более того, у изучаемых крыс наблюдали меньшую мезангиальную пролиферацию и клубочковую гипертрофию.
Таким образом, антикоагулянты, помимо влияния на гемостаз, проявляют плейотропные эффекты, связанные с различными патофизиологическими процессами. Необходимо дальнейшее изучение подобных эффектов с целью установления участия коагуляционных факторов в патогенезе различных заболеваний, поскольку многие из приведенных исследований были одномоментными, в некоторых были использованы лишь неинвазивные методы оценки. Предстоит многое узнать о плейотропных эффектах антикоагулянтов, чтобы полностью оценить возможности их влияния на процессы гемостаза.
Список литературы
1. Jones M., McEwan P., Morgan C.L., et al. Evaluation of the pattern of treatment, level of anticoagulation control, and outcome of treatment with warfarin in patients with non-valvar atrial fibrillation: a record linkage study in a large British population. Heart. 2005; 91: 472–77. DOI: dx.doi.org/10.1136/hrt.2004.042465
2. Takeuchi F., McGinnis R., Bourgeois S., et al. A Genome-Wide Association Study Confirms VKORC1, CYP2C9, and CYP4F2 as Principal Genetic Determinants of Warfarin Dose. PLoS Genet. 2009; 5(3): 100–33. DOI: doi. org/10.1371/journal.pgen.1000433
3. Hankey G.J., Patel M.R., Stevens S.R., et al. Rivaroxaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of ROCKET AF. The Lancet Neurology. 2012; 11: 315–22. DOI: 10.1016/S1474-4422(12)70042-X
4. Connolly S.J., Ezekowitz M.D., Phil D., et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009; 361: 1139–51. DOI: 10.1056/ NEJMoa0905561
5. Schulman S., Kearon C., Kakkar A.K., et al. Extended Use of Dabigatran, Warfarin, or Placebo in Venous Thromboembolism. N Engl J Med. 2013; 368: 709–18. DOI: 10.1056/NEJMoa1113697
6. Mega J.L., Braunwald E., Wiviott S.D., et al. Rivaroxaban in Patients with a Recent Acute Coronary Syndrome. N Engl J Med. 2012; 366: 9–19. DOI: 10.1056/ NEJMoa1112277
7. Gillis A.M., Krahn A.D., Skanes A.C., Nattel S. Management of Atrial Fibrillation in the Year 2033: New Concepts, Tools, and Applications Leading to Personalized Medicine; Can. J Cardiol. 2013; 29: 1141–6. DOI: 10.1016/j. cjca.2013.07.006
8. Papadaki S., Tselepis A.D. Non-haemostatic functions of Factor Xa: Are there pleiotropic effects of the direct oral anti-Xa anticoagulants? Hellenic Journal of Atherosclerosis. 2015; 6(3): 168–79. DOI: 10.23803/hja.v6i3.12
9. Spronk H.M.H., de Jong A.M., Crijns H.J., et al. Pleiotropic effects of factor Xa and thrombin: what to expect from novel anticoagulants. Cardiovascular Research. 2014; 101: 344–51. DOI: 10.1093/cvr/cvt343
10. Shafiq H., Rashid A., Majeed A. Effects of different warfarin doses on IL-6 and COX-2 levels. Pak Armed Forces Med J. 2016; 66(5): 673–75.
11. Levin P.A., Brekken R.A., Byers L.A., et al. Axl receptor axis: a new therapeutic target in lung cancer. J Thorac Oncol. 2016; 11(8): 1357–62. DOI: 10.1016/j. jtho.2016.04.015
12. Kirane A., Ludwig K.F., Sorrelle N., et al. Warfarin blocks Gas6-mediated Axl activation required for pancreatic cancer epithelial plasticity and metastasis; Cancer Res. 2015; 75(18): 3699–705. DOI: 10.1158/0008-5472.CAN-14-2887-T
13. Yanagita M., Arai H., Ishii K., et al. Gas6 regulates mesangial cell proliferation through Axl in experimental glomerulonephritis. Am J Pathol. 2001; 158: 1423–32. DOI: 10.1016/S0002-9440(10)64093-X
14. Yanagita M., Ishii K., Ozaki H., et al. Mechanism of inhibitory effect of warfarin on mesangial cell proliferation. J Am Soc Nephrol. 1999; 10: 2503–9.
15. Esmon C.T. Targeting factor Xa and thrombin: impact on coagulation and beyond. Thromb Haemost. 2014. 111: 625–33. DOI: 10.1160/TH13-09-0730
16. Borensztajn K., Peppelenbosch M.P., Spek C.A. Factor Xa: at the crossroads between coagulation and signaling in physiology and disease. Trends Mol Med. 2008; 14: 429–40. DOI: 10.1016/j.molmed.2008.08.001
17. Fan Y., Zhang W., Mulholland M. Thrombin and PAR-1-AP Increase Proinflammatory Cytokine Expression in C6 Cells. J Surg Res. 2005; 129: 196–201. DOI: 10.1016/j.jss.2005.07.041
18. Nystedt S., Emilsson K., Wahlestedt C., Sundelin J. Molecular cloning of a potential proteinase activated receptor. Proc Natl Acad Sci USA. 1994; 91(20): 9208–12.
19. Rosen E.D. Gene targeting in hemostasis. Factor X. Frontiers Bioscience: A J Virtual Library. 2002; 7: 1915–25.
20. Nakano T., Kawamoto K., Kishino J., et al. Requirement of gamma-carboxyglutamic acid residues for the biological activity of Gas6: contribution of endogenous Gas6 to the proliferation of vascular smooth muscle cells. Biochem J. 1997; 323: 387–92.
21. Varnum B.C., Young C., Elliott G., et al. Axl receptor tyrosine kinase stimulated by the vitamin K-dependent protein encoded by growth-arrest-specific gene 6. Nature. 1995; 373: 623–6. DOI: 10.1038/373623a0
22. Manfioletti G., Brancolini C., Avanzi G., Schneider C. The protein encoded by a growth arrest-specific gene (gas6) is a new member of the vitamin K dependent proteins related to protein S, a negative coregulator in the blood coagulation cascade. Mol Cell Biol. 1993; 13: 4976–85. DOI: 10.1128/MCB.13.8.4976
23. Stitt T.N., Conn G., Gore M., et al. The anticoagulation factor protein S and its relative, Gas6, are ligands for the Tyro 3/Axl family of receptor tyrosine kinases. Cell. 1995; 80: 661–70. DOI: 10.1016/0092-8674(95)90520-0
24. O’Bryan J.P., Frye R.A., Cogswell P.C., et al. Axl, a transforming gene isolated from primary human myeloid leukemia cells, encodes a novel receptor tyrosine kinase. Mol Cell Biol. 1991; 11: 5016–31. DOI: 10.1128/MCB.11.10.5016
25. Janssen J.W., Schulz A.S., Steenvoorden A.C., et al. A novel putative tyrosine kinase receptor with oncogenic potential. Oncogene. 1991; 6(11): 2113–20.
26. Suttie J.W. Vitamin K-dependent carboxylase. Annu Rev Biochem. 1985; 54: 459–77. DOI: 10.1146/annurev.bi.54.070185.002331
27. Boyle J.J. Macrophage Activation in Atherosclerosis: Pathogenesis and Pharmacology of Plaque Rupture. Current Vascular Pharmacology. 2005; 3: 63–8. DOI: 10.2174/1570161052773861
28. Hansson G.K. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005; 352: 1685–95. DOI: 10.1056/NEJMra043430
29. Giesen P.L., Rauch U., Bohrmann B., et al. Blood-borne tissue factor: another view of thrombosis. Proc Natl Acad Sci USA. 1999; 96(5): 2311–5.
30. Lee I.O., Kratz M.T., Schirmer S.H., et al. The Effects of Direct Thrombin Inhibition with Dabigatran on Plaque Formation and Endothelial Function in Apolipoprotein E-Deficient Mice. J. Pharmacol Exp Ther. 2012; 343(2): 253–7. DOI: 10.1124/jpet.112.194837
31. Hara T., Fukuda D., Tanaka K., et al. Rivaroxaban, A Novel Oral Anticoagulant, Attenuates Plaque Progression in ApoE-Deficient Mice Through the Inhibition of Pro-Inflammatory Activation of Macrophages. Am Heart Assoc, Circulation. 2015; 242: 639–46. DOI: 10.1016/j.atherosclerosis.2015.03.023
32. Kadoglou N.P.E., Moustardas P., Katsimpoulas M., et al. The Beneficial Effects of a Direct Thrombin Inhibitor, Dabigatran Etexilate, on the Development and Stability of Atherosclerotic Lesions in Apolipoprotein E-deficient Mice. Cardiovasc Drugs Ther. 2012; 26: 367–74. DOI: 10.1007/s10557-012-6411-3
33. Bea F., Kreuzer J., Preusch M., et al. Melagatran Reduces Advanced Atherosclerotic Lesion Size and May Promote Plaque Stability in Apolipoprotein E– Deficient Mice. Arterioscler Thromb Vasc Biol. 2006; 26: 2787–92. DOI: 10.1161/01.ATV.0000246797.05781
34. Turner N.A., O’Regan D.J., Ball S.G., Porter K.E. Simvastatin inhibits MMP-9 secretion from human saphenous vein smooth muscle cells by inhibiting the RhoA/ ROCK pathway and reducing MMP-9 mRNA levels. FASEB J. 2005; 19(4): 804– 6. DOI: 10.1096/fj.04-2852fje
35. Zhou Q., Bea F., Preusch M., et al. Evaluation of Plaque Stability of Advanced Atherosclerotic Lesions in Apo E-Deficient Mice after Treatment with the Oral Factor Xa Inhibitor Rivaroxaban. Hindawi Publishing Corporation Mediators of Inflammation. 2011; 2011: 9. DOI: 10.1155/2011/432080
36. Katoh H., Nozue T., Michishita I. Anti-inflammatory effect of factor-Xa inhibitors in Japanese patients with atrial fibrillation. Heart and Vessels. 2017; 32: 1130–6. DOI: 10.1007/s00380-017-0962-y
37. Dimitri H., Ng M., Brooks A.G., Kuklik P., et al. Atrial remodeling in obstructive sleep apnea: Implications for atrial fibrillation. Heart Rhythm. 2012; 9: 321–7. DOI: 10.1016/j.hrthm.2011.10.017
38. Azuma M., Yoshimura F., Tanikawa S., et al. Factor XA Inhibition by Rivaroxaban Attenuates Cardiac Remodeling Due To Hypoxic Stress VIA PAR-2/ ERK/NF-κB Signaling Pathway. JACC. 2016; 67: 2238. DOI: 10.1016/S0735- 1097(16)32239-2
39. Mitsuishi R., Imano H., Kato R., et al. Rivaroxaban Attenuates Cardiac Remodeling Due To Intermittent Hypoxia By Suppressing The Synergistic Effects Of PAR-1 And PAR-2. JACC. 2017; 69: 2033. DOI: 10.1016/S0735-1097(17)35422-0
40. Antoniak S., Sparkenbaugh E.M., Tencati M., et al. Protease activated receptor-2 contributes to heart failure. PLoS One. 2013; 8(11): 81733. DOI: 10.1371/ journal.pone.0081733
41. Goto M., Miura S.I., Suematsu Y., et al. Rivaroxaban, a factor Xa inhibitor, induces the secondary prevention of cardiovascular events after myocardial ischemia reperfusion injury in mice. Intl J Cardiol. 2016; 220: 602–7. DOI: 10.1016/j. ijcard.2016.06.212
42. Maruyama K., Asai J., Ii M., et al. Decreased macrophage number and activation lead to reduced lymphatic vessel formation and contribute to impaired diabetic wound healing. Am J Pathol. 2007; 170: 1178–91. DOI: 10.2353/ajpath.2007.060018
43. Wu T.C., Chan J.S., Lee C.Y., et al. Rivaroxaban, a factor Xa inhibitor, improves neovascularization in the ischemic hindlimb of streptozotocin-induced diabetic mice. Cardiovascular Diabetology. 2015; 14: 81. DOI: 10.1186/s12933- 015-0243-y
44. Lange S., Gonzalez I., Pinto M.P., et al. Independent anti-angiogenic capacities of coagulation factors X and Xa. J Cell Physiol; 2014; 229: 1673–80. DOI: 10.1002/jcp.24612
45. Herbert J., Bono F., Herault J., et al. Effector protease receptor 1 mediates the mitogenic activity of factor Xa for vascular smooth muscle cells in vitro and in vivo. J Clin Invest. 1998; 101(5): 993–1000. DOI: 10.1172/JCI1833
46. Yavuz C., Caliskan A., Karahan O., et al. Investigation of the antiangiogenic behaviors of rivaroxaban and low molecular weight heparins. Blood Coagul Fibrinolysis. 2014; 25: 303–8. DOI: 10.1097/MBC.0000000000000019
47. Holland S.J., Powell M.J., Franci C., et al. Multiple Roles for the Receptor Tyrosine Kinase Axl in Tumor Formation. Cancer Res. 2005; 65(20): 9294–303. DOI: 10.1158/0008-5472.CAN-05-0993
48. Maseri A., Cianflone D. Inflammation in acute coronary syndromes. Eur Heart J. 2002; 4: 8–13. DOI: 10.1016/S1520-765X(02)90009-X
49. Libby P. Current concepts of the pathogenesis of the acute coronary syndromes. Am Heart Assoc Circulation. 2001; 104: 365–72. DOI: 10.1161/01. CIR.104.3.365
50. Cirino G., Cicala C., Bucci M., et al. Factor Xa as an interface between coagulation and inflammation: Molecular mimicry of factor Xa association with effector cell protease receptor-1 induces acute inflammation in vivo. J Clin Invest. 1997; 99(10): 2446–51. DOI: 10.1172/JCI119428
51. Ruf W., Dorfleutner A., Riewald M. Specificity of coagulation factor signaling. Journal of Thrombosis and Haemostasis. 2003; 1: 1495–503. DOI: 10.1046/j.1538-7836.2003.00300.x
52. Hezi-Yamit A., Wong P.W., Bien-Ly N., et al. Synergistic induction of tissue factor by coagulation factor Xa and TNF: evidence for involvement of negative regulatory signaling cascades. Proceedings of the National Academy of Sciences of the United States of America. 2005; 102(34): 12077–82. DOI: 10.1073/ pnas.0504526102
53. Daubie V., Cauwenberghs S., Senden N.M.H., et al. Factor Xa and thrombin evoke additive calcium and proinflammatory responses in endothelial cells subjected to coagulation. Biochimica et Biophysica Acta — Molecular Cell Research. 2006; 1763: 860–9. DOI: 10.1016/j.bbamcr.2006.04.010
54. Stephenson D.A., Toltl L.J., Beaudin S., Liaw P.C. Modulation of monocyte function by activated protein c, a natural anticoagulant. J Immunol. 2006; 177(4): 2115–22. DOI: 10.4049/jimmunol.177.4.2115
55. Packard R.R.S., Libby P. Inflammation in atherosclerosis: from vascular biology to biomarker discovery and risk prediction. Clinical Chemistry. 2008; 54(1): 24–38. DOI: 10.1373/clinchem.2007.097360
56. Dorffler-Melly J., Schwarte L.A., Ince C., Levi M. Mouse models of focal arterial and venous thrombosis. Basic Research in Cardiology. 2000; 95: 503–9.
57. Terry C.M., He Y., Cheung A.K. Rivaroxaban improves patency and decreases inflammation in a mouse model of catheter thrombosis. Thrombosis Research. 2016; 114: 106–12. DOI: 10.1016/j.thromres.2016.06.008
58. Moon Y., Pestka J.J. Cyclooxygenase-2 mediates interleukin-6 upregulation by vomitoxin (deoxynivalenol) in vitro and in vivo. Toxicol Appl Pharmacol. 2003; 187(2): 80–8. DOI: 10.1016/S0041-008X(02)00033-9
59. Nagai K., Arai H., Yanagita M., et al. Growth arrest-specific gene 6 is involved in glomerular hypertrophy in the early stage of diabetic nephropathy. J Biol Chem. 2003; 278: 18229–34. DOI: 10.1074/jbc.M213266200
60. Borissoff J.I., Spronk H.M.H., ten Cat H. The Hemostatic System as a Modulator of Atherosclerosis. N Engl J Med. 2011; 364: 1746–1760. DOI: 10.1056/ NEJMra1011670
61. Esmon C.T. Targeting factor Xa and thrombin: impact on coagulation and beyond. J Thromb Haemost. 2014; 111: 625–33. DOI: 10.1160/TH13-09-0730
62. Spronk H.M.H., de Jong A.M., Crijns H.J., et al. Pleiotropic effects of factor Xa and thrombin: what to expect from novel anticoagulants. Cardiovascular Research. 2014; 101: 344–51. DOI: 10.1093/cvr/cvt343
Об авторах
Г. С. ГаляутдиновРоссия
Галяутдинов Геншат Саляхутдинович, доктор медицинских наук, профессор кафедры госпитальной терапии
Л. И. Фейсханова
Россия
Фейсханова Люция Исхаковна, кандидат медицинских наук, доцент кафедры госпитальной терапии
Ш. П. Абдуллаев
Россия
Абдуллаев Шохрух Пардабойевич, студент лечебного факультета
Рецензия
Для цитирования:
Галяутдинов Г.С., Фейсханова Л.И., Абдуллаев Ш.П. ПЛЕЙОТРОПНЫЕ ЭФФЕКТЫ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ. Гематология и трансфузиология. 2019;64(1):90-98. https://doi.org/10.35754/0234-5730-2019-64-1-90-98
For citation:
Galyautdinov G.S., Feiskhanova L.I., Abdullaev Sh.P. PLEIOTROPIC EFFECTS OF ORAL ANTICOAGULANTS. Russian journal of hematology and transfusiology. 2019;64(1):90-98. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-90-98











































