Перейти к:
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПОЛИМОРФНЫХ ВАРИАНТОВ ГЕНОВ CYP3A5 И hOCT1 У БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В РЕСПУБЛИКЕ БАШКОРТОСТАН
https://doi.org/10.35754/0234-5730-2019-64-2-165-174
Аннотация
Введение. У больных хроническим миелолейкозом (ХМЛ) в зависимости от наличия или отсутствия мутаций в гене ВСR-АВL, а также от типа мутаций, наблюдается различный терапевтический эффект при лечении ингибиторами тирозинкиназ (ИТК).
Цель работы: установить прогностическое значение полиморфных вариантов генов, участвующих в метаболизме ИТК: CYP3A5 и hOCT1 у больных ХМЛ в республике Башкортостан (РБ).
Материал и методы. Генетические исследования проведены у 114 больных с клинически и цитогенетически установленным диагнозом хронического миелолейкоза (ХМЛ). Мужчин было 55, женщин 59, медиана возраста составила 43 года (от 14 до 76 лет). Все больные получали лечение ИТК согласно национальным клиническим рекомендациям и критериям European Leukemia Net. Для сравнения больных с различной эффективностью лечения была сформирована группа из 64 больных, резистентных к проводимой терапии. Сравниваемые группы были сопоставимы по полу и возрасту. Анализ полиморфных ДНК-локусов генов hOCT1 и CYP3A5 осуществляли методом полимеразной цепной реакции синтеза ДНК и ПДРФ-анализом с последующим электрофорезом в 7–8 % полиакриламидном геле.
Результаты. Не было обнаружено выраженных различий в распределении частот аллелей и генотипов полиморфного локуса rs776746 гена изофермента P3A5 цитохрома p450 (CYP3A5) (p > 0,05) между больными ХМЛ, у которых была разная эффективность лечения ИТК. При сравнении распределения частот аллелей и генотипов полиморфного варианта rs683369 в гене переносчике органических катионов (hOCT1) обнаружено, что генотип *C*C статистически значимо чаще выявлялся у больных с оптимальным ответом на лечение по сравнению с больными, резистентными к лечению. Частота встречаемости генотипа *С*G была почти в два раза выше у больных ХМЛ, резистентных к терапии, — 42,86 %, по сравнению с группой больных с оптимальным ответом на лечение ИТК — 21,88 %.
Заключение. У больных ХМЛ исследование полиморфного локуса rs683369 гена hOCT1 в отличие от rs776746 гена CYP3A5 имеет прогностическое значение в оценке эффективности лечения ИТК. Частота встречаемости генотипа *С*G была значимо выше у больных ХМЛ, резистентных к терапии ИТК, генотип G*G* встречался реже и был ассоциирован с наименьшей продолжительностью жизни, а наличие генотипа С*С* оказалось благоприятным для общей выживаемости больных.
Ключевые слова
Для цитирования:
Сафуанова Г.Ш., Рябчикова Н.Р., Хуснутдинова Э.К., Каримов Д.О., Минниахметов И.Р. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПОЛИМОРФНЫХ ВАРИАНТОВ ГЕНОВ CYP3A5 И hOCT1 У БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В РЕСПУБЛИКЕ БАШКОРТОСТАН. Гематология и трансфузиология. 2019;64(2):165-174. https://doi.org/10.35754/0234-5730-2019-64-2-165-174
For citation:
Safuanova G.Sh., Ryabchikova N.R., Khusnutdinova E.K., Karimov D.O., Minniakhmetov I.R. PROGNOSTIC VALUE OF CYP3A5 AND hOCT1 POLYMORPHIC GENE VARIANTS IN PATIENTS WITH CHRONIC MYELOID LEUKEMIA IN THE REPUBLIC OF BASHKORTOSTAN. Russian journal of hematology and transfusiology. 2019;64(2):165-174. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-165-174
Введение
В настоящее время накоплено большое количество данных о распространенности, заболеваемости, принципах диагностики и лечения больных хроническим миелолейкозом (ХМЛ) [1]. Успехи терапии позволили существенно изменить продолжительность и качество жизни больных ХМЛ и даже добиваться их излечения [2]. Однако существует проблема развития резистентности и прогрессии заболевания [3—6]. Проводятся исследования по изучению молекулярно-генетических основ ХМЛ, прогноза эффективности таргетной терапии на основании биологических характеристик ХМЛ и понимания молекулярно-биологических механизмов развития резистентности лечения [7—10]. Показано, что при наличии мутаций у больных с ХМЛ в 20 % случаев могут встречаться дополнительные хромосомные аберрации или комплексные аномалии, что значимо ухудшает 10-летнюю выживаемость и летальность у больных ХМЛ по сравнению с больными, не имеющими этих нарушений [11].
ХМЛ возникает в результате приобретенного повреждения хромосомного аппарата одной полипотентной стволовой клетки костного мозга. Причина такого повреждения хромосом у больных ХМЛ пока остается неизвестной [12—15]. Механизмом, обусловливающим развитие заболевания, является реципрокная транслокация t(9,22), (q34;q11), объединяющая гены тирозинкиназы ABLl (хромосома 9) с геном BCR (хромосома 22) с образованием филадельфийской хромосомы (РҺ+) [16]. При этом химерный белок ВСК-АВЬ1 обладает выраженной тирозинкиназной активностью, блокирует апоптоз и стимулирует автономную пролиферацию клеток [14, 17, 18]. На долю ХМЛ приходится 20 % от всех лейкозов у больных в возрасте 30—70 лет [6]. Ежегодно в России регистрируется около 2500 новых случаев ХМЛ (1—2 случая на 100 тыс. населения) [19]. Стандартизованная заболеваемость по 6 регионам России составляет 0,7-0,8 случаев на 100 000 населения [20].
В исследованиях установлены очень хорошие результаты лечения ингибиторами тирозинкиназ (ИТК), если к 12 месяцам терапии ИТК 1 линии достигается оптимальный ответ, то дальнейшая прогрессия исключается [15, 21]. Однако по мере накопления количества наблюдений становится очевидным, что число больных с резистентностью к иматинибу увеличивается с каждым годом [22]. Примерно у 15-30 % больных ХМЛ наблюдается первичная или вторичная резистентность к лечению иматинибом мезилатом [23-27]. Учитывая, что у больных ХМЛ, в зависимости от наличия или отсутствия мутаций в гене BCR-ABL, а также от типа мутаций, наблюдается различный терапевтический эффект на ИТК, актуальным является ранняя идентификация мутаций гена BCR-ABL, что позволяет своевременно определить факторы риска неблагоприятного прогноза течения заболевания, ответ на проводимую терапию и назначить адекватное лечение с целью получения ее максимальной эффективности [11]. Резистентность к терапии может проявляться и при отсутствии мутаций киназного домена, следовательно, есть необходимость изучения новых механизмов образования резистентного к лечению фенотипа, например генов, участвующих в метаболизме ИТК, наличия аберрантной экспрессии онкогенов и супрессоров опухолевого роста у больных ХМЛ [26, 28]. Поскольку в исследованиях, посвященных изучению однонуклеотидных полиморфизмов генов (SNR) при ХМЛ, чаще обнаруживалась ассоциация полиморфизма гена CYP3A5 (rs 7776746) и гена hOCTl M408V (rs628031) с ответом на лечение иматинибом, была изучена связь этих полиморфизмов с резистентностью к терапии и общей выживаемостью больных в многонациональной Республике Башкортостан (РБ) [29-31]. Однако изучение влияния этногенетических особенностей больных на полученные результаты не проводилось в связи с малочисленностью выборки. Все это свидетельствует о необходимости продолжения исследований в этой области для более полного понимания патогенетических механизмов развития заболевания и персонифицированного подхода к проводимому лечению в различных регионах.
Цель настоящей работы — установить прогностическое значение полиморфных вариантов генов, участвующих в метаболизме ИТК, CYP3A5 и hOCTl у больных ХМЛ, и оценить их влияние на эффективность лечения и продолжительность жизни.
Материал и методы
В работе использованы образцы ДНК, выделенные из периферической крови 114 больных (55 мужчин и 59 женщин), проживающих в Республике Башкортостан, с клинически и цитогенетически установленным диагнозом ХМЛ. Все больные получали лечение препаратом ИТК согласно рекомендациям Европейского общества по лечению лейкозов European Leukemia Net (ELN) [15]. В группе больных, включенных в исследование, медиана возраста на момент постановки диагноза составила 43 года (от 14 до 76 лет). На момент исследования у 100 (87,7 %) больных была хроническая фаза ХМЛ, у 11 (9,6 %) больных — стадия акселерации и у 3 (2,6 %) больных — стадия бластного криза. Длительность терапии составила от 6 до 205 мес. (медиана — 65,5 мес.).
Для сравнения больных с различной эффективностью лечения была сформирована группа из 64 больных, резистентных к проводимой терапии. Отсутствие гематологического и цитогенетического ответов после 3, 6, 12 и 18 мес. лечения, а также субоптималь- ный ответ и потеря уже достигнутого гематологического и цитогенетического ответов рассматривались как проявления резистентности. В эту группу входили 30 (47%) мужчин и 34 (53%) женщины, средний возраст — 46 лет. Сравниваемые группы были сопоставимы по полу и возрасту.
Исследование было одобрено этическим комитетом. Больные дали информированное согласие на участие в исследовании.
Анализ полиморфных ДНК-локусов генов hOCTl и CYP3A5 осуществляли методом полимеразной цепной реакции синтеза ДНК и ПДРФ-анализом с последующим электрофорезом в 7-8 % полиакриламидном геле.
Для определения полиморфных вариантов в генах hOCTl и CYP3A5, использовали метод полиморфизма длин рестрикционных фрагментов (ПДРФ). Для амплификации использовали реакционную смесь объемом 25 мкл, которая содержала 2,5 мкл 10 хTaq- буфера (67 мМ трис-HCl (pH 8,8), 16,6 мМ (NH4)2 SO4, 2,5мМ MgCl2, 0,01% Тween-20), 0,1 мкг геномной ДНК, смесь dNTP (dATP, dGTP, dCTP, dTTP по 200 мкМ каждого), 1 ед. ДНК-полимеразы Termus aquaticus (производства фирмы «Силекс», г. Москва) и 5-10 пМ локусспецифич- ных олигонуклеотидных праймеров. Результаты амплификации анализировали в 7 % полиакриламидном геле с последующей окраской в растворе бромистого этидия (конечная концентрация 0,1 мкг/мл) и визуализацией в проходящем УФ-свете при длине волны 312 нм.
После амплификации 10 мкл амплификата обрабатывали 5 единицами соответствующей рестриктазы согласно рекомендациям производителя. Результаты рестрикционного анализа оценивали при проведении электрофореза в 7 % ПААГ с последующим окрашиванием бромистым этидием и визуализации под ультрафиолетовыми лучами. Данные о полиморфных вариантах и названия рестриктаз представлены в таблице 1.
Таблица 1. Полиморфные варианты генов и названия рестриктаз, использованных при ПДРФ анализе
Table 1. Gene polymorphic variants of genes and restriction endonucleases applied for RFLP analysis
Ген, мкРНК Gene, microRNA | Полиморфный вариант, мутация Polymorphic variant, mutation | Рестриктаза Restriction Endonuclease |
|---|---|---|
hOCTl | rs683369 | PdmI (Fermentas) |
CYP3A5 | rs776746 | SspI (Fermentas) |
Статистическая обработка полученных данных проводились на персональном компьютере с использованием программы Microsoft Office Excel и пакета прикладных программ статистической программы Statistica 6.0 for Windows, SAS v.9.3. Для оценки продолжительности жизни в зависимости от генотипа полиморфных локусов генов CYP3A5 и hOCTl был проведен анализ выживаемости методом Каплана — Мейера.
Результаты
При установлении диагнозау всех больных ХМЛ в РБ проведен анализ по критериям риска J. Sokal, Euro [2], с классификацией риска на низкий, промежуточный и высокий (табл. 2).
Таблица 2. Структура больных ХМЛ по критериям риска
Table 2. Structure of patients with CML according to the risk criteria
Риск Risk | J. Sokal [2] | Euro [2] | ||
|---|---|---|---|---|
абс. abs. | % | абс. abs. | % | |
Низкий риск Low-risk | 63 | 34,3 | 120 | 65,2 |
Промежуточный риск Intermediate-risk | 81 | 44,0 | 51 | 27,7 |
Высокий риск High-risk | 40 | 21,7 | 13 | 7,1 |
Таким образом, у больных ХМЛ в РБ выявлялся преимущественно низкий и промежуточный риск прогрессии заболевания. Наблюдение и лечение больных ХМЛ в РБ не выявило каких-либо региональных особенностей заболевания и соответствовало критериям ELN, что позволило организовать диагностику и лечение этой категории больных по общемировым стандартам.
Ранее было показано, что у некоторых больных ХМЛ в РБ мутации киназного домена гена BCR-ABL являются одной из основных причин резистентности к терапии иматинибом [10]. Больные с выявленными мутациями исключались из дальнейшего исследования полиморфных вариантов генов.
С целью изучения BCR-ABL независимых механизмов резистентности к лечению ИТК у больных ХМЛ в РБ проведен анализ распределения частот аллелей и генотипов полиморфного локуса rs776746, локализованного в интроне 3 (chr7:99108475) гена изофермента P3A5 цитохрома p450 (CYP3A5) участвующего в фармакокинетике ИТК. Между больными с разной эффективностью лечения ИТК не было обнаружено выраженных различий в распределении частот аллелей и генотипов данного полиморфного локуса (p > 0,05) (табл. 3).
Таблица 3. Распределение частот аллелей и генотипов полиморфного локуса rs776746 в гене CYP3A5 у больных ХМЛ
Table 3. Frequency distribution for alleles and genotypes of the CYP3A5 gene rs776746 polymorphic locus in CML patients
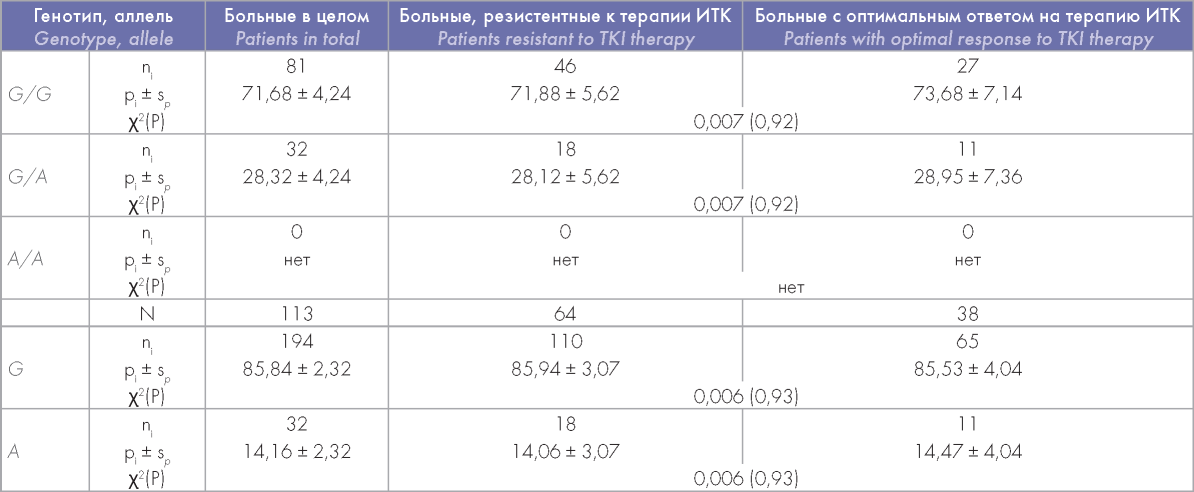
Анализ распределения у больных ХМЛ частот генотипов полиморфного локуса rs776746 в гене CYP3A5 показал, что с наиболее высокой частотой (71,68 %) встречался гомозиготный генотип *G*G, гетерозиготный генотип *A*G определялся в 28,32 % случаев, гомозиготный генотип *А*А выявлен не был.
Для оценки продолжительности жизни в зависимости от генотипа полиморфного локуса rs776746 гена CYP3A5 был проведен анализ выживаемости с помощью метода Каплана — Мейера (рис. 1). Средняя продолжительность жизни у больных с генотипом GA составила 190,3 ± 15,1 мес., с генотипом GG — 154,9 ± 7,2 мес. Различия в продолжительности жизни не достигли уровня статистической значимости (лонг-ранг тест, р = 0,755).
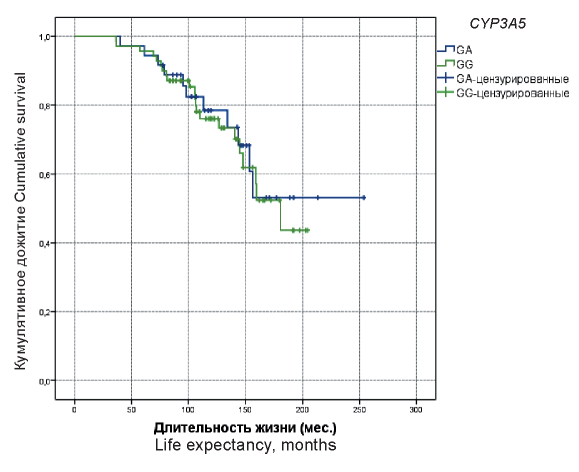
Рисунок 1. Общая выживаемость больных ХМЛ в зависимости от генотипе полиморфного локуса rs776746 гена CYP3A5
Figure 1. The overall survival of CML patients, depending on the genotype of the CYP3A5 gene rs776746 polymorphic locus
Распределение частот аллелей и генотипов полиморфного варианта rs683369 в гене переносчике органических катионов (hOCTl) между группами больных с разной эффективностью лечения ИТК показало, что генотип *C*C достоверно чаще выявлялся у больных ХМЛ с оптимальным ответом на лечение — в 75,00 % случаев по сравнению с больными, резистентными к лечению — 53,57 % (χ2 = 3,94, p = 0,04, отношение шансов (ОШ) = 0,38; 95 % доверительный интервал (ДИ) 0,14—1,00) (рис. 2).
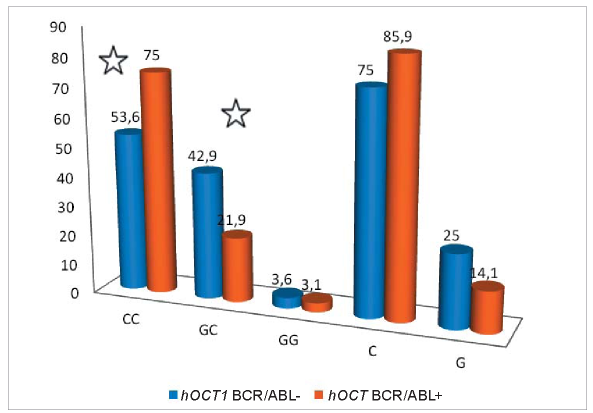
Рисунок 2. Распределение частот аллелей и генотипов полиморфного варианте rs683369 гена hOCTI в выборке больных ХМЛ (больные, резистентные к терапии ИТК — BCR/ABL-; больные с оптимальным ответом на терапию ИТК — BCR/ABL+)
Figure 2. Frequency distribution for alleles and genotypes of the hOCTI gene rs683369 polymorphic variant in a group of CML patients (BCR/ABL- denotes patients resistant to treatment with TKI; BCR/ABL+ denotes patients with an optimal response to TKI treatment)
При сравнении распределения частоты встречаемости генотипа *C*G, она оказалась почти в два раза выше у больных ХМЛ, резистентных к терапии, — 42,86 % по сравнению с группой больных с оптимальным ответом на лечение ИТК — 21,88 % (χ2 = 3,92, p = 0,04, ОШ = 2,67 (95 % ДИ 0,99-7,21).
При анализе выживаемости в зависимости от генотипа полиморфного локуса rs683369 гена hOCTI показаны статистически значимые различия (лонг-ранг тест, р = 0,018) (рис. 3).
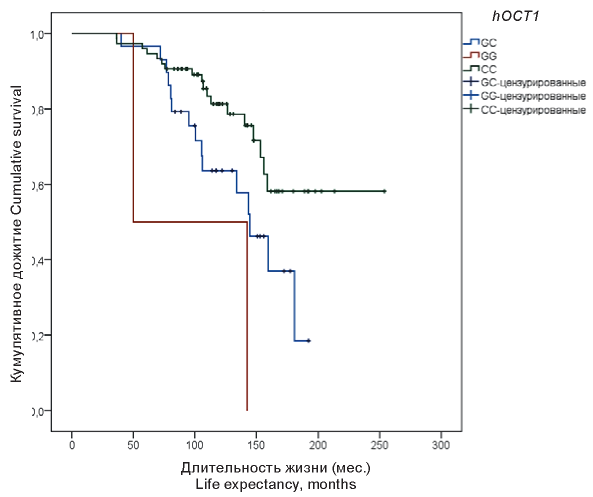
Рисунок 3. Общая выживаемость больных ХМЛ в зависимости от генотипе полиморфного локуса rs683369 гена hOCTl
Figure 3. The overall survival of CML patients, depending on the genotype of the hOCTl gene rs683369 polymorphic locus
Неблагоприятным для продолжительности жизни являлся генотип GG, средняя продолжительность жизни при его наличии составила 96,3 ± 46,3 мес. Продолжительность жизни у больных с генотипом GC занимала промежуточное значение 139,0 ± 9,2 мес. Наиболее благоприятным для прогноза являлся генотип СС, средняя длительность жизни при его наличии составляла 197,7 ± 11,0 мес.
Обсуждение
Проведенный анализ эпидемиологических данных в РБ за период 2000-2016 гг. показал, что зарегистрированная первичная заболеваемость ХМЛ в 2016 г. составила 0,44 на 100 000 всего населения и 1,01 на 100 000 взрослого населения. Средний показатель в РБ за последние 5 лет составил 0,62 ± 0,10 (по данным ВОЗ — 0,7). Заболеваемость имеет тенденцию к росту, распространенность за последние 8 лет выросла в 4 раза, что связано с возможностью выявления Ph-хромосомы и/или гена BCR-ABL, созданием и ведением регистра больных ХМЛ с 2008 г., внедрением терапии ИТК и, как следствие, увеличением продолжительности жизни больных. Показатели смертности имеют лишь тенденцию к снижению за исследуемый период времени [32]. Данные результаты свидетельствуют о том, что существует группа больных, резистентных к терапии ИТК, и прогрессия заболевания даже при проведении терапии приводит к их гибели. Авторы из Вьетнама показали, что применение ИТК нивелирует влияние классических прогностических факторов и требует разработки новых подходов к оценке риска для больных ХМЛ [33]. Поэтому поиск причин неудачи лечения и преодоления резистентности терапии ИТК остается актуальной проблемой рутинной практики не только в целом, но и в различных регионах. Примерно у 20-30 % больных выявляется резистентность к иматинибу [25]. Возникновение устойчивости к ИТК является следствием взаимодействия многих факторов. Эти факторы включают в себя схему лечения, фармакодинамику ИТК, генетические изменения, мутации BCR-ABL киназного домена или комбинацию из этих факторов [25]. Уста новление частоты встречаемости мутаций и их комбинаций позволяет на ранних этапах переключаться на новые схемы лечения [6-8, 11]. Проведенные ранее исследования 50 больных ХМЛ в РБ, резистентных к иматинибу, подтвердили, что мутации киназного домена гена BCR-ABL являются одной из основных причин резистентности. У 32 % больных, резистентных к терапии ИТК, с высоким уровнем экспрессии гена BCR-ABL в РБ выявлялись такие мутации киназного домена гена BCR-ABL, как: M244V — 2 %, T315I — 17 %,
M351T — 20 % и H396R — 2 %. Наиболее высокий (медиана экспрессии 442,3 %) средний уровень экспрессии химерного гена наблюдался у больных с компаунд-мутацией T315I + M351T — 9 %, а также больных с мутацией M351T (медиана экспрессии 94,6 %). Причем мутация M351T являлась самой распространенной мутацией [9]. По данным литературы [18], частота мутации M351T у больных ХМЛ в Германии составляет только 6 %, в Италии и Австралии — до 11 %. В обзоре, посвященном BCR-ABL зависимым и независимым механизмам резистентности к лечению ИТК, E.J. Jabbour и соавт. [34] ставят задачи по разработке стратегии лечения при первичной и вторичной устойчивости к современным методам лечения.
Межиндивидуальная вариабельность ответа на лечение среди больных ХМЛ привела к поиску механизмов, ответственных за такую вариабельность. Изучаются BCR-ABL независимые механизмы резистентности к лечению ИТК. D. Kim и соавт. [29] показали, что, используя новый подход с оценкой нескольких ген-кандидатов, основываясь на фармакогенетике иматиниба, можно предсказать результаты лечения. В этом исследовании проведен скрининг 16 однонуклеотидных полиморфизмов (SNR) в 5 генах у 229 больных ХМЛ. Установлено, что генотип GG в ABCG2 (rs2231137), генотип AA в CYP3A5 (rs 7776746) были в значительной степени ассоциированы с неэффективным лечением иматинибом, а генотип GG в SLC22A2 (rs683369) в поздней стадии коррелировал с высоким уровнем потери ответа или неудачей терапии [30]. У больных из Малайзии, у которых был выявлен гетерозиготный AG и гомозиготный вариант GG генотипа CYP3A5, был значительно меньше риск развития резистентности к иматинибу [35]. Другие авторы [31] в когорте 106 больных ХМЛ показали, что два полиморфизма гена CYP3A5 (rs 7776746) и гена hOCT1 M408V (rs628031) были достоверно связаны с полным цитогенетическим ответом (ПЦГО) через 6 месяцев и полным молекулярным ответом (ПМО) через 12 месяцев лечения. N.A. Hamed и соавт. [32] не нашли ассоциации полиморфизма гена hOCT1 С480G с ответом на лечение у больных из Египта. В следующем исследовании генотип *G*G (480C>G (F160L), rs683369) в гене hOCT1 при прогрессии ХМЛ коррелировал с высокой вероятностью появления резистентности к терапии [29]. М. Gromicho и соавт. [23] обнаружили, что в большинстве изученных ими резистентных клеточных линий были сверхэкспрессирова- ны несколько белков переносчиков, а именно ABCB1, ABCG2, MVP и hOCT-1.
Несмотря на большое число опубликованных статей, посвященных исследованию полиморфизма генов, участвующих в фармакогенетике и фармакодинамике ИТК, неоптимальным ответом больных ХМЛ на таргетную терапию ИТК, до сих пор точно не известно, какой из них является самым решающим для приобретения резистентности клетками ХМЛ к иматинибу. В настоящем исследовании, в отличие от литературных данных, в выборке больных из РБ не встречался генотип AA в CYP3A5 (rs 7776746), ассоциированный с резистентностью к ИТК, а между больными с разной эффективностью лечения ИТК не было обнаружено достоверных изменений в распределении частот аллелей и генотипов CYP3A5. Распределение частот генотипов полиморфного варианта rs683369 в гене переносчике органических катионов (hOCT1) между группами больных с разной эффективностью лечения ИТК показало, что генотип G*G* встречался редко и также был ассоциирован с наименьшей продолжительностью жизни больных, генотип *C*C достоверно чаще выявлялся у больных ХМЛ с оптимальным ответом на лечение по сравнению с больными, резистентными к лечению. Частота встречаемости генотипа *C*G была почти в два раза выше у больных ХМЛ, резистентных к терапии ИТК. Изучение клинико-генетических ассоциаций при ХМЛ позволяет уточнить некоторые механизмы развития резистентности к терапии в разных регионах, совершенствовать индивидуализированный подход при выборе лечебной тактики и в общем прогнозе заболевания.
Таким образом, исследование полиморфного локуса rs683369 гена hOCT1 в отличие от rs776746 гена CYP3A5 имеет прогностическое значение в оценке эффективности лечения ИТК больных ХМЛ в РБ. Частота встречаемости генотипа *С*G была значимо выше у больных ХМЛ, резистентных к терапии ИТК, генотип G*G* встречался реже и был ассоциирован с наименьшей продолжительностью жизни, а наличие генотипа С*С* оказалось благоприятным для общей выживаемости больных.
Список литературы
1. Абдулкадыров К.М., Абдуллаев А.О., Авдеева Л.Б. и др. Федеральные клинические рекомендации по диагностике и терапии хронического миелолейкоза. Вестник гематологии. 2013; 9(3): 4–40.
2. Туркина А.Г., Зарицкий А.Ю., Шуваев В.А. и др. Клинические рекомендации по диагностике и лечению хронического миелолейкоза. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2017; 10.3: 294–316.
3. Челышева Е.Ю., Шухов О.А., Лазарева О.В. Мутации гена BCR-ABL при хроническом миелоидном лейкозе. Клиническая онкогематология.2012; 5: 13–21.
4. Виноградова О.Ю., Куликов С.М., Куцев С.М. Проблемы организации лечения хронического миелолейкоза в России. Клиническая онкогематология. 2011; 4.4: 292–7.
5. Туркина А.Г., Голенков А.К., Напсо Л.И. и др. Российский регистр по лечению хронического миелоидного лейкоза в рутинной клинической практике: итоги многолетней работы. Эффективная фармакотерапия. 2015; 10: 8–13.
6. Corbin A.S., La Rose P., Stoffregen E.P., et al. Several BCR-ABL kinase domain mutants associated with imatinib mesylate resistance remain sensitive to imatinib. Blood. 2003; 101(11): 4611–4.
7. Куцев С.И., Васильченко М.В., Морданов СВ. Роль мутаций гена BCRABL в развитии рефрактерности к иматинибу у пациентов с хроническим миелолейкозом. Клиническая онкогематология. 2009; 1.4: 303–9.
8. Виноградова О.Ю., Асеева Е.А., Воронцова А.В. и др. Влияние различных хромосомных аномалий в Ph-позитивных клетках костного мозга на течение хронического миелолейкоза при терапии ингибиторами тирозинкиназ. Онкогематология. 2012; 4: 24–34.
9. Рябчикова Н.Р., Минниахметов И.Р., Сафуанова Г.Ш. и др. Хронический миелолейкоз: молекулярный мониторинг в клинической практике. Онкогематология. 2013; 1: 1–16.
10. Baccarani M., Deininger M.W., Rosti G., et al. European Leukemia Net recommendations for the management of chronic myeloid leukemia 2013. Blood. 2013; 122(6): 872–84. DOI: 10.1182/ Blood -2013-05:501-569
11. Фоминых М.С., Абдулкадыров К.М., Туркина А.Г. и др. Персонализация терапии хронического миелолейкоза — прогностическое значение индивидуальной динамики уровня BCR-ABL. Гематология и трансфузиология. 2016; 6.1: 4–10.
12. Туркина А.Г., Челышева Е.Ю. Стратегия терапии хронического миелолейкоза: возможности и перспективы. Терапевтический архив. 2013; 85(7): 4–9.
13. Руковицин О.А. (редактор) Гематология: национальное руководство. М.: ГОЭТАР Медиа; 2015.
14. Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. и др. Хронический миелолейкоз: многолетний опыт таргетной терапии. Клиническая онкогематология. 2016; 9: 54–60.
15. Baccarani M., Cortes J., Pane F., et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European Leukemia Net. J Clin Oncol. 2009; 27: 6041–51.
16. Druker D.J., Guilhot F., O’Brien S.G., et al. Five-year follow-up of patients receiving imatinibforchronic myeloid leukemia. N Engl J Med. 2006; 355: 2408– 17. DOI: 10.1056/NEJMoa062867
17. Волкова М.А. Терапия хронических лейкозов в 21 веке. Эффективная фармакотерапия в онкологии, гематологии и радиологии. 2009; 2: 2–7.
18. Branford S., Seymour J.F., Grigg A.A., et al. BCR-ABL messenger RNA levels continue to decline in patients with chronic phase chronic myeloid leukemia treated with imatinib for more than 5 years and approximately half of all first-line treated patients have stable undetectable BCR-ABL using strict sensitivity criteria. Clin. Cancer Res. 2007; 13 (23): 7080–5.
19. Волкова С.А., Ковалишина О.В., Гостюжова Е.А. и др. Эффект от терапии иматинибом по данным клинико-эпидемиологического мониторинга хронического миелолейкоза в Нижегородской области за период 2000– 2010 гг. Гематология и трансфузиология. 2011; 56(4): 17–9.
20. Куликов С.М., Виноградова О.Ю., Челышева Е.Ю. и др. Заболеваемость хроническим миелолейкозом в 6 регионах России по данным популяционного исследования 2009–2012. Терапевтический архив. 2014; 86(7): 24–30.
21. Branford S. Monitoring after successful therapy for chronic myeloid leukemia. ASH Annual Meeting and Exposition. 2012; 105–110.
22. Мисюрин А.В., Мисюрина Е.Н., Тихонова В.В. и др. Частота встречаемости мутаций киназного домена гена BCR-ABL у больных хроническим миелолейкозом, резистентных к терапии иматинибом. Российский биотерапевтический журнал. 2016; 15(4): 102–9.
23. Gromicho М., Dinis D.J., Magalhaes M.M., et al. Development of imatinib and dasatinib resistance: dynamics of expression of drug transporters ABCB1, ABCC1, ABCG2, MVP, and SLC22A1. Leukemia Lymphoma. 2011; 52(10): 1980–90.
24. Тихонова В.В., Исаков М.А., Мисюрин В.А. Резистентность хронического миелолейкоза к ингибиторам тирозинкиназ: 10 лет изучения профиля мутаций гена BCR-ABL в России (2006–2016 гг.). Клиническая онкогематология. 2018; 11: 227–33.
25. Quintas-Cardama A., Kantarjian H., Cortes J. Mechanisms of Primary and Secondary Resistance to Imatinib in Chronic Myeloid Leukemia. Cancer Control. 2009; 16(2): 122–31.
26. Шуваев В.А., Абдукадыров К.М., Мартынкевич И.С., Фоминых М.С. Выбор терапии первой линии хронического миелолейкоза: моделирование клинико-экономических факторов. Клиническая онкогематология. 2015; 8.1: 78–83.
27. Mahon F.X. Discontinuation of tyrosine kinase therapy in CML. Ann Hematol. 2015; 94(2): 187. DOI: 10.1007/s00277-015-2320-4
28. Копнин Б.П. Опухолевые супрессоры и мутаторные гены. Канцерогенез. 2004; 125–56.
29. Kim D., Sriharsha L., Xu W., et al. Clinical Relevance of a Pharmacogenetic Approach Using Multiple Candidate Genes to Predict Response and Resistance to Imatinib Therapy in Chronic Myeloid Leukemia. Clin Cancer Res. 2009; 15(14): 4750–8 DOI: 10.1158/1078-0432.CCR-09-0145
30. Vaidya S., Ghosh K., Shanmukhaiah C., Vundinti B.R. Genetic variations of hOCT1 gene and CYP3A4/A5 genes and their association with imatinib response in Chronic Myeloid Leukemia. European Jornal of Pharmacology. 2015; 765(15): 124–30. DOI: 10.1016/j.ejphar.2015.08.034
31. Hamed N.A., Ghanem A.M., Neanea H., Maha M.A. Polymorphism of Human Organic Cationic Transporter 1 (C80G) in Egyptian Chronic Myeloid Leukemia Patients on Imatinib. Am J Mol Biol. 2018; 08 (02): 83–91. DOI: 10.4236/ ajmb.2018.82007
32. Рябчикова Н.Р., Сафуанова Г.Ш., Никуличева В.И. Эпидемиология хронического миелолейкоза в Республике Башкортостан. Клиническая онкогематология. 2018; 11: 349–53. DOI: 10.21320/2500-2139-2018-11-4- 349-353
33. Nguyen H.T., Nguyen A.T., Nguyen T.T., et al. Results of treatment of chronic myeloid leukemia with imatinib from the Vietnam National Institute of Hematology and Blood Transfusiology. Hematology and transfusiology. 2018; 63(10): 31–43. DOI: 10.258337/HAT.2018.26..1..003
34. Jabbour E.J., Cortes J.E., Kantarjian H.M. Resistance to Tyrosine Kinase Inhibition Therapy for Chronic Myelogenous Leukemia: A Clinical Perspective and Emerging Treatment Options. Clin Lymphoma Myeloma Leuk. 2013; 13(5): 515– 529. DOI: 10.1016/j.clml.2013.03.018
35. Maddin N., Husin A., Gan S.H., et al. Impact of CYP3A4*18 and CYP3A5*3 Polymorphisms on Imatinib Mesylate Response Among Chronic Myeloid Leukemia Patients in Malaysia. Oncol Ther. 2016; 4: 303–14. DOI: 10.1007/s40487-016- 0035-x
36. Адильгереева Э.П., Лавров А.В., Смирнихина С.А. и др. Поиск новых маркеров эффективности терапии ингибиторами тирозинкиназ при хроническом миелолейкозе методом полноэкзомного секвенирования. Гематология и трансфузиология. 2018; 63(2): 134–43. DOI: 10.25837/ HAT.2018.61..2..004
Об авторах
Г. Ш. СафуановаРоссия
Сафуанова Гузяль Шагбановна, доктор медицинских наук, заведующая кафедрой терапии и общей врачебной практики с курсом гериатрии ИДПО
450005, г Уфа, ул. Достоевского, 132.
Н. Р. Рябчикова
Россия
Рябчикова Наира Рафаэлевна, ассистент кафедры терапии и общей врачебной практики с курсом гериатрии ИДПО
Э К. Хуснутдинова
Россия
Хуснутдинова Эльза Камилевна, доктор биологических наук, и.о. директора «Института биохимии и генетики» — обособленное структурное подразделение
Д. О. Каримов
Россия
Каримов Денис Олегович, кандидат биологических наук, заведующий отделом токсикологии и генетики с клиникой экспериментальных животных
И. Р. Минниахметов
Россия
Минниахметов Ильдар Рамилевич, кандидат биологических наук, научный сотрудник лаборатории молекулярной генетики человека «Института биохимии и генетики» — обособленное структурное подразделение
Рецензия
Для цитирования:
Сафуанова Г.Ш., Рябчикова Н.Р., Хуснутдинова Э.К., Каримов Д.О., Минниахметов И.Р. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПОЛИМОРФНЫХ ВАРИАНТОВ ГЕНОВ CYP3A5 И hOCT1 У БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В РЕСПУБЛИКЕ БАШКОРТОСТАН. Гематология и трансфузиология. 2019;64(2):165-174. https://doi.org/10.35754/0234-5730-2019-64-2-165-174
For citation:
Safuanova G.Sh., Ryabchikova N.R., Khusnutdinova E.K., Karimov D.O., Minniakhmetov I.R. PROGNOSTIC VALUE OF CYP3A5 AND hOCT1 POLYMORPHIC GENE VARIANTS IN PATIENTS WITH CHRONIC MYELOID LEUKEMIA IN THE REPUBLIC OF BASHKORTOSTAN. Russian journal of hematology and transfusiology. 2019;64(2):165-174. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-165-174











































