Перейти к:
ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ И ПРЕДИКТОРЫ НЕОНАТАЛЬНОЙ ИММУННОЙ ТРОМБОЦИТОПЕНИИ
https://doi.org/10.35754/0234-5730-2019-64-2-198-210
Аннотация
Введение. Неонатальная тромбоцитопения представляет собой серьезную клиническую проблему в связи с возможным развитием опасных кровотечений у плода и новорожденного.
Цель обзора — рассмотреть патогенез, методы лабораторной диагностики, маркеры и предикторы неонатальной иммунной тромбоцитопении (НАИТ).
Основные сведения. НАИТ развивается вследствие несовместимости матери и плода по аллоантигенам тромбоцитов (HPA, Human Platelet Alloantigens). Мать вырабатывает аллоантитела против аллоантигена, отсутствующего на ее тромбоцитах, но экспрессированного на тромбоцитах плода и отца. Антитела проникают в кровоток плода и вызывают разрушение тромбоцитов плода/новорожденного. Неонатальная транс иммунная тромбоцитопения (НТИТ) диагностируется у части новорожденных (20–40 %) от матерей с иммунной тромбоцитопенической пурпурой (ИТП). В этом случае на тромбоциты плода/новорожденного воздействуют аутоантитела матери с ИТП. Для диагностики неонатальной иммунной тромбоцитопении применяют следующие методы: измерение тромбоцит-ассоциированных иммуноглобулинов G (ТА-IgG), определение антитромбоцитарных циркулирующих (сывороточных) антител (цАТ), идентификация антигенов-мишеней цАТ. При НАИТ у матери отсутствует тромбоцитопения и повышение ТА-IgG, но определяются цАТ, реагирующие с тромбоцитами отца, несущими конфликтный HPA аллоантиген. У новорожденных наблюдается тромбоцитопения и повышение ТА-IgG. Аллоиммунный конфликт подтверждают генотипированием HPA аллоантигенов матери и ребенка и/или определением специфичности цАТ, используя аллоантигены HPA-типированных доноров. В российской популяции наиболее частыми причинами НАИТ являются конфликты по HPA-1a, HPA-1b (33 и 33 % соответственно) и HPA-15a/b аллоантигенам (25 %). При НТИТ у матери c ИТП снижено содержание тромбоцитов и повышены ТА-IgG, а у ребенка на фоне тромбоцитопении отмечается подъем ТА-IgG. Предиктором НТИТ является наличие у беременных с ИТП антитромбоцитарных цАТ.
Ключевые слова
Для цитирования:
Хаспекова С.Г., Шустова О.Н., Головкина Л.Л., Мазуров А.В. ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ И ПРЕДИКТОРЫ НЕОНАТАЛЬНОЙ ИММУННОЙ ТРОМБОЦИТОПЕНИИ. Гематология и трансфузиология. 2019;64(2):198-210. https://doi.org/10.35754/0234-5730-2019-64-2-198-210
For citation:
Khaspekova S.G., Shustova O.N., Golovkina L.L., Mazurov A.V. DIAGNOSTIC MARKERS AND PREDICTORS OF NEONATAL IMMUNE THROMBOCYTOPENIA. Russian journal of hematology and transfusiology. 2019;64(2):198-210. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-198-210
Тромбоцитопения является одной из наиболее распространенных причин повышенной кровоточивости у взрослых и детей. В норме количество тромбоцитов в крови составляет 150—450х109/л. Эти значения могут несколько различаться в зависимости от пола и возраста. Формально тромбоцитопенией принято считать уменьшение количества тромбоцитов ниже 150х109/л. Однако в клинической практике обследование больных начинают при количестве тромбоцитов ниже 100х109/л. Снижение количества тромбоцитов ниже 50х109/л может вызывать развитие умеренного геморрагического синдрома. Количество тромбоцитов ниже 20х109/л из-за риска опасных кровотечений является показанием для госпитализации больного [1—3].
Неонатальная тромбоцитопения представляет собой серьезную клиническую проблему в связи с возможным развитием опасных кровотечений у плода и новорожденного. Эта патология диагностируется у 1—5 % новорожденных. Причины неонатальной тромбоцитопении чаще имеют неиммунный характер: инфекции, аплазия костного мозга, лейкоз, наследственные заболевания и некоторые другие патологические состояния. Однако уменьшение количества тромбоцитов у плода и новорожденных может иметь и иммунную этиологию. Неонатальная иммунная тромбоцитопения развивается вследствие проникновения через плацентарный барьер в кровоток плода антитромбоцитарных антител (IgG типа), вырабатывающихся в организме матери. Антитела вызывают тромбоцитопению у плода, которая сохраняется и у новорожденного в течение нескольких недель после родов. Наиболее опасным осложнением являются внутричерепные кровоизлияния, которые могут привести к гибели ребенка [4, 5].
Неонатальные иммунные тромбоцитопении в зависимости от природы антитромбоцитарных антител можно разделить на две группы: аллоиммунная и трансиммунная тромбоцитопении. Неонатальная аллоиммунная тромбоцитопения (НАИТ) является следствием конфликта матери и плода по аллоантигенам (варианты одного антигена) тромбоцитов (HPA, Human Platelet Alloantigens, аллоантигены тромбоцитов человека). В организме матери вырабатываются аллоантитела против аллоантигена, отсутствующего на ее тромбоцитах, но экспрессированного на тромбоцитах плода и отца ребенка. Антитела проникают в кровоток плода и вызывают разрушение тромбоцитов плода и новорожденного [4—7]. Неонатальная трансиммунная (аутоиммунная) тромбоцитопения (НТИТ) диагностируется у части новорожденных (20—40 %) от матерей с иммунной тромбоцитопениче- ской пурпурой (ИТП). Это заболевание развивается в результате проникновения в кровоток плода/новорожденного антитромбоцитарных аутоантител от матери с ИТП [4, 5].
Иммунологические методы диагностики неонатальной иммунной тромбоцитопении
Для диагностики неонатальной иммунной тром- боцитопении применяют те же иммунологические методы, что и для диагностики ИТП [8]: (1) измерение тромбоцит-ассоциированных иммуноглобулинов класса G (ТА-IgG), (2) определение антитромбоцитарных циркулирующих (сывороточных) антител (цАТ), (3) идентификация антигенов-мишеней цАТ. Описание этих методов представлено на рисунке 1. Тромбоцит-ассоциированные IgG измеряются на поверхности отмытых от плазмы тромбоцитов матери и ребенка по уровню связывания антител против иммуноглобулинов человека. Можно использовать антитела, меченные радиоактивным изотопом 125I (метод радиоиммунного анализа, РИА) [9, 10], однако в настоящее время чаще для этих целей используют флуоресцентно меченные вторые антитела и метод проточной цитофлуориметрии [8]. Повышение TA-IgG не считается высокоспецифичным показателем, однако отсутствие подъема TA-IgG может служить критерием исключения иммунной природы тромбоцитопении [8]. Циркулирующие антитела в сыворотке матери определяют по их реакции с тромбоцитами отца или донора при диагностике НАИТ и НТИТ соответственно. Для этих целей может применяться метод иммуноферментного анализа (ИФА) с использованием в качестве мишени адгезированных на пластике тромбоцитов [9, 10]. Связывание цАТ с тромбоцитами регистрируется с помощью вторых антител против иммуноглобулинов человека, меченных пероксидазой. Тест на определение антитромбоцитарных антител также может проводиться с помощью проточной цитофлуориметрии [8], однако с помощью ИФА можно одновременно анализировать большее количество образцов сыворотки и в разных титрах (более 90 проб в одном планшете для ИФА). Для определения антигенов цАТ обычно используют метод MAIPA (Monoclonal Antibody Immobolized Platelet Antigens, иммобилизованные с помощью моноклональных антител (моноАТ) антигены тромбоцитов) [8, 10]. Из лизата тромбоцитов с помощью предварительно сорбированных на поверхности пластика моноАТ иммобилизуют отдельные антигены, затем добавляют к ним сыворотку матери и регистрируют связывание цАТ с иммобилизованными антигенами методом ИФА. Обычно анализируют связывание цАТ с главными антигенами тромбоцитов, гликопротеинами (ГП) IIb-IIIa и ГП Ib.

Рисунок. 1. Методы анализа алло- и аутоантител против тромбоцитов при исследовании неонатальных иммунных тромбоцитопений. Определение тромбоцит- ассоциированных IgG (TA-IgG), алло- и аутоантител против тромбоцитов отца и донора, антигенов алло- и аутоантител против тромбоцитов (MAIPA, Monoclonal Antibody Immobolized Platelet Antigens, иммобилизованные с помощью моноклональных антител антигены тромбоцитов). 1 Циркулирующие антитела (цАТ) в сыворотке матери против тромбоцитов отца определяют при исследовании НАИТ, а против тромбоцитов донора — при исследовании НТИТ. 2 Обычно используют моноклональные антитела (моноАТ) против главных тромбоцитарных антигенов ГП IIb-IIIa и ГП Ib. 3 При исследовании НАИТ используют тромбоциты доноров, типированных по основным HPA аллоантигенам, а при исследовании НТИТ — тромбоциты от любого здорового донора
Figure. 1. Analysis of antiplatelet allo- and autoantibodies in studies of neonatal immune thrombocytopenias. Detection of platelet-associated IgG (PA-IgG), allo- and autoantibodies against platelets of father and donor, antigens of allo- and autoantibodies against platelets (MAIPA, Monoclonal Antibody Immobolized Platelet Antigens). 1 Circulating antibodies (cAB) in maternal serum against father's platelets are detected in NAiT studies, and against dono's platelets in NTIT studies. 2 Monoclonal antibodies (monoAB) against major platelet antigens, glycoproteins (GP) IIb-IIIa and GP Ib are usually used. 3 Platelets from donors typed for major IdPA are used in NAIT studies, and platelets from any healthy donor in NTIT studies
Неонатальная аллоиммунная тромбоцитопения (НАИТ)
НАИТ является следствием выработки в организме матери аллоантител против аллоантигенов плода/новорожденного и отца ребенка, отсутствующих на ее собственных тромбоцитах. Так как такие аллоантитела не реагируют с тромбоцитами матери, тромбоци- топении у матерей не регистрируется. Частота НАИТ составляет 1 случай на 2-3 тысячи новорожденных. При умеренной тромбоцитопении это заболевание может не диагностироваться. Характерной особенностью НАИТ является то, что она может развиваться уже при первой беременности. Наиболее опасное осложнение этой патологии — внутричерепные кровоизлияния, частота которых может достигать 15-20 % [4-7].
Причиной возникновения НАИТ является несовместимость матери и ребенка по аллоантигенам системы HPA. Большая часть этих аллоантигенов локализована в мембранных белках поверхности тромбоцитов — ГП IIb-IIIa (CD61/CD41), ГП Ib (CD42b), ГП Ia (CD49b), CD109. HPA аллоантигены, как правило, имеют два аллеля — «а» и «b». Полиморфизмы (аллельные варианты) HPA обычно обусловлены однонуклеотидной заменой в ДНК гена, что приводит к замене одной аминокислоты в молекуле соответствующего белка/антигена. При развитии НАИТ организм матери вырабатывает антитела против НРА варианта, отсутствующего на ее тромбоцитах, но представленного на тромбоцитах плода и отца (от которого этот вариант наследуется ребенком). [4—7, 11, 12]. В таблице 1 приведены основные варианты НРА аллоантигенов и частота их встречаемости в российской популяции [13]. Известно, что для европейских популяций характерны приблизительно те же частоты полиморфизмов HPA [8, 11].
Таблица 1. Характеристика основных HPA (Human Platelet Alloantigen) аллоантигенов и частота их встречаемости в российской популяции1
Table 1. Characteristics of the main HPA (Human Platelet Alloantigen) alloantigens and their frequencies in the Russian population1
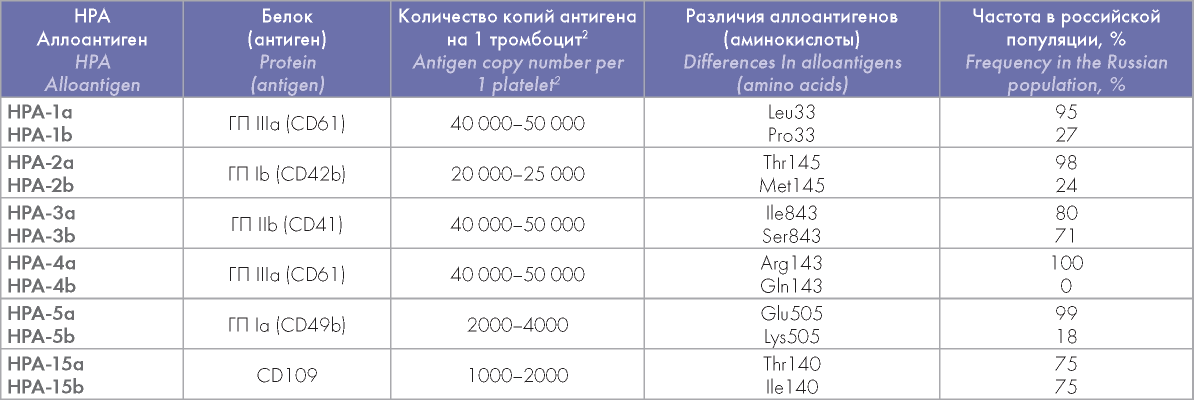
Примечание. 1 Обследованные лица идентифицировали себя как русские. 2 По количеству связывающихся с тромбоцитами специфических моноАТ. Данные по частотам HPA аллоантигенов из работы Л.Л. Головкиной и соавт. [13].
Note.'Tested subjects identified themselves as russians. 2According to the number of specifica monoAB bound to platelets. Data on HPA frequency from Golovkina et al. [13].
В семьях, имеющих детей с НАИТ, зарегистрированы полиморфизмы более 30 HPA аллоантигенов [11, 12]. Однако наиболее частой причиной НАИТ (до 70—80 % случаев) в европейских популяциях является несовместимость по аллоантигену НРА-1 (или PLA согласно тривиальной номенклатуре). Этот антиген представлен на мембране тромбоцитов двумя аллельными формами — НРА-1а и НРА1-b, отличающимися друг от друга одной аминокислотой. В ГП IIIa происходит замена лейцина (HPA-1a) на пролин (HPA-1b) в 33 положении аминокислотной последовательности, которая является результатом однонуклеотидной замены 1565Т/С в гене этого белка. В подавляющем большинстве случаев происходит иммунизация матери, гомозиготной по более редкому аллоантигену НРА1-b (частота встречаемости гомозиготного генотипа HPA-1b/b — 1—2 %), аллоантигеном НРА-1а, присутствующим на тромбоцитах плода. НРА-5 конфликты являются второй по частоте причиной НАИТ в европейских популяциях. Однако они встречаются существенно реже, чем HPA-1 конфликты, — приблизительно в 10—15 % НАИТ. Известно также, что, в отличие от европейских популяций, в Азии НАИТ главным образом развивается вследствие несовместимости по НРА-4 и НРА-5 аллоантигенам [4—7, 11, 12].
Основой диагностики НАИТ является выявление аллоантител в крови матери и определение молекулярной природы аллоиммунного конфликта. Клинически необходимо исключить возможные неиммунные причины тромбоцитопении (инфекция, аплазия костного мозга, лейкоз и др.). Характерным признаком НАИТ является отсутствие тромбоцитопении у матери при наличии тромбоцитопении у ребенка. Однако у беременных женщин может наблюдаться некоторое уменьшение количества тромбоцитов, особенно на поздних сроках беременности [14]. В связи с этим для исключения диагноза ИТП у матери и, соответственно НТИТ у новорожденного, нужно продемонстрировать у нее отсутствие подъема TA-IgG. Несмотря на нормальный уровень TA-IgG у матери, у новорожденного с НАИТ, вследствие сорбции материнских аллоантител, TA-IgG должны быть повышены. У ребенка определение этого показателя необходимо проводить до начала возможной терапии внутривенными иммуноглобулинами, т. к. введение в кровоток больших количеств иммуноглобулинов может влиять на определение ТА-IgG. Для установления диагноза НАИТ необходимо продемонстрировать наличие у матери цАТ, реагирующих с тромбоцитами отца, несущих конфликтный HPA аллоантиген, присутствующий и на тромбоцитах ребенка. Тромбоциты новорожденного в этом случае не используются, т.к. крайне сложно получить у новорожденного необходимое количество крови, и на поверхности тромбоцитов новорожденного уже присутствуют эндогенные аллоантитела, которые могут препятствовать связыванию добавляемых к ним аллоантител из сыворотки матери. На рисунке 2А представлены кривые связывания цАТ из сыворотки матери ребенка с НАИТ с тромбоцитами отца [9]. В данном случае концентрация цАТ в тестируемой материнской сыворотке была очень высока — положительная реакция с тромбоцитами отца регистрировалась даже при титре 64. Проведенный генетический анализ показал, что мать является гомозиготной носительницей редкого НРА-1b аллеля, а отец и ребенок — носителями НРА-1а аллеля. Таким образом, иммунный конфликт был обусловлен несовместимостью именно по HPA-la аллоантигену, против которого и вырабатывались материнские аллоантитела.

После выявления цАТ в сыворотке матери, реагирующих с тромбоцитами отца, для окончательной верификации диагноза НАИТ определяют молекулярную природу иммунного конфликта с помощью генетических или антиген-специфических иммунологических методов.
Генотипирование HPA матери, ребенка и отца (генотипирование отца не является обязательным для установления природы несовместимости) обычно проводят с помощью ПЦР, используя соответствующие коммерческие наборы. С.Г. Хаспековой и соавт. [9] был проведен анализ аллельных полиморфизмов НРА-1, -2, -3, -4, -5 и -15 в 28 семьях, в которых у новорожденных была диагностирована НАИТ. Родители в этих семьях относили себя к русским (большинство) или к другим европейским популяциям Российской Федерации. Во всех случаях отмечалось снижение тромбоцитов у новорожденного менее 100х109/л и повышенный уровень ТА-IgG. У матерей эти показатели соответствовали норме. Однако у всех матерей было зарегистрировано наличие в сыворотке цАТ, реагирующих с тромбоцитами отца. На основании этих данных была диагностирована НАИТ. В результате генотипирования несовместимость по НРА была идентифицирована в 24 из 28 семей. В остальных четырех семьях генотипирование не выявило конфликтных аллоантигенов, что, по-видимому, указывает на наличие несовместимости по другим, не тестированным в работе аллоантигенам. Результаты генотипирования представлены в таблице 2. В 16 из 24 семей (67 %) была выявлена несовместимость по НРА-1, при этом количество конфликтов по НРА-1 а и НРА-lb было одинако - вым, каждый из них был идентифицирован в 8 семьях (33,5 %). В некоторых случаях конфликты по НРА-1 сочетались с другими возможными несовместимостями. В одной семье был идентифицирован изолированный конфликт по НРА-3 и в одной по HPA-5 аллоантигенам. В 6 семьях (25 %) были выявлены конфликты по НРА-15 аллоантигену. Таким образом, в отличие от европейских популяций, в которых наиболее часто встречаются несовместимости по HPA-1a (70—80 %), а второе место занимают несовместимости по HPA- 5 (15—20 %) (см. выше), в обследованных российских семьях было зарегистрировано одинаково высокое количество HPA-1a и HPA-1b несовместимостей (по 33,5 %), а вторыми по частоте были несовместимости по HPA-15 (25 %).
Таблица 2. Конфликты по НРА аллоантигенам при НАИТ в российской популяции
Table 2. НРА conflicts in NAIT in Russian population
Конфликтный аллоантиген Conflict alloantigen | 1n (%) | Титры аллоантител в сыворотке матери (против тромбоцитов отца) Maternal serum titers of alloantibodies (against father's platelets) |
|---|---|---|
НРА-1a | 8 (33,5)2 1 1 | 1/16-1/64 1/32 1/32 |
НРА-1b | 8 (33,5)2 2 | 1/16–1/64 |
НРА-3b | 1 (4)3 | 1/16 |
НРА-5b | 1 (4)3 | 1/16 |
НРА-15a | 3 (12,5)3 | 1/4; 1/4;1/8 |
НРА-15b | 3 (12,5)3 | 1/4; 1/8; 1/8 |
Примечание. 1 Из 24 зарегистрированных HPA конфликтов после генотипирования HPA-1, -2, -3, 4, -5, -15 в 28 семьях, имеющих детей с НАИТ. 2 В том числе комбинированные несовместимости НРА-1а + НРА-2b, НРА-3b и НРА-lb + HPA-5a. 3 Изолированные несовместимости по одному аллоантигену. Данные из работы С.Г. Хаспековой и соавт. [9].
Note.1 Out of 24 registered HPA conflicts after genotyping for HPA-1,-2, -3, 4, -5, -15 in 28 families, having babies with NAIT. 2 Including combined incompatibilities НРА-1а + НРА-2b, HPA-3b and НРА-lb + HPA-5a. 3Isolaed incompatibilities for one alloantigen. Data from Khaspekova et al. [9].
Распределение основных НРА полиморфизмов в российской популяции (таблица 1) [13] не отличается от других европейских популяций [8, 11], и поэтому единственное возможное объяснение столь большого вклада НРА-1b и НРА-15 конфликтов в развитие НАИТ в России — это более высокая вероятность аллоиммунизации матерей по этим аллоантигенам. Это явление, возможно, обусловлено особенностями распределения в российской популяции HLA антигенов, участвующих в презентации НРA-1b и HPA-15. В частности, в соответствии с этим предположением у доноров русского происхождения зарегистрирована высо - кая частота HLA гаплотипов HLA-DRB1*07:01,-DQB1*02 [15], наличие которых ассоциировано с продукцией анти-HPA-1b аллоантител у HPA-1a/a пациентов, кото - рым проводились множественные переливания тромбоцитов [16].
Титры цАТ несколько различаются при конфликтах по разным НРА аллоантигенам [9]. Наиболее высокие титры были зарегистрированы при НРА-1, а наиболее низкие — при НРА-15 конфликтах (таблица 2). По-видимому, низкие титры анти-НРА-15 аллоантител объясняются существенно более низким содержанием несущего их антигена CD109 на поверхности тромбоцитов (1000—2000 копий на 1 тромбоцит), по сравнению с носителем НРА-1 антигена, ГП IIb-IIIa (40 000—50 000 копий на 1 тромбоцит) (таблица 1) [11].
Результаты генотипического анализа молекулярной природы конфликтов при НАИТ могут быть подтверждены с помощью иммунологического антиген специфического теста MAIPA [8]. На рисунке ЗА представлены примеры проверки связывания аллоантител из сыворотки двух матерей, предположительно (по результатам HPA генотипирования) направленных против НРА-la и -lb (генотипы HdPA-Ibfb и -1a/a соответственно) с ГП IIb-IIIa, иммобилизованного из лизата тромбоцитов доноров с генотипами HPA- 1а/а и -lb/b. (Использованный вариант теста MAIPA был описан ранее [10].) Положительные реакции регистрируются только при добавлении сыворотки пациентки с генотипом HPA-la/a к ГП IIb-IIIa донора с генотипом HPA-lb/b и пациентки с генотипом HPA-lb/b к ГП IIb-IIIa донора с генотипом HPA-la/a, что подтверждает наличие у этих матерей аллоантител со специфичностью, соответствующей результатам генетипирования.

Таким образом, представленные исследования [9], показали, чтовроссийскойпопуляцииприобследовании семей, имеющих детей с НАИТ, следует обращать особое внимание на несовместимости по HPA-1a, HPA- 1b и HPA-15 аллоантигенам, являющимися наиболее частыми причинами развития этой патологии.
Неонатальная трансиммунная тромбоцитопения (НТИТ)
Неонатальная трансиммунная (аутоимунная) тромбоцитопения (НТИТ) диагностируется у части новорожденных от матерей с ИТП. ИТП является классической аутоиммунной патологией, при которой снижение количества тромбоцитов обусловлено выработкой аутоантител, реагирующих с тромбоцитар- ными антигенами. Чаще всего мишенью аутоантител являются мажорные антигены тромбоцитов — ГП IIb-IIIa и ГП Ib. Распространенность ИТП составляет 2-4 случая на 100 000 населения в год. При этом женщины детородного возраста заболевают приблизительно в два раза чаще мужчин. [2, 3]. У беременных ИТП регистрируется с частотой приблизительно 1 случай на 1000 беременностей [5, 14]. Новорожденные от матерей с ИТП имеют риск развития тромбоцитопении (НТИТ) в связи с возможным трансплацентарным переходом материнских аутоантител в кровоток плода. Частота развития НТИТ со снижением количества тромбоцитов у новорожденного ниже 100-150х109/л составляет, по разным данным, от 20 до 40 %, а в более тяжелой форме с количеством тромбоцитов ниже 50х109/л — около 10 %. Внутричерепные кровоизлияния, как и в случае НАИТ, являются наиболее грозными осложнениями НТИТ, однако встречаются существенно реже — у 1-2 % новорожденных [4, 5, 14, 17-19].
Сама по себе диагностика НТИТ после родов не вызывает существенных проблем. Исключение неиммунных причин тромбоцитопении, уменьшение количества тромбоцитов и повышение уровня ТА-IgG у матери и новорожденного позволяют диагностировать ИТП у матери и НТИТ у ребенка. При этом заболевании, в отличие от НАИТ, у матери наблюдается и тромбоцитопения, и повышение ТА-IgG. Так же как и при диагностике НАИТ (см. выше), необходимо проводить определение ТА-IgG у новорожденного до начала возможной терапии внутривенными иммуноглобулинами.
Гораздо более сложным вопросом является не диагностика НТИТ, а возможность предсказания развития тромбоцитопении у ребенка еще до родов, т.е. на основании обследования беременных с ИТП. Как уже указывалось выше [4, 5, 14, 17-19], риск развития НТИТ у новорожденных в этой ситуации составляет 20-40 %. В качестве возможных предикторов НТИТ у беременных с ИТП рассматривали: количество тромбоцитов (глубина тромбоцитопении), применение кортикостероидов, время начала ИТП (до или во время беременности), уровень антитромбоцитарных антител (как связанных с тромбоцитами, т.е. TA-IgG, так и цАТ) и другие показатели. Однако ни один из них не был идентифицирован как надежный предиктор, по крайней мере, в нескольких независимых исследованиях. В большинстве публикаций содержание тромбоцитов у матери с ИТП [17-22] и применение кортикостероидов [17, 19-22] никак не коррелировали с развитием НТИТ. В трех исследованиях начало ИТП до беременности было ассоциировано с более высоким риском тромбоцитопении у новорожденных [17, 21, 22], однако эти наблюдения не были подтверждены другими авторами [19, 20]. Умеренная отрицательная корреляция между уровнем ТА-IgG и количеством тромбоцитов у новорожденных была отмечена в одной работе [23], но еще в двух работах такой корреляции выявлено не было [17, 21]. Определение антитромбоцитарных цАТ у беременных с ИТП проводили в трех исследованиях [17, 21, 23]. В двух из них, с включением относительно небольшого количества больных (около 60 матерей с ИТП), авторы отмечали: умеренную обратную корреляцию между титром цАТ и количеством тромбоцитов у новорожденных [23] и несколько более высокий процент детекции цАТ в группе матерей, родивших детей с тромбоцитопенией, по сравнению с группой матерей, родивших детей без тромбоци- топении [21]. В крупном исследовании, проведенном P. Samuels и соавт. [17], в которое было включено 162 беременные с ИТП, было убедительно показано, что отсутствие цАТ ассоциировано с минимальным риском развития НТИТ. Однако наличие цАТ имело низкое прогностическое значение, т.к. у многих женщин с цАТ родились дети с нормальным содержанием тромбоцитов. На основании этих данных авторы сделали вывод о высокой чувствительности (низкий уровень ложноотрицательных ответов), но низкой специфичности (высокий уровень ложноположительных ответов) используемого ими теста.
С целью поиска надежных предикторов НТИТ в работе S.G. Khaspekova и соавт. [10] было проведено обследование 100 беременных с ИТП и их новорожденных. Иммунную тромбоцитопеническую пурпуру диагностировали в соответствии со следующими критериями: количество тромбоцитов <100х109/л, отсутствие не иммунных причин тромбоцитопении и повышение уровня TA-IgG >200 % от контроля у здоровых доноров. Содержание тромбоцитов <100х109/л у новорожденных являлось диагностическим показателем НТИТ. Обследование беременных женщин проводилось за 1-2 месяца до родов. После родов матерей разделили на две группы — 37 матерей, у которых родились дети с НТИТ, и 63 матери, у которых родились дети с нормальным количеством тромбоцитов. Как видно из таблицы 3, не было обнаружено никаких различий между этими группами по таким показателям, как возраст, количество тромбоцитов, частота применения кортикостероидов и уровень ТА-IgG, что в основном соответствует и данным ранее проведенных исследований (см. выше). Впервые в этих группах сравнили такой показатель, как средний объем тромбоцитов (характеристика размера), который также не показал взаимосвязи с развитием НТИТ.
Единственный показатель, по которому были обнаружены высоко достоверные различия между группами — это наличие цАТ в сыворотке беременных. Такие антитела были выявлены у 33 из 37 матерей, у которых родились дети с НТИТ, и лишь у 2 из 63 матерей, у которых родились дети без НТИТ. Таким образом, чувствительность этого теста составила 89 %, а специфичность — 97 %. Примеры определения цАТ у беременных с ИТП представлены на рис. 2Б. Как видно из этого рисунка, определялось не только наличие цАТ, но и их титр. Оказалось, что существует сильная и высоко достоверная обратная корреляция между титром цАТ и количеством тромбоцитов у новорожденных с НТИТ (коэффициент корреляции -0,749, p < 0,001, n = 37). Эти данные указывают на то, что с помощью этого теста можно предсказывать не только наличие тромбоцитопении у новорожденного, но и, возможно, степень снижения количества тромбоцитов. В отличие от работы Samuels и соавт. [17], тест на цАТ, применяемый в работе S.G. Khaspekova и соавт. [10], отличала не только высокая чувствительность с точки зрения предсказания НТИТ, но и высокая специфичность, т.е. низкий уровень ложноположительных ответов. Скорее всего, это связано с различием применяемых для определения цАТ методов — метод ИФА с использованием адгезированных на поверхности тромбоцитов в исследовании S.G. Khaspekova и соавт. [10] и метод РИА с использованием тромбоцитов в суспензии в исследовании P. Samuels и соавт. [17]. Также, по-видимому, важным является то, что S.G. Khaspekova и соавт. [10] титровали сыворотки и считали положительными ответы только при превышении (не менее двукратного) не специфического уровня связывания у доноров (отрицательный контроль) не только в неразведенной сыворотке (титр 1), но и при ее двукратном разведении (титр 2) (см. рис. 2 Б).
Таблица 3. Характеристики беременных с ИТП, у которых родились дети с и без НТИТ (НТИТ+ и НТИТ- группы)
Table 3. Characteristics of pregnant women with ITP giving birth to babies with and without NTIT (NTIT+ and NTIT- groups)
Показатель Indicator | НТИТ+ группа1 NTIT + group1 (n = 37) | НТИТ- группа2 NTIT- group2 (n = 63) | p |
|---|---|---|---|
Средний возраст, лет Average age, years | 28 (23-31) | 30 (26-33) | >0,05 |
ИТП до беременности, % (η) ITP before pregnancy, % (n) | 29 (11) | 35 % (22) | >0,05 |
Терапия кортикостероидами, % (η) Corticosteroid therapy, % (n) | 16 (6) | 19 % (12) | >0,05 |
Количество тромбоцитов, х109/л Platelet count, х '09/ L | 58 (45-68) | 59 (43-79) | >0,05 |
Средний объем тромбоцитов, фл The average volume of platelets, fL | 9,7 (9,2-10,3) | 9,9 (9,1-11,0) | >0,05 |
ТА-IgG, % от контроля3 TA-IgG, % of control3 | 360 (310-420) | 320 (270-400) | >0,05 |
Антитромбоцитарные цАТ, % (η) Antiplatelet antibodies, % (n) | 89 (33) | 3 (2) | <0,001 |
Примечание. Количественные показатели представлены в виде медианы и межквартильного интервала; качественные показатели — в виде % от всех больных в группе и количество больных (в скобках). р — достоверность различий между группами (тест Манна — Уитни и тест хи-квадрат для количественных и качественных показателей соответственно). 1 Количество тромбоцитов у новорожденных <100х109/л. 2 Количество тромбоцитов у новорожденных >100х109/л. 3 ТА-IgG >200 % от уровня здоровых доноров у всех беременных с ИТП. Данные из работы S.G. Khaspekova и соавт. [10].
Note. Quantitative parameters are presented as median and interquartile range; for qualitative parameters — % of all patients in the group and number of patients (in brackets). р — Significance of differences between groups (Mann — Whitney test and Chi-square test for quantitative and qualitative parameters respectively); ns — differencies are not sufnificant (p > 0.05). 'Number of platelets in newborns < 100 х 109/л. 2Number of platelets in newborns > 100 х 109/л. 3PA-IgG > 200 % of the level in healthy donors in all pregnant women with ITP Data from Khaspekova et al. [10].
В работе S.G. Khaspekova и соавт. [10] также определяли антигены цАТ у беременных с ИТП, используя метод MAIPA. В качестве мишеней рассматривали главные антигены тромбоцитов — ГП IIb-IIIa и ГП Ib. Примеры анализа цАТ с помощью метода MAIPA представлены на рисунке 3Б. Таким образом были проверены 19 сывороток матерей ИТП, у которых родились дети с НТИТ. Несмотря на то что во всех этих сыворотках были идентифицированы антитромбоцитарные цАТ в тесте ИФА с адгезированными тромбоцитами, положительные реакции по отношению к ГП IIb-IIIa или ГП Ib наблюдались только в 10 из 19 сывороток. Антигенная специфичность оставшихся сывороток осталась неясной. По-видимому, они реагируют с другими, минорными антигенами тромбоцитов, не включенными в анализ. Эти данные также указывают на то, что тест на определение цАТ с использованием в качестве мишени целых тромбоцитов обладает более высокой чувствительностью, чем тест MAIPA с использованием двух главных антигенов тромбоцитов, ГП IIb-IIIa и ГП Ib.
Алгоритм диагностики неонатальной иммунной тромбоцитопении
На основании представленных в обзоре результатов предлагается алгоритм лабораторных диагностических исследований неонатальной иммунной тромбоцитопении (рис. 4). После определения количества тромбоцитов у матери и ребенка и исключения возможных не иммунных причин тромбоцитопении предлагается провести определение у них уровня ТA-IgG (у ребенка строго до начала лечения внутривенными иммуноглобулинами, т.е. по возможности сразу после родов). Если у ребенка отсутствует повышение ТА-IgG, диагноз иммунной тромбоцитопении можно отклонить. Если у матери не регистрируется снижение количества тромбоцитов и подъем ТА-IgG, а у ребенка наблюдается тромбоцитопения и повышение ТА-IgG, то предполагается диагноз НАИТ и для его подтверждения необходимо проверить реактивность цАТ матери по отношению к тромбоцитам отца. В случае положительной реакции в этом тесте диагноз НАИТ можно считать установленным. Однако для выяснения молекулярной природы аллоиммунного конфликта целесообразно проведение генотипирования HPA аллоантигенов матери, ребенка и отца (по возможности) и/или определение аллоантигенов цАТ с помощью метода МАIPA с использованием тромбоцитов (источник антигенов) ранее HPA- типированных доноров. При наличиb у матери ИТП (снижение тромбоцитов и подъем ТА-IgG) и тромбоцитопении, ассоциированной с повышением ТА-IgG, у новорожденного выставляется диагноз НТИТ. У беременных с ИТП для оценки риска развития НТИТ у новорожденных рекомендуется определить в сыворотке цАТ, реагирующие с тромбоцитами донора. Использование в этом случае антиген-специфического теста MAIPA мало информативно вследствие его низкой специфичности.

Рисунок 4. Алгоритм диагностики неонатальных иммунных тромбоцитопений. Подробно — см. текст. 1 При отсутствии повышения ТА-IgG у новорожденного диагноз неонатальной иммунной тромбоцитопении отклоняется вне зависимости от содержания тромбоцитов у матери
Figure 4. Diagnostic algorithm of neonatal immune thrombocytopenias. See text for details. 1In the absence of PA-IgG increase in the newborn diagnosis of immune thrombocytopenia is excluded independently of mother's platelet count
Список литературы
1. Rodeghiero F., Stasi R., Gernsheimer T., et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009; 113: 2386–93.
2. Veneri D., Franchini M., Randon F., et al. Thrombocytopenias: a clinical point of view. Blood Transfus. 2009; 7: 75–85.
3. Psaila B., Bussel J.B. Immune thrombocytopenia (ITP). Platelets. (Michelson AD, ed.). Amsterdam, Boston, Heidelberg et al: Academic Press, Elsevier Inc. 2013: 819–33.
4. Roberts I., Murray N.A. Neonatal thrombocytopenia: causes and management. Arch Dis Child Fetal Neonatal Ed. 2003; 88: 359–64.
5. Roberts I.A.G., Chakravotny S. Thrombocytopenia in the newborn. Platelets. (Michelson AD, editor). Amsterdam, Boston, Heidelberg et al. Elsivier.: Academic Press. 2013: 929–52.
6. Bussel J.B., Primiani A. Fetal and neonatal alloimmune thrombocytopenia: progress and ongoing debates. Blood Reviews. 2008; 22: 33–52.
7. Zdravic D., Yougbare I., Vadasz B., et al. Fetal and neonatal alloimmune thrombocytopenia. Seminars in Fetal & Neonatal Medicine. 2016; 21: 19–27
8. Lochowicz A.J., Curtis B.R. Clinical applications of platelet antibody and antigen testing. Laboratory Medicine. 2011; 42: 687–92.
9. Хаспекова С.Г., Головкина Л.Л., Донюш Е.К. и др. Несовместимость матери и плода по тромбоцитарным аллоантигенам HPA-1a, -1b и -15 — главные причины неонатальной аллоиммунной тромбоцитопении в России. Терапевтический архив. 2018: 90: 65–9.
10. Khaspekova S.G., Shustova O.N., Golubeva N.V., et al. Circulating antiplatelet antibodies in pregnant women with immune thrombocytopenic purpura as predictors of thrombocytopenia in the newborns. Platelets. 2019; 7: 1–5. DOI: 10.1080/09537104.2018.1557615
11. Curtis B.R., McFarland J.G. Human platelet antigens 2013. Vox Sanguinis. 2014; 106: 93–102.
12. Kaplan C., Heyu N., Freedman J. Alloimmune thrombocytopenia. Platelets. (Michelson AD, ed.). Amsterdam, Boston, Heidelberg et al: Academic Press, Elsevier Inc. 2013: 953–70.
13. Головкина Л.Л., Атрощенко Г.В., Пушкина Т.Д. и др. Распределение HPAгенов у больных и относительный риск аллоиммунизации при трансфузиях тромбоцитов. Трансфузиология. 2011; 12 (2): 36–7.
14. Kelton J.G. Idiopathic thrombocytopenic purpura complicating pregnancy. Blood Rev. 2002; 16: 43–6.
15. Хамаганова Е.Г, Кузьминова Е.П., Чапова Р.С. и др. HLA-A*/B*C*/ DRB1*/DQB1*-гены и гаплотипы у доноров костного мозга регистра ФГБУ «Гематологический научный центр» Минздрава России, самоопределившихся как русские. Гематология и трансфузиология. 2017; 62 (2): 65–70.
16. Golovkina L.L., Pushkina T.D., Mikhailova E.A., Savchenko V.G. Genetic risk factors in humoral immune response to platelet antigens HLA and HPA systems in multitransfused hematological patients. Haematologica. 2015; 100: 630.
17. Samuels P., Bussel J.B., Braitman L.E., et al. Estimation of the risk of thrombocytopenia in the offspring of pregnant women with presumed immune thrombocytopenic purpura. N Eng J Med. 1990; 323: 229–35.
18. Webert K.E., Mittal R., Sigouin C.A., et al. retrospective 11-year analysis of obstetric patients with idiopathic thrombocytopenic purpura. Blood. 2003; 102: 4306–11.
19. Koyama S., Tomimatsu T., Kanagawa T., et al. Reliable predictors of neonatal immune thrombocytopenia in pregnant women with idiopathic thrombocytopenic purpura. Am. J. Hematol. 2012; 87: 15–21.
20. Payne S.D., Resnik R., Moore T.R., et al. Maternal characteristics and risk of severe neonatal thrombocytopenia and intracranial hemorrhage in pregnancies complicated by autoimmune thrombocytopenia. Am J Obstet Gynecol. 1997; 177: 149–55.
21. Yamada H., Kato E.H., Kobashi G., et al. Passive immune thrombocytopenia in neonates of mothers with idiopathic thrombocytopenic purpura: incidence and risk factors. Semin Thromb Hemost. 1999; 25: 491–6.
22. Kawaguchi K., Matsubara K., Takafuta T., et al. Factors predictive of neonatal thrombocytopenia in pregnant women with immune thrombocytopenia. Int J Hematol. 2014; 99: 570–76.
23. Mazzucconi M.G., Petrelli V., Gandolfo G.M., et al. Autoimmune thrombocytopenic purpura in pregnancy: maternal risk factors predictive of neonatal thrombocytopenia. Autoimmunity. 1993; 16: 209–14.
Об авторах
С. Г. ХаспековаРоссия
Хаспекова Светлана Георгиевна, кандидат биологических наук, старший научный сотрудник
тел.: +7(495)414-69-88, +7(916)146-46-07; 121552, г. Москва, ул. 3-я Черепковская, д. 15а.
О. Н. Шустова
Россия
Шустова Ольга Николаевна, младший научный сотрудник
Л. Л. Головкина
Россия
Головкина Лариса Леонидовна, доктор медицинских наук, врач иммуногематолог клинической лабораторной диагностики высшей категории, руководитель лаборатории
А. В. Мазуров
Россия
Мазуров Алексей Владимирович, доктор медицинских наук, профессор, главный научный сотрудник, исполняющий обязанности руководителя лаборатории
Рецензия
Для цитирования:
Хаспекова С.Г., Шустова О.Н., Головкина Л.Л., Мазуров А.В. ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ И ПРЕДИКТОРЫ НЕОНАТАЛЬНОЙ ИММУННОЙ ТРОМБОЦИТОПЕНИИ. Гематология и трансфузиология. 2019;64(2):198-210. https://doi.org/10.35754/0234-5730-2019-64-2-198-210
For citation:
Khaspekova S.G., Shustova O.N., Golovkina L.L., Mazurov A.V. DIAGNOSTIC MARKERS AND PREDICTORS OF NEONATAL IMMUNE THROMBOCYTOPENIA. Russian journal of hematology and transfusiology. 2019;64(2):198-210. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-198-210











































