Перейти к:
Массивная кровопотеря в педиатрической практике
https://doi.org/10.35754/0234-5730-2020-65-1-70-86
Аннотация
Введение. Массивная кровопотеря является одной из основных причин летальных исходов и осложнений как у больных, нуждающихся в обширных хирургических вмешательствах, так и у пострадавших с тяжелой травмой. Цель — анализ публикаций, посвященных определению, патогенезу, диагностике и интенсивной терапии острой массивной кровопотери у детей.
Материалы и методы. Проведен анализ 102 отечественных и зарубежных публикаций, посвященных проблеме массивной кровопотере у детей и доступных в базе данных PubMed.
Основные сведения. Представлены современные определения массивной кровопотери у детей, особенности патогенеза, диагностики и лечения массивной кровопотери при тяжелой травме. Рассмотрены принципы коррекции дефицита объема циркулирующей крови, применения инотропных и вазопрессорных препаратов, устранения тяжелой анемии и расстройств гемостаза. Представлены работы, посвященные поиску оптимального соотношения глобулярного и плазменного объемов при проведении трансфузий компонентов крови. Продемонстрирована противоречивость и неоднозначность мнений в отношении применения антифибринолитических препаратов, отражены высокая эффективность использования транексамовой кислоты и ее положительное влияние на функциональный исход у больных с тяжелой травмой. Для оптимизации интенсивной терапии массивной кровопотери у детей необходимо проведение дальнейших мультицентровых исследований в зависимости от основного заболевания, ставшего причиной развития массивной кровопотери, и лечебно-диагностических возможностей стационара, где находится ребенок.
Для цитирования:
Пшениснов К.В., Александрович Ю.С. Массивная кровопотеря в педиатрической практике. Гематология и трансфузиология. 2020;65(1):70-86. https://doi.org/10.35754/0234-5730-2020-65-1-70-86
For citation:
Pshenisnov K.V., Aleksandrovich Yu.S. Massive blood loss in pediatric practice. Russian journal of hematology and transfusiology. 2020;65(1):70-86. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-1-70-86
Введение
Массивная кровопотеря — наиболее частая причина развития жизнеугрожающих осложнений и летальных исходов как у детей, так и у взрослых, особенно у пострадавших с тяжелой травмой и больных, нуждающихся в обширных хирургических вмешательствах. Тяжелая механическая травма является одной из основных проблем здравоохранения [1, 2]. Ежегодно в мире погибает более 5,8 млн человек от тяжелой травмы и ее осложнений, среди которых первое место занимает массивная кровопотеря и травматическая коагулопатия, приводящие к развитию полиорганной недостаточности [3—12]. По мнению многих авторов, именно гиповолемический шок в результате острой массивной кровопотери является фактором риска летального исхода у пострадавших с тяжелой травмой на догоспитальном этапе и в течение первых суток после получения повреждений [13, 14].
Цель обзора — анализ исследований, посвященных определению, патогенезу, диагностике и интенсивной терапии острой массивной кровопотери у детей.
Определения массивной кровопотери
Несмотря на несомненную актуальность рассматриваемой проблемы и многочисленные исследования, посвященные этому вопросу, в настоящее время отсутствует однозначное определение массивной кровопотери, о чем свидетельствует наличие нескольких определений, предложенных различными авторами для разных категорий больных. Широко известно определение, которое гласит, что массивная кровопотеря — это потеря более чем одного объема циркулирующей крови за сутки после травмы или обширного хирургического вмешательства [15]. Однако оно не получило широкого распространения и не может использоваться в клинической практике для принятия решения в режиме реального времени, поскольку объем кровопотери может быть оценен только ретроспективно. Более конкретное определение предложено В. А. Мазурком и соавт. [16], в котором указано, что массивная кровопотеря — это одномоментная утрата более тридцати процентов объема циркулирующей крови (ОЦК) или постепенная утрата 60—70 % ОЦК. Однако это определение тоже малопригодно для практического использования, поскольку имеет недостатки, указанные выше. Наиболее удачными определениями являются те, где авторами указывается объем потери крови в мл/кг массы тела за определенный временной интервал. Особого внимания заслуживают определения, представленные Олманом К. и соавт. [17, 18] и другими авторами.
- Массивной кровопотерей, возникшей во время хирургического вмешательства, считается кровопотеря в объеме 2—3 мл/кг/мин, или 50 % от ОЦК, развившаяся в течение 3 часов[17].
- Массивная кровопотеря — замещение полного объема циркулирующей крови менее чем за 2-4 часа или темп кровопотери, превышающий 1 мл/кг/мин[18].
E. Rosenfeld и соавт. [19] предложили определение массивной кровопотери у детей с тяжелой травмой и повреждением головного мозга, согласно которому под массивной кровопотерей у детей с тяжелой травмой, полученной в мирное время, следует понимать кровопотерю, составляющую 37 мл/кг массы тела за 4 часа и требующую проведения массивной гемотрансфузии. У детей c тяжелой травмой головного мозга критерием массивной кровопотери является скорость кровотечения, превышающая 40 мл/кг/час, что ассоциируется с высоким риском летального исхода и может использоваться в качестве прогностического маркера [20].
В отличие от травмы в педиатрической кардиохирургии для верификации диагноза «послеоперационное кровотечение» используется определение, предложенное R. S. Bercovitz и соавт. [21], согласно которому кровотечением в послеоперационном периоде является темп кровопотери по торакальному дренажу 84 мл/кг массы тела или более в первые сутки после операции или более 7 мл/кг/час в течение двух и более часов в первые двенадцать часов после завершения хирургического вмешательства с использованием аппарата искусственного кровообращения. С этим определением в клинической практике согласны и другие авторы [22].
Факторы риска массивной кровопотери
Факторами риска массивной кровопотери являются тяжелая сочетанная травма с повреждением внутренних органов, желудочно-кишечное кровотечение, кровотечение из варикозно расширенных вен пищевода при синдроме портальной гипертензии, ранение магистрального артериального сосуда, разрыв аневризмы аорты, коагулопатия различного генеза, травматичные хирургические манипуляции [18].
Среди хирургических вмешательств, высокий риск массивной кровопотери возникает при операциях на сердце, головном мозге и позвоночнике. Крайне высок риск массивной кровопотери при коррекции врожденных аномалий черепа, особенно при краниостенозе [23, 24].
Факторами риска развития массивной кровопотери являются особенности хирургического вмешательства и анестезиологического обеспечения. При операциях на позвоночнике к хирургическим факторам риска относятся величина разреза, число фиксируемых позвонков, длительность операции, место забора, количество костных трансплантатов, этап их получения, предварительные операции фиксации позвоночника и хирургическая техника. В качестве особенностей анестезии следует отметить повышение системного артериального и венозного давлений, интраабдоминальную гипертензию, обусловленную положением больного на животе, и длительную респираторную поддержку с положительным давлением на вдохе, которые также могут стать причиной увеличения объема кровопотери [25].
Риск развития массивной кровопотери высок у больных неонатального и раннего детского возраста, что обусловлено анатомо-физиологическими особенностями. В периоде новорожденности имеется значительный дефицит факторов, принимающих участие в гемостазе, особенно витамин К-зависимых факторов свертывания крови [26—29]. Кроме этого, у данной категории больных отмечается и существенный дефицит естественных антикоагулянтов — активность протеинов С и S у новорожденных составляет лишь 35 %, и система гемостаза окончательно формируется лишь к шести месяцам [30].
У детей старшего возраста высокий риск массивной кровопотери может быть обусловлен анатомо-физиологическими особенностями, особенностями гемостаза, наличием инфекционно-воспалительного процесса в качестве сопутствующего заболевания и применением различных лекарственных препаратов, оказывающих отрицательное влияние на гемостаз: аспирин, гепарин, простагландины [31—33].
Патогенез массивной кровопотери
Массивная кровопотеря опасна не только значительным снижением объема циркулирующей крови за минимально короткое время, но и развитием ряда патофизиологических и патобиохимических каскадов, которые приводят к полиорганной недостаточности. Массивная кровопотеря всегда сопровождается развитием гипотермии, коагулопатии и метаболического ацидоза, сочетание которых известно как «летальная» триада [3, 34, 35]. Значительные сдвиги отмечаются в деятельности вегетативной и иммунной систем, развиваются массивный фибринолиз, иммунный дисбаланс и синдром системного воспалительного ответа, требующие проведения максимально ранней, патогенетически обоснованной интенсивной терапии [36— 40]. Наиболее опасным осложнением массивной кровопотери является тяжелая коагулопатия, механизм развития которой при тяжелой травме представлен на рисунке 1 [41].
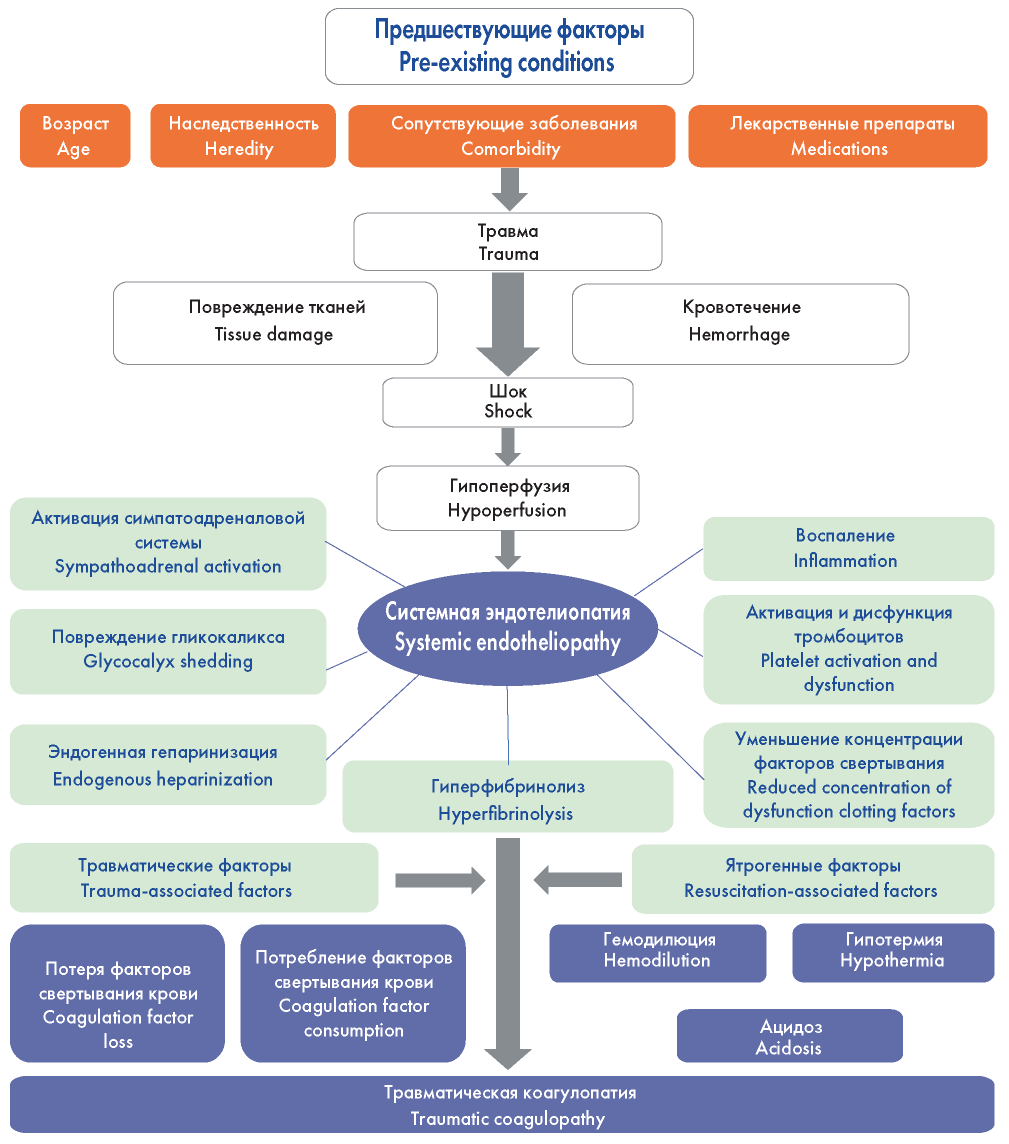
Рисунок 1. Травматическая коагулопатия [41]
Figure 1. Traumatic coagulopathy [41]
Сочетание гиповолемического шока на фоне продолжающегося кровотечения с травматическим повреждением тканей приводит к дисбалансу регуляции тромбо- модулина, выбросу тканевого тромбопластина, который запускает развитие травматической коагулопатии и синдрома полиорганной недостаточности [38]. Ятрогенные воздействия также могут стать причиной нарушений гемостаза. К ним относятся: введение большого количества несогретых кристаллоидных растворов, для которых характерен низкий уровень рН, несвоевременная коррекция метаболического ацидоза и гипокальциемии, позднее устранение гипотермии [39—41].
Оценка степени тяжести массивной кровопотери
Для оценки степени тяжести кровопотери, как у детей, так и у взрослых, используют классификацию, предложенную Американской ассоциацией хирургов в 2012 г. (табл. 1), однако она не учитывает особенности детского возраста и имеет определенные ограничения для применения в педиатрической практике [40].
Таблица 1. Оценка тяжести кровопотери [39]
Table 1. Assessment of the severity of blood loss [39]
|
Характеристики Characteristics |
I степень Class I |
II степень Class II |
III степень Class III |
IV степень Class IV |
|---|---|---|---|---|
|
Объем кровопотери Blood loss, % |
< 15 <15 |
15-30 |
30-40 |
> 40 |
|
Объем кровопотери, мл Blood loss, mL |
<750 < 750 |
750-1500 |
1500-2000 |
> 2000 |
|
Частота сердечных сокращений, ударов/минуту Heart rate, bpm |
<100 |
100-120 |
120-140 |
>140 |
|
Систолическое АД, мм рт. ст. Systolic blood pressure, mm Hg |
Норма Normal |
Норма Normal |
Снижено Decreased |
Очень низкое Very decreased |
|
Пульсовое артериальное давление, мм рт. ст. Pulse pressure, mm Hg |
Норма или повышено Normal or increased |
Снижено Decreased |
Снижено Decreased |
Снижено Decreased |
|
Частота дыхания, в минуту Respiratory rate, per min |
14-20 |
20-30 |
30-40 |
>35 |
|
Диурез, мл/час Urine output, mL/h |
>30 |
20-30 |
5-15 |
0-10 |
|
Центральная нервная система Central nervous system |
Легкое возбуждение Slightly anxious |
Умеренное возбуждение Mildly anxious |
Возбуждение, угнетение сознания Anxious, confused |
Угнетение сознания, летаргия Confused, lethargic |
|
Стартовая волемическая нагрузка Initial fluid load |
Кристаллоиды Crystalloid |
Кристаллоиды Crystalloid |
Кристаллоиды и кровь Crystalloid and blood |
Кристаллоиды и кровь Crystalloid and blood |
В десятом издании руководства Advanced Trauma Life Support [40] авторы предлагают критерии системного ответа для оценки тяжести кровопотери у детей, представленные в таблице 2.
Таблица 2. Оценка тяжести кровопотери у детей [40]
Table 2. Assessment of the severity of blood loss in children [40]
|
Степень тяжести кровопотери Severity of blood loss |
Легкая степень тяжести (менее 30 % ОЦК) Mild blood volume loss (<30 % of blood volume) |
Средняя степень тяжести (30-45 %ОЦК) Moderate blood volume loss (30-45 % of blood volume) |
Тяжелая степень тяжести (более 45 % ОЦК) Severe blood volume loss (>45 % of blood volume) |
|---|---|---|---|
|
Сердечно-сосудистая система Cardiovascular system |
Увеличение ЧСС*, слабый, нитевидный пульс на периферических артериях, нормальное САД и пульсовое АД Increased heart rate; weak, threadlike peripheral pulse; normal systolic blood pressure; normal pulse pressure |
Значительное увеличение ЧСС, слабый, нитевидный пульс на магистральных артериях, отсутствие пульса на периферических артериях, уменьшение пульсового АД Markedly increased heart rate; weak, threadlike central pulse; absent peripheral pulse; low normal systolic blood pressure; narrowed pulse pressure |
Тахикардия с переходом в брадикардию, слабый, нитевидный пульс на магистральных артериях, отсутствие пульса на периферических артериях, уменьшение САД и пульсового АД (ДАД не определяется!) Tachycardia followed by bradycardia; very weak or absent central pulses; absent peripheral pulses; hypotension; narrowed pulse pressure (or undetectable diastolic blood pressure!) |
|
Центральная нервная система Central nervous system |
Беспокойство, возбуждение, дезориентация Anxious; irritable, confused |
Летаргия, отсроченный ответ на боль Lethargic; dulled response to pain |
Кома Comatose |
|
Кожа Skin |
Холодная, мраморность, увеличение времени наполнения капилляров Cool, mottled; prolonged capillary refill |
Цианоз, значительное увеличение времени наполнения капилляров Cyanotic, markedly prolonged capillary refill |
Бледная, холодная Pale, cold |
|
Диурез Urine output |
Низкий или очень низкий Low or very low |
Олигурия Oliguria |
Анурия Anuria |
Примечание. ЧСС — частота сердечных сокращений, САД — систолическое АД, ДАД — диастолическое АД.
Note. ЧСС — heart rate, САД — systolic blood pressure, ДАД — diastolic blood pressure.
В качестве критериев тяжести острой кровопотери у детей рассматриваются лишь клинические признаки (табл. 3), в то время как у взрослых используется оценка дефицита оснований как показатель тяжести гиповолемического шока и системной гипоперфузии. Дефицит оснований до —2 ммоль/л свидетельствует о гиповолемии легкой степени, дефицит оснований до —6 ммоль/л — об умеренной гиповолемии, до —10 ммоль/л — о гиповолемии средней степени тяжести, а дефицит оснований, превышающий 10 ммоль/л, является достоверным признаком гиповолемии тяжелой степени и соответствует четвертому классу тяжести кровопотери по классификации Американской ассоциации хирургов [40, 42]. В пользу того, что дефицит оснований является достоверным маркером тяжести кровопотери и полученных травматических повреждений, свидетельствует ряд работ, в которых показана высокая прогностическая ценность шкалы BIG, оценивающей дефицит оснований, международное нормализованное отношение и оценку по шкале комы Глазго у детей с тяжелой черепно-мозговой травмой [43—46].
Таблица 3. Гемодинамические эффекты норадреналина
Table 3. Circulation effects of norepinephrine
|
Показатель гемодинамики Hemodynamic parameter |
Эффекты Effects |
|---|---|
|
ЧСС Heart rate |
Зависимая величина: остается без изменений или уменьшается при увеличении АД; возрастает, если АД остается сниженным Dependent value: remains unchanged or decreases as arterial pressure increases; Increases if arterial pressure remains reduced |
|
Сократимость миокарда Contractility |
Незначительно возрастает Slightly increases |
|
Сердечный выброс Cardiac output |
Увеличивается или уменьшается, в зависимости от ОПСС Increases or decreases, depending on systemic vascular resistance |
|
Артериальное давление Arterial pressure |
Возрастает Increases |
|
Периферическое сосудистое сопротивление Systemic vascular resistance |
Заметно увеличивается Considerably increases |
|
Легочное сосудистое сопротивление Pulmonary vascular resistance |
Возрастает Increases |
В европейском руководстве по коррекции кровопотери и коагулопатии у больных с травмой с целью оценки степени тяжести гиповолемического шока также рекомендуют использовать шоковый индекс, дефицит оснований и концентрацию лактата [41].
Интенсивная терапия массивной кровопотери
Основной задачей интенсивной терапии острой массивной кровопотери является устранение дефицита объема циркулирующей крови, системной гипоперфузии и коагулопатии, причем чем раньше начато лечение, тем благоприятнее исход [41, 47].
На догоспитальном этапе в первую очередь необходимо предпринять меры для остановки наружного кровотечения, для чего могут использоваться различные методы, начиная от прижатия и заканчивая применением турникетов и специальных противошоковых костюмов. Больные с тяжелой сочетанной травмой должны быть максимально быстро госпитализированы в специализированный центр, что укладывается в концепцию «золотого часа» [48].
При поступлении больного в стационар должны быть предприняты меры по максимально быстрой остановке кровотечения путем оперативного вмешательства и устранения повреждений внутренних органов, что отражено в концепции damage control [49—51].
Коррекция дефицита объема циркулирующей крови
Для устранения дефицита объема циркулирующей крови препаратом первой линии является сбалансированные кристаллоидные растворы или 0,9 %-й раствор хлорида натрия, однако избыточного введения последнего следует избегать, поскольку это может привести к гиперхлоремическому метаболическому ацидозу и стать причиной развития дилюционной коагулопатии и гемодинамических нарушений [52—54]. Применение гипоосмолярных растворов (раствор Рингера-лактата) у больных с черепно-мозговой травмой противопоказано, поскольку их введение может стать причиной прогрессирования внутричерепной гипертензии [55, 56]. Использование коллоидных растворов должно быть ограничено вследствие их негативного влияния на гемостаз и функцию почек [41].
Как на догоспитальном этапе, так и на этапе оказания помощи пострадавшему в специализированном стационаре, с целью профилактики прогрессирования кровотечения применяется стратегия пермиссивной гипотензии и рестриктивной инфузионной терапии вплоть до полной остановки кровотечения и стабилизации состояния больного [57]. В ряде работ было установлено, что агрессивная инфузионная терапия, начатая уже на догоспитальном этапе, оказывает негативное влияние на исход тяжелой травмы [58—68]. Показано, что введение больших объемов жидкости увеличивало частоту развития компартмент-синдрома [67], лапаротомий в рамках реализации концепции damage control [65], коагулопатии [64, 68], полиорганной недостаточности [66], нозокомальных инфекций [66], частоты и объемов гемотрансфузий [68], а также увеличивало продолжительность пребывания в отделениях интенсивной терапии и в стационаре [61, 66].
У взрослых больных с тяжелой травмой без поражения головного мозга целевое систолическое артериальное давление должно находиться в диапазоне 80—90 мм рт. ст. (среднее артериальное давление 50— 60 мм рт. ст.) до остановки кровотечения. При тяжелой черепно-мозговой травме среднее артериальное давление должно быть выше 80 мм рт. ст. [41]. В педиатрической практике в настоящее время отсутствуют четкие рекомендации по целевым показателям систолического артериального давления у детей с тяжелыми травматическими повреждениями и массивной кровопотерей, однако доказано, что как артериальная гипотензия, так и гипертензия ассоциируются с неблагоприятными исходами тяжелой черепно-мозговой травмы у детей [69, 70]. При лечении массивной кровопотери у детей с тяжелой черепно-мозговой травмой следует поддерживать такие показатели системного артериального давления, при которых обеспечивается оптимальное церебральное перфузионное давление.
При наличии жизнеугрожающей артериальной гипотензии оправдано назначение вазопрессоров, препаратом выбора является норадреналин, который обладает вазоконстрикторным эффектом и существенно повышает периферическое сосудистое сопротивление [41, 71]. Терапевтические эффекты норадреналина представлены в таблице 3 [72]. Следует использовать только минимально необходимые дозы препарата, чтобы не вызвать чрезмерного вазоспазма и прогрессии недостаточности кровообращения [73]. Применение инотропных препаратов оправдано лишь при наличии дисфункции миокарда, которая может возникнуть при ушибе сердца, наличии выпота в полости перикарда или быть проявлением тяжелой внутричерепной гипертензии [41, 74].
Применение норадреналина или фенилэфрина оправдано у больных со спинальной травмой, особенно при поражении средней и нижней трети грудного отдела позвоночника и спинного мозга [75].
Y. R. Lin и соавт. [76] показали, что раннее применение адреналина у детей с тяжелой травмой позволило обеспечить более длительное выживание больных в постреанимационном периоде. Однако авторы отметили, что применение адреналина в ранние сроки после травмы сопровождалось как положительными эффектами, в частности увеличением сердечного выброса, так и негативными эффектами в виде снижения диуреза, метаболического ацидоза, увеличения риска летального исхода.
Коррекция гипоксемии и нарушений газообмена
При наличии тяжелой травмы и массивной кровопотери показан максимально ранний перевод больного на искусственную вентиляцию легких с целью устранения гипоксемии, при этом следует избегать как гиповентиляции, так и гипервентиляции, которые могут усугубить уже имеющиеся гемодинамические нарушения. Кратковременная гипервентиляция показана лишь при наличии признаков дислокационного синдрома [41]. Кроме этого, алкалоз может стать причиной гипокальциемии и снижения сердечного выброса: увеличение рН на 0,1 единицы приводит к снижению концентрации кальция примерно на 0,05 ммоль/л [77].
Коррекция анемии и коагулопатии
Низкие начальные показатели концентрации гемоглобина крови являются индикатором кровотечения тяжелой степени. Показатели концентрации гемоглобина в пределах референсных значений могут стать причиной ложной интерпретации состояния больного и замаскировать кровотечение, поэтому целесообразно повторное исследование концентрации гемоглобина крови с целью исключения продолжающегося кровотечения. Целевая концентрация гемоглобина у больных с острой кровопотерей в структуре сочетанной травмы составляет 70—90 г/л, поэтому должны быть предприняты все усилия для достижения указанных показателей.
Оптимальное соотношение объема свежезамороженной плазмы к объему эритроцитов при проведении трансфузии компонентов крови у взрослых больных с тяжелой травмой составляет 1:2. При жизнеугрожающем геморрагическом шоке соотношение объема эритроцитов к объему плазмы и тромбоцитов должно быть равно 2:1:1 или 1:1:1, при отсутствии риска для жизни соотношение компонентов крови должно составлять 1:1:1 [78]. Однако в обзоре G. Maw и C. Furyk [79], в который было включено 35 публикаций, показано, что в настоящее время отсутствуют доказательства того, что соотношение компонентов крови 1:1:1 способствует значительному улучшению исходов кровопотери, а повышенные соотношения не влияют на смертность. Авторы [79] полагают, что перспективным является подход, основанный на оценке показателей гемостаза с помощью вискоэластических тестов, раннем введении транексамовой кислоты и концентрата фибриногена.
С этих позиций особого внимания заслуживает исследование, в которое было включено 465 детей с тяжелой механической травмой [80]. Из исследования были исключены больные с термической травмой, умершие при поступлении и имевшие не совместимую с жизнью травму. В зависимости от соотношения объема плазмы к объему эритроцитов дети были разделены на три группы. В первую группу были включены больные с низким соотношением объема плазмы к объему форменных элементов (менее 1:2), во вторую — со средним (более 1:2, но менее 1:1) и в третью — с высоким соотношением (более 1:1). Установлено, что высокое соотношение объема плазмы по отношению к объему форменных элементов сопровождалось улучшением показателей выживаемости, при этом объем трансфузии тромбоцитов не оказывал никакого влияния на исход [80]. Имеющиеся в настоящее время отечественные нормативные документы, регламентирующие проведение трансфузий компонентов крови, уже значительно устарели и не содержат современных рекомендаций по оптимизации соотношения глобулярного и плазменного компонентов донорской крови [81, 82].
Показанием к назначению свежезамороженной плазмы является удлинение протромбинового времени или активированного частичного тромбинового времени более чем в 1,5 раза более нормы. Однако введение чрезмерно больших объемов этого компонента крови чревато объемной перегрузкой и развитием острого трансфузионного повреждения легких, связанного с трансфузией, который в англоязычной литературе известен как TRALI — transfusion acute lung injury [83].
Назначение факторов свертывания крови оправдано лишь при наличии доказанного дефицита конкретного фактора. Концентрат фибриногена назначается, когда его концентрация в плазме крови снижается до 1,5 г/л и ниже. Стартовая доза концентрата фибриногена у взрослых составляет 3—4 г [41]. К сожалению, в Российской Федерации он отсутствует, поэтому его применение в рутинной практике в настоящее время невозможно и вместо него может быть использован криопреципитат (табл. 4).
Таблица 4. Лекарственные препараты для коррекции гипокоагуляции
Table 4. Drugs for correction of hypocoagulation
|
Препарат Drug |
Доза Dose |
|
|---|---|---|
|
Криопреципитат Cryoprecipitate |
5-10 мл/кг |
|
|
Концентрат протромбинового комплекса Prothrombin complex concentrate |
25-50 МЕ/кг |
|
|
Рекомбинантный активированный фактор свертывания крови VII Recombinant activated factor VII |
90 мкг/кг |
|
|
Транексамовая кислота Tranexamic acid |
Насыщающая доза — 15 мг/кг, поддерживающая доза — 2 мг/кг/час в течение 8 ч, если кровотечение остановлено |
|
Количество тромбоцитов у больных с тяжелой травмой должно быть не ниже 50 х 10 9/л. У больных с продолжающимся кровотечением или тяжелой черепномозговой травмой целевое количество тромбоцитов должно быть не ниже 100 х 10 9/л. Трансфузия тромбоцитов проводится в стартовой дозе 4—8 единиц концентрата тромбоцитов или одна доза аферезного концентрата тромбоцитов [41].
Для устранения гипокоагуляции необходимы максимально ранняя профилактика и устранение гипотермии.
У больных с жизнеугрожающим кровотечением оправдано максимально раннее назначение транексамовой кислоты в дозе, соответствующей возрасту (табл. 5). У взрослых она назначается в дозе 1 г в течение 10 минут с последующей инфузией 1 грамма препарата в течение 8 часов [41]. Назначение транексамо- вой кислоты показано в первые три часа после травмы как на догоспитальном этапе, так и на этапе стационарного лечения. Показания к назначению транекса- мовой кислоты у детей с тяжелой травмой включают наличие тяжелой артериальной гипотензии (систолическое артериальное давление менее 80 мм рт. ст. у детей до 5 лет и менее 90 мм рт. ст. у детей старше 5 лет); отсутствие или плохая реакция на волемическую нагрузку в объеме 20—40 мл/кг и продолжающееся выраженное кровотечение [84]. S. M. Goobie и D. Faraoni [85] полагают, что применение транексамовой кислоты в нагрузочной дозе 10—30 мг/кг с последующей продленной инфузией 5—10 мг/кг/час обладает максимальным терапевтическим эффектом и минимальными побочными реакциями. Назначение транексамовой кислоты оправдано и в нейрохирургии при коррекции врожденных аномалий развития черепа. N. M. Kurnik и соавт. [86] установили, что объем интраопераци- онной кровопотери (25 против 34 мл/кг; p < 0,0143) и трансфузий компонентов крови ((264 против 428 мл; p < 0,0001) был значительно меньше у детей, получавших транексамовую кислоту. Трансфузии компонентов крови после операции им также не проводилась, в то время как у больных, которым транексамовая кислота не назначалась, трансфузия компонентов крови потребовалась в 45 % случаев. Аналогичные результаты были получены и в исследовании E. J. Kim и соавт. [87], которые, оценивая эффективность транексамовой кислоты на основе показателей ротационной тромбоэластометрии, показали, что инфузия транексамовой кислоты позволяла уменьшить кровопотерю и потребность в переливании компонентов крови во время хирургического лечения краниосиностоза. Кроме этого, было отмечено, что введение транексамовой кислоты предотвращало повышение плазменной концентрации D-димера, не воздействуя на системный гемостаз.
Одним из показаний к назначению транексамовой кислоты являются обширные операции на позвоночнике. D. J. Johnson и соавт. [88] установили, что применение больших доз транексамовой кислоты обладало более выраженным гемостатическим эффектом по сравнению с малыми дозами и способствовало уменьшению объема кровопотери и трансфузий компонентов крови у детей с идиопатическим сколиозом, нуждавшихся в хирургическом лечении. Однако J. McNeil и соавт. [89] при анализе результатов операций на позвоночнике у 604 детей показали: несмотря на то, что антифибринолитические препараты широко использовались в данной области хирургии, их назначение не оказывало положительного влияния на частоту и объем трансфузий аллогенных компонентов крови как во время операции, так и в послеоперационном периоде. В то же время в метаанализе K. Siotou и соавт. [90] было отмечено, что применение антифрибинолитических препаратов в черепно-лицевой и ортопедической хирургии представляется перспективным методом терапии нарушений гемостаза. Авторы [90] показали, что применение антифибринолитиков приводило к статистически значимому уменьшению кровопотери и трансфузий компонентов крови при черепно-лицевых операциях у взрослых и детей и к значительно меньшей кровопотере во время ортопедических хирургических вмешательств. На основании полученных результатов они сделали вывод, что антифибринолитики могут значительно уменьшить кровопотерю при краниофациальных хирургических вмешательствах, включая краниосиностоз у детей и ринопластику у взрослых. Применение указанных препаратов способствовало уменьшению частоты трансфузий компонентов крови при краниофациальных операциях у детей, однако безопасность применения этих лекарственных средств по-прежнему вызывает сомнения из-за относительной скудности информации о неблагоприятных эффектах, что сопоставимо и с заключениями ранее проведенных исследований [90, 91].
Особого внимания заслуживает работа D. K. Nishijima и соавт. [92], в которой оценивалось влияние транексамовой кислоты на функциональный исход у 13432 больных с тяжелой травмой, из которых 6679 получали плацебо и 6753 — транексамовую кислоту. Авторами [91] установлено, что применение транексамовой кислоты оказывало существенное позитивное влияние на исход у взрослых больных с тяжелой сочетанной травмой. По данным многоцентрового рандомизированного исследования CRASH-3 [93], в которое было включено 12 737 больных с черепно-мозговой травмой из 175 госпиталей 29 стран, раннее, в течение первых трех часов после получения травмы, назначение транексамовой кислоты эффективно, безопасно и позволяло уменьшить смертность. Делается вывод, что лечение транексамовой кислотой должно быть начато в максимально ранние сроки после получения травмы.
Применение антифибринолитиков в педиатрической кардиохирургии в настоящее время спорно в связи с отсутствием достоверной информации о побочных эффектах, осложнениях и дозах препаратов в зависимости от возраста ребенка [94, 95]. Аминокапроновая кислота вводится в нагрузочной дозе 75 мг/кг с последующей инфузией со скоростью 75 мг/кг/час. Помимо этого, она еще добавляется в контур аппарата искусственного кровообращения (АИК) в дозе 75 мг/кг. У новорожденных доза насыщения аминокапроновой кислоты составляет 40 мг/кг, а скорость инфузии — 30 мг/кг/час. В контур АИК она добавляется из расчета 100 мг/л. Транексамовая кислота назначается в насыщающей дозе 100 мг/кг с последующей постоянной инфузией 10 мг/кг в течение всей операции. В контур АИК она добавляется в дозе 100 мг/кг [96].
С целью коррекции гипокальциемии показано назначение кальция хлорида, однако осмолярность этого раствора крайне высока (3000 мОсм /л), поэтому вводить его можно только в магистральные венозные сосуды [97]. У детей старшего возраста целевая концентрация ионизированного кальция составляет 1,12—1,23 ммоль/л. Терапевтические дозы препаратов для коррекции гипокоагуляции представлены в таблице 4 [98].
После устранения острой массивной кровопотери показано применение терапевтических средств, направленных на устранение тромбозов и профилактику тромбообразования [41].
При отсутствии эффекта от проводимых терапевтических мероприятий, прогрессировании коагулопатии и наличии дефицита факторов свертывания целесообразно назначение концентратов протромбинового комплекса [41].
При развитии острой массивной кровопотери во время операции целесообразно применение протокола массивной гемотрансфузии, который должен быть создан в каждой медицинской организации, исходя из ее лечебно-диагностических возможностей и наличия банка крови. Вариант протокола массивной гемотрансфузии представлен на рисунке 2 [99, 100]. Кроме трансфузий аллогенных компонентов крови необходимо обязательно использовать методы предварительной заготовки и переливания аутологичных эритроцитов больного, применение которых в клинической практике впервые предложил наш соотечественник В. В. Сутугин. В 1865 г. в Военно-медицинской академии им была защищена диссертация на степень доктора медицины, в которой он впервые в мире предложил консервировать кровь для ее последующего применения, а также высказал идею о возможности возвращения (реинфузии) излившейся крови в сосудистое русло больному. Таким образом, он является основоположником двух методов трансфузиологии, спасших впоследствии тысячи, если не миллионы, жизней больных и раненых людей, однако его имя в настоящее время практически забыто [101].

Рисунок 2. Протокол гемотрансфузии при массивной кровопотере у детей [97, 98]
Примечания. ЭСК — эритроцитсодержащие компоненты крови, крио — криопрециптат, СЗП — свежезамороженная плазма, КТ — концентрат тромбоцитов
Figure 2. Blood transfusion protocol for massive blood loss in children [97, 98]
Notes. RBC — RBC-containing blood components, Cryo — cryoprecipitate, FFP — Fresh frozen plasma, PC — platelet concentrate
Одним из перспективных направлений для исследований является оценка эффективности синтетических аналогов вазопрессина с целью коррекции нарушений гемостаза, однако доказательства целесообразности его использования как у детей, так и взрослых отсутствуют, хотя имеется ряд работ, в которых показаны положительные эффекты применения вазопрессина [102, 103].
Таким образом, несмотря на наличие значительного количества публикаций, большинство представленных результатов являются дискутабельными, а порой даже носят противоречивый характер, что требует проведения дальнейших многоцентровых исследований в зависимости от основного заболевания, ставшего причиной развития массивной кровопотери, и лечебно-диагностических возможностей стационара, где находится ребенок.
Список литературы
1. G. B. D. Causes of Death Collaborators. Global, regional, and national agesex specific mortality for 264 causes of death, 1980–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2017; 390 (10100): 1151–210. DOI: 10.1016/S0140-6736(17)32152-9.
2. World Health Organization (ed.): Injuries and violence: the facts 2014, Publication edn. On line: World Health Organization; 2014: https://www.who.int/violence_injury_prevention/media/news/2015/Injury_violence_facts_2014/en/.
3. Brohi K., Singh J., Heron M., Coats T. Acute traumatic coagulopathy. J Trauma. 2003; 54(6): 1127–30.
4. Frith D., Goslings J.C., Gaarder C. et al. Definition and drivers of acute traumatic coagulopathy: clinical and experimental investigations. J Thromb Haemost. 2010; 8(9): 1919–25. DOI: 10.1111/j.1538-7836.2010.03945.x.
5. Khan S., Davenport R., Raza I. et al. Damage control resuscitation using blood component therapy in standard doses has a limited effect on coagulopathy during trauma hemorrhage. Intensive Care Med. 2015; 41(2): 239–47. DOI: 10.1007/s00134-014-3584-1.
6. MacLeod J.B., Lynn M., McKenney M.G., Cohn S.M. et al. Early coagulopathy predicts mortality in trauma. J Trauma. 2003; 55(1): 39–44.
7. Maegele M., Lefering R., Yucel N. et al. Early coagulopathy in multiple injury: an analysis from the German Trauma Registry on 8724 patients. Injury. 2007; 38(3): 298–304.
8. Maegele M., Schöchl H., Cohen M.J. An update on the coagulopathy of trauma. Shock. 2014; 41(Suppl 1): 21–5. DOI: 10.1097/SHK.0000000000000088.
9. Schöchl H., Frietsch T., Pavelka M., Jambor C. Hyperfibrinolysis after major trauma: differential diagnosis of lysis patterns and prognostic value of thrombelastometry. J Trauma. 2009; 67(1): 125–31. DOI: 10.1097/TA.0b013e31818b2483.
10. Schöchl H., Nienaber U., Maegele M. et al. Transfusion in trauma: thromboelastometry-guided coagulation factor concentrate-based therapy versus standard fresh frozen plasma-based therapy. Crit Care. 2011; 15(2): R83. DOI: 10.1186/cc10078.
11. Cap A., Hunt B.J. The pathogenesis of traumatic coagulopathy. Anaesthesia. 2015; 70(Suppl 1): 96–101 e132–104. DOI: 10.1111/anae.12914.
12. Moore E.E., Knudson M.M., Jurkovich G.J. et al. Emergency traumatologist or trauma and acute care surgeon: decision time. J Am Coll Surg. 2009; 209(3): 394–5. DOI: 10.1016/j.jamcollsurg.2009.06.003.
13. Кешишян Р.А., Амчеславский В.Г., Саруханян О.О., Янюшкина О.Г. Пятилетний мониторинг детского травматизма со смертельным исходом в городе Москве. Неотложная медицинская помощь. 2012; 2: 34–41.
14. Cothren C.C., Moore E.E., Hedegaard H.B., Meng K. Epidemiology of urban. trauma deaths: a comprehensive reassessment 10 years later. World J Surg. 2007; 31(7): 1507–11.
15. Worasak Keeyapaj. Bleeding and Coagulation Catastrophes in the Operating Room. https://emedicine.medscape.com/article/2500074-overview#a2.
16. Кровообращение и анестезия. Под ред. К.М. Лебединского. 2-е изд-е. СПб.: Человек, 2015. 1076 с.
17. Massive blood loss in children. NHS: East of England Regional Transfusion Committee.
18. Олман К. Неотложные состояния в анестезиологии. М.: Бином-Пресс, 2013. 367 с.
19. Rosenfeld E., Lau P., Zhang W. et al. Defining massive transfusion in civilian pediatric trauma. J Pediatr Surg. 2019; 54(5): 975–9. DOI: 10.1016/j.jpedsurg.2019.01.029.
20. Rosenfeld E.H., Lau P., Cunningham M.E. et al. Defining massive transfusion in civilian pediatric trauma with traumatic brain injury. J Surg Res. 2019;236:44–50. DOI: 10.1016/j.jss.2018.10.053.
21. Bercovitz R.S., Shewmake A.C., Newman D.K. et al. Validation of a definition of excessive postoperative bleeding in infants undergoing cardiac surgery with cardiopulmonary bypass. J Thorac Cardiovasc Surg. 2018; 155(5): .e2 2112–24. DOI: 10.1016/j.jtcvs.2017.12.038.
22. Maroney S.A., Peterson J.A., Zwifelhofer W. et al. Plasma proteolytic cascade activation during neonatal cardiopulmonary bypass surgery. Thromb Haemost. 2018; 118(9): 1545–55. DOI: 10.1055/s-0038-1667198.
23. Mogensen S., Lubenow N., Nilsson P. et al. An evaluation of the mixed pediatric unit for blood loss replacement in pediatric craniofacial surgery. Paediatr Anaesth. 2017; 27(7): 711–7. DOI: 10.1111/pan.13140.
24. Thottathil P., Sesok-Pizzini D., Taylor J.A. et al. Whole blood in pediatric craniofacial reconstruction surgery. J Craniofac Surg. 2017; 28(5): 1175–8. DOI: 10.1097/SCS.0000000000003594.
25. Грегори Д.А. Анестезия в педиатрии. М.: Медицина, 2003. 1181 с.
26. Шабалов Н.П. Неонатология. Учебное пособие в двух томах. М.: ГЭОТАР-Медиа, 2019.
27. Шабалов Н.П. Детские болезни. Учебник для вузов. СПб.: Питер, 2019.
28. Рыбка М.М., Самсонова Н.Н., Климович Л.Г. и др. Коррекция гемостаза препаратами крови при хирургическом лечении врожденных пороков сердца у новорожденных и детей раннего возраста. Анестезиология и реаниматология. 2015; 60(5): 42–6.
29. Рыбка М.М., Самсонова Н.Н., Лобачева Г.В. и др. Эффективность и безопасность применения препарата Коагил-VII — эптаког альфа (активированный) при хирургической коррекции врожденных пороков сердца у новорожденных и детей раннего возраста. Тромбоз, гемостаз и реология. 2014; 1(57): 9–14.
30. Ohga S. Ishiguro A. Takahashi Y. et al. Protein C deficiency as the major cause of thrombophilias in childhood. Pediatr Int. 2013; 55(3): 267–71. DOI: 10.1111/ped.1210231.
31. Klauwer D., Neuhäuser С., Thul J., Zimmermann R. Pädiatrische Intensivmedizin — Kinderkardiologische Praxis. Deutscher Ärzte-Verlag, 2013. 410 с.
32. Ghasemi A., Horri M., Salahshour Y. Coagulation abnormalities in pediatric patients with congenital heart disease: a literature review. Int J Pediatr. 2014; 2(5): 141–3. DOI: 10.22038/IJP.2014.2458.
33. Zabala L.M., Guzzetta N.A. Cyanotic congenital heart disease (CCHD): focus on hypoxemia, secondary erythrocytosis, and coagulation alterations. Paediatr Anaesth. 2015; 25(10): 981–9. DOI: 10.1111/pan.12705.
34. Cannon J.W. Hemorrhagic shock. N Engl J Med. 2018; 378: 370–9. DOI:10.1056/NEJMra1705649.
35. Simmons J.W., Powell M.F. Acute traumatic coagulopathy: pathophysiology and resuscitation. Br J Anaesth. 2016; 117 (suppl 3): iii31–43.
36. Sorensen B, Fries D. Emerging treatment strategies for trauma-induced coagulopathy. Br J Surg. 2012; 99 Suppl 1: 40–50. DOI: 10.1002/bjs.7770.
37. Tanaka K.A., Bader S.O., Görlinger K. Novel approaches in management of perioperative coagulopathy. Curr Opin Anaesthesiol. 2014; (1): 72–80. DOI:10.1097/ACO.0000000000000025.
38. Diab Y.A., Wong E.C., Luban N.L. Massive transfusion in children and neonates. Br J Haematol. 2013; 161(1): 15–26. DOI: 10.1111/bjh.12247.
39. American College of Surgeons Committee on Trauma. ATLS® Student Manual 9th Edition. Chicago, IL: American College of Surgeons; 2012.
40. American College of Surgeons Committee on Trauma. ATLS® Student Manual 10th Edition. Chicago, IL: American College of Surgeons; 2018.
41. Spahn D.R., Bouillon B., Cerny V. et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019; 23(1): 98. DOI: 10.1186/s13054-019-2347-3.
42. Mutschler A., Nienaber U., Brockamp T. et al. A critical reappraisal of the ATLS classification of hypovolaemic shock: does it really reflect clinical reality? Resuscitation. 2013; 84: 309–313.
43. Davis A., Wales P.W., Malik T. et al. The BIG score and prediction of mortality in pediatric blunt trauma. J Pediatr. 2015; 167(3): 593–8.e1. DOI: 10.1016/j.jpeds.2015.05.041.
44. El-Gamasy M.A., Elezz A.A., Basuni A.S., Elrazek M.E. Pediatric trauma BIG score: Predicting mortality in polytraumatized pediatric patients. Indian J Crit Care. 2016; 20(11): 640–6.
45. Grandjean-Blanchet C., Emeriaud G., Beaudin M., Gravel J. Retrospective evaluation of the BIG score to predict mortality in pediatric blunt trauma. CJEM. 2018;20(4):592-599. DOI: 10.1017/cem.2017.379.
46. Александрович Ю.С., Пшениснов К.В., Баиндурашвили А.Г., Виссарионов С.В. Объективизация оценки тяжести травмы. учебное пособие для врачей. СПб.: изд-во СПбГПМУ, 2019. 24 с.
47. Klein K., Lefering R., Jungbluth P. et al. Is prehospital time important for the treatment of severely injured patients? a matched-triplet analysis of 13,851 patients from the TraumaRegister DGU. Biomed Res Int. 2019; 2019: 5936345. DOI:10.1155/2019/5936345.
48. Tribute to R Adams Cowley, M.D., University of Maryland Medical Center, R Adams Cowley Shock Trauma Center [Процитировано 07.01.2020.] Доступно: https://www.umms.org/ummc/health-services/shock-trauma/about/history.
49. Hornez E., Monchal T., Boddaert G. et al. Penetrating pelvic trauma: initial assessment and surgical management in emergency. J Visc Surg. 2016; 153(4 Suppl): 79–90. DOI: 10.1016/j.jviscsurg.2016.04.006.
50. Karmy-Jones R., Jurkovich G.J., Shatz D.V. et al. Management of traumatic lung injury: a Western Trauma Association multicenter review. J Trauma. 2001; 51(6): 1049–53.
51. de Lesquen H., Avaro J-P., Gust L. et al. Surgical management for the first 48 h following blunt chest trauma: state of the art (excluding vascular injuries). Interact Cardiovasc Thorac Surg. 2015; 20(3): 399–408. DOI: 10.1093/icvts/ivu397.
52. Vincent J.L. Fluid management in the critically ill. Kidney Int. 2019; 96(1): 52–7. DOI: 10.1016/j.kint.2018.11.047.
53. Song J.W., Shim J.K., Kim N.Y. et al. The effect of 0.9 % saline versus plasmalyte on coagulation in patients undergoing lumbar spinal surgery; a randomized controlled trial. Int J Surg. 2015; 20: 128–34. DOI: 10.1016/j.ijsu.2015.06.065.
54. Белоусова Е.И., Матинян Н.В., Мартынов Л.А. Стратегия инфузионнотрансфузионной терапии при операциях с массивной кровопотерей у детей с опухолями торакоабдоминальной локализации. Рос. вест. дет. хирургии, анестезиол. реаниматол. 2018; 8(2): 56–64. DOI: 10.30946/2219-40612018-8-2-56-64.
55. Alvis-Miranda H.R., Castellar-Leones S.M., Moscote-Salazar L.R. Intravenous fluid therapy in traumatic brain injury and decompressive craniectomy. Bull Emerg Trauma. 2014; 2(1): 3–14.
56. Rossi S., Picetti E., Zoerle T. et al. Fluid management in acute brain injury. Curr Neurol Neurosci Rep. 2018. 11; 18(11): 74. DOI: 10.1007/s11910-018-0885-8.
57. Drucker N.A., Wang S.K., Newton C. Pediatric trauma-related coagulopathy: Balanced resuscitation, goal-directed therapy and viscoelastic assays. Semin Pediatr Surg. 2019; 28(1): 61–66. DOI: 10.1053/j.sempedsurg.2019.01.011.
58. Hussmann B., Lefering R., Waydhas C. et al. Does increased prehospital replacement volume lead to a poor clinical course and an increased mortality? A matched-pair analysis of 1896 patients of the Trauma Registry of the German Society for Trauma Surgery who were managed by an emergency doctor at the accident site. Injury. 2013; 44(5): 611–7. DOI: 10.1016/j.injury.2012.02.004.
59. Brown J.B., Cohen M.J., Minei J.P. et al. Goal-directed resuscitation in the prehospital setting: a propensity-adjusted analysis. J Trauma Acute Care Surg. 2013;74(5):1207–12. DOI: 10.1097/TA.0b013e31828c44fd.
60. Champion H.R. Prehospital intravenous fluid administration is associated with higher mortality in trauma patients. Ann Surg. 2014; 259(2): e19. DOI: 10.1097/SLA.0b013e3182456b51.
61. Driessen A., Frohlich M., Schafer N. et al. Prehospital volume resuscitation did evidence defeat the crystalloid dogma? An analysis of the TraumaRegister DGU(R) 2002–2012. Scand J Trauma Resusc Emerg Med. 2016; 24: 42. DOI:10.1186/s13049-016-0233-4.
62. Harada M.Y., Ko A., Barmparas G. et al. 10-Year trend in crystalloid resuscitation: reduced volume and lower mortality. Int J Surg. 2017; 38: 78–82. DOI:10.1016/j.ijsu.2016.12.073.
63. Haut E.R., Kalish B.T., Cotton B.A. et al. Prehospital intravenous fluid administration is associated with higher mortality in trauma patients: a National Trauma Data Bank analysis. Ann Surg. 2011; 253(2): 371–7. DOI: 10.1097/SLA.0b013e318207c24f.
64. Maegele M., Lefering R., Yucel N. et al. Early coagulopathy in multiple injury: an analysis from the German Trauma Registry on 8724 patients. Injury. 2007; 38(3): 298–304.
65. Joseph B., Azim A., Zangbar B., et al. Improving mortality in trauma laparotomy through the evolution of damage control resuscitation: analysis of 1,030 consecutive trauma laparotomies. J Trauma Acute Care Surg. 2017; 82(2): 328–33. DOI: 10.1097/TA.0000000000001273.
66. Kasotakis G., Sideris A., Yang Y. et al. Aggressive early crystalloid resuscitation adversely affects outcomes in adult blunt trauma patients: an analysis of the Glue Grant database. J Trauma Acute Care Surg. 2013; 74(5): 1215–212. DOI:10.1097/TA.0b013e3182826e13.
67. Madigan M.C., Kemp C.D., Johnson J.C., Cotton B.A. Secondary abdominal compartment syndrome after severe extremity injury: are early, aggressive fluid resuscitation strategies to blame? J Trauma. 2008; 64(2): 280–5. DOI: 10.1097/TA.0b013e3181622bb6.
68. Morrison C.A., Carrick M.M., Norman M.A. et al. Hypotensive resuscitation strategy reduces transfusion requirements and severe postoperative coagulopathy in trauma patients with hemorrhagic shock: preliminary results of a randomized controlled trial. J Trauma. 2011; 70(3): 652–63. DOI: 10.1097/TA.0b013e31820e77ea.
69. Suttipongkaset P., Chaikittisilpa N., Vavilala M.S. et al. Blood pressure thresholds and mortality in pediatric traumatic brain injury. Pediatrics. 2018;142(2). pii: e20180594. DOI: 10.1542/peds.2018-0594.
70. Johnson M.A., Borgman M.A., Cannon J.W. et al. Severely elevated blood pressure and early mortality in children with traumatic brain injuries: the neglected end of the spectrum. West J Emerg Med. 2018; 19(3): 452–9. DOI: 10.5811/westjem.2018.2.36404.
71. Протокол реанимации и интенсивной терапии при острой массивной кровопотере. Рекомендации Федерации анестезиологов-реаниматологов России, 2018: http://www.far.org.ru/recomendation.
72. Практическая кардиоанестезиология. Ред. Ф.А. Хенсли, мл., Д.Е. Мартин, Г.П. Грэвли; пер. с англ. под ред. А.А. Бунятяна. М.: ООО Медицинское информационное агентство, 2017. 1084 с.
73. Jentzer J.C., Coons J.C., Link C.B., Schmidhofer M. Pharmacotherapy update on the use of vasopressors and inotropes in the intensive care unit. J Cardiovasc Pharmacol Ther. 2015; 20(3): 249–60. DOI: 10.1177/1074248414559838.
74. Krishnamoorthy V., Rowhani-Rahbar A., Gibbons E.F. et al. Early systolic dysfunction following traumatic brain injury: a cohort study. Crit Care Med. 2017; 45(6): 1028–36. DOI: 10.1097/CCM.0000000000002404.
75. Saadeh Y.S., Smith B.W., Joseph J.R. et al. The impact of blood pressure management after spinal cord injury: a systematic review of the literature. Neurosurg Focus. 2017; 43(5): E20. DOI: 10.3171/2017.8.FOCUS17428.
76. Lin Y.R., Wu M.H., Chen T.Y. et al. Time to epinephrine treatment is associated with the risk of mortality in children who achieve sustained ROSC after traumatic out-of-hospital cardiac arrest. Crit Care. 2019; 23(1): 101. DOI: 10.1186/s13054-019-2391-z.
77. Lier H., Krep H., Schroeder S., Stuber F. Preconditions of hemostasis in trauma: a review. The influence of acidosis, hypocalcemia, anemia, and hypothermia on functional hemostasis in trauma. J Trauma. 2008; 65(4): 951–60. DOI: 10.1097/TA.0b013e318187e15b.
78. Valentine S.L., Bembea M.M., Muszynski J.A., Cholette J.M. Consensus recommendations for RBC transfusion practice in critically ill children from the pediatric critical care transfusion and anemia expertise Initiative. Pediatr Crit Care Med. 2018; 19(9): 884–98. DOI: 10.1097/PCC.0000000000001613.
79. Maw G., Furyk C. Pediatric Massive Transfusion: A Systematic Review. Pediatr Emerg Care. 2018; 34(8): 594–8. DOI: 10.1097/PEC.0000000000001570.
80. Cunningham M.E., Rosenfeld E.H., Zhu H. et al. A high ratio of plasma: RBC improves survival in massively transfused injured children. J Surg Res. 2019; 233: 213–20. DOI: 10.1016/j.jss.2018.08.007.1.
81. Приказ № 183н от 2 апреля 2013 г. «Об утверждении правил клинического использования донорской крови и/или ее компонентов» МЗ РФ. http://www.garant.ru.
82. Национальный стандарт Российской Федерации. Кровь донорская и ее компоненты. Руководство по применению компонентов донорской крови. ГОСТ Р 53470-2009.
83. Неймарк М.И. TRALI-синдром: диагностика, профилактика, лечение. Вест. анестезиол. реаниматол. 2019; 16(2): 44–50. DOI: 10.21292/20785658-2019-16-2-44-50.
84. Beno S., Ackery A.D., Callum J., Rizoli S. Tranexamic acid in pediatric trauma: why not? Crit Care. 2014; 18(4): 313. DOI: 10.1186/cc13965.
85. Goobie S.M., Faraoni D. Tranexamic acid and perioperative bleeding in children: what do we still need to know? Curr Opin Anaesthesiol. 2019; 32(3): 343–52. DOI: 10.1097/ACO.0000000000000728.
86. Kurnik N.M., Pflibsen L.R., Bristol R.E., Singh D.J. Tranexamic acid reduces blood loss in craniosynostosis surgery. J Craniofac Surg. 2017; 28(5): 1325–9. DOI: 10.1097/SCS.0000000000003731.
87. Kim E.J., Kim Y.O., Shim K.W. et al. Effects of tranexamic acid based on its population pharmacokinetics in pediatric patients undergoing distraction osteogenesis for craniosynostosis: rotational thromboelastometry (ROTEMTM ) analysis. Int J Med Sci. 2018; 15(8): 788–95. DOI: 10.7150/ijms.25008.
88. Johnson D.J., Johnson C.C., Goobie S.M. et al. High-dose versus lowdose tranexamic acid to reduce transfusion requirements in pediatric scoliosis surgery. J Pediatr Orthop. 2017; 37(8): e552–e557. DOI: 10.1097/BPO.0000000000000820.
89. McNeil J., Raphael J., Chow J.H. et al. Antifibrinolytic drugs and allogeneic transfusion in pediatric multi-level spine surgery: a propensity score matched cohort study. Spine (Phila Pa 1976). 2019. DOI: 10.1097/BRS.0000000000003273.
90. Siotou K., Siotos C., Azizi A. et al. The role of antifibrinolytics in reducing blood loss during craniofacial or orthognathic surgical procedures: a metaanalysis. J Oral Maxillofac Surg. 2019; 77(6): 1245–60. DOI: 10.1016/j.joms.2019.01.032.
91. McLeod L.M., French B., Flynn J.M. et al. Antifibrinolytic use and blood transfusions in pediatric scoliosis surgeries performed at us children’s hospitals. J Spinal Disord Tech. 2015; 28(8): E460–6. DOI: 10.1097/BSD.0b013e3182a22a54.
92. Nishijima D.K., Kuppermann N., Roberts I. et al. The effect of tranexamic acid on functional outcomes: an exploratory analysis of the CRASH-2 randomized controlled trial. Ann Emerg Med. 2019; 74(1): 79–87. DOI: 10.1016/j.annemergmed.2018.11.018.70.
93. CRASH-3 trial collaborators. Effects of tranexamic acid on death, disability, vascular occlusive events and other morbidities in patients with acute traumatic brain injury (CRASH-3): a randomised, placebo-controlled trial. Lancet. 2019; pii: S0140-6736(19)32233-0. DOI: 10.1016/S0140-6736(19)32233-0.
94. Chauhan S. Comparison of tranexamic acid with aprotinin in pediatric cardiac surgery. Ann Card Anaesth. 2015; 18(1): 27–8. DOI: 10.4103/09719784.148317.
95. Muthialu N., Balakrishnan S., Sundar R., Muralidharan S. Efficacy of tranexamic acid as compared to aprotinin in open heart surgery in children. Ann Card Anaesth. 2015; 18(1): 23–6. DOI: 10.4103/0971-9784.148316.
96. Gottlieb E.A., Andropoulos D.B. Current and future trends in coagulation management for congenital heart surgery. J Thorac Cardiovasc Surg. 2017; 153(6): 1511–5. DOI: 10.1016/j.jtcvs.2016.11.075.
97. Александрович Ю.С., Пшениснов К.В. Сердечно-легочная реанимация у детей. Изменения и дополнения 2015 года. СПб.: Тактик-Студио, 2016. 200 с.
98. Blain S., Paterson N. Paediatric massive transfusion. BJA Education. 2016; 16(8): 269–75. DOI: 10.1093/bjaed/mkv051.
99. Reeve K., Jones H. Transfusion guidelines in children: I, Anaesthesia and intensive care medicine. 2017. DOI: 10.1016/j.mpaic.2017.07.008.
100. Александрович Ю.С., Пшениснов К.В. Волемическая поддержка у детей. СПб., 2019. 124 с.
101. Иванов Д.О., Аврелькина Е.В., Алешина Е.И. и др. Руководство по перинатологии. В двух томах. Том 2 (Изд. 2-е, переработанное и дополненное). СПб., 2019.
102. Desborough M.J., Oakland K., Brierley C. et al. Desmopressin use for minimising perioperative blood transfusion. Cochrane Database Syst Rev. 2017; 7: CD001884. DOI: 10.1002/14651858.CD001884.pub3.
103. Александрович Ю.С., Ростовцев А.В., Кононова Е.С. и др. Применение терлипрессина с целью уменьшения кровопотери при кесаревом сечении. Вест. анестезиол. реаниматол. 2018; 15(6): 20–27. DOI: 10.21292/20785658-2018-15-6-20-27.
Об авторах
К. В. ПшенисновРоссия
Пшениснов Константин Викторович – кандидат медицинских наук, доцент кафедры анестезиологии, реаниматологии и неотложной педиатрии.
194100, Санкт-Петербург
тел. 8-911-265-82-00
Ю. С. Александрович
Россия
Александрович Юрий Станиславович – доктор медицинских наук, профессор, заведующий кафедрой анестезиологии, реаниматологии и неотложной педиатрии. eLibrary SPIN: 2225-1630
194100, Санкт-Петербург
тел. 591-791-9
Рецензия
Для цитирования:
Пшениснов К.В., Александрович Ю.С. Массивная кровопотеря в педиатрической практике. Гематология и трансфузиология. 2020;65(1):70-86. https://doi.org/10.35754/0234-5730-2020-65-1-70-86
For citation:
Pshenisnov K.V., Aleksandrovich Yu.S. Massive blood loss in pediatric practice. Russian journal of hematology and transfusiology. 2020;65(1):70-86. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-1-70-86











































