Перейти к:
Микробиологическая безопасность компонентов крови и эффективность мер по ее совершенствованию
https://doi.org/10.35754/0234-5730-2020-65-3-242-250
Аннотация
Введение. Проблема бактериальной контаминации компонентов крови сохраняется, несмотря на успехи выявления вирусного инфицирования доноров крови и уменьшение рисков неинфекционных осложнений переливания донорской крови и ее компонентов.
Цель: оценить динамику обнаружения микробной контаминации компонентов крови и меры по ее снижению.
Материалы и методы. Материалом исследования служили результаты микробиологических посевов компонентов крови, заготовленных в Республиканском научно-практическом центре трансфузиологии и медицинских биотехнологий (РНПЦ ТМБ) Минздрава Республики Беларусь в 2012–2018 гг., а также результаты исследования содержания аэрозольных частиц размером 0,5 и 5,0 мкм в 1 м 3 воздуха и микробиологических испытаний воздуха производственных помещений отделения заготовки крови и ее компонентов за аналогичный период. В работе использованы микробиологические, визуальные, статистические методы.
Результаты. В период с 2012 по 2018 г. в РНПЦ ТМБ оценили динамику заготовки компонентов крови, отбора доз для микробиологического контроля, положительных результатов микробиологического контроля компонентов крови. Большинство положительных результатов микробиологического контроля концентратов тромбоцитов были связаны с дозами, заготовленными из цельной крови, но не полученными методом автоматического афереза. Выявлена тенденция к уменьшению инцидентности случаев микробной контаминации эритроцитсодержащих компонентов (ЭСК) донорской крови с 1,21 (95 % ДИ 0,39–3,28) в 2012 г. до 0 (95 % ДИ 0–0,8) (р < 0,001) в 2018 г. на 100 доз ЭСК, отобранных для микробиологического анализа. Это сопровождалось повышением частоты отбора доз ЭСК для анализа и проведением в 2015–2016 гг. организационных мероприятий по повышению микробиологической чистоты воздуха рабочих помещений отделения заготовки крови.
Заключение. Выявлено снижение в течение 2012–2018 гг. рисков бактериальной контаминации ЭСК, но не других компонентов крови за счет проведения комплекса мер при подготовке к аттестации по классам чистоты производственных помещений и других организационных мероприятий.
Для цитирования:
Вяткина О.И., Потапнев М. П М.П., Красько О. В. О.В. Микробиологическая безопасность компонентов крови и эффективность мер по ее совершенствованию. Гематология и трансфузиология. 2020;65(3):251-262. https://doi.org/10.35754/0234-5730-2020-65-3-242-250
For citation:
Viatkina O.I., Potapnev M.P., Krasko O.V. Microbial safety of blood components and effi cacy of measures for its improvement. Russian journal of hematology and transfusiology. 2020;65(3):251-262. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-242-250
Введение
Инфекционная безопасность донорской крови и ее компонентов за последние десятилетия значительно повысилась прежде всего за счет улучшения качества диагностики возбудителей вирусных инфекций, передающихся с переливанием крови и ее компонентов. На этом фоне успехи по снижению риска бактериальной контаминации компонентов крови, ведущей к развитию сепсиса у реципиентов, незначительны, что делает эту проблему актуальной [1][2][3][4]. В период с 2012 по 2016 г. в США отмечено 18 случаев трансфузий компонентов крови, которые были контаминированы бактериями, что привело к развитию у реципиентов сепсиса и смертельным исходам. Они включали 7 случаев, связанных с переливанием эритроцитсодержащих компонентов (ЭСК), 8 случаев, связанных с переливанием аферезных концентратов тромбоцитов (КТ), 2 случая, связанных с переливанием пулированных КТ, полученных из дозы крови, и 1 случай, связанный с переливанием свежезамороженной плазмы (СЗП). Среди доказанных причин смерти реципиентов, связанных с переливанием компонентов крови, бактериальная контаминация занимает 4-е место (10 % случаев) после обусловленного трансфузией острого повреждения легких (30 % случаев), трансфузионной циркуляторной перегрузки (18 % случаев) и трансфузионных гемолитических реакций (18 % случаев) [5]. Анализ причин гемотрансмиссивных инфекций за период 2010—2016 гг. в США показал, что 69 % (37 из 54 случаев) были бактериального происхождения, 30 % (16 из 54 случаев) — паразитарного, 2 % (1 из 54) — вирусного [6]. Это потребовало разработки стратегии снижения риска бактериальной контаминации донорской крови и ее компонентов [2][7][8][9]. Первоначально исходили из того, что микробная контаминация компонентов может происходить с кожи донора, с оборудования для заготовки крови, из донорской крови, попадать в кровь в процессе обработки и хранения. На основании этого мероприятия, снижающие риск микробной контаминации, включали совершенствование рецептуры (использование хлоргексидина) и двукратную обработку кожи локтевого сгиба, наличие дополнительного контейнера для заготовки первой порции (40—50 мл) донорской крови, проведение бактериологического тестирования компонентов крови в сроки через 24 ч после заготовки. Это позволило снизить риск микробной контаминации на 50—75 % [7][8][10]. Внедрение системы гемонадзора (hemovigilance) также способствовало снижению риска микробной контаминации компонентов крови [11]. Широкое применение для микробиологического анализа получили системы ускоренного бактериального контроля типа BacT/ALERT [7][10][12], позволившие снизить риски на 2/3 от предыдущего уровня [12]. Тем не менее считается, что только 20—40 % контаминированных доз компонентов крови выявляются при таком тестировании [9]. Поэтому совершенствование стратегии снижения риска микробной контаминации компонентов крови включало следующие основные мероприятия: применение патогенредукции для СЗП и КТ, повторное тестирование на бактериальные продукты методами иммуноанализа, повторное бактериологическое тестирование [10][12][13].
Считается, что наибольший риск бактериальной контаминации имеют КТ, которые хранятся при комнатной температуре [11]. Помимо КТ, опасность микробной контаминации высока для ЭСК, имеющих более длительные (до 28—45 дней) сроки хранения до клинического использования, что увеличивает риск выявления положительных результатов бактериальной контаминации [14][15].
Цель настоящего исследования — оценить динамику обнаружения микробной контаминации компонентов крови и меры по ее снижению.
Материалы и методы
Материалом исследования служили результаты микробиологических посевов компонентов крови, заготовленных в Республиканском научно-практическом центре трансфузиологии и медицинских биотехнологий (РНПЦ ТМБ) Министерства здравоохранения Республики Беларусь в 2012—2018 гг., а также результаты исследования содержания аэрозольных частиц размером 0,5 и 5,0 мкм в 1 м3 воздуха (п = 19 008) и микробиологических испытаний воздуха производственных помещений отделения заготовки крови и ее компонентов (п = 21 209) за аналогичный период.
Микробиологический анализ проводили в соответствии с требованиями приказа Министерства здравоохранения Республики Беларусь № 325 от 6 апреля 2018 года «Об утверждении Перечня требований по безопасности и качеству крови, ее компонентов, заготавливаемых от доноров или производимых различными методами из крови доноров и предназначенных для оказания медицинской помощи и иных целей». Микробиологическому анализу подвергали 1 % от всех заготовленных доз компонентов крови, но не менее 4 доз в месяц. Для микробиологического анализа отбирали дозы компонентов крови через 24 часа от момента заготовки (ЭСК, КТ, СЗП), а также ежеквартально к концу карантинного 3-месячного хранения дополнительно отбирались для исследования 10 доз СЗП. Проведение микробиологического анализа осуществляли работники лаборатории бактериологического контроля отдела управления качеством и внутреннего аудита РНПЦ ТМБ. Был использован автоматический анализатор гемокультур BacT/ALERT 3D, использующий колориметрический метод детекции роста бактерий за счет изменения цвета красителя при изменении рН среды флакона при размножении бактерий во время культивирования. Питательные среды BacT/ALERT могут определить 98 % изолятов бактерий, грибов и дрожжей в течение 24—48 часов инкубации. При получении первично положительного результата выполняли пересев из всех подозрительных флаконов на мясо-пептонный агар (МПА) (с последующей инкубацией в течение 24— 48 часов при температуре 32,5 ± 2,5 °C) и приготавливали мазки с окраской по Граму для микроскопического подтверждения микробного роста.
Исследования содержания аэрозольных частиц в воздухе проводили 1 раз в неделю с использованием счетчика аэрозольных частиц AEROTRACK 9306 (TSI Inc., США) в соответствии с инструкцией по использованию аппарата. Минимальное количество точек отбора и объем пробы воздуха для оценки концентрации аэрозольных частиц определялся в соответствии с требованиями ТКП 435—2017 (33050) «Производство лекарственных средств. Квалификация чистых помещений».
Микробиологические испытания воздуха выполняли во время работ по заготовке крови в помещениях отделения заготовки крови РНПЦ ТМБ. Кратность отбора проб воздуха колебалась от 1 раза в день до 1 раза в неделю в зависимости от класса чистоты помещения и критичности выполняемой процедуры. Количество контрольных точек зависело от площади и категорийности помещения. В каждой контрольной точке пробы отбирали седиментационным методом на две чашки Петри (диаметр 90 мм) с питательной средой для выращивания бактерий (среда № 1) и на две чашки Петри со средой для выращивания грибов (среда № 2). Время экспозиции чашек с питательными средами — не менее времени выполнения критических операций, но не более 4-х часов. После отбора проб воздуха чашки помещали в термостат для последующего культивирования в течение 5 суток при температуре 32,5 ± 2,5 °C (среда № 1) и 22,5 ± 2,5 °C (среда № 2).
После окончания инкубации проводился подсчет количества колоний микроорганизмов, образовавшихся в каждой чашке Петри. Результаты учитывали как количество колониеобразующих единиц за 4 часа бактерий или грибов на чашку Петри.
На основании результатов оценки ключевых элементов (воздух, персонал, поверхности) программы мониторинга производственной среды отделения заготовки крови при получении первично положительных результатов оценки риска микробной контаминации компонентов крови проводилось эпидемиологическое расследование каждого случая бактериальной контаминации с целью установления источника контаминации. Анализ результатов микробиологического мониторинга позволил установить источники контаминации в 13 случаях расследования причин бактериальной контаминации компонентов крови (в одном случае источник контаминации установлен не был).
Статистическая обработка данных. Данные представлены в количественном выражении по годам исследования. При расчете интенсивности контроля и случаев положительных проб принимался во внимание пуассоновский характер распределения редких событий. Расчеты проводились в специализированном пакете Join Point версия 4.5. Использовалась пуассоновская модель трендов интенсивности событий во времени. Ежегодные частоты рассчитывались на 100 доз. Уровень статистической значимости в исследовании (α) принимался равным α = 0,05.
Результаты
Микробиологическая контаминация компонентов крови и профиль выделенных микроорганизмов
Микробиологический анализ компонентов крови, отобранных при их заготовке в РНПЦ ТМБ, дал единичные положительные результаты (от 1 до 5 случаев в год) в течение 2012—2015 гг. (табл. 1). В 2017 и 2018 гг. положительные результаты отсутствовали. Наибольшее количество положительных результатов было выявлено при микробиологическом анализе ЭСК, и наименьшее — при анализе аферезных КТ и компонентов плазмы. Анализ выросших культур микроорганизмов показал, что компоненты крови были контаминированы грамположительными кокками — представителями семейства Staphylococcus spp. (п = 12) и в единичных случаях — грамположительными палочками Propionibacterium spp. (п = 1) и грамотрицательными палочками Escherichia coli (п = 1). Среди грамположительных кокков Staphylococcus spp. выявлены S. epidermidis (п = 8), а также S. saprophyticus (п = 4). ЭСК были контаминированы как грамположительными кокками (S. epidermidis, п = 5, S. saprophyticus, п = 2), так и грамположительной палочкой (Propionibacte- rium spp., п = 1).
Таблица 1. Результаты микробиологического контроля качества компонентов крови
Table 1. Results of blood components microbiological testing
Компоненты крови | Частота положительных результатов микробиологического анализа компонентов крови, годы Number of positive results of blood components microbiological testing per total tested units, year | |||||||
|---|---|---|---|---|---|---|---|---|
Blood components | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | Всего Total |
ЭСК Red blood cells | 4/331 | 1/211 | 1/284 | 2/567 | 0/415 | 0/792 | 0/592 | 8/3192 |
КТ, полученные из дозы крови* Platelets* (single units) | 0/338 | 1/410 | 0/472 | 1/538 | 1/328 | 0/236 | 0/126 | 3/2448 |
Компоненты плазмы Plasma components | 0/399 | 1/318 | 0/364 | 2/630 | 0/257 | 0/310 | 0/376 | 3/2654 |
Все компоненты Total blood components | 4/1068 | 3/939 | 1/1120 | 5/1735 | 1/1000 | 0/1338 | 0/1094 | 14/8294 |
Примечание. * — микробиологический контроль КТ, полученных методом автоматического афереза, всегда давал отрицательный результат.
Note. * — the results of bacterial contamination of platelets apheresis were always negative.
Из бактериально контаминированных КТ были выделены Escherichia coli (n = 1), S. saprophyticus (n = 1), S. epidermidis (n = 1). Компоненты плазмы были контаминированы S. epidermidis (n = 2), S. saprophyticus (n = 1).
Расследование причин положительных результатов микробиологического анализа позволило установить источники контаминации (n = 13). Медицинский персонал (n = 12) чаще всего выступал источником контаминации грамположительными кокками (Staphylococcus spp.). Аэрозольные частицы размером 5,0 мкм рассматривались как возможный источник грамположительных палочек (Propionibacterium) в 1 случае на основании идентичных фенотипических характеристик бактерий, выделенных при микробиологическом исследовании воздуха и компонента крови (ЭСК). При этом учитывали тот факт, что количество частиц размером 0,5 мкм в контрольных точках соответствовало требованиям, а количество частиц размером 5,0 мкм превышало допустимые значения более чем в 3,1 раза. Один источник контаминации не был установлен (для КТ — Escherichia coli (n = 1)).
Связь микробиологической контаминации с объемом заготовки и отбора доз компонентов крови для анализа
Оценка связи частоты положительных результатов микробиологического контроля отдельных компонентов крови (в первую очередь — ЭСК и КТ) с объемами заготовки и количеством отобранных проб для контроля показала, что в течение 2012—2018 гг. прирост объема заготовки доз ЭСК составил в среднем 13,83 % (табл. 2). За это время наблюдался статистически значимый прирост количества доз ЭСК, отобранных для микробиологического контроля (р = 0,043), который составил 1,01 (95 % доверительный интервал (ДИ) 0,91-1,13) в 2012 г. и 1,53 (95 % ДИ 1,41-1,65) в 2018 г.
Таблица 2. Соотношение количества заготовленных доз, отобранных доз для микробиологического анализа и положительных результатов микробиологического анализа ЭСК
Table 2. Relationship of the number of collected red cell units, selected units for microbiological testing, and positive results of bacterial contamination
Год Year | Количество заготовленных доз ЭСК крови в год* Number of collected red blood cell units per year* | Количество отобранных доз ЭСК для микробиологического контроля в год Number of red blood cell units, selected for microbiological testing per year | Количество положительных результатов микробиологического контроля в год Number of positive results of microbiological testing per year |
|---|---|---|---|
2012 | 32768 | 331 | 4 |
2013 | 32733 | 211 | 1 |
2014 | 36079 | 284 | 1 |
2015 | 45567 | 567 | 2 |
2016 | 40600 | 415 | 0 |
2017 | 42860 | 792 | 0 |
2018 | 38819 | 592 | 0 |
Примечание.* — одна доза ЭСК принята в среднем как 240 мл.
Note. * — one red cell unit has a mean volume of 240 ml.
в пересчете на 100 заготовленных доз компонента крови. Это сопровождалось статистически значимым снижением частоты выявления положительных результатов микробиологического анализа ЭСК (р < 0,001) с 1,21 (95 % ДИ 0,39-3,28) в 2012 г. до 0 (95 % ДИ 0-0,8) в 2018 г. на 100 доз ЭСК, отобранных для микробиологического анализа. Ежегодное уменьшение количества положительных результатов микробиологического контроля за этот период составило 38,3 % (95 % ДИ 28,2-47,0 %).
При микробиологическом контроле доз КТ, заготовленных аферезным способом, не было выявлено положительных проб за все указанные годы наблюдения (2012-2018 гг.). Среднее количество доз КТ, отобранных для микробиологического исследования, составило 1,07 на 100 заготовленных доз аферезных тромбоцитов (95 % ДИ 1,01-1,13) (табл. 3). Микробиологический контроль доз КТ, заготовленных из цельной крови, периодически давал положительные результаты без выраженной тенденции к изменению за наблюдаемый период (наблюдалось незначительное нарастание частоты количества положительных результатов на 0,17 % в год). При этом в период с 2012 по 2015 г. наблюдалась тенденция к увеличению частоты отбора проб для микробиологического анализа (р = 0,064) с 6,05 (95 % ДИ 5,45-6,72) в 2012 г. до 13,39 (95 % ДИ 12,36-14,49) в 2015 г. на 100 заготовленных доз КТ из цельной крови. В период с 2015 по 2018 гг. наблюдалось статистически значимое уменьшение частоты отбора доз КТ, полученных из цельной крови (р = 0,031) с 13,39 (95 % ДИ 12,36-14,49) в 2015 г. до 3,4 (95 % ДИ 2,85-4,05) в 2018 г. на заготовленных 100 доз. В целом за весь период исследования 2012-2018 гг. частота отбора образцов для микробиологического анализа по вышеназванным компонентам не изменялась и составила 1,16 (95 % ДИ 1,11-1,12) на 100 заготовленных доз КТ из дозы крови. За весь исследуемый период сохранялась высокая частота отбора проб КТ из дозы крови для проведения микробиологического анализа, которая составила в среднем 7,9 (95 % ДИ 7,61-8,21) на 100 заготовленных доз в год. При этом за период 2012-2018 гг. не выявлено статистически значимых тенденций изменения частоты положительных результатов микробиологических посевов КТ, полученных из дозы крови (р = 0,171), за период исследования изучаемый показатель составил 0,12 (95 % ДИ 0,03-0,33) на 100 доз, отобранных для микробиологического анализа.
Таблица 3. Соотношение количества заготовленных доз, отобранных доз для микробиологического анализа, и положительных результатов микробиологического анализа концентрата тромбоцитов
Table 3. The relationship of the number of collected units, selected units for microbiological testing and positive results for bacterial contamination of platelet component units
Год | Объем заготовки КТ в год (дозы) The number of collected platelet units per year | Объем контроля КТ в год (дозы) The number of platelet units selected for microbiological testing per year | Количество положительных результатов микробиологического контроля в год The number of positive results for bacterial contamination per year | |||||
|---|---|---|---|---|---|---|---|---|
всего total | методом автоматического афереза apheresis | из дозы крови from single blood dose | всего total | методом автоматического афереза apheresis | из дозы крови from single blood dose | автоматического афереза apheresis | из дозы крови from single blood dose | |
2012 | 27934 | 22348 | 5586 | 550 | 212 | 338 | 0 | 0 |
2013 | 21636 | 17304 | 4327 | 610 | 200 | 410 | 0 | 1 |
2014 | 21486 | 17190 | 4296 | 676 | 204 | 472 | 0 | 0 |
2015 | 20082 | 16065 | 4017 | 734 | 196 | 538 | 0 | 1 |
2016 | 21586 | 17268 | 4318 | 520 | 192 | 328 | 0 | 1 |
2017 | 23598 | 18878 | 4720 | 432 | 196 | 236 | 0 | 0 |
2018 | 18529 | 14824 | 3705 | 252 | 126 | 126 | 0 | 0 |
Примечание. Одна доза концентрата тромбоцитов (КТ) из дозы крови принята как 50 мл, при автоматическом аферезе — 4-6 доз КТ; среднее значение количества доз КТ, заготовленных автоматическим методом, за период наблюдения составляет 80 %.
Note. Single unit of platelet has a volume of 50 ml, platelet apheresis is estimated as 4-6 single units of platelets; mean value of platelet apheresis is estimated as 80 % of total platelet units.
Сопоставление объемов заготовки, обследования и выявления положительных результатов микробиологического контроля заготовленных доз компонентов плазмы представлены в таблице 4. Только в 2013 и 2015 гг. были выявлены положительные результаты микробиологического контроля доз компонентов плазмы вне зависимости от объема заготовки и объема отбора проб для микробиологического обследования, составлявшего 0,4-0,9 % от заготовленных.
Таблица 4. Соотношение количества заготовленных доз, отобранных доз для микробиологического анализа, и положительных результатов микробиологического анализа компонентов плазмы
Table 4. Relationship of the number of collected plasma component units, selected units for microbiological testing, and positive results of bacterial contamination
Годы Year | Объем заготовки компонентов плазмы в год(дозы) Number of collected plasma units per year | Объем контроля компонентов плазмы в год(дозы) Number of plasma units, selected for microbiological testing per year | Количество положительных результатов микробиологического контроля в год Number of positive results of microbiological testing per year |
|---|---|---|---|
2012 | 47828 | 399 | 0 |
2013 | 49226 | 318 | 1 |
2014 | 66880 | 364 | 0 |
2015 | 57863 | 630 | 2 |
2016 | 62583 | 257 | 0 |
2017 | 61100 | 310 | 0 |
2018 | 62279 | 376 | 0 |
Примечание. Средняя доза компонента плазмы принята за 260 мл.
Note. Mean value of plasma component is estimated as 260 ml.
Как видно из приведенных таблиц, наиболее часто проводился отбор гемоконтейнеров для микробиологического анализа КТ, полученных из дозы крови, наименее часто — СЗП (рис. 1). При этом до 2015 г. количество отобранных для микробиологического анализа доз КТ из цельной крови увеличивалось на 26,2 % в год (р = 0,064), далее статистически значимо уменьшалось на 38,7 % в год (р = 0,031). В течение 2012-2018 гг. наблюдался устойчивый рост количества доз ЭСК, отбираемых для микробиологического анализа (в среднем на 13,8 % в год, р = 0,042). При этом в 2012-2015 гг. количество отобранных для микробиологического контроля доз КТ из дозы крови и ЭСК было сопоставимо (р = 0,194). После 2015 г. отмечено уменьшение количества отобранных для проведения микробиологического анализа доз КТ, заготовленных из цельной крови, в то время как количество доз ЭСК, отобранных для микробиологического контроля, сохраняло тенденцию к увеличению (р < 0,001). Количество доз СЗП, отбираемых для микробиологического контроля, не изменялось на протяжении всего времени наблюдения (р = 0,446).
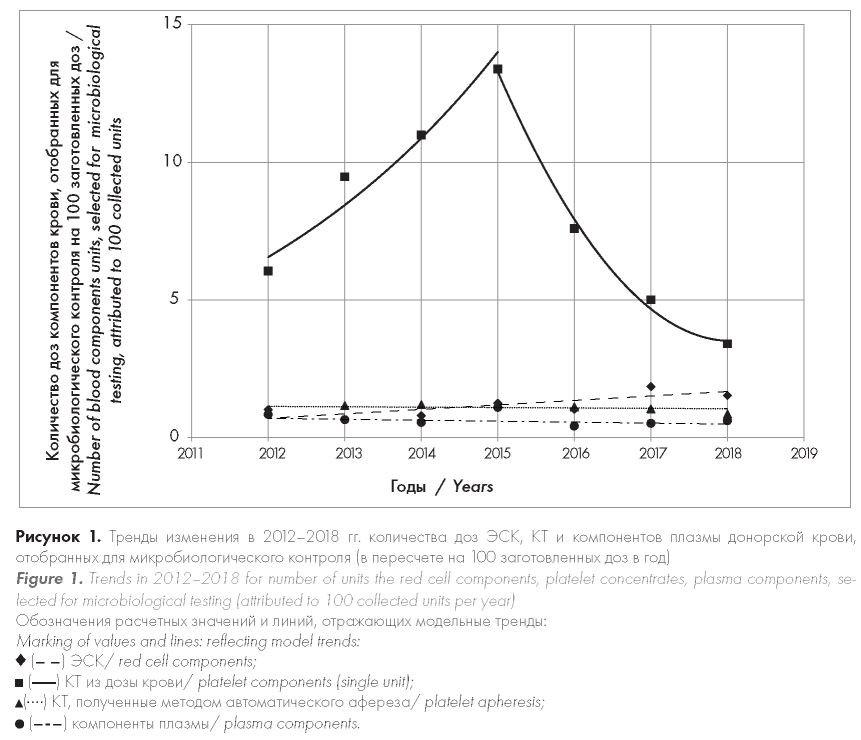
Такой же сравнительный подход был использован для оценки частоты положительных результатов микробиологического контроля доз компонентов крови, отобранных для анализа (рис. 2). Количество случаев микробной контаминации ЭСК в пересчете на 100 отобранных доз для микробиологического анализа в течение 2012-2018 гг. уменьшалось в среднем на 38,3 % в год (р < 0,001). Количество положительных результатов микробиологического контроля КТ из дозы крови и СЗП не изменялось на протяжении времени наблюдения (р = 0,171 и р = 0,662 соответственно).
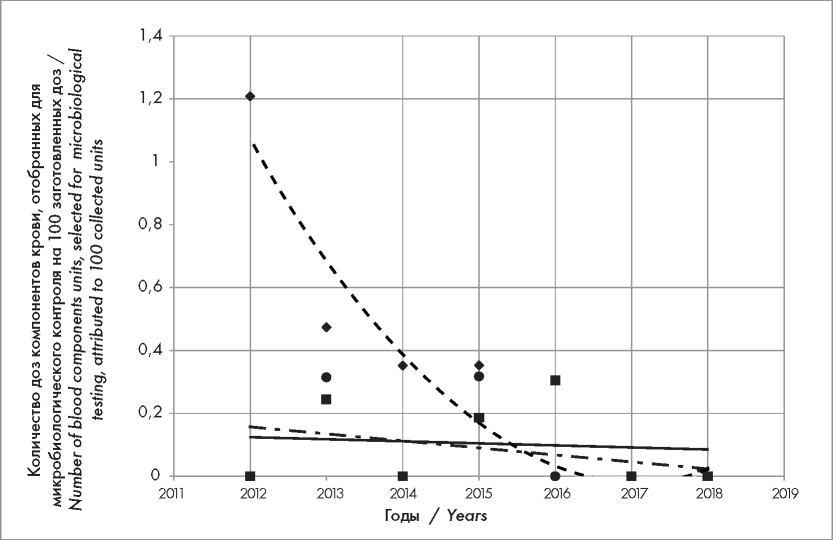
Рисунок 2. Тренды выявления в 2012-2018 гг. положительных результатов микробиологического контроля ЭСК, КТ (полученных из дозы крови) и компонентов плазмы донорской крови (в пересчете на 100 апробированных доз в год). Данные по КТ, полученному методом автоматического афереза, не представлены в связи с отсутствием положительных результатов микробиологического контроля Обозначения — см. рис. 1
Figure 2. Trends in 2012-2018 for positive results of microbiological testing of red cell components, platelet concentrates (single units), plasma components, attributed to 100 units, selected for bacterial contamination assessment. Data for bacterial contamination of platelet apheresis do not presented due to negative results of testing. Figure marking — see Fig. 1
В целом по всем компонентам донорской крови частота положительных результатов микробиологического контроля имела тенденцию к снижению (р = 0,086), в том числе в 2012 г. составила 0,31 (95 % ДИ 0,1-0,86), а в 2018 г. — 0 (95 % ДИ 0-0,39) на 100 доз, отобранных для микробиологического анализа.
Мероприятия по снижению микробной контаминации донорской крови
Были проведены разнообразные мероприятия по повышению микробиологической безопасности реализуемых компонентов крови (табл. 5). При этом ориентировались на требования специализированного комитета Совета Европы по переливанию крови [17] в связи с отсутствием аналогичных регламентирующих актов в Республике Беларусь, которые в настоящее время разрабатываются.
Обсуждение
Вопросы микробиологической безопасности являются постоянными для организаций, заготавливающих и распределяющих компоненты крови. При существующих технологиях заготовки в донорскую кровь попадает 10—100 жизнеспособных микробных частиц [18], что, несмотря на микробицидные свойства крови, создает риск ее инфицирования. Поэтому актуальна проблема микробиологического контроля заготавливаемых компонентов крови с целью снижения риска их бактериальной контаминации. Проблема эта многогранна и включает различные подходы (табл. 5). Один из подходов — повышение чувствительности микробиологического анализа, предполагающее внедрение нескольких систем скрининга, включая систему отсроченного, повторного и отдаленного тестирования, в том числе к концу сроков хранения, использование достаточного объема материала для анализа [11][16][19][20]. В то же время остается недостаточно реализованной стратегия ускоренного бактериологического контроля компонентов крови непосредственно перед реализацией (point of release), основанная на тестировании в реализуемом компоненте крови микробных пептидогликанов, бактериальных липополисахаридов или липотейховой кислоты методами иммуноанализа [21]. Такая стратегия, рекомендованная Управлением по контролю за продуктами питания и лекарственными препаратами (Food and Drug Administration), пока не является рутинной и общепринятой [12]. Также актуальны меры по селекции безопасного контингента доноров крови, внедрение системы гемонадзора (haemovigilance) [11]. Общепринятыми остаются использование конструкций системы для забора крови с добавлением бактивама, а также преимущественного использования методов автоматического афереза для получения компонентов крови [3][7][15]. По оценочным данным [15], это позволяет снизить количество переливаний бактериально контаминированных компонентов крови и на 60—83 % — количество смертельных случаев, связанных с ними. В РНПЦ ТМБ внедрен и используется метод патогенредукции СЗП и КТ, в то же время широкое внедрение этих методов ограничивается достаточно благоприятной эпидемиологической обстановкой среди доноров крови Республики Беларусь и затратностью метода патогенредукции [9]. Проведенный в РНПЦ ТМБ комплекс мер в течение 2012—2018 гг. был связан с улучшением условий производства, налаживанием системы контроля аэрозольных частиц, аттестацией помещений по классам чистоты. В 2015 г. была переоснащена система воздухоподготовки и проведена аттестация рабочих помещений по классу чистоты в отделении заготовки крови и ее компонентов в РНПЦ ТМБ. Фракционирование цельной крови стали осуществлять в помещении класса чистоты В. Учитывая, что в 93,3 % случаев основной причиной контаминации компонентов крови было несоблюдение персоналом требований санитарно-гигиенического контроля и нарушение требований условий заготовки, была проведена внеочередная аттестация медицинского персонала. С декабря 2015 г. была внедрена система мероприятий по микробиологическому мониторингу производственной среды в соответствии с требованиями ТКП 030—2017 (33050) «Надлежащая производственная практика». Начиная с марта 2016 г., была внедрена система мониторинга аэрозольных частиц размером 0,5 и 5,0 мкм в производственных помещениях. С учетом площади производственных помещений дополнительно к ультрафиолетовым облучателям были установлены проточные рециркуляторы. Проведенный комплекс профилактических мероприятий в производственных помещениях отделения заготовки крови реализовался в улучшении как микробиологических показателей воздуха рабочих помещений, так и микробиологической об- семененности компонентов крови [16]. Учитывая, что заготовка ЭСК требует значительного объема ручного труда сотрудников, был проведен анализ активности персонала в рабочей зоне, оценены эффективность процедуры подготовки рабочих помещений и правильность выполнения персоналом стандартных операционных процедур по производимым работам.
Таблица 5. Мероприятия, использованные для снижения риска микробной контаминации компонентов крови
Table 5. The main measures used to reduce risk of microbial contamination of blood components
№ | Основные мероприятия Main events | Год внедрения The year of introduction | Характеристика показателей (2018 г.) Characteristics of indicators (2018) | Ожидаемые результаты внедрения Expected results |
|---|---|---|---|---|
1 | Селекция доноров Blood donor selection | 2004 | 75.1 % повторных доноров, 88,1 % допущенных к кроводаче 75.1 % repeated donors, 88.1 % of accepted for blood donation | Тщательное клиниколабораторное обследование не допускает кроводачу лиц со скрытыми инфекциями [7] Careful clinical and laboratory examination does not permit blood donations of subjects with occult infections [7] |
2 | Аппаратная заготовка крови Automated blood collection | 2007 | 80,0 % КТ, 76.2 % СЗП, 0 %ЭСК 80 %PC, 76.2 % FFP 0 % RBC | Автоматическая заготовка крови и ее компонентов снижают риск внешней микробной контаминации [8] Automated blood collection decreases risk of microbial contamination [8] |
3 | Патогенредукция КТ и СЗП Pathogen reduction for PC and FFP | 2011 | 16.2 % КТ, 1 % СЗП 16.2 %PC, 1 % FFP | Снижение риска микробной контаминации для переливания иммунокомпрометированным реципиентам [7][12] Decrease of microbial contamination of blood component for immunocompromised patients [7][12] |
4 | Двукратная обработка кожи локтевого сгиба Double treatment of donor arm | 2010 | 100 % охват доноров крови 100 % of blood donors | Внедрение СОП* улучшило показатели отсутствия высева микробов до 94 % [7][12] Introduction of SOP* improves indicators of sterility up to 94 % [7][16] |
5 | Переход на забор крови с бактивамом Use of blood collection into blood collection system with bactivam | 2012 | 75.3 % объема заготовки донорской крови 75.3 % of total volume of collected donor blood | Снижение риска микробной контаминации на 30-40 % [7] Decrease the risk of microbial contamination by 30-40 % [7] |
6 | Мониторинг окружающей среды Environment monitoring | 2015 | Увеличен с 5 до 9 перечень контролируемых показателей, увеличено с 3-4 до 9-29 количество контрольных точек забора материала для анализа Increase from 5 to 9 in the number of controlling indicators, increase from 3-4 to 9-29 in the number of controlling sites of sample collection for testing | Уменьшение количества аэрозольных частиц размером 0,5 и 5,0 мкм достоверно снизило частоту положительных результатов микробиологического анализа воздуха и компонентов крови [16] Decreasing the number of aerosolic particles size 0.5 and 5.0 qm was significantly associated with a lower frequency of positive results of microbial testing of air and blood component samples [16] |
7 | Увеличение количества и объема анализируемых образцов Increasing the number and volume of samples for testing | 2015 | Вместо 1 % от объема заготовки внедрена формула 0,4 × √n, объем образца 10 или 20 мл †, используется отсроченное (на 24 часа) тестирование, с 2018 г. начат отбор образцов к концу хранения компонента крови Instead of 1 % from number of collected blood components the formula 0,4 x √n was introduced; the volume of blood sample became10 or 20 ml; Delayed testing is used (for 24 hours); Since 2018, secondary bacterial culture has been introduced | Требования приведены в соответствие с общеевропейскими [17] Requirements are implemented according to Guide to the preparation, use, and quality assurance of blood components in EU [17] |
Примечание. * СОП — стандартная операционная процедура, † — объем забора материала — не менее 10 мл при тестировании на аэробные микроорганизмы и не менее 20 мл — на анаэробные микроорганизмы при использовании аппарата BacT/ALERT.
Note. PC — platelet concentrate, FFP — fresh frozen plasma, RBC — red blood cells; * — standard operation procedure, † — the volume of collected blood samples are 10 ml for testing of aerobic microbes and 20 ml for testing of anaerobic microbes using BacT/ALERT.
Наконец, в соответствии с международными рекомендациями [12][13] было начато проведение отсроченного тестирования микробной контаминации компонентов крови к концу сроков хранения (ЭСК — 28 дней, КТ — 7 дней), что является предметом дальнейшего рассмотрения. Не всегда результаты микробиологического анализа компонента крови прямо ассоциируются с риском инфицирования реципиента при переливании компонента крови. Бактериальную контаминацию КТ чаще выявляют при их хранении в плазме, а не в добавочном (PAS) растворе. В то же время доказанные случаи трансмиссивных инфекций при переливании КТ чаще выявлялись при их хранении в FAS-растворе [22].
Таким образом, в настоящей работе выявлена статистически значимая тенденция к уменьшению количества положительных результатов микробиологического контроля ЭСК донорской крови, заготовленных в 2012—2018 гг. в РНПЦ ТМБ. При этом результаты микробиологического контроля КТ, полученных методом автоматического афереза, были отрицательными, а для КТ, полученных из цельной крови, и СЗП — редкими случаями бактериальной контаминации (по 3 случая в течение 7 лет). Увеличение количества доз ЭСК, отбираемых для микробиологического анализа, сопровождалось уменьшением частоты выявления положительных результатов микробной контаминации заготовленных ЭСК. Своевременное проведение аттестации на соответствие классу чистоты рабочих помещений отделения заготовки крови, внедрение с 2015 г. системы микробиологического мониторинга чистых производственных помещений (воздух, поверхности, персонал) оказали влияние на снижение риска бактериальной контаминации компонентов крови, связанного с факторами внешней среды. Достигнутое снижение рисков бактериальной контаминации компонентов крови требует продолжения системной работы, в том числе внедрения новых подходов профилактики и микробиологического анализа.
Список литературы
1. Klein H.G., Anderson D., Bernardi M-J. et al. Pathogen inactivation: making decisions about new technologies. Report of a consensus conference. Transfusion. 2007; 47(12): 2338–47. DOI: 10.1111/j.1537-2995.2007.01512.x.
2. Никитин И.К. Бактериальная контаминация компонентов крови. Гематология и трансфузиология. 2010; 55(5): 10–3.
3. Потапнев М.П. Еремин В.Ф. Инфекционная безопасность донорской крови. Проблемы и решения. Гематология и трансфузиология. 2013; 58(3): 49–56.
4. Чеботкевич В.Н., Кайтанджан Е.И., Киселева Е.Е. и др. Проблемы бактериальной безопасности гемотрансфузий. Трансфузиология. 2015; 16(3): 14–25.
5. US Food and Drug Administration. Fatalities reported to FDA following blood collection and transfusion: annual summary for fi scal year 2016. [Online]. 2016. Available: https://www.fda.gov/downloads/BiologicsBloodVaccines/SafetyAvailability/ReportaProblem/Transfusion Donation Fatalities/UCM598243.pdf (Accessed 22 Apr 2018).
6. Haas K.A., Sapiano M.R.P., Savinkina A. et al. Transfusion-transmitted infections reported to the National Safety Network hemovigilance module. Transfus Med Rev. 2019; 33(2): 84–91. DOI: 10.1016/j.tmrv.2019.01.001.
7. McDonald C.P. Bacterial risk reduction by improved donor arm disinfection, diversion and bacterial screening. Transfus Med. 2006; 16: 381–96. DOI: 10.1111/j.1365-3148.2006.00697.x.
8. Stormer M., Wood E.M., Gathof B. Microbial safety of cellular therapeutics — lessons from over ten years’ experience in microbial safety of platelet concentrates. ISBT Science Series. 2019; 14: 37–44. DOI 10.1111/voxs.12452.
9. Kacker S., Bloch E.M., Ness P.M. et al. Financial impact of alternative approaches to reduce bacterial contamination of platelet transfusions. Transfusion. 2019; 59: 1291–9. DOI: 10.1111/trf.15139.
10. Bloch E.M., Marshall C.E., Boyd J.S. et al. Implementation of secondary bacterial culture testing of platelets to mitigate residual risk of septic transfusion reactions. Transfusion. 2018; 58(7): 1574–7. DOI: 10.111/trf.14618.
11. Levy J.H., Neal M.D., Herman J.H. Bacterial contamination of platelets for transfusion: strategies for prevention. Crit Care. 2018; 22: 271. DOI: 10.1186/ s13054-018-2212-9.
12. Sachais B.S., Paradiso S., Strauss D., Shaz B.H. Implication of US Food and Drug Administration draft guidance for mitigating septic reactions from platelet transfusions. Blood Adv. 2017; 1(15): 1142–7. DOI: 10.1182/bloodadvances.2017008334.
13. FDA-CBER. Bacterial risk control strategies for blood collection establishments and transfusion services to enhance the safety and availability of platelets for transfusion. December 2018 [cited 2019 January 4]. Available from: https:// www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation /Guidances/Blood/UCM627407.pdf.
14. Zimrin A.B., Hess J.R. Current issues related to the transfusion of stored red blood cells. Vox Sang. 2009; 96: 93–103. DOI: 10.1111/j.1423-0410.2008.01117.x.
15. Erony S.M., Marshall C.E., Gehrie E.A. et al. The epidemiology of bacterial culture-positive and septic transfusion reactions at a large tertiary academic center: 2009 to 2016. Transfusion. 2018; 58: 1933–9. DOI: 10.1111/trf.14789.
16. Вяткина О.И., Потапнев М.П. Анализ содержания аэрозольных частиц и микробиологической чистоты воздуха рабочих помещений организации переливания крови. Гематология. Трансфузиология. Восточная Европа. 2018; 4(4): 497–505.
17. Guide to the preparation, use and quality assurance of blood component. Recommendation No.R (95) 15. 19th Edition. Strasbourg. 2017.
18. Brecher M.E., Holland P.V., Pineda A.A. et al. Growth of bacteria in inoculated platelets: implication for bacteria detection and the extension of platelet storage. Transfusion. 2000; 40 (11): 1308–12. DOI:10.l046/j.l537-2995.2000. 40111308.x.
19. Dreier J., Stormer M., Pichl L., Schottstedt V. et al. Sterility screening of platelet concentrates: questioning the optimal test strategy. Vox Sang. 2008; 95: 181–8. DOI: 10.1111/j.1423-0410.2008.01087.x.
20. Staley E., Grossman B. Blood safety in the United States: prevention, detection, and pathogen reduction. Clin Microbiol Newsletter. 2019; 41(17): 149–57. DOI: 10.1016/j.clinmicnews.2019.08.002.
21. Vollmer T., Hinse D., Kleesiek K., Dreier J. The Pan Genera Detection immunoassay: a novel point-od issue method for detection of bacterial contamination in platelet concentrates. J. Clin. Microbiol. 2010; 48(10): 3475–81. DOI: 10.1128/ JCM.00542-10.
22. Ramirez-Arcos S., McDonald C., Deol P. et al. Bacterial safety of blood components — a congress review of the ISBT transfusion-transmitted infectious diseases working party, bacterial subgroup. ISBT Science Series. 2019; 0: 1–9. DOI: 10.1111/voxs.12483.
Об авторах
О. И. ВяткинаБеларусь
Вяткина Ольга Ивановна, врач-бактериолог, заведующая лабораторией бактериологического контроля отдела управления качеством и внутреннего аудита
М. П. Потапнев М. П
Беларусь
Потапнев Михаил Петрович, доктор медицинских наук, профессор, заведующий отделом клеточных биотехнологий
О. В. Красько О. В.
Беларусь
Красько Ольга Владимировна, ведущий научный сотрудник лаборатории биоинформатики
Рецензия
Для цитирования:
Вяткина О.И., Потапнев М. П М.П., Красько О. В. О.В. Микробиологическая безопасность компонентов крови и эффективность мер по ее совершенствованию. Гематология и трансфузиология. 2020;65(3):251-262. https://doi.org/10.35754/0234-5730-2020-65-3-242-250
For citation:
Viatkina O.I., Potapnev M.P., Krasko O.V. Microbial safety of blood components and effi cacy of measures for its improvement. Russian journal of hematology and transfusiology. 2020;65(3):251-262. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-242-250










































