Перейти к:
Сравнение результатов лечения взрослых больных острыми Ph-негативными лимфобластными лейкозами по протоколам Российских многоцентровых исследований «ОЛЛ-2009» и «ОЛЛ-2016»
https://doi.org/10.35754/0234-5730-2022-67-4-460-477
Аннотация
Введение. За последние 5 лет достигнуты значимые успехи в лечении больных Ph-негативными острыми лимфобластными лейкозами (ОЛЛ). В двух протоколах российских многоцентровых исследований («ОЛЛ-2009» и «ОЛЛ-2016») не использовали многокомпонентную высокодозную консолидацию, соблюдали принцип непрерывности лечения с модификацией доз цитостатических препаратов в зависимости от глубины цитопении.
Цель – сопоставление 5-летних результатов двух исследований и определение факторов неблагоприятного прогноза при лечении больных ОЛЛ.
Материалы и методы. Исследования были выполнены с апреля 2009 г. по апрель 2016 г. («ОЛЛ-2009») и с апреля 2016 г. по март 2022 г. («ОЛЛ-2016»). В них были включены 596 больных: 330 – в «ОЛЛ-2009» и 266 – в «ОЛЛ-2016». Анализ выполнен в сентябре 2021 г. Медиана возраста больных в «ОЛЛ-2009» составила 28 лет, в «ОЛЛ-2016» – 32,5 года. Цитогенетические исследования были выполнены 242 больным в «ОЛЛ-2009» (73,3 %) и 236 больным в «ОЛЛ-2016» (88,7 %). Больным в протоколе «ОЛЛ-2016» выполняли централизованную оценку минимальной остаточной болезни (МОБ) методом проточной цитометрии на +70 день протокола (после завершения двух фаз индукции), +133 и +190 дни. Трансплантация аллогенных стволовых гемопоэтических клеток была проведена 7 % больных в «ОЛЛ-2009» и 9 % – в «ОЛЛ-2016».
Результаты. Общая выживаемость (ОВ), безрецидивная выживаемость (БРВ) и вероятность развития рецидива на сроке 3 года от момента включения больных в то или иное исследование составили для «ОЛЛ-2009» 59, 63 и 23 %, а для «ОЛЛ-2016» – 64, 59 и 22 % соответственно. Для больных В-ОЛЛ были сформированы две группы цитогенетического риска, в которых значимо отличались показатели долгосрочной выживаемости: группа стандартного риска (гиперплоидный набор хромосом и нормальный кариотип) – ОВ 63 %, БРВ 70 %, и высокогоцитогенетического риска (любой аномальный кариотип, за исключением гиперплоидии) – ОВ 49 %, БРВ 52 % (р = 0,001, р = 0,0014). При Т-ОЛЛ цитогенетические маркеры не имели прогностического значения, но важным предиктором неблагоприятного прогноза оказался иммунофенотип ранних Т-клеточных предшественников (вероятность развития рецидива составила 52 % в сравнении с 15 % при всех других иммунофенотипических вариантах). По результатам централизованного мониторинга МОБ было определено, что для В-ОЛЛ значимыми негативными факторами является группа высокого цитогенетического риска и положительный МОБ-статус на +70 день, а для Т-ОЛЛ – ранний иммунофенотип и положительный МОБ-статус на +133 день.
Заключение. Результаты сравнения показали сопоставимую эффективность двух российских протоколов.
Ключевые слова
Для цитирования:
Паровичникова Е.Н., Алешина О.А., Троицкая В.В., Чабаева Ю.А., Соколов А.Н., Исинова Г.А., Котова Е.С., Ахмерзаева З.Х., Клясова Г.А., Гальцева И.В., Давыдова Ю.О., Кузьмина Л.А., Бондаренко С.Н., Баранова О.Ю., Антипова А.С., Самойлова О.С., Гришунина М.Е., Капланов К.Д., Капорская Т.С., Константинова Т.С., Свешникова Ю.В., Борисенкова Е.А., Фокина Е.С., Минаева Н.В., Зинина Е.Е., Лапин В.А., Грибанова Е.О., Звонков Е.Е., Двирнык В.Н., Галстян Г.М., Обухова Т.Н., Судариков А.Б., Куликов С.М. Сравнение результатов лечения взрослых больных острыми Ph-негативными лимфобластными лейкозами по протоколам Российских многоцентровых исследований «ОЛЛ-2009» и «ОЛЛ-2016». Гематология и трансфузиология. 2022;67(4):460-477. https://doi.org/10.35754/0234-5730-2022-67-4-460-477
For citation:
Parovichnikova E.N., Aleshina O.A., Troitskaya V.V., Chabaeva Yu.A., Sokolov A.N., Isinova G.A., Kotova E.S., Akhmerzaeva Z.H., Klyasova G.A., Galtseva I.V., Davydova Yu.O., Kuzmina L.A., Bondarenko S.N., Baranova O.Yu., Antipova A.S., Samoilova O.S., Grishunina M.E., Kaplanov K.D., Kaporskaya T.S., Konstantinova T.S., Sveshnikova Yu.V., Borisenkova E.A., Fokina E.S., Minaeva N.V., Zinina E.E., Lapin V.A., Gribanova E.O., Zvonkov E.E., Dvirnyk V.N., Galstyan G.M., Obukhova T.N., Sudarikov A.B., Kulikov S.M. Comparison of the treatment results in adult patients with acute Ph-negative lymphoblastic leukemia on protocols of the Russian multicenter studies ALL-2009 and ALL-2016. Russian journal of hematology and transfusiology. 2022;67(4):460-477. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-460-477
Введение
Используя принцип непрерывности лечения, который подразумевает не столько агрессивность цитостатического воздействия, сколько его постоянство, Российская исследовательская группа по лечению острых лейкозов смогла за 10 лет фактически в полтора раза улучшить показатели пятилетней долгосрочной выживаемости больных Ph-негативными острыми лимфобластными лейкозами (ОЛЛ): с 45 до 65 %. Эти результаты были получены в рамках выполненного «ОЛЛ-2009» и завершенного в 2022 г. «ОЛЛ-2016» многоцентровых исследований [1–4]. В отличие от большинства протоколов лечения взрослых больных ОЛЛ, в протоколах «ОЛЛ-2009/ОЛЛ-2016» не использовали многократную многокомпонентную высокодозную консолидацию, соблюдали принцип непрерывности лечения с модификацией доз цитостатических препаратов в зависимости от глубины цитопении, кроме того, изучали роль трансплантации аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) у больных Т-клеточными ОЛЛ (Т-ОЛЛ), и при этом выполняли малое количество трансплантаций аллогенных гемопоэтических стволовых клеток (алло-ТГСК) — только у больных из крайне неблагоприятной группы риска (t(4;11), t(1;19), недостижение полной ремиссии (ПР) после двух фаз индукционного лечения). Важным компонентом второго многоцентрового исследования «ОЛЛ-2016» стал централизованный мониторинг минимальной остаточной болезни (МОБ) методом проточной цитометрии.
Целью настоящей работы стало сопоставление 5-летних результатов двух исследований и определение факторов неблагоприятного прогноза.
Материалы и методы
В работе объединены данные двух многоцентровых проспективных исследований по лечению взрослых больных Ph-негативными ОЛЛ, которые были проведены с апреля 2009 г. по апрель 2016 г. («ОЛЛ-2009») и с апреля 2016 г. по март 2022 г. («ОЛЛ-2016»). Дизайн исследований был опубликован ранее [5]. Анализ выполнен в марте 2022 г. Между терапевтическими протоколами двух исследований были определенные отличия.
- Длительность введения L-аспарагиназы в протоколе «ОЛЛ-2016» была уменьшена до 1 года от начала терапии.
- Вместо двух трехдневных блоков с метотрексатом и цитарабином в высоких дозах (консолидация IV–V) были введены четырехнедельные низкодозные программы IV–V консолидаций.
- Увеличено количество люмбальных пункций — с 15 до 21.
- В рамках протокола «ОЛЛ-2016» было выполнено рандомизированное исследование для оценки необходимости выполнения ауто-ТГСК после V консолидации, в которое были включены на обе ветви 87 больных Т-ОЛЛ (43 — без ауто-ТГСК, 44 — с ауто-ТГСК).
- При проведении протокола «ОЛЛ-2009» больным Т-ОЛЛ ауто-ТГСК выполняли «по возможности», т. е. присутствовал компонент существенной селекции, что изложено в предыдущих публикациях [6].
Всего в эти два исследования были включены 596 больных Ph-негативными ОЛЛ: 330 — в протокол «ОЛЛ-2009» и 266 — в протокол «ОЛЛ-2016». В первом исследовании приняло участие 31 гематологическое отделение, во втором — 12 отделений, из них 3 — в «академических» центрах. Ключевые клинико-лабораторные характеристики больных представлены в таблице 1.
Таблица 1. Клинико-лабораторные характеристики больных ОЛЛ, включенных в два проспективных исследования
Table 1. Clinical and laboratory characteristics of ALL patients included in the two prospective studies
Параметры / Parameters | Протокол / Protocol | p, χ2 | |
ОЛЛ-2009 / ALL-2009 | ОЛЛ-2016 / ALL-2016 | ||
Мужчины / Женщины | 182 (55 %) / 148 (45 %) | 167 (63 %) / 99 (37 %) | 0,061 |
Возраст, годы (медиана (разброс)) | 28 (15–55) | 32,5 (18–55) | 0,0004 |
B-ОЛЛ / BСP-ALL | 195 (59 %) | 145 (54,5 %) | 0,018 |
T-ОЛЛ / T-ALL | 125 (38 %) | 109 (41 %) | |
Смешанно-клеточный ОЛЛ | 4 (1 %) | 11 (4 %) | |
Неизвестно / Unknown | 6 (2 %) | 1 (0,5 %) | |
Лейкоциты × 109/л, медиана, разброс WBC × 109/L, median, range | 13,2 (0,4–899) | 11,1 (0,66–833,94) | 0,38 |
> 30 × 109/л, B-ОЛЛ > 30 × 109/L, BCP-ALL | 48 (27 %) | 28 (19 %) | 0,24 |
> 100 × 109/л, T-ОЛЛ > 100 × 109/L, T-ALL | 50 (42 %) | 25 (23 %) | 0,4622 |
ЛДГ, МЕ / LDH U/L | 0,67 | ||
> 2N | 169 (58 %) | 114 (60 %) | |
< 2N | 122 (42 %) | 76 (40 %) | |
Беременность на момент диагностики | 15 (4,5 %) | 8 (3 %) | 0,34 |
Полная ремиссия / Complete remission | 281 (85 %) | 215/259 (87 %) | 0,2076 |
Рефрактерность / Refractory | 24 (7 %) | 13/259 (5 %) | 0,8882 |
Ранняя летальность (в период двух фаз индукции) | 25 (8 %) | 21/259 (8 %) | 0,9522 |
Позднее достижение ПР (на +70 день) | 27 (10 %) из 281 ПР | 35 (16 %) из 215 ПР | 0,5842 |
МОБ-позитивность на 70 день, n, % | 75/207 (36,2 %) | ||
МОБ-позитивность на 133 день, n, % | 23/170 (13,5 %) | ||
Лечение в: / Treatment in: | 0,457 | ||
академических центрах | 142 (43 %) | 123 (46 %) | |
региональных центрах | 188 (57 %) | 143 (54 %) | |
Примечание: В-ОЛЛ — В-клеточный острый лимфобластный лейкоз, T-ОЛЛ — Т-клеточный острый лимфобластный лейкоз, ПР — полная ремиссия, МОБ — минимальная остаточная болезнь, ЛДГ — лактатдегидрогеназа.
Note: ВCP-ALL — B-cell precursor acute lymphoblastic leukemia, T-ALL — T-cell lymphoblastic leukemia, CR — complete remission, MRD — minimal residual disease, LDH — lactate dehydrogenase.
Первичное иммунофенотипирование бластных клеток при проведении протокола «ОЛЛ-2009» осуществляли в локальных лабораториях, затем экспертную оценку результатов иммунофенотипирования по отнесению к тому или иному варианту ОЛЛ осуществляли координаторы протокола при внесении информации в on-line базу исследования. В этом исследовании не выделяли вариант Т-ОЛЛ из ранних Т-клеточных предшественников (early T-precursor (ЕТР) вариант). При проведении протокола «ОЛЛ-2016» иммунофенотипирование осуществляли централизовано и определяли ЕТР-вариант Т-ОЛЛ.
Результаты цитогенетических исследований доступны по 242 (73,3 %) больным, включенным в протокол «ОЛЛ-2009», и по 236 (88,7 %) больным, включенным в протокол «ОЛЛ-2016». Эти исследования, а также исследования методом флуоресцентной гибридизации in situ (fluorescence in situ hybridization, FISH), выполняли при проведении протокола «ОЛЛ-2009» в локальных лабораториях, а для протокола «ОЛЛ-2016» — централизованно в лаборатории цитогенетики ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России (заведующая лабораторией — к.м.н. Т.Н. Обухова). Методом FISH оценивали перестройки генов BCR, ABL, MLL. Молекулярные исследования у больных при проведении протокола «ОЛЛ-2009» выполняли выборочно, в зависимости от наличия архивного биоматериала, а для протокола «ОЛЛ-2016» — централизованно в лаборатории молекулярной гематологии ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России (заведующий лабораторией — д.б.н. А.Б. Судариков). Оценивали мутации в генах IKZF1, NRAS, KRAS, JAK2, FLT3, ТР53. Подробные цитогенетические и молекулярные характеристики приведены в таблице 2.
Таблица 2. Результаты цитогенетических исследований у больных на момент диагностики ОЛЛ в зависимости от протокола
Table 2. Results of cytogenetic studies in patients at the time of diagnosis of ALL, depending on the protocol
Исследования / Analysis | Протокол / Protocol | |
ОЛЛ-2009 / ALL-2009 | ОЛЛ-2016 / ALL-2016 | |
Цитогенетическое / Cytogenetics: | ||
Нормальный кариотип / Normal karyotype | 97 (40,1 %) | 97 (41,1 %) |
Гиперплоидный / Hyperploid | 27 (11,2 %) | 26 (11,0 %) |
11q23 | 6 (2,5 %) | 10 (4,2 %) |
Гипоплоидный / Hypoploid | 5 (2,1) | 5 (2,12 %) |
t(1;19) | 1 (0,4 %) | 5 (2,1 %) |
Комплексный / Complex | 7 (3,7 %) | 27 (11,4 %) |
Иные аномалии / Other anomalies | 61 (25,8 %) | 46 (24,2 %) |
Нет митозов / No mitoses | 16 (6,7 %) | 21 (8,9 %) |
Молекулярное / Molecular: | ||
IKZF1 | 6/33 (18 %) | 7/68 (11 %) |
NRAS | 2/31 (7 %) | 7/64 (11 %) |
KRAS | 5/31 (16 %) | 6/62 (11 %) |
JAK2 | – | 3/93 (3 %) |
FLT3 | – | 2/101 (2 %) |
мТР53 / mutTP53 | 5/42 (11 %) | 6/109 (5,5 %) |
Примечание: м — мутация.
Note: mut — mutation.
При проведении протокола «ОЛЛ-2016» всем больным осуществляли централизованный мониторинг МОБ методом проточной цитометрии в лаборатории иммунофенотипирования ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России (заведующая лабораторией — к.м.н. И.В. Гальцева). Исследования выполняли на +70 день протокола (после завершения двух фаз индукции), на +133 и +190 дни.
Ауто-ТГСК у больных Т-ОЛЛ выполняли в рамках рандомизированного исследования при проведении протокола «ОЛЛ-2016». Больных на момент достижения ПР рандомизировали на ветвь ауто-ТГСК с последующей химиотерапией или на продолжение только химиотерапии. На ветвь ауто-ТГСК рандомизированы 44 больных, а на ветвь только химиотерапии — 43 больных. Медиана времени выполнения ауто-ТГСК составила 7 мес. (214 дней).
Алло-ТГСК была проведена в первой ПР у 7 % больных в протоколе «ОЛЛ-2009» и 9 % — в протоколе «ОЛЛ-2016». Показанием к ней служило отнесение больного к группе высокого риска (обнаружение перестроек 11q23, персистенция МОБ на всех сроках мониторинга).
Базовым статистическим методом являлся событийный анализ, в ходе которого оценивали в группах больных общую выживаемость (ОВ), безрецидивную выживаемость (БРВ) и вероятность развития рецидивов. ОВ рассчитывали от дня начала терапии по протоколу до смерти от любых причин, БРВ — от дня достижения ремиссии до рецидива или смерти от любых причин. Вероятность развития рецидивов оценивали от дня достижения ПР до рецидива. Больные, умершие в ПР, цензурировались на день смерти.
Поиск и оценку факторов риска проводили с помощью мультивариантного событийного анализа, основанного на регрессионной модели пропорциональных рисков Кокса. В анализ входили объединенные данные двух исследований. Выделение наиболее значимых факторов выполняли путем пошагового отбора из исходного набора признаков, включающего: пол, возраст, исходный лейкоцитоз, сывороточная концентрация лактатдегидрогеназы (ЛДГ), иммунофенотип, позднее достижение ПР, центр, где осуществляли лечение. Мультивариантный анализ с включением такого фактора, как группа риска по цитогенетике и МОБ-статус, был выполнен только по больным, включенным в исследование «ОЛЛ-2016» (признаки: пол, возраст, исходный лейкоцитоз, концентрация ЛДГ, иммунофенотип, позднее достижение ПР, цитогенетические аномалии, МОБ-статус на +70, +133 дни, центр, где осуществляли лечение). Анализ выполняли отдельно для больных В-ОЛЛ и Т-ОЛЛ.
При оценке результатов рандомизированного исследования по определению необходимости выполнения ауто-ТГСК на этапе поздней консолидации был использован метод ленд-марк-анализа, в котором начало отсчета временных интервалов сдвигалось на определенную величину. Выживаемость и вероятность развития рецидива оценивали от даты ауто-ТГСК у больных, кому выполнили трансплантацию, и от даты медианы времени выполнения ауто-ТГСК (7 мес.) у тех, кому ауто-ТГСК не выполняли.
Исследования были утверждены на локальном этическом комитете координационного центра. Все включенные в исследование подписали информированное согласие. Все процедуры проводились в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации. Исследования зарегистрированы на сайте Clinicaltrials.gov (ОЛЛ-2009 — NCT01193933, ОЛЛ-2016 — NCT03462095).
Результаты
Принципиальных отличий в дизайне, временном регламенте введения лекарственных препаратов, суммарных дозах цитостатических препаратов между двумя описываемыми протоколами не было. Исходные клинико-лабораторные характеристики представлены в таблице 1. При сопоставлении основных клинико-лабораторных параметров больных, включенных в оба исследования, выявлены отличия по демографическим показателям. Больные в исследовании «ОЛЛ-2016» были старше: медиана возраста составила 32,5 года (18–55) по сравнению с 28 годами (15–55) в исследовании «ОЛЛ-2009» (р = 0,0004). В исследовании «ОЛЛ-2016» доля больных мужского пола была несколько больше, чем в «ОЛЛ-2009» (63 и 55 % соответственно, р = 0,061).
Результаты цитогенетических и молекулярных исследований в целом свидетельствуют о фактически одинаковом молекулярно-генетическом профиле ОЛЛ у больных в разных исследованиях, что позволило объединить данные этих исследований для совместного анализа. Основную долю составили больные с нормальным кариотипом (40 % в «ОЛЛ-2009» и 41 % в «ОЛЛ-2016»), частота выявления перестроек 11q23 — 2,5 и 4,2 % соответственно, комплексного кариотипа — 3,7 и 11,4 % соответственно, иных аномалий — 25,8 и 24,2 %; не получены митозы, соответственно, у 6,7 и 8,9 %.
Частота достижения ПР на момент завершения индукции на протоколе «ОЛЛ-2009» составила 85 %, на протоколе «ОЛЛ-2016» — 87 %; ранняя летальность — 8 и 8 % соответственно; рефрактерные формы диагностированы у 7 и 5 % соответственно (табл. 1).
На первом этапе событийного анализа было проведено сравнение оценок ОВ и БРВ больных двух исследований. Результаты двух исследований были схожи (рис. 1, 2). Пятилетняя ОВ и БРВ от момента включения больных в исследование составили для «ОЛЛ-2009» 59 и 63 %, а для «ОЛЛ-2016» — 64 и 59 % соответственно, что свидетельствует о стабильности и воспроизводимости программной терапии по обоим протоколам. При сопоставлении долгосрочных результатов у больных, включенных в оба исследования, 5-летняя и ОВ, и БРВ существенно отличались в зависимости от того, в каком центре больному проводили лечение. В федеральных центрах ОВ и БРВ составили 73 и 71 %, а в региональных — 52 и 56 % соответственно (р < 0,0001; р = 0,0009) (рис. 3, 4).
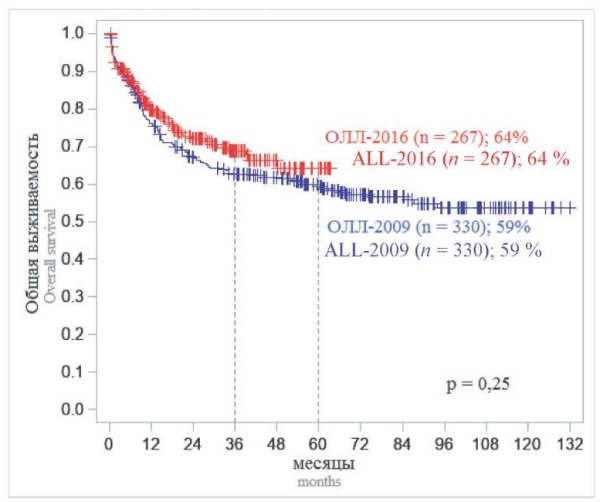
Рисунок 1. Общая выживаемость больных, включенных в два исследования «ОЛЛ-2009» и «ОЛЛ-2016»
Примечание: n — число больных.
Figure 1. Overall survival of patients included in the two studies ALL-2009 and ALL-2016
Note: n — number of patients.
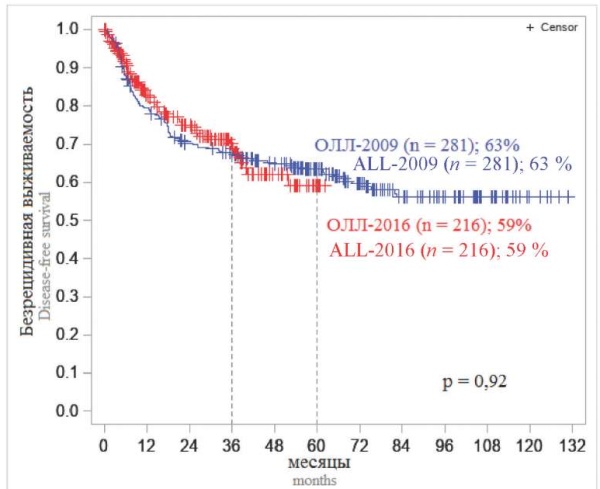
Рисунок 2. Безрецидивная выживаемость больных, включенных в два исследования «ОЛЛ-2009» и «ОЛЛ-2016»
Примечание: n — число больных.
Figure 2. Relapse-free survival of patients included in the two studies ALL-2009 and ALL-2016
Note: n — number of patients.
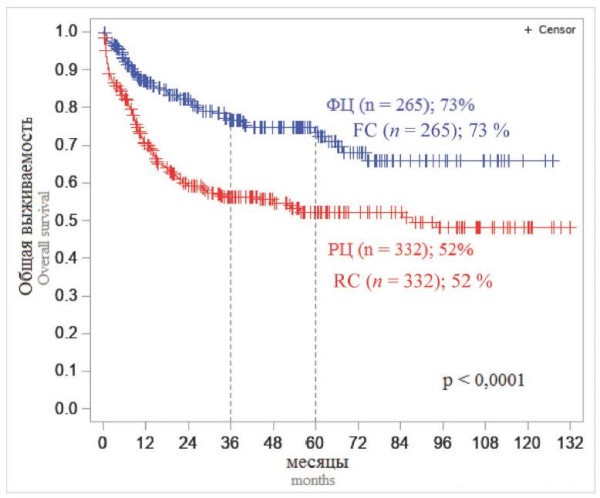
Рисунок 3. 5-летняя общая выживаемость больных ОЛЛ двух исследований в зависимости от центра, где проводили терапию
Примечание: ФЦ — федеральные центры, РЦ — региональные центры, n — число больных.
Figure 3. 5-year overall survival of patients with ALL in two studies, depending on the center where the therapy was performed
Note: FC — federal centers, RC — regional centers, n — number of patients.
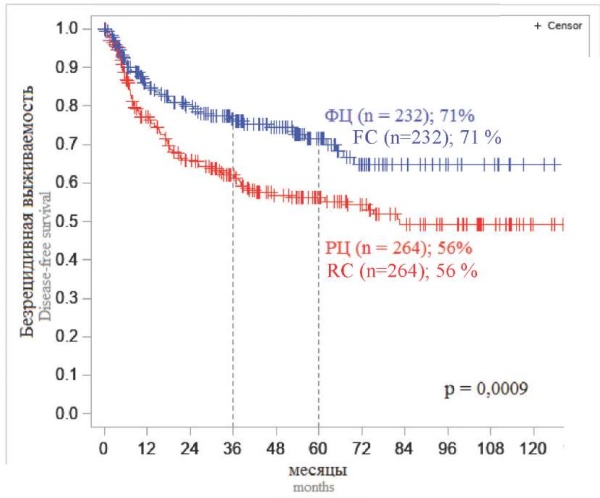
Рисунок 4. 5-летняя безрецидивная выживаемость больных ОЛЛ двух исследований в зависимости от центра, где проводили терапию
Примечание: ФЦ — федеральные центры, РЦ — региональные центры, n — число больных.
Figure 4. 5-year relapse-free survival of patients with ALL in two studies, depending on the center where the therapy was performed
Note: FC — federal centers, RC — regional centers, n — number of patients.
Для выяснения значимости цитогенетических аномалий в объединенной когорте В-ОЛЛ был сформирован двухуровневый показатель цитогенетического риска. В группах по этому показателю значимо отличались показатели долгосрочной выживаемости: группа стандартного цитогенетического риска (гиперплоидный набор хромосом и нормальный кариотип) — ОВ 70 %, БРВ 72 %, и высокого цитогенетического риска (любой аномальный кариотип, за исключением гиперплоидии) — ОВ 49 %, БРВ 52 % (р = 0,001, р = 0,0014).
При Т-ОЛЛ ни для каких из выбранных цитогенетических маркеров не удалось подтвердить их прогностическое значение. Однако при анализе долгосрочных результатов терапии Т-ОЛЛ в исследовании «ОЛЛ-2016», в котором выделяли ЕТР-вариант Т-ОЛЛ, исключительно важным предиктором крайне неблагоприятного прогноза оказался иммунофенотип ранних Т-клеточных предшественников: вероятность развития рецидива в течение 3 лет составила 52 % в сравнении с 15 % привсех других иммунофенотипических вариантах, а ОВ — менее 50 %.
Итоги рандомизации больных Т-ОЛЛ на ветвь с ауто-ТГСК и без нее позволили сделать вывод, что в рамках существующего химиотерапевтического протокола ауто-ТГСК как этап поздней консолидации не привнес значимых дополнительных преимуществ. Вероятность безрецидивного течения заболевания составила после ауто-ТГСК — 62 %, без ауто-ТГСК — 78 % (рис. 5), а вероятность развития рецидива — 25 и 22 % соответственно.
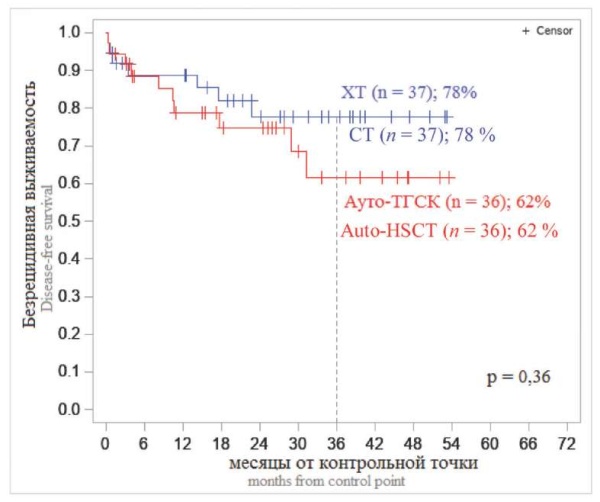
Рисунок 5. 3-летняя безрецидивная выживаемость больных Т-клеточными ОЛЛ в зависимости от ветки рандомизации — выполнение или невыполнение ауто-ТГСК
Примечание: ХТ — химиотерапия, Ауто-ТГСК — трансплантация аутологичных гемопоэтических стволовых клеток, n — число больных.
Figure 5. 3-year relapse-free survival of patients with T-cell ALL depending on the randomization branch — performance or failure of auto-HSCT
Note: CT — chemotherapy, Auto-HSCT — autologous hematopoietic stem cell transplantation, n — number of patients.
По данным централизованного мониторинга МОБ (n = 207) (табл. 3), к +70 дню протокола МОБ-негативность регистрировали у 74,2 % больных Т-ОЛЛ и 55,6 % больных В-ОЛЛ, к +133 дню — у 90,8 и 81,6 %, к +190 дню — у 90,3 и 85,4 % соответственно. Скорость достижения МОБ-негативного статуса была существенно ниже у больных В-ОЛЛ по сравнению с Т-ОЛЛ (рис. 6). Оценки вероятности достижения МОБ негативного статуса на 70-й день от начала терапии составили 76 %для Т-ОЛЛ и 62 % для В-ОЛЛ, на 133-й день терапии — 96 и 83 %, на 190-й день — 98 и 89 % соответственно.
Таблица 3. Результаты централизованного мониторинга МОБ
Table 3. Results of centralized monitoring of MRD
Вариант ОЛЛ/МОБ статус | +70 день | +133 день | +190 день |
B-ОЛЛ / BCP-ALL | n = 108 | n = 87 | n = 82 |
МОБ+ / MRD+ | 48 (44,4 %) | 16 (18,4 %) | 12 (14,6 %) |
МОБ– / MRD– | 60 (55,6 %) | 71 (81,6 %) | 70 (85,4 % %) |
T-ОЛЛ / T-ALL | n = 89 | n = 76 | n = 62 |
МОБ+ / MRD+ | 23 (25,8 %) | 7 (9,2 %) | 6 (9,7 %) |
МОБ– / MRD– | 66 (74,2 %) | 69 (90,8 %) | 56 (90,3 %) |
Смешанно-клеточный | n = 10 | n = 7 | n = 6 |
МОБ+ / MRD+ | 4 (40 %) | 0 | 0 |
МОБ– / MRD– | 6 (60 %) | 7 (100 %) | 6 (100 %) |
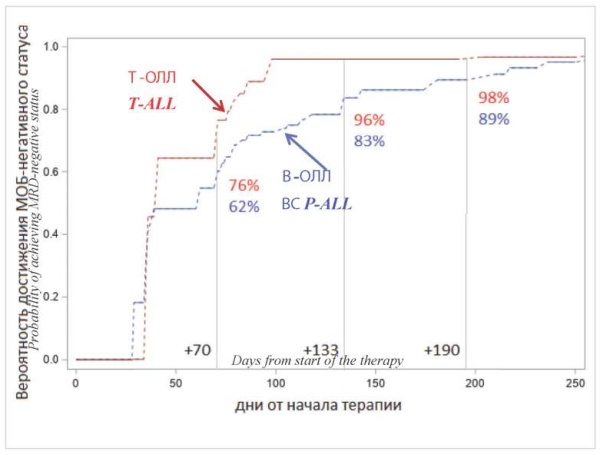
Рисунок 6. Скорость достижения МОБ-негативного статуса у больных с Т-ОЛЛ и В-ОЛЛ (интервальные право-лево цензурированные оценки Тернбула)
Примечание: В-ОЛЛ — В-клеточный острый лимфобластный лейкоз, T-ОЛЛ — Т-клеточный острый лимфобластный лейкоз, МОБ — минимальная остаточная болезнь.
Figure 6. The rate of achievement of MRD-negative status in patients with T-ALL and BCP-ALL (interval right-left censored Turnbull scores)
Note: ВCP-ALL — B-cell precursor acute lymphoblastic leukemia, T-ALL — T-cell lymphoblastic leukemia, MRD — minimal residual disease.
Анализ зависимости 3-летней БРВ у больных В-ОЛЛ и Т-ОЛЛ от МОБ-статуса в контрольных временных точках выявил значимые и наиболее существенные отличия БРВ в зависимости от обнаружения МОБ-позитивности на +70 день (завершение двух фаз индукционной терапии) (рис. 7, 8). Эти данные позволяют считать +70 день наиболее информационно-дискриминирующей временной точкой: обнаружение МОБ в костном мозге на этом сроке позволяет отнести больных кгруппе неблагоприятного прогноза и рассматривать возможность выполнения алло-ТГСК, поскольку вероятность безрецидивного течения заболевания у больных с МОБ-позитивностью в этой точке достоверно ниже (для В-ОЛЛ — 47 %, для Т-ОЛЛ — 35 %), чем у больных с отрицательными значениями МОБ на этом сроке (для В-ОЛЛ — 78 %, для Т-ОЛЛ — 79 %) (р < 0,001).
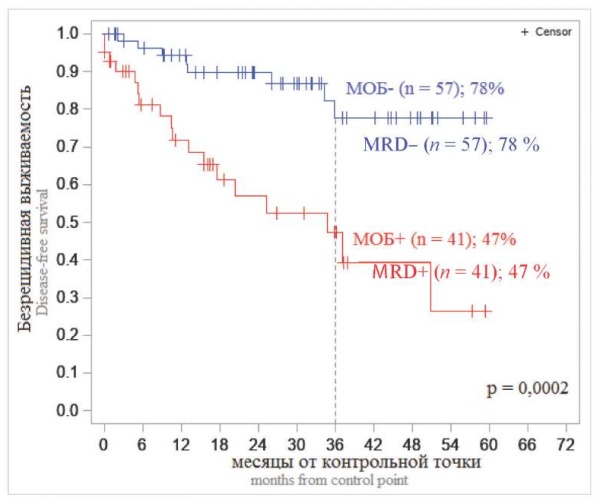
Рисунок 7. Безрецидивная выживаемость больных В-клеточными ОЛЛ в зависимости от МОБ-статуса на +70 день
Примечание: МОБ — минимальная остаточная болезнь, n — число больных.
Figure 7. Relapse-free survival of patients with BCP-cell ALL depending on MRD status at +70 day
Note: MRD — minimal residual disease, n — number of patients.
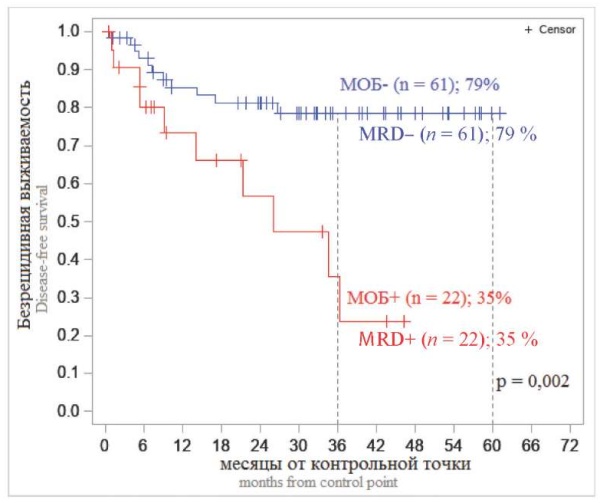
Рисунок 8. Безрецидивная выживаемость больных Т-клеточными ОЛЛ в зависимости от МОБ-статуса на +70 день
Примечание: МОБ — минимальная остаточная болезнь, n — число больных.
Figure 8. Relapse-free survival of patients with T-cell ALL depending on MRD status at +70 day
Note: MRD — minimal residual disease, n — number of patients.
В ходе мультивариантного анализа данных объединенной когорты больных двух исследований в результате пошаговой селекции были отобраны три независимых неблагоприятных фактора для ОВ: регион, где осуществляли лечение (отношение рисков (ОР) = 2,14; 95%-ный доверительный интервал (95% ДИ): 1,58–2,91; p = 0,0015), возраст старше 30 лет (ОР = 1,73; 95% ДИ: 1,21–2,49); p = 0,0028), инициальный лейкоцитоз более 30 × 109/л для В-ОЛЛ и более 100 × 109/л для Т-ОЛЛ (ОР = 1,79; 95% ДИ: 1,25–2,57; p = 0,0104). Для вероятности развития рецидива было отобрано три неблагоприятных фактора: достижение ПР после второй фазы индукции (ОР = 2,46; 95% ДИ: 1,25–4,80; p = 0,0085), возраст старше 30 лет (ОР = 1,53; 95% ДИ: 1,21–2,49; p = 0,054), инициальный лейкоцитоз более 30 × 109/л для В-ОЛЛ и более 100 × 109/л для Т-ОЛЛ (ОР = 1,70; 95% ДИ: 1,05–2,75; p = 0,031).
Мультивариантный анализ, выполненный только в группе больных из исследования «ОЛЛ-2016» и включивший, помимо ранее указанных признаков, ЕТР-вариант Т-ОЛЛ и результаты мониторинга МОБ, показал, что для ОВ при В-клеточных ОЛЛ независимыми неблагоприятными признаками являются группа высокого цитогенетического риска (ОР = 4,18; 95% ДИ: 1,67–10,44; p = 0,022) и положительный МОБ-статус на +70 день (ОР = 4,78; 95% ДИ: 1,70–13,39; p = 0,029), а при Т-клеточных ОЛЛ — положительный МОБ-статус на +70 день (ОР = 2,34; 95% ДИ: 0,88–6,19; p = 0,086). Фактором риска развития рецидива для В-ОЛЛ стали положительный МОБ-статус на +70 день (ОР = 3,56; 95% ДИ: 1,30–9,74; p = 0,013) и группа высокого цитогенетического риска (ОР = 2,74; 95% ДИ: 0,99–7,57; p = 0,052), а для Т-ОЛЛ значимым остался положительный МОБ-статус на +70 день (ОР = 4,95; 95% ДИ: 1,64–14,91; p = 0,0045), а также ETP-вариант Т-ОЛЛ (ОР = 3,091; 95% ДИ: 0,959–9,966; p = 0,0467).
Обсуждение
В два последовательных проспективных многоцентровых исследования по лечению ОЛЛ взрослых — «ОЛЛ-2009» и «ОЛЛ-2016» — были включены 596 больных в возрасте от 18 до 55 лет (медиана — 32 года). Сравнение пятилетних ОВ и БРВ в каждом из этих исследований показало сопоставимые результаты. Пятилетняя ОВ и БРВ взрослых больных ОЛЛ составили для «ОЛЛ-2009» 59 и 63 %, а для «ОЛЛ-2016» — 64 и 59 % соответственно.
Оба протокола основаны на принципе низкодозного, но постоянного длительного воздействия с незначительной долей алло-ТГСК [3][6]. Большинство исследовательских групп в настоящее время используют так называемый «педиатрический» подход, подразумевая под этим применение курсов высокодозной многокомпонентной консолидации с метотрексатом, цитарабином в высоких дозах, интеграцией пегилированной аспарагиназы. Столь интенсивные программы лечения малореализуемы в условиях гематологических центров субъектов РФ, поэтому более 10 лет назад Российская исследовательская группа отказалась от такого варианта терапии. Однако если сравнить результаты лечения взрослых больных попротоколам «ОЛЛ-2009/ОЛЛ-2016» с результатами других исследований, то можно убедиться, что они вполне сопоставимы (табл. 4). Представленные в таблице 4 показатели демонстрируют 73–77 % трехлетнюю ОВ (у больных в возрасте до 45–50 лет) и 62–66 % БРВ [7–13]. При этом 5-летняя ОВ варьировала от 47 до 78 % (в зависимости от иммунофенотипа ОЛЛ), а БРВ — от 49 до 74 %. Многие исследования, в которых зафиксированы более высокие показатели выживаемости, включали именно больных в возрасте до 40–45 лет.
Таблица 4. Результаты крупных многоцентровых исследований по лечению взрослых больных Ph-негативными ОЛЛ
Table 4. Results of large multicenter studies on the treatment of adult patients with Ph-negative ALL
Исследование | Число больных, возраст, годы | ОВ / OS | БРВ / RFS | |||
3-летняя | 5-летняя | 3-летняя | 5-летняя | |||
GRAAL [7] | 423 | В-ОЛЛ | 79 % (СР / SR) | 77 % (СР / SR) | ||
T-ОЛЛ | 91 % (СР / SR) | 86 % (СР / SR) | ||||
Dana Faber (DFCI Adult ALL Consortium Protocol) [8] | 92 (18–50) | 67 % | 69 % | |||
NOPHO [9] | 221 (18–45) | 78 % | 74 % | |||
CALGB 10403 [10] | 295 (17–39) | 73 % | 64 % | 66 % | 56 % | |
NILG 10/07 [11] | 161 | В-ОЛЛ | 47 % | 49 % | ||
T-ОЛЛ | 73 % | 60 % | ||||
UKALL 14 [12] | 144 (Т-ОЛЛ / T-ALL) | 62 % | 55 % | |||
GMALL 08/2013 [13] | 770 | В-ОЛЛ | 77 % | |||
T-ОЛЛ | 74 % | |||||
ОЛЛ-2009 | 330 (18–55) | 63 % | 59 % | 68 % | 63 % | |
Примечание: В-ОЛЛ — В-клеточный острый лимфобластный лейкоз, T-ОЛЛ — Т-клеточный острый лимфобластный лейкоз, ОВ — общая выживаемость, БРВ — безрецидивная выживаемость, СР — стандартный риск, ВР — высокий риск.
Note: ВCP-ALL — B-cell precursor acute lymphoblastic leukemia, T-ALL — T-cell lymphoblastic leukemia, OS — overall survival, RFS — relapse-free survival, ST — standard risk, HR — high risk.
Исследование цитогенетических аберраций опухолевых клеток является необходимым диагностическим критерием для отнесения больных ОЛЛ к той или иной группе риска и, соответственно, позволяет определять общую терапевтическую стратегию на самых ранних этапах лечения. В настоящем исследовании, объединившем данные цитогенетического анализа у больных, которые получали лечение по двум протоколам, было сначала сформировано несколько подгрупп в зависимостиот выявления тех или иных хромосомных аномалий. Были выделены больные с нормальным кариотипом, с гиперплоидией, с гипоплоидией, с перестройками 11q23, t(1;19), комплексным кариотипом (более трех перестроек) и иные аномалии. При оценке пятилетней ОВ и БРВ у больных Т-ОЛЛ не было выявлено отличий в зависимости от обнаружения описанных изменений кариотипа, в то время как у больных В-ОЛЛ были получены значимые отличия между подгруппами, которые позволили в дальнейшем сформировать фактически всего две группы риска: стандартного (гиперплоидия, нормальный кариотип) и высокого (гипоплоидия, с перестройками 11q23, t(1;19), комплексным кариотипом (более трех перестроек), все иные аномалии). Пятилетняя ОВ у больных из групп стандартного и высокого риска составила 62 и 43 %, БРВ — 65 и 44 % соответственно. Французское исследование [7] представило вероятность пятилетней ОВ, равную 79 и 50 %, для больных В-ОЛЛ из группы стандартного и высокого риска соответственно. Пятилетняя БРВ у этих же больных составила 77 и 44 %. В этом исследовании, помимо цитогенетических аномалий, при формировании группы риска учитывали еще и показатели МОБ, что, несомненно, является более четким дискриминирующим фактором [7]. Если сопоставить результаты, полученные в настоящей работе, с данными крупнейшего американского ракового центра М.Д. Андерсона, в котором для больных ОЛЛ применяют протокол «HyperCVAD» в сочетании с различными таргетными препаратами (например, ритуксимабом), то выявляются значимые расхождения в пятилетней ОВ и БРВ у больных с нормальным кариотипом: 51 и 41 % в сравнении с 70 и 73 % при лечении по протоколам «ОЛЛ-2009/ОЛЛ-2016». При этом при гиперплоидном наборе хромосом и иных аномалиях (включая комплексный, перестройки MLL-гена и иные аберрации) результаты совпадают [14].
К сожалению, при проведении двух исследований проблемой, на которую неоднократно указывали [15], остается ранняя летальность (смерть в течение первых двух фаз индукции) — 8 %. При этом в зарубежных публикациях этот показатель редко превышает 5 %: 4,9 % — во французском «GRAAL-2003», 4 % — в немецком «GMALL 08/2013», 3 % — в американском «CALGB 10403», 1 % — в американском «DFCI Adult ALL Consortium Protocol», [7][8][10][13]. В ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России ранняя летальность в исследовании «ОЛЛ-2016» составила 0 %, то есть высокие показатели ранней летальности в настоящем исследовании полностью определяются региональными гематологическими центрами. Итогом этого становятся худшие ОВ и БРВ: в федеральных центрах при анализе данных объединенных исследований «ОЛЛ-2009/2016» ОВ и БРВ составили 62 и 64 %, а в региональных — 44 и 50 % соответственно (р < 0,0001; р = 0,0018). Более того, в мультивариантном анализе объединенных данных двух исследований при учете многих клинико-лабораторных параметров независимым фактором неблагоприятного прогноза для ОВ, помимо инициального лейкоцитоза и возраста, стал центр, где проводили лечение. Для вероятности развития рецидива центр, где проводили лечение, уже не являлся фактором риска. Имели независимое негативное значение старший возраст, инициальный лейкоцитоз и факт позднего достижения ПР (после двух фаз индукции). Эти негативные факторы риска (кроме центра, где проводили лечение) выделяли фактически все ранее выполняемые зарубежные исследования, когда в качестве параметров для анализа не использовались цитогенетические аномалии, МОБ-статус и ЕТР-вариант Т-ОЛЛ.
Рандомизированное исследование по оценке роли ауто-ТГСК у больных Т-ОЛЛ, выполненное в рамках «ОЛЛ-2016», показало, что такой вариант поздней консолидации не изменяет безрецидивного течения заболевания. Поэтому было принято решение в дальнейших исследованиях отказаться от этого подхода.
Для Т-ОЛЛ при анализе факторов прогноза был выделен ЕТР-вариант в качестве самого неблагоприятного, как в оценках ОВ, так и БРВ. Более того, в мультивариантном анализе ЕТР-вариант оказался независимым негативным прогностическим фактором и для развития рецидивов, причем очень ранних (6–12 мес. ПР). Этот факт не является новым, поскольку многие исследования указывали на вариант из ранних Т-клеточных предшественников как на самый неблагоприятный и на необходимость выполнения алло-ТГСК в первой ПР. Немецкая группа в ретроспективном анализе сообщила лишь о 37 % трехлетней ОВ у больных с ЕТР-ОЛЛ, которым проводили только химиотерапию, и о 74 % — у тех, кому выполнили алло-ТГСК (р = 0,006) [16]. Французские исследователи также подчеркивают, что без алло-ТГСК 5-летняя ОВ больных ЕТР-ОЛЛ значительно хуже (49,2 %), в сравнении с теми, кому алло-ТГСК была проведена (67,5 %, р = 0,02) [17]. Худшая 4-летняя ОВ у больных ЕТР была отмечена и испанской группой PETHEMA — 36 % (p = 0,037), по сравнению с 49 % у больных с другими вариантами Т-ОЛЛ [18]. В обзорной статье китайских авторов приводятся не только худшие результаты терапии ЕТР-варианта Т-ОЛЛ у взрослых, но и у детей, указывается на то, что для ЕТР-ОЛЛ свойствен замедленный клиренс МОБ, что необходимо выполнение алло-ТГСК в первой ПР, а также рассматриваются новые способы противоопухолевого воздействия [19].
В настоящее время все протоколы лечения больных ОЛЛ основаны на мониторинге МОБ, обнаружение которой в определенные дни протокола является ключевым для принятия решения о том, к какой группе риска отнести больного и, соответственно, как изменить тактику терапии (выполнение алло-ТГСК, включение моноклональных антител, таргетных препаратов). По результатам мониторинга МОБ в настоящем исследовании было показано, что МОБ-негативность быстрее достигается у больных Т-ОЛЛ по сравнению с В-ОЛЛ. Этот феномен был ранее отмечен и немецкими исследователями: к +71 дню лечения у 79 % больных Т-ОЛЛ была диагностирована молекулярная ремиссия (отсутствие МОБ) по сравнению с66 % у больных В-ОЛЛ (р = 0,001) [20]. При анализе долгосрочных результатов в зависимости от МОБ-статуса больных с Т-ОЛЛ и В-ОЛЛ на разных строках мониторинга в настоящем исследовании было показано, что ключевой дискриминирующей на группы риска точкой стал +70 день. Пятилетняя БРВ больных, у которых МОБ на +70 день не выявляли, была существенно выше (79 % при Т-ОЛЛ и 78 % при В-ОЛЛ), чем у больных, у которых обнаруживали резидуальные опухолевые клетки (20 % при Т-ОЛЛ и 23 % при В-ОЛЛ). Эта закономерность отмечена во всех клинических исследованиях по лечению взрослых больных ОЛЛ, в которых выполняли мониторинг МОБ и оценивали долгосрочные результаты в зависимости от значений МОБ в определенной временной точке, характерной для каждого конкретного протокола [7][10][11][20]. Ранее уже отмечалось, что несмотря на значимо меньшую интенсивность противоопухолевого воздействия при выполнении протокола «ОЛЛ-2016», клиренс МОБ при его использовании не отличается от результатов, полученных при применении более интенсивных протоколов, подразумевающих применение нескольких курсов высокодозной консолидации [21]. С учетом того, что и долгосрочные результаты российских исследований сопоставимы с зарубежными исследованиями, можно полагать, что принципиальное значение имеет химиочувствительность опухоли, определяемая на ранних сроках индукционной терапии (2 мес.), и дальнейшая интенсификация нецелесообразна.
Мультивариантный анализ, в котором учитывали и цитогенетические аномалии, и МОБ-статус, и ЕТР-вариант Т-ОЛЛ, был выполнен в настоящем исследовании только у больных, получавших лечение по протоколу «ОЛЛ-2016». По итогам этого анализа стало очевидным, что такие традиционные факторы риска, как инициальный лейкоцитоз, возраст старше 30 лет, позднее достижение ПР, а также и специфический российский фактор риска — центр, где осуществляли терапию, — утрачивают свою значимость. Ключевым фактором риска, фактором неблагоприятного прогноза для любого варианта ОЛЛ стало недостижение МОБ-негативности на момент завершения индукции (+70 день), что является универсальным маркером химиочувствительности опухолевых клеток.
По итогам выполненных исследований «ОЛЛ-2009» и «ОЛЛ-2016» был разработан новый исследовательский протокол «ОЛЛ-2016м». К основным изменениям в новом протоколе относятся: 1) исключение ауто-ТГСК как одного из курсов консолидации для Т-ОЛЛ/лимфобластной лимфомы; 2) применение препаратов таргетной терапии (один курс с блинатумомабом для В-ОЛЛ, трех курсов консолидации с венетоклаксом — для Т-ОЛЛ) у больных с персистенцией МОБ после окончания индукции (при достижении МОБ-негативного статуса всем больным продолжают терапию по протоколу, при персистенции МОБ — решение вопроса о алло-ТГСК); 3) включение венетоклакса в терапию первой линии при ETP-варианте T-ОЛЛ с последующим обязательным выполнением алло-ТГСК.
Таким образом, эффективность двух российских протоколов по лечению взрослых больных ОЛЛ в целом одинаковая, несмотря разные периоды времени их выполнения. Для В-ОЛЛ значимыми негативными факторами явились группа высокого цитогенетического риска (все аномалии за исключением гиперплоидии и нормального кариотипа) и положительный МОБ-статус на +70 день, а для Т-клеточных — «ЕТР»-иммунофенотип и положительный МОБ-статус на +70 день. Оценка МОБ-статуса на +70 день позволила выделить группу высокого риска развития рецидива и использовать новые таргетные воздействия, направленные на элиминацию МОБ.
Список литературы
1. Паровичникова Е.Н., Давидян Ю.Р., Исаев В.Г. и др. Итоги лечения острых лимфобластных лейкозов взрослых по протоколу ОЛЛ-2005 как основа для новых исследований. Терапевтический архив. 2009; 81(7): 8–15.
2. Паровичникова Е.Н., Троицкая В.В., Соколов А.Н. и др. Острые В-лимфобластные лейкозы взрослых: выводы из российского проспективного многоцентрового исследования ОЛЛ-2009. Терапевтический архив. 2017; 89(7): 10–7. DOI: 10.17116/terarkh201789710-17.
3. Паровичникова Е.Н., Соколов А.Н., Троицкая В.В. и др. Острые Ph-негативные лимфобластные лейкозы взрослых: факторы риска при использовании протокола ОЛЛ-2009. Терапевтический архив. 2016; 88(7): 15–24. DOI: 10.17116/terarkh201688715-24.
4. Паровичникова Е.Н., Троицкая В.В., Соколов А.Н. и др. Промежуточные результаты по лечению острых Ph-негативных лимфобластных лейкозов у взрослых больных (итоги российской исследовательской группы по лечению острых лимфобластных лейкозов (RALL)). Онкогематология. 2014; 9(3): 6–15. DOI: 10.17650/1818-8346-2014-9-3-6-15.
5. Паровичникова Е.Н., Троицкая В.В., Соколов А.Н. и др. Протокол лечения Рh-негативных острых лимфобластных лейкозов взрослых «ОЛЛ-2009», модифицированный в 2017 г. В кн: Алгоритмы диагностики и протоколы лечения заболеваний системы крови. М., 2018: 571–617.
6. Parovichnikova E., Troitskaya V., Sokolov A., et al. Can less intensive chemotherapy and an autotransplant cure adult T-cell acute lymphoblastic leukemia? Acta Haematol. 2020; 143(2): 131–9. DOI: 10.1159/000502435.
7. Beldjord K., Chevret S., Asnafi V., et al. Oncogenetics and minimal residual disease are independent outcome predictors in adult patients with acute lymphoblastic leukemia. Blood. 2014; 123(24): 3739–49. DOI: 10.1182/blood-2014-01-547695.
8. DeAngelo D.J., Stevenson K.E., Dahlberg S.E., et al. Long-term outcome of a pediatric-inspired regimen used for adults aged 18–50 years with newly diagnosed acute lymphoblastic leukemia Leukemia. 2015; 29(3): 526–34. DOI: 10.1038/leu.2014.229.
9. Toft N., Birgens H., Abrahamsson J., et al. Results of NOPHO ALL2008 treatment for patients aged 1–45 years with acute lymphoblastic leukemia. Leukemia. 2018; 32(3): 606–15; DOI: 10.1038/leu.2017.265.
10. Stock W., Luger S.M., Advani A.S., et al. A pediatric regimen for older adolescents and young adults with acute lymphoblastic leukemia: Results of CALGB 10403. Blood. 2019; 133(14): 1548–59. DOI: 10.1182/blood-2018-10-881961.
11. Bassan R., Pavoni C., Intermesoli T., et al. Updated risk-oriented strategy for acute lymphoblastic leukemia in adult patients 18–65 years: NILG ALL 10/07. Blood Cancer J. 2020; 10(11): 119. DOI: 10.1038/s41408-020-00383-2.
12. Rowntree C.J., Kirkwood A.A., Clifton-Hadley L., et al. First analysis of the UKALL14 randomized trial to determine whether the addition of nelarabine to standard chemotherapy improves event free survival in adults with T-cell acute lymphoblastic leukaemia (CRUK/09/006). Blood. 2021; 138(Suppl 1): 366. DOI: 10.1182/blood-2021-152355.
13. Goekbuget N., Stelljes M., Viardot A., et al. First results of the risk-adapted, MRD-stratified GMALL trial 08/2013 in 705 adults with newly diagnosed acute lymphoblastic leukemia/lymphoma (ALL/LBL). Blood. 2021; 138(Suppl 1): 362. DOI: 10.1182/blood-2021-146306.
14. Issa G.C., Kantarjian H.M., Yin C.C., et al. Prognostic impact of pretreatment cytogenetics in adult Philadelphia chromosome-negative acute lymphoblastic leukemia in the era of minimal residual disease. Cancer. 2017; 123(3): 459–67. DOI: 10.1002/cncr.30376.
15. Паровичникова Е.Н., Гармаева Т.Ц., Лазарева О.В. и др. Обоснование нового оперативного интегрального показателя для оценки качества и эффективности работы гематологической службы в субъектах Российской Федерации. Клиническая онкогематология. 2022; 15(1): 1–15. DOI: 10.21320/2500-2139-2022-15-1-1-15.
16. Neumann M., Coskun E., Fransecky L., et al. FLT3 mutations in early T-cell precursor ALL characterize a stem cell like leukemia and imply the clinical use of tyrosine kinase inhibitors. PLoS One. 2013; 8(1): e53190. DOI: 10.1371/journal.pone.0053190.
17. Bond J., Graux C., Lhermitte L., et al. Early response-based therapy stratification improves survival in adult early thymic precursor acute lymphoblastic leukemia: A group for research on adult acute lymphoblastic leukemia study. J Clin Oncol. 2017; 35(23): 2683–91. DOI: 10.1200/JCO.2016.71.8585.
18. Genesca E., Morgades M., Montesinos P., et al. Unique clinico-biological, genetic and prognostic features of adult early T-cell precursor acute lymphoblastic leukemia. Haematologica. 2020; 105(6): e294–7. DOI: 10.3324/haematol.2019.225078.
19. Sin C.F., Man P.M. Early T-cell precursor acute lymphoblastic leukemia: Diagnosis, updates in molecular pathogenesis, management, and novel therapies. Front Oncol. 2021; 11: 750789. DOI: 10.3389/fonc.2021.750789.
20. Gokbuget N., Kneba M., Raff T., et al. Adult patients with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies. Blood. 2012; 120(9): 1868–76. DOI: 10.1182/blood-2011-09-377713.
21. Гальцева И.В., Давыдова Ю.О., Паровичникова Е.Н. и др. Мониторинг минимальной остаточной болезни и В-клеточных субпопуляций у больных острым В-лимфобластным лейкозом, леченных по протоколу «ОЛЛ-2016». Гематология и трансфузиология. 2021; 66(2): 192–205.DOI: 10.35754/0234-5730-2021-66-2-192-205.
Об авторах
Е. Н. ПаровичниковаРоссия
Паровичникова Елена Николаевна, доктор медицинских наук, генеральный директор
125167, Москва
О. А. Алешина
Россия
Алешина Ольга Александровна, кандидат медицинских наук, заведующая отделением гематологии и химиотерапии острых лейкозов и лимфом
125167, Москва
В. В. Троицкая
Россия
Троицкая Вера Витальевна, кандидат медицинских наук, первый заместитель генерального директора центра по лечебной работе
125167, Москва
Ю. А. Чабаева
Россия
Чабаева Юлия Александровна, кандидат технических наук, старший научный сотрудник информационно-аналитического отдела
125167, Москва
А. Н. Соколов
Россия
Соколов Андрей Николаевич, кандидат медицинских наук, старший научный сотрудник отделения интенсивной высокодозной химиотерапии
гемобластозов и депрессий кроветворения с блоком трансплантации гемопоэтических стволовых клеток и костного мозга
125167, Москва
Г. А. Исинова
Россия
Исинова Галина Александровна, кандидат медицинских наук, гематолог отделения интенсивной высокодозной химиотерапии гемобластозов и депрессий кроветворения с блоком трансплантации гемопоэтических стволовых клеток и костного мозга
125167, Москва
Е. С. Котова
Россия
Котова Екатерина Сергеевна, гематолог дневного стационара онкологии и химиотерапии гемобластозов и депрессий кроветворения
125167, Москва
З. Х. Ахмерзаева
Россия
Ахмерзаева Залина Хатаевна, кандидат медицинских наук, гематолог отделения гематологии и химиотерапии острых лейкозов и лимфом
125167, Москва
Г. А. Клясова
Россия
Клясова Галина Александровна, доктор медицинских наук, профессор, заведующая отделом микробиологии и антимикробной терапии
125167, Москва
И. В. Гальцева
Россия
Гальцева Ирина Владимировна, кандидат медицинских наук, заведующая лабораторией иммунофенотипирования клеток крови и костного мозга
125167, Москва
Ю. О. Давыдова
Россия
Давыдова Юлия Олеговна, кандидат медицинский наук, врач клинической лабораторной диагностики научно-клинической лаборатории иммунофенотипирования клеток крови и костного мозга
125167, Москва
Л. А. Кузьмина
Россия
Кузьмина Лариса Анатольевна, кандидат медицинский наук, заведующая отделением химиотерапии гемобластозов и трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
С. Н. Бондаренко
Россия
Бондаренко Сергей Николаевич, доктор медицинских наук, доцент кафедры гематологии, трансфузиологии и трансплантологии с курсом детской онкологии ФПО имени профессора Б.В. Афанасьева
197022, Санкт-Петербург
О. Ю. Баранова
Россия
Баранова Ольга Юрьевна, кандидат медицинских наук, онколог отделения химиотерапии гемобластозов
115478, Москва
А. С. Антипова
Россия
Антипова Алина Сергеевна, кандидат медицинских наук, гематолог, онколог отделения химиотерапии гемобластозов отдела гематологии и трансплантации костного мозга и гемопоэтических стволовых клеток
115478, Москва
О. С. Самойлова
Россия
Самойлова Ольга Сергеевна, кандидат медицинских наук, заведующая гематологическим отделением, главный внештатный специалист гематолог-трансфузиолог Приволжского федерального округа
603126, Нижний Новгород
М. Е. Гришунина
Россия
Гришунина Мария Евгеньевна, гематолог
603126, Нижний Новгород
К. Д. Капланов
Россия
Капланов Камиль Даниялович, кандидат медицинских наук, заведующий гематологическим отделением № 11
125284, Москва
Т. С. Капорская
Россия
Капорская Татьяна Семеновна, заведующая отделением гематологии
664003, Иркутск
Т. С. Константинова
Россия
Константинова Татьяна Семеновна, кандидат медицинских наук, заведующая отделением гематологии, химиотерапии и ТКМ
620102, Екатеринбург
Ю. В. Свешникова
Россия
Свешникова Юлия Валентиновна, гематолог отделения гематологии, химиотерапии и трансплантации костного мозга
620102, Екатеринбург
Е. А. Борисенкова
Россия
Борисенкова Елена Александровна, заведующая отделением гематологии
248007, Калуга
Е. С. Фокина
Россия
Фокина Елена Сергеевна, кандидат медицинских наук, гематолог, заместитель начальника отдела организации и сопровождения научных исследований
610027, Киров
Н. В. Минаева
Россия
Минаева Наталья Викторовна, кандидат медицинских наук, заместитель директора по лечебной работе
610027, Киров
Е. Е. Зинина
Россия
Зинина Елена Евгеньевна, заведующая клинико-диагностическим (гематологическим) центром; главный внештатный гематолог департамента Здравоохранения Ханты-Мансийского автономного округа Югры
628408, Сургут
В. А. Лапин
Россия
Лапин Валерий Альбертович, гематолог
150062, Ярославль
Е. О. Грибанова
Россия
Грибанова Елена Олеговна, кандидат медицинских наук, заведующая отделением химиотерапии гематологических заболеваний
125167, Москва
Е. Е. Звонков
Россия
Звонков Евгений Евгеньевич, доктор медицинских наук, заведующий отделением гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
В. Н. Двирнык
Россия
Двирнык Валентина Николаевна, кандидат медицинских наук, заведующая отделением централизованной клинико-диагностической лаборатории
125167, Москва
Г. М. Галстян
Россия
Галстян Геннадий Мартинович, доктор медицинских наук, заведующий отделением реанимации и интенсивной терапии
125167, Москва
Т. Н. Обухова
Россия
Обухова Татьяна Никифоровна, кандидат медицинских наук, заведующая лабораторией кариологии
125167, Москва
А. Б. Судариков
Россия
Судариков Андрей Борисович, доктор биологических наук, заведующий лабораторией молекулярной гематологии
125167, Москва
С. М. Куликов
Россия
Куликов Сергей Михайлович, кандидат технических наук, заведующий информационно-аналитическим отделом
125167, Москва
Рецензия
Для цитирования:
Паровичникова Е.Н., Алешина О.А., Троицкая В.В., Чабаева Ю.А., Соколов А.Н., Исинова Г.А., Котова Е.С., Ахмерзаева З.Х., Клясова Г.А., Гальцева И.В., Давыдова Ю.О., Кузьмина Л.А., Бондаренко С.Н., Баранова О.Ю., Антипова А.С., Самойлова О.С., Гришунина М.Е., Капланов К.Д., Капорская Т.С., Константинова Т.С., Свешникова Ю.В., Борисенкова Е.А., Фокина Е.С., Минаева Н.В., Зинина Е.Е., Лапин В.А., Грибанова Е.О., Звонков Е.Е., Двирнык В.Н., Галстян Г.М., Обухова Т.Н., Судариков А.Б., Куликов С.М. Сравнение результатов лечения взрослых больных острыми Ph-негативными лимфобластными лейкозами по протоколам Российских многоцентровых исследований «ОЛЛ-2009» и «ОЛЛ-2016». Гематология и трансфузиология. 2022;67(4):460-477. https://doi.org/10.35754/0234-5730-2022-67-4-460-477
For citation:
Parovichnikova E.N., Aleshina O.A., Troitskaya V.V., Chabaeva Yu.A., Sokolov A.N., Isinova G.A., Kotova E.S., Akhmerzaeva Z.H., Klyasova G.A., Galtseva I.V., Davydova Yu.O., Kuzmina L.A., Bondarenko S.N., Baranova O.Yu., Antipova A.S., Samoilova O.S., Grishunina M.E., Kaplanov K.D., Kaporskaya T.S., Konstantinova T.S., Sveshnikova Yu.V., Borisenkova E.A., Fokina E.S., Minaeva N.V., Zinina E.E., Lapin V.A., Gribanova E.O., Zvonkov E.E., Dvirnyk V.N., Galstyan G.M., Obukhova T.N., Sudarikov A.B., Kulikov S.M. Comparison of the treatment results in adult patients with acute Ph-negative lymphoblastic leukemia on protocols of the Russian multicenter studies ALL-2009 and ALL-2016. Russian journal of hematology and transfusiology. 2022;67(4):460-477. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-460-477











































