Перейти к:
Цитокины в механизмах регуляции моноцитопоэза при ишемической болезни сердца
https://doi.org/10.35754/0234-5730-2022-67-4-511-524
Аннотация
Введение. Актуальным является изучение связи нарушения субпопуляционного состава моноцитов крови при ишемической кардиомиопатии (ИКМП) с изменениями моноцитопоэза, а также изучение влияния колониестимулирующего фактора макрофагов (М-КСФ) и цитокинов на дифференцировку моноцитов различных иммунофенотипов в костном мозге (КМ).
Цель – исследовать роль цитокинов в механизмах локальной и дистантной регуляции дифференцировки классических, промежуточных, неклассических и переходных моноцитов КМ в комплексе с содержанием VEGFR2+-моноцитов и гипоксией-индуцируемого фактора-1α (HIF-1α) в крови у больных ишемической болезнью сердца (ИБС) с ИКМП и без ИКМП.
Материалы и методы. Обследовано 74 больных ИБС с ИКМП и без ИКМП (30 и 44 человек соответственно). В образцах КМ определяли численность субпопуляций классических (CD14++CD16–), промежуточных (CD14++CD16+), неклассических (CD14+CD16++) и переходных (CD14+CD16–) моноцитов, а также CD14+VEGFR2+-моноцитов в крови и КМ методом проточной цитофлуориметрии; в КМ и крови – концентрации цитокинов: интерлейкинов (ИЛ) ИЛ-10, ИЛ-13, фактора некроза опухоли альфа (ФНО-α), интерферона гамма (ИФН-γ), М-КСФ, а также HIF-1α в крови методом иммуноферментного анализа.
Результаты. Содержание гемопоэтинов ИЛ-10, ИЛ-13, ФНО-α, М-КСФ в КМ, а также способность М-КСФ активировать ИЛ-13 и ингибировать дифференцировку классических моноцитов из переходных форм клеток были сопоставимы между группами больных ИБС. В крови у больных ИКМП концентрация ИЛ-10 была выше, а содержание HIF-1α и CD14+VEGFR2+-клеток ниже, чем при ИБС без ИКМП (ИЛ-10 – 30,00 (26,25–34,50) пг/мл против 24,0 (23,0–28,0) пг/мл, р < 0,05; HIF-1α – 0,040 (0,029–0,053) нг/мл против 0,063 (0,054–0,122) нг/мл, р < 0,05; CD14+VEGFR2+ – 7,00 (5,67–7,15) % против 7,80 (7,23–8,17) %, р < 0,05). Особенностью моноцитопоэза при ИКМП по сравнению с больными ИБС без ИКМП являлась высокая концентрация ИФН-γ в КМ и низкое соотношение М-КСФ/ИЛ-13 (соответственно 10,00 (0,65–18,23) и 0,02 (0–0,15) пг/мл, р < 0,001; 1,02 (0,41–2,00) и 9,00 (2,13–22,09), р < 0,05), в ассоциации со снижением количества классических, промежуточных моноцитов и увеличением количества переходных клеток в КМ у больных ИКМП относительно больных без ИКМП (соответственно 21,0 (19,5–23,0) и 47 (41–61,5) %, р < 0,001; 0,3 (0,0–1,2) и 18,5 (6,5–28,0) %, р < 0,01; 76,2 (73,0–78,5) и 30,5 (13,0–41,5) %, р < 0,001). В последнем случае М-КСФ служит локальным фактором моноцитопоэза, а ИФН-γ не оказывает на него значимого влияния; при ИКМП М-КСФ становится дистантным, а ИФН-γ – локальным гемопоэтином. Вне зависимости от клинической формы ИБС ИЛ-10 и ИЛ-13 являются дистантными гемопоэтинами, ФНО-α – локальным. Заключение. Увеличение концентрации ИФН-γ и низкое соотношение М-КСФ/ИЛ-13 в КМ, а также избыток ИЛ-10 и недостаток HIF-1α и CD14+VEGFR2+-клеток в крови при ИБС ассоциированы с угнетением дифференцировки зрелых форм моноцитов и развитием ИКМП.
Ключевые слова
Для цитирования:
Чумакова С.П., Уразова О.И., Денисенко О.А., Винс М.В., Шипулин В.М., Пряхин А.С., Невская К.В., Гладковская М.В., Чурина Е.Г. Цитокины в механизмах регуляции моноцитопоэза при ишемической болезни сердца. Гематология и трансфузиология. 2022;67(4):511-524. https://doi.org/10.35754/0234-5730-2022-67-4-511-524
For citation:
Chumakova S.P., Urazova O.I., Denisenko O.A., Vins M.V., Shipulin V.M., Pryakhin A.S., Nevskaya K.V., Gladkovskaya M.V., Churina E.G. Cytokines in the mechanisms of regulation of monocytopoiesis in ischemic heart disease. Russian journal of hematology and transfusiology. 2022;67(4):511-524. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-511-524
Введение
В настоящее время имеются сведения об иммунофенотипической и функциональной гетерогенности моноцитов крови. Большинство исследователей выделяют три субпопуляции моноцитов: классические, промежуточные и неклассические. Данная классификация основана на различиях в экспрессии на мембране моноцитарных клеток CD14- и CD16-молекул, кодирующих, соответственно, рецептор к липополисахариду и низкоаффинный гамма-рецептор к Fс-фрагменту комплемента (FCGR3) [1–3].
Классические моноциты CD14++CD16– являются наиболее многочисленной субпопуляцией в периферической крови и составляют до 90 % пула циркулирующих моноцитов [4]. Классические моноциты экспрессируют хемокиновые рецепторы (CCR1, CCR2, CCR5, CXCR1 и CXCR2). Наряду с этим CD14++CD16–-моноциты производят широкий диапазон цитокинов и хемокинов, в том числе интерлейкины (ИЛ) ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, фактор некроза опухоли альфа (ФНО-α) и CCL2 (C-C motif ligand 2 или моноцитарный хемоаттрактантный протеин-1) в ответ на стимуляцию липополисахаридом [5]. Более того, классические моноциты участвуют в противомикробной защите за счет активации миелопероксидазы, предшественника лизоцима C, кальций-связывающего белка S100 A9 (S100A9), белка RNASE3 (ribonuclease A family member 3) [6]. Анализ профиля экспрессии генов показал, что классические моноциты человека преимущественно экспрессируют гены, участвующие в ангиогенезе, заживлении ран и гемокоагуляции [4–6], неклассические — оказывают атеропротективное действие [7].
Промежуточные CD14++CD16+-моноциты обладают высоким воспалительным потенциалом и способны активно секретировать ФНО-α, ИЛ-1β, ИЛ-6 и CCL3 при стимуляции Toll-рецептора. A. Szaflarska и соавт. [1] описали противоопухолевый фенотип этих клеток. Кроме того, промежуточные моноциты характеризуются самой высокой экспрессией молекул главного комплекса гистосовместимости (МНС) класса II (HLA-DR) и ангиотензинпревращающего фермента (ACE; CD143), а также выраженной способностью стимулировать пролиферацию CD4+ Т-лимфоцитов [5].
Неклассические CD14+CD16++-моноциты продуцируют ИЛ-1β и ФНО-α в ответ на вирусы и иммунные комплексы с участием провоспалительного сигнального пути TLR7-TLR8-MyD88-MEK. CD14+CD16++-моноциты подвижны по своей природе и осуществляют «патрулирование» эндотелия путем перемещения по нему и устранения микрочастиц, погибших клеток, иммунных комплексов и вирусных частиц TLR-7-зависимым образом [1][4][8][9]. Неклассические моноциты способствуют образованию грануляционной ткани и сходны с тканевыми макрофагами низкой экспрессией CD11b и CD33 и функциональной активностью [5].
В исследованиях [10][11] показано наличие еще одной популяции моноцитов — «переходных» (CD14+CD16–), увеличение численности которых зарегистрировано у инфицированных вирусом иммунодефицита человека. Функциональное значение и происхождение этих клеток уточняются. Предполагают, что переходные моноциты отражают иммунную активацию и дифференцируются из классических моноцитов или же являются их предшественниками. Кроме того, описано наличие субпопуляции моноцитов, принадлежащих к прогениторным эндотелиальным клеткам и участвующих в ангиогенезе (CD14+VEGFR2+) [12].
Нарушения субпопуляционного состава моноцитов крови отмечены при заболеваниях различных органов и систем [1][6][13]. Повышение численности промежуточных моноцитов обнаруживается при бактериальном сепсисе, болезни Крона, лихорадке Денге и ревматоидном артрите. Увеличение численности неклассических моноцитов выявлено у больных с хронической обструктивной болезнью легких, уменьшение — у лиц, перенесших инсульт [2][14]. При туберкулезе легких обнаружено увеличение численности промежуточных моноцитов и уменьшение доли переходных клеток [15]. У взрослых людей с ожирением содержание промежуточных и неклассических моноцитов в крови увеличено [16]. H. S. Schipper и соавт. [17] выявили корреляцию индекса массы тела с содержанием классических и промежуточных моноцитов в крови у детей с ожирением. В исследованиях субпопуляционного состава моноцитов при онкологических заболеваниях выявлено увеличение количества промежуточных и неклассических моноцитов при раке желудка и толстого кишечника; при почечно-клеточном раке отмечается увеличение доли неклассических моноцитов [18][19]. При хроническом миеломоноцитарном лейкозе установлено увеличение доли классических моноцитов на фоне уменьшения численности промежуточных и неклассических форм в крови [20].
Одними из наиболее распространенных патологий, в патогенезе которых моноциты/макрофаги принимают участие, являются ишемическая болезнь сердца (ИБС) и атеросклероз [1]. В связи с наличием нескольких клинических вариантов течения ИБС не всегда изменения субпопуляционного состава моноцитов единообразны при различных ее формах. При стабильной стенокардии в результате атеросклероза коронарных артерий повышается содержание моноцитов промежуточной субпопуляции в крови [21], при инфаркте миокарда — уменьшается число классических клеток, поскольку они первыми мигрируют в зону инфаркта, на фоне некоторого увеличения доли промежуточных и неклассических моноцитов в крови, накопление которых в миокарде отмечается только через несколько суток [22]. При стресс-индуцированной кардиомиопатии выявлено увеличение количества классических моноцитов на фоне уменьшения промежуточных и неклассических форм [23]. Наиболее тяжелой хронической формой ИБС с выраженной сердечной недостаточностью является ишемическая кардиомиопатия (ИКМП), патогенез которой окончательно не изучен [24][25]. Предполагается, что, с одной стороны, особенности субпопуляционного состава моноцитов крови могут влиять на атерогенез и развитие ИКМП. С другой стороны, гипоксия при ИКМП может влиять на дифференцировку моноцитов, модулируя цитокиновый профиль крови икостного мозга (КМ) [25][26]. При ИБС в крови отмечается избыток ФНО-α [24][27], при сердечной недостаточности — дефицит интерферона гамма (ИФН-γ) [28], а при ИКМП — избыток ИЛ-10 [29], что указывает на супрессию клеточного звена иммунитета. Содержание противовоспалительного цитокина ИЛ-13 в крови при ИБС до сих пор не определено. В отдельных исследованиях установлено увеличение концентрации ИЛ-13 в крови больных с хронической сердечной недостаточностью, в то же время у больных острым инфарктом миокарда наблюдается значительно более низкие плазменные концентрации ИЛ-13 по сравнению с нормой. ИЛ-13 усиливает поляризацию дифференцировки макрофагов в клетки типа М2, может уменьшать как инфильтрацию сердца Т-лимфоцитами, так и активацию Т-лимфоцитов в селезенке, а также влиять на выработку ИФН-γ и ИЛ-17, снижать секрецию ИЛ-1β и ИЛ-18, предотвращать липополисахарид-зависимую активацию каспазы-1 в моноцитах [30][31]. На баланс цитокинов и субпопуляций моноцитов в крови влияет характер гипоксии, регулирующей синтез гипоксией-индуцируемых факторов (hypoxia-inducible factors, HIF). В ответ на быстрое уменьшение оксигенации тканей во всех клетках организма возрастает продукция HIF-1α, после нескольких эпизодов гипоксии тканей она нормализуется [32], а при хронической гипоксии синтез HIF переключается с HIF-1 на HIF-2. При наличии общей субъединицы HIF-β они содержат HIF-1α и HIF-2α соответственно. Последний запускает долговременную адаптацию организма к гипоксии: активирует ангиогенез и ремоделирование тканей [33][34].
Сведения о нарушениях цитокиновой продукции и субпопуляционного состава моноцитов крови при ИБС и сердечной недостаточности позволяют предположить, что дисбаланс цитокинового профиля крови влияет на дифференцировку моноцитов. В кровь из КМ поступают классические моноциты, которые затем дифференцируются в промежуточные клетки и мигрируют в ткани, где дифференцируются в макрофаги. Последние, являясь рециркулирующими клетками, возвращаются с током лимфы в кровоток в виде неклассических моноцитов [35]. Нет данных о том, что дифференцировка моноцитов на субпопуляции, различающиеся по экспрессии CD14 и CD16, протекает только экстрамедуллярно и не реализуется в КМ. Информация о субпопуляционном составе моноцитов КМ как у больных, так и у здоровых лиц в литературе отсутствует. Неизвестно, как влияют цитокины крови на их содержание в КМ и какие цитокины реализуют механизмы дистантной и локальной регуляции моноцитопоэза. Изучение этих взаимосвязей у человека затруднительно ввиду сложности выполнения пункции КМ, которая здоровым лицам не проводится, а больным назначается при тяжелых гематологических заболеваниях, которые сопровождаются нарушениями гемопоэза. В этом аспекте информативным может оказаться сравнительный анализ цитокинового фона и субпопуляционного состава моноцитов в крови с таковым в КМ у хирургических больных с негематологическими заболеваниями, у которых взятие КМ осуществляется во время операции при разрезе грудины во время стернотомии. Сопоставление подобных результатов у больных с различными формами хронической ИБС и гипоксией на фоне хронической сердечной недостаточности (ИКМП, стенокардия без ИКМП) позволит ответить на вопрос, связано ли нарушение субпопуляционного состава моноцитов крови при ИКМП с изменениями моноцитопоэза или реализуется только экстрамедуллярно, и ассоциировано ли оно с характером гуморального ответа организма на гипоксию (по HIF-1). Ответ на этот вопрос поможет уточнить патогенез заболевания. Учитывая важную роль колониестимулирующего фактора макрофагов (M-КСФ) в моноцитопоэзе [36], актуальным является изучение влияния M-КСФ и цитокинов ФНО-α, ИФН-γ, ИЛ-10, ИЛ-13 на дифференцировку моноцитов различных иммунофенотипов в КМ в ассоциации с анализом экспрессии HIF-1 при ИБС, осложненной и неосложненной ИКМП.
Цель настоящей работы — исследование роли цитокинов в механизмах локальной и дистантной регуляции дифференцировки классических, промежуточных, неклассических и переходных моноцитов КМ в комплексе с содержанием VEGFR2+-моноцитов и HIF-1α в крови больных ИБС с ИКМП и без ИКМП.
Материалы и методы
В исследование были включены 74 больных c ИБС со стенокардией напряжения II–IV функционального класса и недостаточностью кровообращения II–III класса по NYHA, страдающих ИКМП (27 мужчин и 3 женщины, возраст — 61,0 (56,0–64,0) года) и без ИКМП (36 мужчин и 8 женщин, возраст — 64,0 (59,5–68,0) года), имеющих инфаркт миокарда в анамнезе. Всем больным на базе отделения сердечно-сосудистой хирургии НИИ кардиологии ФГБНУ «Томский национальный исследовательский медицинский центр Российской академии наук» (НИИ кардиологии Томского НИМЦ) выполнялась операция коронарного шунтирования в сочетании с реконструкцией полости левого желудочка в условиях искусственного кровообращения. Критериями диагностики ИКМП являлись: фракция выброса левого желудочка ≤ 40 %, острый инфаркт миокарда или реваскуляризация в анамнезе, стеноз ≥ 75 % левой основной или проксимальной части левой нисходящей артерии или ≥ 75 % стеноз двух или более эпикардиальных сосудов [37]. По данным эхокардиографии, больные ИКМП характеризовались достоверно меньшим систолическим индексом левого желудочка (14,58 (13,00–15,83) мл/м2) при большем значении массы его миокарда (233,5 (222,3–265,3) г) и диастолического индекса левого желудочка (80,93 (72,16–101,2) мл/м2) относительно больных ИБС без ИКМП (соответственно 30,47 (25,54–34,33) мл/м2, р < 0,001; 187,5 (142,8–215,0) г,р < 0,001; 18,07 (14,60–27,05) мл/м2, р < 0,001). Встречаемость больных с различными функциональными классами недостаточности кровообращения по NYHA составила среди больных ИБС без ИКМП I 9,09 %, со II классом — 40,91 %, с III — 50,00 %, а среди больных ИКМП — соответственно 6,67 % (р = 0,840), 63,33 % (р = 0,187) и 30,00 % (р = 0,240). На дооперационном этапе больным ИБС обеих групп исследования проводили сходное лечение лекарственными средствами: антиангинальная терапия с применением нитратов пролонгированного действия, бета1-адреноблокаторов, блокаторов Ca2+-каналов, коррекция гемостаза путем назначения антиагрегантов и коррекция липидного обмена с использованием статинов. Премедикацию и индукцию в наркоз больным обеих групп исследования проводили аналогичным образом с использованием седативных и наркозных средств, наркотических анальгетиков и миорелаксантов (диазепама, кетамина, фентанила, тримеперидина, пипекурония) в сопоставимых дозах.
Критериями исключения больных из исследования считали наличие аутоиммунных заболеваний, аллергического процесса в стадии обострения, опухолевого процесса, гипопластической, В12- или фолиеводефицитной анемий, лейкозов и других гематологических заболеваний и синдромов, хронических инфекций (вирусных гепатитов, сифилиса, ВИЧ-инфекции), проведение до операции курсов лечения железосодержащими препаратами, эритропоэтиновой или иммуносупрессивной терапиии наличие острых инфекционных заболеваний менее чем за 3 недели до операции, а также отказ больного от исследования.
Непосредственно перед операцией у всех обследованных больных ИБС с ИКМП и без ИКМП производили забор периферической крови из локтевой вены. Во время операции после получения доступа к сердцу путем срединной стернотомии и до начала искусственного кровообращения осуществлялся забор КМ из разреза грудины. В образцах КМ у больных обеих групп определяли численность субпопуляций классических (CD14++CD16–), промежуточных (CD14++CD16+), неклассических (CD14+CD16++) и переходных (CD14+CD16–) моноцитов методом проточной цитофлуориметрии, принимая за 100 % все клетки, положительные по CD14. Для идентификации моноцитов использовали моноклональные антитела CD14-FITC, CD16-PE и VEGFR2(KDR; CD309)-Alexa Fluor 647 («BD Biosciens», США) и лизирующий раствор («BD Biosciens», США) согласно методике, изложенной в инструкциях производителя.
Плазму крови и миелоплазму (надосадок КМ) больных получали путем центрифугирования соответствующего биоматериала при 200 g, консервировали и хранили при температуре –80 °С. Концентрации ФНО-α, ИФН-γ, ИЛ-10, ИЛ-13, М-КСФи HIF-1α определяли с помощью коммерческих наборов для иммуноферментного анализа «альфа-TNF-ИФА-БЕСТ», «гамма-IFN-ИФА-БЕСТ», «IL-10-ИФА-БЕСТ» производства АО «Вектор-БЕСТ» (г. Новосибирск), «Human IL-13 Platinum ELISA» («eBioscience», Австрия), «RayBio Human M-CSF ELISA Kit» («RayBiotech», США), «Human HIF-1alpha ELISA Kit» («Clou-Clone-Corp», США).
Статистический анализ. Для статистического описания результатов исследования вычисляли медиану (Ме), межквартильный интервал (МКИ). Ввиду малочисленности выборок и несоответствия распределения выборочных данных нормальному закону применяли непараметрические методы статистического анализа. С целью проверки нулевой гипотезы при сравнении независимых выборок использовали критерий Манна—Уитни. Для оценки взаимосвязей между исследуемыми показателями рассчитывали коэффициент корреляции Спирмена. Результаты считали статистически значимыми при уровне р менее 0,05.
Результаты
Анализ субпопуляционного состава моноцитов в КМ показал, что содержание переходных (CD14+CD16–) их форм в медуллярной ткани у больных ИКМП превышал, а классических (CD14++CD16–) и промежуточных (CD14++CD16+) клеток — не достигал показателей у больных ИБС без ИКМП (рис. 1). Численность неклассических моноцитов (CD14+CD16++) в КМ была сопоставимой между группами больных ИБС, проявляя тенденцию к их снижению у больных ИКМП. Преобладающими субпопуляциями моноцитов в КМ у больных ИБС без ИКМП были классические и переходные клетки, в то время как у больных ИКМП — исключительно переходные клетки (рис. 1). В обеих группах больных ИБС регистрировалась отрицательная связь численности переходных моноцитов с долей классических клеток (r = –0,69; p < 0,01 и r = –0,72; p < 0,01 у больных с ИКМП и без ИКМП соответственно), а у больных ИБС без ИКМП — еще и с количеством промежуточных моноцитов (r = –0,54; p < 0,05).
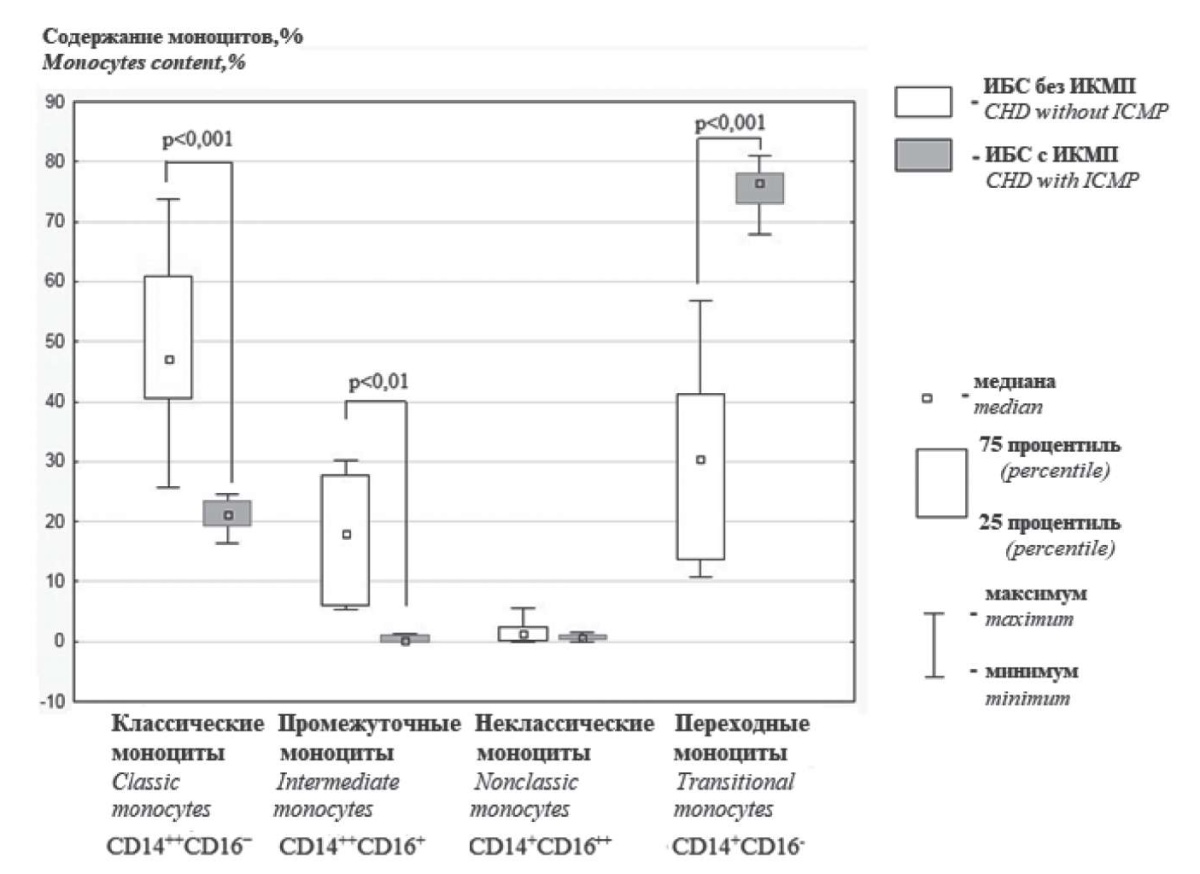
Рисунок 1. Субпопуляционный состав моноцитов костного мозга у больных ИБС с ИКМП и без ИКМП
Примечание. ИБС — ишемическая болезнь сердца, ИКМП — ишемическая кардиомиопатия, р — уровень статистической значимости различий показателей между группами больных.
Figure 1. Subpopulation composition of bone marrow monocytes in IHD patients with and without ICMP
Note. IHD — ischemic heart disease, ICMP — ischemic cardiomyopathy, p — the level of statistical significance of differences in indicators between groups of patients.
Численность CD14+VEGFR2+-клеток среди всех моноцитов крови у больных ИКМП была меньшей, чем у больных ИБС без ИКМП (соответственно 7,00 (5,67–7,15) и 7,80 (7,23–8,17) %, р < 0,05). При этом содержание CD14+VEGFR2+-клеток в КМ было сопоставимым с их количеством в крови вне зависимости от наличия или отсутствия ИКМП (соответственно 7,29 (6,85–8,48) %, р < 0,05 и 7,23 (5,49–8,07) %, р < 0,05) и не различалось между группами больных.
Содержание цитокинов в КМ у больных ИБС обеих групп исследования не различалось, за исключением ИФН-γ, концентрация которого у больных ИКМП оказалась многократно выше, чем у больных ИБС без ИКМП. Для остальных измеряемых цитокинов были характерны тенденции к изменениям: к увеличению содержания ИЛ-10 и ИЛ-13, ФНО-α и к снижению концентрации М-КСФ в КМ у больных ИКМП относительно их медуллярной концентрации у больных ИБС без ИКМП. В крови у больных ИКМП отмечалась достоверно большая концентрация ИЛ-10 и отчетливая тенденция к снижению содержания М-КСФ по сравнению со значениями аналогичных показателей у больных ИБС без ИКМП. У больных ИКМП в крови обнаруживалась меньшая, чем у больных ИБС без ИКМП, концентрация HIF-1α (табл.).
Таблица. Концентрации цитокинов в КМ и крови и HIF-1α в крови у больных ИБС с ИКМП и без ИКМП, Me (МКИ)
Table. The concentration of cytokines (in the bone marrow and in the blood) and hypoxia-induced factors (in the blood) in CHD patients with and without ICMP, Me (IQR)
Содержание медиаторов | Больные ИБС без ИКМП | Больные ИБС с ИКМП | ||
Костный мозг | Кровь | Костный мозг | Кровь | |
ФНО-α, пг/мл | 10,80 (9,90–21,84) | 1,16 (0,90–1,82) | 18,06 (14,15–19,40) | 2,08 (1,04–3,60) |
ИФН-γ, пг/мл | 0,02 (0–0,15) | 0 | 10,00 (0,65–18,23) | 0 |
ИЛ-10, пг/мл | 22,75 (21,0–26,0) | 24,0 (23,0–28,0) | 26,0 (22,5–27,0) | 30,00 (26,25–34,50) |
ИЛ-13, пг/мл | 1,00 (0,80–1,23) | 0,60 (0,41–0,82) | 1,22 (0,80–2,41) | 0,82 (0,40–0,95) |
М-КСФ, пг/мл | 7,16 (3,45–16,33) | 0,40 (0,12–2,37) | 3,22 (1,20–8,04) | 2,00 (1,21–3,24) |
Коэффициент М-КСФ/ИЛ-13 | 9,00 (2,13–22,09) | – | 1,02 (0,41–2,00) | – |
HIF-1α, нг/мл | – | 0,063 (0,054–0,122) | – | 0,040 (0,029–0,053) |
Примечание. ИБС — ишемическая болезнь сердца, ИКМП — ишемическая кардиомиопатия, ФНО-α — фактор некроза опухоли альфа, ИФН-γ — интерферон-гамма, ИЛ — интерлейкин, М-КСФ — колониестимулирующий фактор макрофагов, HIF — гипоксией-индуцируемый фактор, р1 — уровень статистической значимости различий показателей по сравнению с содержанием цитокина в костном мозге, р2 — у больных ИБС.
Note. CHD — coronary heart disease, ICMP — ischemic cardiomyopathy, TNF-α — tumor necrosis factor alpha, IFN-γ — interferon gamma, IL — interleukin, M-CSF — macrophage colony-stimulating factor, HIF — hypoxia-inducible factor, p1 — the level of statistical significance of the differences in indicators compared with the cytokine content in the bone marrow, p2 — in patients with coronary artery disease.
Несмотря на высокую концентрацию ИФН-γ в КМ у больных с ИКМП, линейных взаимосвязей содержания данного цитокина с численностью субпопуляций моноцитов в КМ у этой группы больных не установлено. Концентрация М-КСФ в КМу больных ИБС без ИКМП положительно коррелировала с концентрацией ФНО-α (r = 0,60; p < 0,01) и ИФН-γ (r = 0,72; p < 0,05). У больных ИКМП эти связи отсутствовали, и определялась только одна корреляция между концентрациями М-КСФ и ИЛ-13 (r = 0,72; p < 0,01) в КМ. У больных ИБС без ИКМП относительно невысокие концентрации в КМ ФНО-α и ИФН-γ (относительно больных ИКМП) сочетались с более высоким содержанием в КМ М-КСФ (в 2 раза больше, чем при ИКМП) (табл.).
Внутригрупповые взаимосвязи между концентрацией цитокинов и содержанием различных субпопуляций моноцитов в КМ у больных ИБС с ИКМП и без ИКМП не обнаружены. Ввиду этого корреляционный анализ был проведен в объединенной выборке всех больных ИБС, как с ИКМП, так и без нее. Концентрация ИЛ-13 в КМ позитивно коррелировала с численностью переходных моноцитов (r = 0,60; p < 0,05) и отрицательно – с долей классических клеток (r = –0,53;p < 0,05), а содержание М-КСФ положительно коррелировало с долей классических (r = 0,52; p < 0,05) и отрицательно — с количеством переходных (r = –0,52; p < 0,05) моноцитов (рис. 2). В объединенной выборке больных ИБС определялась негативная корреляция доли переходных моноцитов в КМ с численностью классических и промежуточных клеток (r = –0,95; p < 0,001 и r = –0,64; p < 0,05 соответственно) (рис. 2).
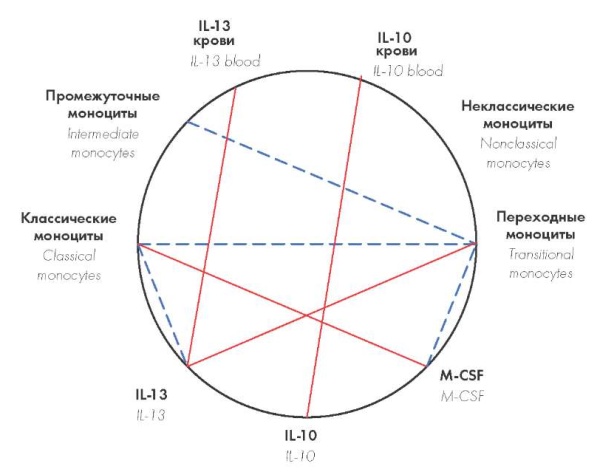
Рисунок 2. Данные корреляционного анализа показателей субпопуляционного состава моноцитов костного мозга, концентрации цитокинов в костном мозге и в крови у больных ИБС вне зависимости от наличия ИКМП
Примечание. Сплошная линия — положительная корреляция, пунктирная — отрицательная.
Figure 2. Data of comparative and correlation analysis of indicators of subpopulation composition of bone marrow monocytes, concentration cytokines in the bone marrow and blood in patients with IHD, regardless of ischemic cardiomyopathy
Note. IL — interleukin, M-CSF — macrophage colony-stimulating factor, solid line — positive correlation, dotted — negative one.
Содержание М-КСФ и ИЛ-13 в КМ у больных ИБС в зависимости от наличия ИКМП не различалось, но тенденции к их изменению у больных обеих групп были разнонаправленными. Учитывая этот факт и противоположные эффекты М-КСФ иИЛ-13 на моноцитопоэз, был произведен расчет коэффициента М-КСФ/ИЛ-13, отражающего соотношение концентраций в КМ цитокинов разного типа действия — М-КСФ, активирующего моноцитопоэз, и ИЛ-13, угнетающего моноцитопоэз. Величина коэффициента М-КСФ/ИЛ-13 у больных ИБС без ИКМП была в 9 раз больше, чем у больных ИКМП (табл.).
С целью определения локальных и дистантных медиаторов цитокин-зависимой регуляции моноцитопоэза проведен сравнительный анализ концентрации исследуемых цитокинов в КМ и в крови. В обеих группах больных ИБС концентрация ФНО-α в КМ была больше, чем в крови, в то время как содержание ИЛ-10 и ИЛ-13 в КМ и крови у них было сопоставимым (табл.). Наряду с этим имелись и некоторые отличительные закономерности. У больных без ИКМП костномозговая концентрация М-КСФ была выше его плазменной концентрации при крайне низком содержании ИФН-γ в КМ и его отсутствии в крови. У больных ИКМП, наоборот, содержание М-КСФ в КМ и крови не различалось, в то время как содержание ИФН-γ в КМ оказался выше, чем у больных ИБС без ИКМП. В то же время межгрупповых различий по концентрации ИЛ-13, ФНО-α, ИФН-γ и M-КСФ в крови между больными ИБС с ИКМП и без ИКМП выявлено не было (табл.).
Информативность результатов корреляционного анализа между концентрациями цитокинов в КМ и в крови тоже оказалась выше в объединенной выборке больных ИБС вне зависимости от наличия ИКМП. Концентрации ИЛ-10 и ИЛ-13 в КМ у больных положительно коррелировали с его концентрациями в крови (соответственно r = 0,59, p < 0,001 и r = 0,78, p < 0,001) (рис. 2), тогда как для ФНО-α и М-КСФ подобные связи не определялись, а корреляционный анализ для ИФН-γ был невозможен ввиду нулевых значений его концентрации в крови (табл.).
Обсуждение
Иммунофенотипирование моноцитов у больных ИБС выявило существенные отличия их субпопуляционного состава в КМ в численности классических, промежуточных и переходных форм в зависимости от наличия ИКМП. Преобладающими субпопуляциями моноцитов в КМ у больных ИБС без ИКМП оказались классические и переходные клетки, в то время как у больных ИКМП — исключительно переходные клетки (рис. 1). В обеих группах больных ИБС регистрировалась отрицательная связь численности переходных моноцитов с долей классических клеток, а у больных ИБС без ИКМП — еще и с количеством промежуточных моноцитов, свидетельствуя о взаимопревращении этих клеток при созревании. Учитывая, что доля переходных клеток в КМ у больных ИБС превышает таковую в крови, а классических и промежуточных моноцитов — напротив, не достигает их числа в циркуляции [26], переходные моноциты являются предшественниками классических и промежуточных клеток, а не их производными. У больных ИКМП данный процесс нарушен и более зрелые формы моноцитов в КМ не образуются.
Дифференцировка неклассических моноцитов осуществляется экстрамедуллярно, поскольку численность этих клеток у больных ИБС без ИКМП и с ИКМП в КМ не коррелировала с количеством других субпопуляций моноцитов, проявляя тенденцию к их снижению у больных ИКМП (рис. 1), и была выше в крови, чем в КМ [26]. Это согласуется с выявленным ранее дефицитом неклассических моноцитов в крови при ИКМП [29] и отражает нарушение их образования или миграции макрофагов из тканей в кровь у этих больных. Неклассические моноциты обеспечивают элиминацию погибших клеток, патогенов и окисленных липидов с поверхности сосудистой стенки [1]. Учитывая наличие атеросклеротического поражения коронарных артерий как при ИБС без ИКМП, так и при ИКМП [38], установленные в настоящей работе различия субпопуляционного состава моноцитов КМ у больных ИБС в зависимости от ИКМП можно рассматривать как дисфункцию моноцитопоэза в условиях атеросклероза и гипоксии. Ввиду протективной для сосудов роли неклассических (наиболее дифференцированных форм) моноцитов их недостаточность при атеросклерозе может предрасполагать к фиксации липидов в стенке самых мелких коронарных артерий и формированию диффузной ишемии миокарда с развитием ИКМП [29].
Незначительное повышение содержания клеток CD14+VEGFR2+ в крови у больных ИКМП относительно их количества у больных ИБС без ИКМП также может способствовать более распространенному гипоксическому поражению миокарда при ИКМП, затрудняя репарацию сосудистой стенки и формирование коллатерального кровотока. Увеличение численности CD14+VEGFR2+-клеток в крови является компенсаторной реакцией в ответ на повреждение сосудов при атеросклерозе и на циркуляторную гипоксию вследствие сердечной недостаточности [12]. Сопоставимость доли CD14+VEGFR2+-клеток в КМ между когортами больных при меньшем, чем у больных ИБС без ИКМП, их содержании в крови у больных ИКМП позволяет предположить нарушение миграции CD14+VEGFR2+-клеток в кровоток у больных ИКМП в отсутствие нарушения их генерации в КМ.
Содержание цитокинов в КМ у больных ИБС обеих групп исследования не различалось, за исключением ИФН-γ, концентрация которого у больных ИКМП оказалась многократно выше, чем у больных ИБС без ИКМП (табл.). Источником этого цитокина могут быть Т-лимфоциты-хелперы типа 1 (Th1), цитотоксические Т-лимфоциты, натуральные киллеры (NK) и иммуносупрессорные регуляторные Т-лимфоциты (Treg) [39], которые присутствуют во многих тканях, включая КМ. Имеются сведения об активации Treg, экспрессирующих ИФН-γ, при экспериментальной ИКМП у мышей [24]. Для остальных измеряемых цитокинов была характерна тенденция к увеличению содержания ИЛ-10 и ИЛ-13, ФНО-α и к снижению концентрации M-КСФ в КМ у больных ИКМП относительно их концентрации в КМ у больных ИБС без ИКМП (табл.). Подобные девиации цитокинового фона (за исключением некоторого повышения концентрации ФНО-α в КМ и в крови) также свидетельствуют в пользу иммуносупрессии при ИКМП. Последняя, по данным анализа содержания цитокинов в периферической крови, подтверждалась достоверно большей концентрацией ИЛ-10 и отчетливой тенденцией к меньшему содержанию M-КСФ в крови у больных ИКМП, чем у больных ИБС без ИКМП (табл.).
При хронической гипоксии синтез HIF переключается с HIF-1α на HIF-2α, который инициирует не только долговременную адаптацию организма к гипоксии, но и иммуносупрессию [33][34]. Именно для больных ИКМП был характерен недостаток HIF-1α относительно его содержания у больных ИБС без ИКМП (табл.). Дефицит HIF-1 в лимфоцитах растормаживает созревание регуляторных Foxp3+-Т-клеток (Тreg) [40]. Вероятно, эти клетки, продуцируя избыток ИФН-γ в КМ у больных ИБС с ИКМП, подавляют моноцитопоэз. Существуют данные, что ИФН-γ снижает митотическую активность гемопоэтических стволовых клеток и способствуют их апоптозу [41]. Не исключено, что ИФН-γ может угнетать дифференцировку более зрелых форм моноцитов — классических и промежуточных клеток. Это объясняет ассоциацию высокой медуллярной концентрации ИФН-γ с низким содержанием этих клеток в КМ у больных ИКМП (рис. 1, табл.).
Несмотря на высокую концентрацию ИФН-γ в КМ у больных с ИКМП, прямых взаимосвязей содержания данного цитокина с численностью субпопуляций моноцитов в КМ у этой группы больных не установлено. Вероятно, влияние ИФН-γ намоноцитопоэз является опосредованным, о чем свидетельствуют результаты корреляционного анализа между содержанием M-КСФ как специфического индуктора моноцитопоэза [42] и других цитокинов в КМ: при ИБС без кардиомиопатии концентрация M-КСФ в КМ оказалась положительно взаимосвязанной с концентрациями ФНО-α и ИФН-γ, а при ИКМП содержание M-КСФ положительно коррелировало с концентрацией ИЛ-13 в КМ. Сопоставляя данные измерений содержания цитокинов в КМ и результаты корреляционного анализа, можно заключить, что у больных ИБС без ИКМП невысокие концентрации в КМ ФНО-α и ИФН-γ относительно таковых у больных ИКМП сочетаются с более активной секрецией M-КСФ, концентрация которого в КМ была в 2 раза больше, чем при ИКМП (табл.). Такие реципрокные изменения обусловлены взаимопотенцирующим влиянием данных цитокинов на синтез М-КСФ. По-видимому, у больных ИКМП высокое содержание ИФН-γ разобщает влияние на секрецию М-КСФ индукторов его образования, т. е. избыток ИФН-γ оказывает негативное влияние на костномозговую дифференцировку классических и промежуточных моноцитов опосредованно через нарушение цитокин-зависимой регуляции секреции M-КСФ.
По данным корреляционного анализа, в объединенной выборке всех больных ИБС, как с ИКМП, концентрация ИЛ-13 в КМ позитивно коррелировала с численностью переходных моноцитов и отрицательно — с долей классических клеток; содержание М-КСФ, напротив, было положительно взаимосвязанным с долей классических и отрицательно — с количеством переходных моноцитов; доля переходных моноцитов — с численностью классических и промежуточных клеток (рис. 2). Содержание ИЛ-10 в КМ не коррелировало с численностью какой-либо из субпопуляций моноцитов, однако, как было установлено ранее [29], в крови оно было обратно пропорционально связано с долей неклассических моноцитов у больных ИБС вне зависимости от наличия ИКМП. Сопоставляя эти данные, можно заключить, что М-КСФ способствует медуллярной дифференцировке переходных моноцитов в классические клетки, ИЛ-13 тормозит этот процесс в КМ, а ИЛ-10 препятствует созреванию неклассических моноцитов экстрамедуллярно.
Несмотря на обсуждаемую роль М-КСФ и ИЛ-13 в дифференцировке моноцитов различных субтипов, содержание этих цитокинов в КМ у больных ИБС в зависимости от наличия ИКМП не различалось, но величина коэффициента М-КСФ/ИЛ-13 у больных ИБС без ИКМП была в 9 раз больше, чем у больных с ИКМП (табл.). Это позволяет расценивать коэффициент М-КСФ/ИЛ-13 как индикаторный параметр регуляции моноцитопоэза и дополнительный (наряду с ИФН-γ) показатель цитокинового профиля КМ, достоверно различающийся у больных ИБС с ИКМП и без ИКМП.
Интеграция данных сравнительного и корреляционного анализа содержания цитокинов в КМ и крови для выявления локальных и дистантных факторов цитокин-зависимой регуляции моноцитопоэза позволила предположить, что вне зависимостиот формы ИБС (наличие/отсутствие ИКМП) ИЛ-13 и ИЛ-10 представляют собой дистантные медиаторы регуляции моноцитопоэза, поскольку их концентрация в КМ и крови была сопоставимой и взаимосвязанной (табл., рис. 2). ФНО-α является локальным фактором этого процесса ввиду того, что его костномозговое содержание превышало содержание в крови в обеих группах больных (табл.).
Роль ИФН-γ и М-КСФ в моноцитопоэзе зависела от формы ИБС. У больных ИБС без ИКМП М-КСФ представляет собой локальный фактор гемопоэза, поскольку его концентрация в КМ была выше, чем в крови (табл.). ИФН-γ не оказывал значимого влияния на моноцитопоэз ввиду крайне низкого его содержания в КМ. У больных ИКМП М-КСФ может расцениваться как дистантный гемопоэтин, поскольку его концентрации в крови и КМ были сопоставимы (табл.). ИФН-γ может рассматриваться как локальный медиатор дифференцировки моноцитов, поскольку содержание его в КМ оказалось многократно выше, чем в крови (табл.). ИФН-γ в КМ у больных ИКМП подавляет активирующее влияние М-КСФ на дифференцировку переходных моноцитов в классические и промежуточные клетки. При этом локальное влияние ИФН-γ на моноцитопоэз при ИКМП исключает возможность управления его костномозговой концентрацией через модуляцию содержания цитокинов в крови. М-КСФ и ИЛ-13, реализуя дистантный механизм регуляции моноцитопоэза у больных с ИКМП, могут служить потенциальной молекулярной мишенью для коррекции дифференцировки моноцитов в КМ опосредованно, через направленное изменение концентрации цитокинов в крови. Установленные закономерности открывают новую перспективу для цитокиновой (антицитокиновой) терапии ИКМП, лечение который в настоящий момент затруднительно.
Таким образом, при циркуляторной гипоксии у больных ИБС с кардиомиопатией и без ее развития содержание HIF-1 в крови различается, что определяет особенности цитокинового профиля крови и КМ и опосредует нарушение моноцитопоэзас перераспределением численности иммунофенотипов моноцитов. Развитие ИКМП ассоциировано с недостаточностью HIF-1α и CD14+VEGFR2+-клеток, иммуносупрессией и угнетением костномозговой дифференцировки классических ипромежуточных моноцитов в условиях гиперсекреции ИФН-γ и уменьшения соотношения М-КСФ/ИЛ-13 в КМ по сравнению с больными ИБС без ИКМП. М-КСФ способствует медуллярной дифференцировке переходных моноцитов в классические клетки, ИЛ-13 ингибирует этот процесс. Вне зависимости от клинической формы ИБС ИЛ-13 и ИЛ-10 являются дистантными гемопоэтинами, ФНО-α — локальным. При ИБС без ИКМП М-КСФ служит локальным фактором моноцитопоэза, а ИФН-γ не оказывает на него значимого влияния. При ИКМП М-КСФ может расцениваться как дистантный гемопоэтин ввиду его недостаточного образования в КМ, а ИФН-γ — как локальный фактор, активно продуцируемый вмедуллярной ткани. Расстройство цитокиновой регуляции моноцитопоэза при ИКМП обусловливает пониженную дифференцировку зрелых форм моноцитов, что может влиять на субпопуляционный состав моноцитов крови и способствовать прогрессированию атеросклероза с развитием ИКМП. Управление этим процессом путем коррекции концентраций М-КСФ и ИЛ-13 в крови представляет собой потенциальную мишень для терапии ИКМП и других заболеваний человека, сопровождающихся изменением субпопуляционного состава моноцитов крови.
Соответствие принципам этики
Исследования проведены с разрешения локального этического комитета (протокол № 5046 от 28.11.2016 г.).
Список литературы
1. Kapellos T.S., Bonaguro L., Gemund I., et al. Human monocyte subsets and phenotypes in major chronic inflammatory diseases. Front Immunol. 2019; 10: 2035. DOI: 10.3389/fimmu.2019.02035.
2. Thomas G.D., Hamers A.A.J., Nakao C., et al. Human blood monocyte subsets: A new gating strategy defined using cell surface markers identified by mass cytometry. Arterioscler Thromb Vasc Biol. 2017; 37(8): 1548–58. DOI: 10.1161/ATVBAHA.117.309145.
3. Dick S.A., Zaman R., Epelman S. Using high-dimensional approaches to probe monocytes and macrophages in cardiovascular disease. Front Immunol. 2019; 10: 2146. DOI: 10.3389/fimmu.2019.02146.
4. Davis F.M., Gallagher K.A. Epigenetic mechanisms in monocytes/macrophages regulate inflammation in cardiometabolic and vascular disease. Arterioscler Thromb Vasc Biol. 2019; 39(4): 623–34. DOI: 10.1161/ATVBAHA.118.312135.
5. Idzkowska E., Eljaszewicz A., Miklasz P., et al. The role of different monocyte subsets in the pathogenesis of atherosclerosis and acute coronary syndromes. Scand J Immunol. 2015; 82(3): 163–73. DOI: 10.1111/sji.12314.
6. Sampath P., Moideen K., Ranganathan U.D., Bethunaickan R. Monocyte subsets: phenotypes and function in tuberculosis infection. Front Immunol. 2018; 9: 1726. DOI: 10.3389/fimmu.2018.01726.
7. Hamers A.A.J., Dinh H.Q., Thomas G.D., et al. Human monocyte heterogeneity as revealed by high-dimensional mass cytometry. Arterioscler Thromb Vasc Biol. 2019; 39(1): 25–36. DOI: 10.1161/ATVBAHA.118.311022.
8. Cros J., Cagnard N., Woollard K., et al. Human CD 14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 2010; 33(3): 375–86. DOI: 10.1016/j.immuni.2010.08.012.
9. Hernandez G.E., Iruela-Arispe M.L. The many flavors of monocyte/macrophage--endothelial cell interactions. Curr Opin Hematol. 2020; 27(3): 181–9. DOI: 10.1097/MOH.0000000000000573.
10. Ziegler-Heitbrock L., Hofer T.P.J. Toward a refined definition of monocyte subsets. Front Immunol. 2013; 4: 23. DOI: 10.3389/fimmu.2013.00023.
11. Shikuma C.M., Chow D.C., Gangcuangco L.M.A., et al. Monocytes expand with immune dysregulation and is associated with insulin resistance in older individuals with chronic HIV. PLoS One. 2014: 9(2): e90330. DOI: 10.1371/journal.pone.0090330.
12. Guerin C.L., Guyonnet L., Goudot G., et al. Multidimensional proteomic approach of endothelial progenitors demonstrate expression of KDR restricted to CD19 cells. Stem Cell Rev Rep. 2021; 17(2): 639–51. DOI: 10.1007/s12015-020-10062-1.
13. Patel A.A., Zhang Y., Fullerton J.N., et al. The fate and lifespan of human monocyte subsets in steady state and systemic inflammation. J Exp Med. 2017; 214(7): 1913–23. DOI: 10.1084/jem.20170355.
14. Cornwell W.D., Kim V., Fan X., et al. Activation and polarization of circulating monocytes in severe chronic obstructive pulmonary disease. BMC Pulm Med. 2018; 18(1): 101. DOI: 10.1186/s12890-018-0664-y.
15. Чумакова С.П., Винс М.В., Уразова О.И. и др. Субпопуляции моноцитов крови у больных с генерализованной гипоксией. Бюллетень сибирской медицины. 2019; 81(1): 277–85. DOI: 10.20538/1682-0363-2019-1-277-285.
16. Flynn M.C., Pernes G., Lee M.K.S., et al. Monocytes, macrophages, and metabolic disease in atherosclerosis. Front Pharmacol. 2019; 10: 666. DOI: 10.3389/fphar.2019.00666.
17. Friedrich K., Sommer M., Strobel S., et al. Perturbation of the monocyte compartment in human obesity. Front Immunol. 2019; 10: 1874. DOI: 10.3389/fimmu.2019.01874.
18. Патышева М.Р., Стахеева М.Н., Ларионова И.В. и др. Моноциты при злокачественных новообразованиях: перспективы и точки приложения для диагностики и терапии. Бюллетень сибирской медицины. 2019; 18(1): 76–83. DOI: 10.20538/1682-0363-2019-1-76–83.
19. Савченко А.А., Борисов А.Г., Модестов А.А. и др. Фенотипический состав и хемилюминесцентная активность моноцитов у больных почечно-клеточным раком. Медицинская иммунология. 2015; 17(2): 141–50. DOI: 10.15789/1563-0625-2015-2-141-150.
20. Hwang S.M., Ahn H., Jeon S., et al. Monocyte subsets to differentiate chronic myelomonocytic leukemia from reactive monocytosis. J Clin Lab Anal. 2021; 35(1): e23576. DOI: 10.1002/jcla.23576.
21. Ruiz-Limon P., Ortega-Castro R., Barbarroja N., et al. Molecular characterization of monocyte subsets reveals specific and distinctive molecular signatures associated with cardiovascular disease in rheumatoid arthritis. Front Immunol. 2019; 10: 1111. DOI: 10.3389/fimmu.2019.01111.
22. Kazimierczyk E., Eljaszewicz A., Zembko P., et al. The relationships among monocyte subsets, miRNAs and inflammatory cytokines in patients with acute myocardial infarction. Pharmacol Rep. 2019; 71(1): 73–81. DOI: 10.1016/j.pharep.2018.09.007.
23. Scally C., Abbas H., Ahearn T., et al. Myocardial and systemic inflammation in acute stress-induced (takotsubo) cardiomyopathy. Circulation. 2019; 139(13): 1581–92. DOI: 10.1161/CIRCULATIONAHA.118.037975.
24. Bansal S.S., Ismahil M.A., Goel M., et al. Dysfunctional and proinflammatory regulatory T-lymphocytes are essential for adverse cardiac remodeling in ischemic cardiomyopathy. Circulation. 2019; 139(2): 206–21. DOI: 10.1161/CIRCULATIONAHA.118.036065.
25. Гавриш А.С., Пауков В.С. Ишемическая кардиомиопатия. М.: ГЭОТАР-Медиа; 2015: 536 с.
26. Винс М.В., Чумакова С.П., Уразова О.И. и др. Субпопуляционный состав моноцитов крови и костного мозга у больных с хронической сердечной недостаточностью. Бюллетень сибирской медицины. 2018; 17(4): 16–22. DOI: 10.20538/1682-0363-2018-4-16–22.
27. Yuan S., Carter P., Bruzelius M., et al. Effects of tumour necrosis factor on cardiovascular disease and cancer: A two-sample mendelian randomization study. EBioMedicine. 2020; 59: 102956. DOI: 10.1016/j.ebiom.2020.102956.
28. Mahmoudi M.J., Harsini S., Farhadi E., et al. Interleukin-2 and interferon-gamma single nucleotide polymorphisms in Iranian patients with chronic heart failure. Avicenna J Med Biotechnol. 2018; 10(3): 173–7.
29. Чумакова С.П., Шипулин В.М., Уразова О.И. и др. Ишемическая кардиомиопатия: моноциты крови и медиаторы их дифференциации. Вестник Российской академии медицинских наук. 2019; 74(6): 396–404. DOI: 10.15690/vramn1185.
30. Wodsedalek D.J., Paddock S.J., Wan T.C., et al. IL-13 promotes in vivo neonatal cardiomyocyte cell cycle activity and heart regeneration. Physiol Heart Circ Physiol. 2019; 316(1): H24–34. DOI: 10.1152/ajpheart.00521.2018.
31. Qian N., Gao Y., Wang J., Wang Y. Emerging role of interleukin-13 in cardiovascular diseases: A ray of hope. Cell Mol Med. 2021; 25(12): 5351–7. DOI: 10.1111/jcmm.16566.
32. Wan D.Y., Zhang Z., Yang H.H. Cardioprotective effect of miR-214 in myocardial ischemic postconditioning by down-regulation of hypoxia inducible factor 1, alpha subunit inhibitor. Cell Mol Biol (Noisy-le-grand). 2015; 61(2): 1–6.
33. Koh M.Y., Powis G. Passing the baton: The HIF switch. Trends Biochem Sci. 2012; 37(9): 364–72. DOI: 10.1016/j.tibs.2012.06.004.
34. Lin N., Simon M.C. Hypoxia-inducible factors: Key regulators of myeloid cells during inflammation. J Clin Invest. 2016; 126(10): 3661–71. DOI: 10.1172/JCI84426.
35. Van Dongen J.J.M., Orfao De Matos Correia J.A. Methods and means for monitoring disruption of tissue homeostasis in the total body. Patent No 20140024019; US 2014/0024019; Publication 23.01.2014.
36. Ushach I., Zlotnik A. Biological role of granulocyte macrophage colony-stimulating factor (GM-CSF) and macrophage colony-stimulating factor (M-CSF) on cells of the myeloid lineage. J Leukoc Biol. 2016; 100(3): 481–9. DOI: 10.1189/jlb.3RU0316-144R.
37. Felker G.M., Shaw L.K., O’Connor C.M. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol. 2002; 39(2): 210–8. DOI: 10.1016/s0735-1097(01)01738-7.
38. Kaski J.C., Crea F., Gersh B.J., Camici P.G. Reappraisal of ischemic heart disease. Circulation. 2018; 138(14): 1463–80. DOI: 10.1161/CIRCULATIONAHA.118.031373.
39. Уразова О.И., Есимова И.Е., Кононова Т.Е. Молекулярные механизмы супрессии иммунного ответа при туберкулезе легких. Медицинская иммунология. 2017; 19(Suppl): 206.
40. Hsiao H.W., Hsu T.S., Liu W.H., et al. Deltex1 antagonizes HIF-1α and sustains the stability of regulatory T cells in vivo. Nat Commun. 2015; 6: 6353. DOI: 10.1038/ncomms7353.
41. Morales-Mantilla D.E., King K.Y. The role of interferon-gamma in hematopoietic stem cell development, homeostasis, and disease. Curr Stem Cell Rep. 2018; 4(3): 264–71. DOI: 10.1007/s40778-018-0139-3.
42. Jeannin P., Paolini L., Adam C., Delneste Y. The roles of CSFs on the functional polarization of tumor-associated macrophages. FEBS J. 2018; 285(4): 680–99. DOI: 10.1111/febs.14343.
Об авторах
С. П. ЧумаковаРоссия
Чумакова Светлана Петровна, доктор медицинских наук, профессор кафедры патофизиологии
634050, Томск
О. И. Уразова
Россия
Уразова Ольга Ивановна, доктор медицинских наук, профессор, член-корр. РАН, заведующая кафедрой патофизиологии; профессор кафедры комплексной информационной безопасности электронно-вычислительных систем
634050, Томск
О. А. Денисенко
Россия
Денисенко Ольга Анатольевна, врач клинической лабораторной диагностики
634045, Томск
М. В. Винс
Россия
Винс Мария Васильевна, ассистент кафедры патофизиологии
634050, Томск
В. М. Шипулин
Россия
Шипулин Владимир Митрофанович, доктор медицинских наук, профессор, главный научный сотрудник НИИ кардиологии; профессор кафедры госпитальной хирургии с курсом сердечно-сосудистой хирургии
634050, Томск;
634012, Томск
А. С. Пряхин
Россия
Пряхин Андрей Сергеевич, сердечно-сосудистый хирург кардиохирур-гического отделения № 1 НИИ кардиологии
634012, Томск
К. В. Невская
Россия
Невская Ксения Владимировна, кандидат медицинских наук, младший научный сотрудник центральной научно-исследовательской лаборатории
634050, Томск
М. В. Гладковская
Россия
Гладковская Маргарита Вадимовна, студентка медико-биологического факультета
634050, Томск
Е. Г. Чурина
Россия
Чурина Елена Георгиевна, доктор медицинских наук, профессор кафедры патофизиологии; профессор кафедры органической химии, ведущий научный сотрудник лаборатории трансляционной клеточной и молекулярной биомедицины
634050, Томск
Рецензия
Для цитирования:
Чумакова С.П., Уразова О.И., Денисенко О.А., Винс М.В., Шипулин В.М., Пряхин А.С., Невская К.В., Гладковская М.В., Чурина Е.Г. Цитокины в механизмах регуляции моноцитопоэза при ишемической болезни сердца. Гематология и трансфузиология. 2022;67(4):511-524. https://doi.org/10.35754/0234-5730-2022-67-4-511-524
For citation:
Chumakova S.P., Urazova O.I., Denisenko O.A., Vins M.V., Shipulin V.M., Pryakhin A.S., Nevskaya K.V., Gladkovskaya M.V., Churina E.G. Cytokines in the mechanisms of regulation of monocytopoiesis in ischemic heart disease. Russian journal of hematology and transfusiology. 2022;67(4):511-524. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-511-524











































