Перейти к:
Особенности клинико-лабораторной диагностики редкой коагулопатии — приобретенной гемофилии
https://doi.org/10.35754/0234-5730-2022-67-4-535-550
Аннотация
Введение. Образование циркулирующих аутоантител, способных ингибировать факторы свертывающей системы крови, сопровождается возникновением спонтанных и/или посттравматических кровотечений у больных без предшествующих нарушений системы гемостаза в анамнезе. Одной из причин развития таких состояний является приобретенная гемофилия.
Цель – представить алгоритмы лабораторной диагностики приобретенной гемофилии.
Основные сведения. Первичная диагностика и контроль терапии заболевания осуществляются на основании результатов коагулологических исследований, при расшифровке и интерпретации которых часто возникают сложности, обусловленные низкой осведомленностью врачей об алгоритмах лабораторной диагностики и тактике ведения больных. При приобретенной гемофилии отсутствует прямая связь между результатами лабораторных исследований и клиническими проявлениями, что определяется кинетикой взаимодействия аутоантител с фактором свертывания крови (F) VIII. Встречается «ложное» in vitro снижение активности факторов внутреннего пути (FIX, FXI и FXII), ассоциированное с эффектом «быстродействующего» ингибитора в высоких титрах. Важной задачей представляется определение волчаночного антикоагулянта, который затрудняет своевременную диагностику и верификацию диагноза.
Ключевые слова
Для цитирования:
Суренков А.А., Орел Е.Б., Зозуля Н.И., Двирнык В.Н. Особенности клинико-лабораторной диагностики редкой коагулопатии — приобретенной гемофилии. Гематология и трансфузиология. 2022;67(4):535-550. https://doi.org/10.35754/0234-5730-2022-67-4-535-550
For citation:
Surenkov A.A., Orel E.B., Zozulya N.I., Dvirnyk V.N. Features of clinical and laboratory diagnosis of rare coagulopathy – acquired hemophilia. Russian journal of hematology and transfusiology. 2022;67(4):535-550. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-535-550
Введение
Приобретенные коагулопатии, характеризующиеся образованием нейтрализующих аутоантител против факторов свертывающей системы крови, представляют собой группу редких, но потенциально опасных для жизни заболеваний. Аутоантитела к фактору внутреннего пути свертывания крови (F) VIII — наиболее распространенная форма ингибитора, которая встречается при приобретенной гемофилии.
Цель настоящей работы — представить алгоритмы лабораторной диагностики приобретенной гемофилии.
Клинические проявления и патогенез приобретенной гемофилии
Приобретенная гемофилия — это остро развивающееся аутоиммунное нарушение свертывания крови, обусловленное образованием ингибитора FVIII, снижающего его остаточную активность и ускоряющего клиренс, что клинически проявляется спонтанными и/или посттравматическими, нередко опасными для жизни кровотечениями, у больных без предшествующих нарушений гемостаза в анамнезе. Среди них наиболее часто встречаются обширные подкожные, межмышечные и забрюшинные гематомы, кровотечения из слизистых оболочек (маточные, из мочевыводящих путей, легочные, желудочно-кишечные, носовые). Гемартрозы, типичные для больных с наследственной формой гемофилии А, встречаются редко (до 3 %). Выраженный геморрагический синдром возникает у 80 % больных в дебюте заболевания, как правило, в первые 10–14 дней заболевания [1]. В 35 % случаев диагноз не устанавливается в первые 14 дней, а в 70 % случаев наблюдаются опасные для жизни кровотечения, требующие экстренного медицинского вмешательства. Редкость этой патологии и низкая осведомленность врачей о тактике ведения больных могут быть причиной несвоевременной диагностики, неверного лечения и, как следствие, высокой смертности (от 9 до 33 %) [2].
Приобретенная гемофилия встречается с частотой 1,5–2 случая на 1 млн населения в год. В отличие от наследственной гемофилии A, которой подвержены преимущественно мужчины, частота развития приобретенной гемофилии практически одинакова у мужчин и женщин. При оценке статистических данных Европейского регистра, выделяют два пика заболеваемости: один приходится на женщин в возрасте 20–40 лет (средний возраст — 34 года), наличие ингибитора у которых ассоциируют с беременностью и родами (заболеваемость — 1 на 350 000 родов); другой — на пожилых людей старше 65 лет (средний возраст — 74 года), встречается с одинаковой частотой у мужчин и женщин [3–5]. Только в 50 % случаев удается установить состояния, послужившие причиной развития приобретенной гемофилии: аутоиммунные заболевания, злокачественные новообразования, заболевания крови (в т. ч. гемобластозы), беременность, инфекционные заболевания, прием лекарственных препаратов. В остальных ситуациях этиологический фактор установить не представляется возможным, и заболевание приобретает первичный (идиопатический) характер [4][5].
Патогенез заболевания до конца не изучен, однако известно, что при приобретенной гемофилии образуются поликлональные аутоантитела — иммуноглобулины (Ig) класса IgG4, реже IgG1, которые блокируют домены А2, А3 и С2 FVIII, исключая его из каскада коагуляции и значительно снижая остаточную активность [4][5]. Таким образом, ингибитор препятствует взаимодействию FVIII с FIXа, кофактором которого он является, FXа, FIIа, фактором фон Виллебранда (vWF) и фосфолипидами на поверхности активированных тромбоцитов (рис. 1, 2) [6].

Рисунок 1. Влияние ингибитора FVIII на коагуляционный каскад внутреннего пути свертывания крови
Примечание: F — фактор свертывания крови, Ig — иммуноглобулин.
Figure 1. Effect of a FVIII inhibitor on the coagulation cascade of the intrinsic pathway of blood coagulation
Note: F — blood coagulation factor, Ig — immunoglobulin.
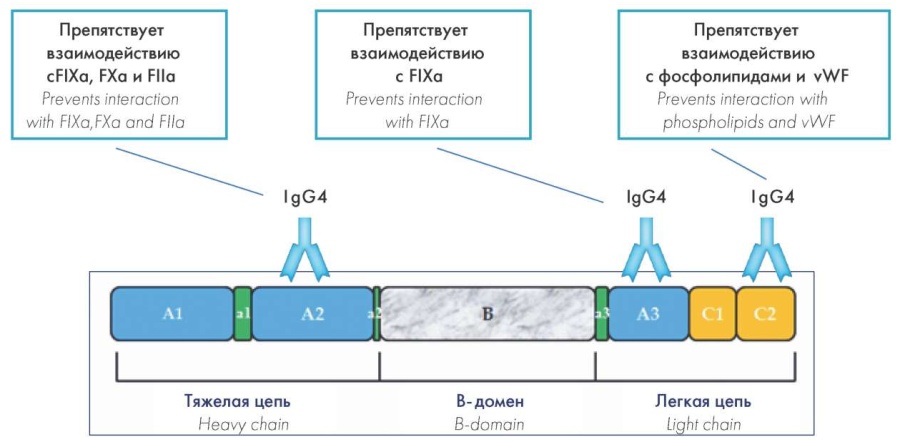
Рисунок 2. Механизм взаимодействия FVIII с ингибитором (IgG4)
Figure 2. Mechanism of FVIII interaction with an inhibitor (IgG4)
Лечение приобретенной гемофилии
Тактика терапии приобретенной гемофилии определяется тяжестью кровотечения, активностью FVIII и титром ингибитора в дебюте заболевания, а также включает в себя комплексный двусторонний целевой подход, направленный на купирование геморрагического синдрома и устранение (эрадикацию) ингибитора [2][7]. Первая цель достигается преимущественно гемостатическими препаратами с шунтирующим механизмом действия (антиингибиторный коагулянтный комплекс, рекомбинантный активированный FVII (rFVIIa)) [7]. При отсутствии тяжелых кровотечений, исходной активности FVIII > 2 % и титре ингибитора < 5 БЕ/мл применяют ингибиторы фибринолиза (антифибринолитические препараты), средства, увеличивающие содержание FVIII + vWF, и препараты FVIII [2][6]. Последние годы появляются новые терапевтические препараты, позволяющие эффективно осуществлять профилактику кровотечений у больных приобретенной гемофилией. Один из таких препаратов — миметик FVIII (эмицизумаб), который представляет собой рекомбинантное гуманизированное биспецифическое моноклональное антитело, не подвергающееся действию ингибитора. Препарат имеет удобную подкожную форму введения, интервал между инъекциями составляет 1–2 недели [8]. Однако лабораторный мониторинг активности FVIII и титра ингибитора при проведении терапии эмицизумабом проводится только хромогенными методами, поскольку препарат искажает результаты всех клоттинговых тестов на основе активированного частичного тромбопластинового времени (АЧТВ). Данный эффект сохраняется до 6 мес. со дня введения последней дозы препарата [6][8].
Вторая цель терапии заключается в успешной эрадикации ингибитора, при этом лабораторный контроль на фоне проводимого лечения необходим каждые 7–10 дней (табл. 1). Терапия «первой линии» проводится при активности FVIII ≥ 2 % и титре ингибитора ≤ 20 БЕ/мл в дебюте заболевания и заключается в применении глюкокортикостероидов (ГКС) в течение 3–4 недель [2][6]. Отсутствие тенденции к росту активности FVIII и снижения титра ингибитора указывает на необходимость подключения терапии «второй линии», которая включает в себя добавление ритуксимаба или циклофосфамида. При активности FVIII < 2 % и титре ингибитора > 20 БЕ/мл назначается комбинированная терапия ГКС + ритуксимаб (или циклофосфамид) с возможностью смены препаратов на ГКС + циклофосфамид (или ритуксимаб) в случае неэффективности лечения в течение 3–4 недель [2][6].
Таблица 1. Больные наследственной гемофилией А, осложненной ингибитором
Table 1. Patients with hereditary hemophilia A complicated by an inhibitor
Тесты | Больной Н. | Больной П. | Больной C. | Больной К. | Больной В. |
Активность FVIII (50–150 %) | 0,4 | 0 | 0,8 | 0 | 0,2 |
Ингибитор FVIII (< 0,6 БЕ/мл) | 10 | 40 | 2,75 | 24 | 15 |
Примечание: Чаще всего активность FVIII составляет < 1 % и нередко достигает 0 % при титре ингибитора > 5 БЕ/мл, что сопровождается клиническим ухудшением и неэффективностью заместительной терапии.
Note: Most often, FVIII activity is < 1 % and often reaches 0 % with an inhibitor titer > 5 BU/mL, which is accompanied by clinical deterioration and failure of replacement therapy.
Эффект от комбинированной терапии ГКС + ритуксимаб часто отмечается в отсроченные периоды — через 3–5 месяцев. Эрадикационная терапия считается успешной при достижении активности FVIII > 50 %, титре ингибитора < 0,6 БЕ/мл и отсутствии клинических проявлений.
Учитывая редкость заболевания и отсутствие своевременной лабораторной диагностики, ведение таких больных является сложной клинической задачей. Кроме того, возникает значительное количество ошибок на всех этапах лабораторного процесса, начиная с назначения диагностических тестов, взятия, транспортировки и пробоподготовки биоматериала, применения специальных методик и аналитических алгоритмов, заканчивая интерпретацией полученных результатов и назначением лечения [9].
Преаналитические ошибки
Самое большое количество лабораторных ошибок (до 65 %) приходится на преаналитический этап. Среди них наиболее часто встречаются: гемолиз, нарушение соотношения крови и консерванта в пробирке («перебор» или «недобор»), сгустки и микросгустки, хилез, несоответствие пробирок по разновидности консерванта, шприцевое взятие крови, нарушение временных и температурных интервалов доставки, попадание гепарина при заборе крови из центрального венозного катетера, взятие крови в условиях гемодилюции и др. [9][10]. Такие ошибки часто ускользают из видимости врачей клинической лабораторной диагностики и влекут за собой диагностически значимые искажения результатов коагулограммы. Основные лабораторные тесты, такие как АЧТВ, активность FVIII, титр ингибитора FVIII и волчаночный антикоагулянт (ВА), применяемые при диагностике приобретенной гемофилии, являются одними из самых чувствительных к преаналитическим ошибкам. Это нередко затрудняет первичную диагностику и контроль терапии [11].
Лабораторная диагностика ВА на преаналитическом этапе заключается в соблюдении ряда важных факторов, которые следует учитывать при выполнении исследования. Двойное центрифугирование (первичное — 2000 g 15 мин, повторное — 2500 g 10 мин) рекомендовано Международным обществом по тромбозу и гемостазу для получения обедненной тромбоцитами плазмы. Несоблюдение этих рекомендаций приводит к избыточному содержанию фосфолипидов тромбоцитарных мембран, нейтрализации антифосфолипидных антител и маскировке эффекта ВА.
Терапия антикоагулянтами, которая может проводиться больным приобретенной гемофилией до установления диагноза по поводу сопутствующих заболеваний, часто приводит к ложноположительному результату исследования ВА, поэтому лечащему врачу необходимо рассмотреть тактику отмены или замены препарата перед выполнением исследования. Больным, получающим лечение антагонистами витамина K, рекомендуется отложить исследование до момента окончания терапии и достижения целевых значений результатов международного нормализованного отношения (МНО) < 1,5. В случае невозможности отмены предлагается вариант временного перехода на низкомолекулярные гепарины (НМГ) по причине низкого воздействия терапевтических доз препарата на результат теста. Исследование проводят не ранее, чем через 12 ч после введения последней дозы НМГ [10–12].
Алгоритм лабораторной диагностики
При выполнении скрининговой оценки системы гемостаза (АЧТВ, протромбин по Квику, фибриноген) отмечается изолированное удлинение АЧТВ. В условиях лаборатории выполняется тест качественного определения ингибитора — индекс циркулирующего антикоагулянта (ИЦА, индекс Рознера), который заключается в выполнении математического расчета на основании следующих данных: АЧТВ нормального контроля (результат внутрилабораторного контроля качества), АЧТВ больного (результат, полученный при выполнении скринингового исследования) и тест смешивания АЧТВ mix (определяется в результате инкубации смеси плазмы больного и нормальной контрольной плазмы в течение 2 ч при температуре 37 °C) (рис. 3) [2][6][9]. На сегодня определение ИЦА стало доступным на автоматических коагулометрах последних модификаций.
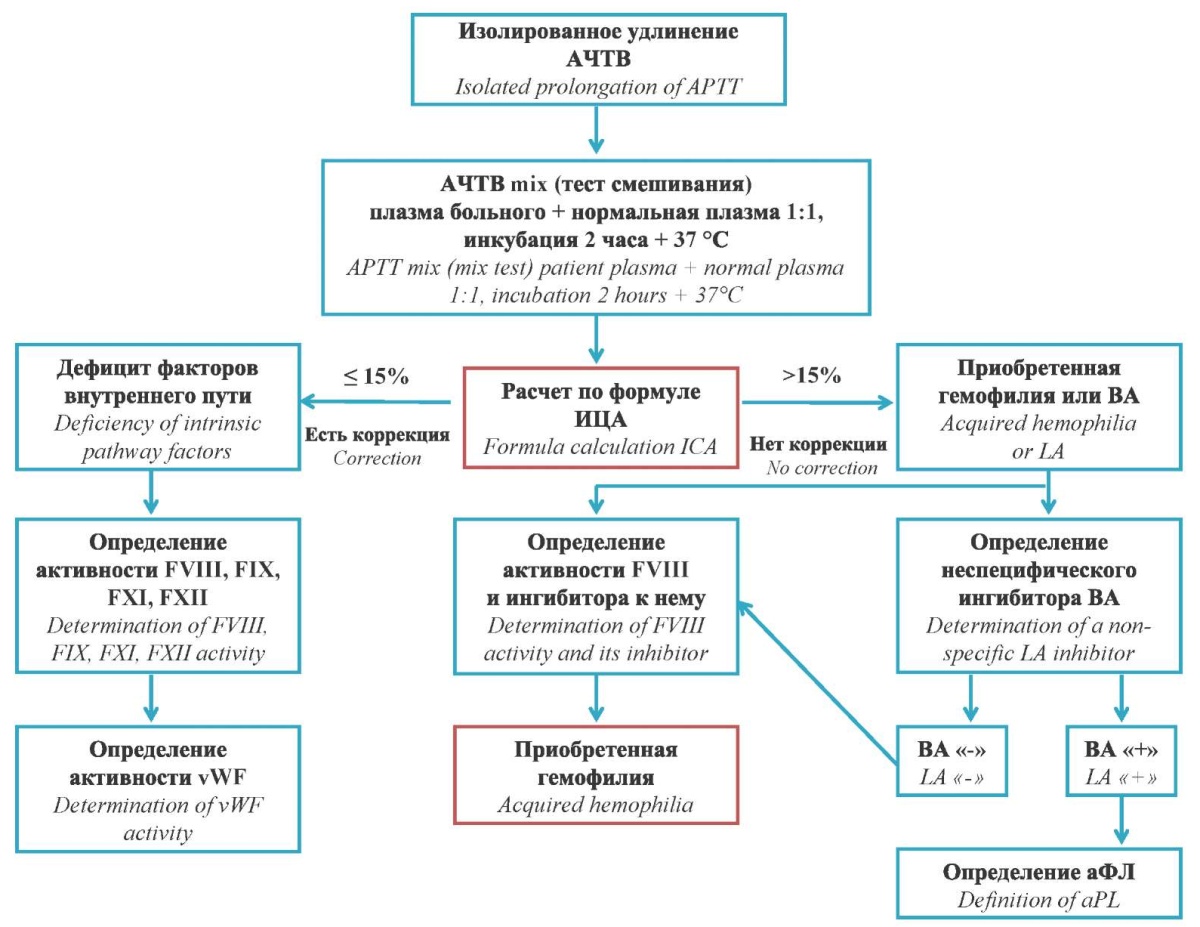
Рисунок 3. Алгоритм лабораторной диагностики приобретенной гемофилии
Примечание: аФЛ — антифосфолипидные антитела
Figure 3. Algorithm for laboratory diagnosis of acquired hemophilia
Note: aPL — antiphospholipid antibodies.
ИЦА основан на определении АЧТВ и может выполняться в любой лаборатории, не требуя специальных реагентов. Он позволяет определить направление диагностического поиска по двум критериям: наличие коррекции в данном тесте (ИЦА ≤ 15 %) свидетельствует об истинном дефиците факторов внутреннего пути, а ее отсутствие (ИЦА > 15 %) — о воздействии специфического/неспецифического ингибитора факторов. Отсутствие коррекции указывает на необходимость выполнения дифференциальной диагностики между приобретенной гемофилией и эффектом ВА [13][14].
Специальные тесты для подтверждения приобретенной гемофилии включают в себя определение активности FVIII и титра ингибитора к нему методом Бетесда в клоттинговых и хромогенных тестах. Преимуществом хромогенной методики является возможность снижения воздействия ВА на результат исследования.
Диагностика циркулирующих волчаночных антител осуществляется в качественных (АЧТВ-реагент, чувствительный к эффекту ВА; тест с разбавленным ядом гадюки Рассела и время свертывания с кварцевым активатором) и количественных (антифосфолипидные антитела к кардиолипину и бета-2-гликопротеину I, изотипов IgM и IgG) лабораторных тестах.
Определение активности FVIII
Оценку активности FVIII при диагностике приобретенной гемофилии осуществляют двумя лабораторными методами: одностадийным клоттинговым и двухстадийным хромогенным, которые имеют свои преимущества и недостатки.
На сегодняшний день одностадийное клоттинговое исследование на основе АЧТВ является наиболее часто используемым тестом в рутинной лабораторной практике. Принцип метода заключается в определении АЧТВ смеси субстратной дефицитной плазмы по FVIII (реагент) и предварительно разведенной исследуемой плазмы (плазма больного). В результате смешивания происходит коррекция (укорочение) АЧТВ дефицитной плазмы пропорционально активности FVIII плазмы больного, поскольку содержание всех других факторов свертывания реагента соответствует референсным значениям. Это позволяет сопоставить полученный результат со значениями калибровочного графика зависимости АЧТВ в секундах от активности фактора свертывания в процентах и по нему определить активность FVIII в исследуемом образце. Одноэтапный анализ определения активности FVIII и других факторов внутреннего пути имеет ряд недостатков, связанных с относительно плохой воспроизводимостью и вариабельностью между реагентами, высокой чувствительностью метода к воздействию антикоагулянтов и некоторых лекарственных препаратов (эмицизумаб), эффекту ВА и других иммунных агентов, которые могут искажать истинные результаты факторной диагностики [15].
Исключить подобные воздействия позволяет двухстадийный хромогенный метод определения активности FVIII. Принцип метода заключается в фотометрическом измерении амидолитической активности фактора при расщеплении хромогенного субстрата в кювете анализатора. На первой стадии плазму больного с неизвестной концентрацией FVIII инкубируют с реагентом, содержащим фосфолипиды, ионы Са2+, очищенные FIXa и FX. В результате образуется FХа в количестве, прямо пропорциональном активности FVIIIа. На второй стадии FХа гидролизует специфический для него хромогенный субстрат с высвобождением р-нитроанилина (pNA), окраску среды которым регистрирует спектрофотометр. Количество образовавшегося FХа, а следовательно, и интенсивность окрашивания среды в кювете анализатора пропорциональны активности FVIII в исследуемом образце. Полученные данные переносят на калибровочный график зависимости интенсивности окрашивания от активности фактора, где и формируют окончательный результат [15]. Недостатком хромогенного метода является его недостаточный клинический опыт применения, относительная высокая стоимость и низкая стабильность реагентов.
Клинико-лабораторные наблюдения демонстрируют, что две методики не исключают друг друга и применимы как для первичной диагностики, так и для мониторинга терапии у больных приобретенной гемофилией [15][16].
Диагностика наличия ингибитора методом Бетесда
Диагностика титра ингибитора методом Бетесда используется для количественного определения ингибирующих антител на основании их способности снижать активность FVIII. Исследуемую плазму больного в разных разведениях (1 : 1, 1 : 2, 1 : 4, 1 : 8) имидазоловым буфером (pH 7,4) смешивают с контрольной (нормальной) плазмой. После 2-часовой инкубации при температуре 37 °C определяют остаточную активность FVIII для каждого разведения и сравнивают с контрольным образцом плазмы.

Полученные результаты переводят в Бетесда единицы (БЕ/мл), где 100%-ная остаточная активность фактора равна 0 БЕ/мл, а 50%-ная остаточная активность фактора — 1 БЕ/мл и т. д. Для разведений с остаточной активностью от 25 до 75 % результат в БЕ/мл можно считать по номограмме (рис. 4) и умножить на коэффициент разведения для получения конечной концентрации ингибитора. Если остаточная активность менее 25 %, то делают разведение плазмы (1 : 16, 1 : 32, 1 : 64, ...) больного имидазоловым буфером (рН 7,4), чтобы остаточная активность находилась в интервале 25–75 % [2][9][17].

Рисунок 4. Номограмма для перевода остаточной активности FVIII от 25 до 75 % в БЕ/мл
Figure 4. Nomogram for converting residual FVIII activity from 25 to 75 % in BU/mL
Результаты внешнего контроля качества демонстрируют высокую межлабораторную вариабельность результатов классического метода Бетесда (рис. 5), которая достигает 50 % [9][13]. Поэтому с целью повышения чувствительности и специфичности исследований при диагностике ингибиторных коагулопатий рекомендовано использовать метод Бетесда в модификации Неймегена (рис. 6), признанный «золотым стандартом». За счет буферизации контрольной (нормальной) плазмы (pH 7,4) и замены имидазолового буфера (pH 7,4) плазмой, дефицитной по FVIII, удается стандартизовать процедуру выполнения анализа: сохранить постоянство pH исследуемой смеси, свести к минимуму искусственное разрушение фактора [9][17].
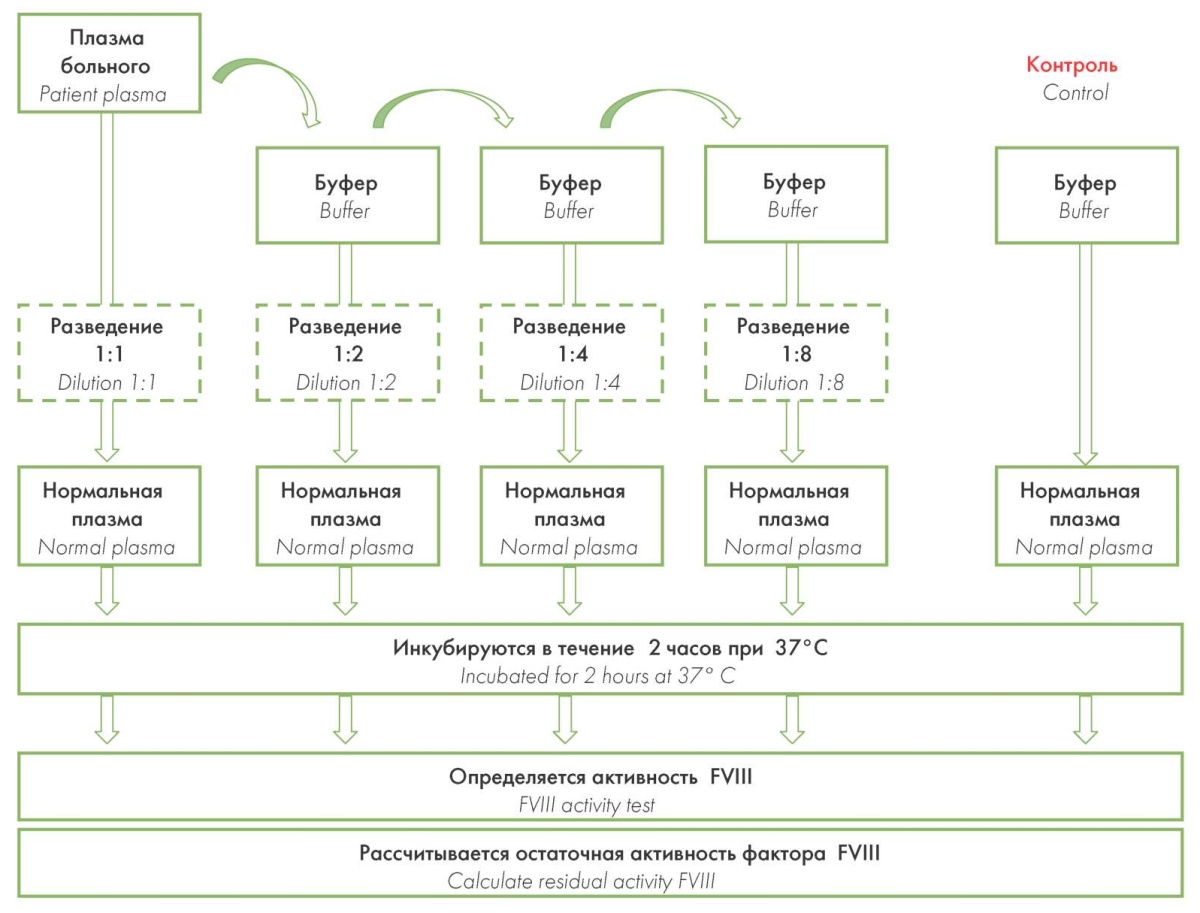
Рисунок 5. Алгоритм определения титра ингибитора методом Бетесда
Figure 5. Algorithm for determining the inhibitor titer by the Bethesda method
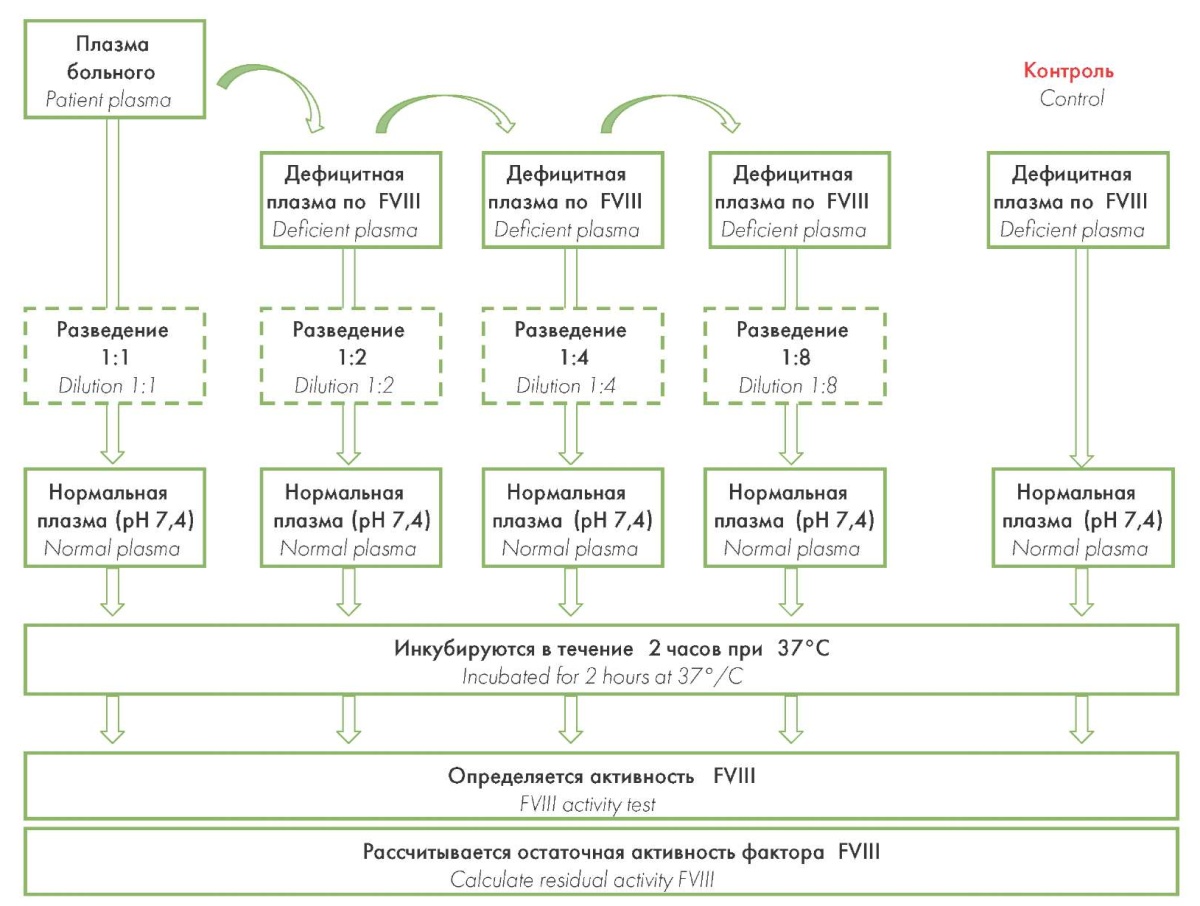
Рисунок 6. Алгоритм определения титра ингибитора методом Бетесда в модификации Неймегена
Figure 6. Algorithm for determining the inhibitor titer by the Bethesda method modified by Nijmegen
Особенности кинетики ингибиторов I и II типа
При приобретённой гемофилии, в отличие от наследственной гемофилии, нет прямой зависимости между титром специфического ингибитора и степенью подавления активности FVIII, что обусловлено различными кинетическими реакциями взаимодействия между фактором и инактивирующими антителами (рис. 7). При наследственной гемофилии А, осложненной образованием ингибитора, связывание FVIII с антителами происходит посредством реакций кинетики I типа («медленнодействующий» тип ингибитора), таким образом степень снижения активности FVIII прямо пропорционально (линейно) зависит от титра ингибитора и приводит к полному подавлению активности FVIII (необратимое ингибирование) (табл. 1) [9][18].
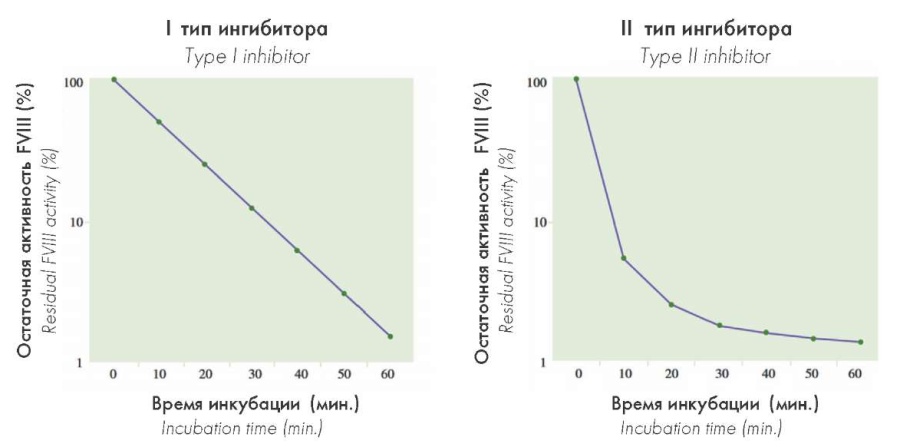
Рисунок 7. Особенности кинетики ингибиторов I и II типов
Figure 7. Features of the kinetics of type I and II inhibitors
При приобретенной гемофилии наблюдаются кинетические реакции «антиген – антитело II типа» («быстродействующий» тип взаимодействия), поскольку большинство аутоантител имеют высокую начальную скорость инактивации с последующей медленной фазой, при которой остаточная активность FVIII может определяться методом Бетесда даже при высоких концентрациях ингибитора в плазме (обратимое ингибирование) (табл. 2) [9][18]. Поэтому при сопоставимой активности FVIII у больных приобретенной гемофилией титр ингибитора и тяжесть кровотечений могут быть значительно выше, чем у больных наследственной гемофилией А.
Таблица 2. Больные приобретенной гемофилией
Table 2. Patients with acquired hemophilia
Тесты | Больной П. | Больной А. | Больной Р. | Больной Т. | Больной Р. |
Активность FVIII (50–150 %) | 0,4 | 2,1 | 0,5 | 0,3 | 37,5 |
Ингибитор FVIII (< 0,6 БЕ/мл) | 428 | 53 | 880 | 1740 | 10 |
Примечание: Не всегда активность FVIII < 1 % и редко достигает 0 %, при этом титр ингибитора может превышать > 1000 БЕ/мл и проявляться массивными кровотечениями.
Note: FVIII activity is not always < 1 % and rarely reaches 0 %, while the inhibitor titer may exceed > 1000 BU/mL and manifest as massive bleeding.
Дифференциальная диагностика
Удлинение АЧТВ как основного скринингового теста оценки внутреннего пути плазменного гемостаза может быть вызвано многими причинами (табл. 3). Из основных дифференциальных диагнозов: дефицит плазменного FVIII (гемофилия A, болезнь фон Виллебранда), FIX (гемофилия B) и FXI (болезнь Розенталя) — все связаны с повышенным риском кровотечения, однако анамнез по кровоточивости и характер геморрагических проявлений может отличаться от приобретенной гемофилии [17][18]. Дефицит FХII, прекалликреина (ПК) и высокомолекулярного кининогена (ВМК), при которых отмечается выраженное удлинение АЧТВ, нельзя в полной мере отнести к геморрагическим заболеваниям. Дефицит активности ВМК или ПК клинически никак не проявляется. У больных с дефицитом FХII (болезнь Хагемана) имеются разнонаправленные тенденции. У большинства из них, даже при глубоком дефиците фактора, нет геморрагических проявлений, однако удругих больных этой группы имеет место повышенная кровоточивость. Некоторые больные с дефицитом FХII имеют тенденцию к тромботическим проявлениям.
Таблица 3. Основные причины удлинения АЧТВ
Table 3. Main causes of aPTT prolongation
Причина удлинения АЧТВ | Клинические проявления | Комментарий |
Дефицит факторов внутреннего пути: | Изолированное удлинение АЧТВ | |
Дефицит FVIII | Кровотечение | Врожденная или приобретенная гемофилия A, некоторые формы болезни фон Виллебранда или приобретенный синдром фон Виллебранда Congenital or acquired hemophilia A, some forms of von Willebrand disease or acquired von Willebrand syndrome |
Дефицит FIX | Кровотечение | Гемофилия В (болезнь Кристмаса) |
Дефицит FXI | Кровотечение | Синдром Розенталя |
Дефицит FXII, ВМК и ПК | Тромбоз/кровотечение отсутствуют | Болезнь Хагемана, дефект Вильямса, дефект Фитцджеральда, дефект Фложак, дефект Флетчера Hageman’s disease, Williams defect, Fitzgerald defect, Flajac defect, Fletcher defect |
Другие дефициты факторов свертывания: | Также отмечается и удлинение ПВ | |
Дефицит FX | Кровотечение | Болезнь Стюарта—Прауэра |
Дефицит FV | Кровотечение | Гипопроакцелеринемия (парагемофилия) |
Дефицит FII | Кровотечение | Гипопротромбинемия |
Дефицит FI (фибриноген) | Кровотечение/тромбоз | Гипофибриногенемия < 1,0 г/л Hypofibrinogenemia < 1,0 g/L |
Комбинированный дефицит FV + FVIII | Кровотечение | Редкое аутосомно-рецессивное заболевание. A rare autosomal recessive disorder. The activity of factors is 5–20 % |
Тяжелая патология печени (печеночная недостаточность) | Кровотечение | Удлинение АЧТВ и ПВ, дефицит факторов свертывания (снижения белковосинтетической функции печени) Prolongation of aPTT and PT, deficiency of coagulation factors (decrease in the protein-synthetic function of the liver) |
Эффект ВА | Склонность к тромбозам | Удлинение АЧТВ редко сочетается с удлинением ПВ (зависит от чувствительности реактивов и аналитических особенностей анализаторов) aPTT prolongation is rarely combined with PT prolongation (this depends on the sensitivity of the reagents and the analytical features of the analyzers) |
Действие антикоагулянтов: | ||
Непрямые антикоагулянт (антагонисты витамина K) | Возрастает риск кровотечения при передозировке | Влияние на ПВ (МНО) выражено сильнее, чем на АЧТВ (отмечается при передозировке препарата) |
Нефракционированный гепарин | Влияние на АЧТВ зависит от используемых реактивов | |
Низкомолекулярный гепарин | Влияние на АЧТВ только при высоких терапевтических дозах, передозировке | |
Прямые ингибиторы FХа | Влияние на ПВ выражено сильнее, чем на АЧТВ | |
Прямые ингибиторы тромбина | Влияние на АЧТВ выражено сильнее, чем на ПВ |
Примечание: ПК — прекалликреин, ВМК — высокомолекулярного кининоген, ПВ — протромбиновое время, МНО — международное нормализованное отношение, ВА — волчаночный антикоагулянт.
Note: PC — prekallikrein, HMWK — high molecular weight kininogen, PT — prothrombin time, INR — international normalized ratio, LA — lupus anticoagulant.
Среди причин удлинения АЧТВ учитываются и другие дефициты FX, FV, FII, FI, в том числе комбинированный дефицит FV + FVIII, эффект ВА, патология печени. Гепарины и многие другие антикоагулянты, включая антагонисты витамина K и пероральные антикоагулянты прямого действия, также могут вызывать удлинение АЧТВ. У больных с кровотечением следует рассматривать возможность отмены этих препаратов или использования антидотов. Если пролонгация АЧТВ сохраняется, необходимо немедленно определить активность FVIII [9][14][15].
Дифференциальную лабораторную диагностику приобретенной гемофилии проводят с наследственной гемофилией A (с ингибитором или без), болезнью фон Виллебранда и приобретенным синдромом фон Виллебранда, антифосфолипидным синдромом (АФС), другими дефицитами факторов и действием антикоагулянтов (табл. 4). При приобретенной гемофилии необходимо учитывать «ложное» in vitro снижение активности факторов внутреннего пути в клоттинговых тестах, которое нередко возникает из-за истощения FVIII в субстратной дефицитной плазме по FIX, FXI и FXII под действием высоких титров специфического ингибитора (> 100 БЕ/мл). С целью уменьшения влияния ингибитора на результат активности FIX, FXI и FXII применяются хромогенные факторные тесты, а также лабораторные методики с предварительным разбавлением плазмы больного буферным раствором [2][3][6]. Ингибирующие антитела против FVIII у больных легкой формой гемофилии А встречаются редко, но иногда они могут снижать остаточную прокоагулянтную активность, клинически и лабораторно напоминая приобретенную гемофилию.
Таблица 4. Дифференциальная лабораторная диагностика приобретенной гемофилии
Table 4. Differential laboratory diagnosis of acquired hemophilia
Патологическое состояние, терапия | Изменение лабораторных показателей | Дополнительные лабораторные исследования и диагностические критерии |
Приобретенная гемофилия | Удлинение АЧТВ Prolongation of Aptt | Семейный анамнез не отягощен Non-burdened familial history |
Наследственная гемофилия А | Удлинение АЧТВ Prolongation of aPTT | Семейный анамнез отягощен Burdened familial history |
Наследственная гемофилия А, ингибиторная форма | Удлинение АЧТВ Prolongation of aPTT | Семейный анамнез отягощен Burdened familial history |
Болезнь фон Виллебранда или приобретенный синдром фон Виллебранда | Удлинение АЧТВ Prolongation of aPTT | RIPA — ристоцетин-индуцированная агрегация тромбоцитов RIPA — ristocetin-induced platelet aggregation |
АФС | Удлинение АЧТВ Prolongation of aPTT | АЧТВ-реагент, чувствительный к эффекту ВА aPPT-reagent sensitive to the effect of LA |
Дефицит факторов внутреннего пути: Deficiency of intrinsic pathway factors: | Изолированное удлинение АЧТВ Isolated aPTT prolongation | Отмечается снижение активности FIX, FXI и FXII in vitro (при высоком титре ингибитора FVIII) Reduced FIX, FXI, FXII activity in vitro (with a high duration of action of the FVIII inhibitor) |
Непрямые антикоагулянты (антагонисты витамина К) | Влияние на ПВ (МНО) выражено сильнее, чем на АЧТВ (отмечается при передозировке препарата) Effect on PT (INR) often stronger than on aPTT (in case of drug overdose) | Определение ПВ (МНО) Determination of PT (INR) |
Нефракционированный гепарин | Удлинение АЧТВ Prolongation of aPTT | Определение тромбинового времени Determination of thrombin time |
Низкомолекулярный гепарин | Удлинение АЧТВ (отмечается при передозировке препарата) | Определение анти-FХа активности для подтверждения или исключения действия антикоагулянтов Anti-FXa assay to confirm or exclude anticoagulant drug action |
Прямые ингибиторы FХа | Удлинение АЧТВ | Определение анти-FХа активности для подтверждения или исключения действия антикоагулянтов Anti-FXa assay to confirm or exclude anticoagulant drug action |
Прямые ингибиторы тромбина | Удлинение АЧТВ | Влияние на АЧТВ выражено сильнее, чем на ПВ Effect on aPTT often stronger than on prothrombin time |
Примечание: МНО — международное нормализованное отношение, vWF:Ag — антиген фактора фон Виллебранда, vWF:Rco — ристоцетин-кофакторная активность фактора фон Виллебранда, RIPA — ристоцетин-индуцированная агрегация тромбоцитов, vWF:FVIIIB — фактор VIII-связывающая активность фактора фон Виллебранда, vWF:CB — коллагенсвязывающая активность фактора фон Виллебранда, dRVVT Screen/dRVVT Confirm — время свертывания с разбавленным ядом гадюки Рассела Скрининг/Подтверждение, SCT Screen/SCT Confirm — время свертывания с кварцевым активатором Скрининг/Подтверждение, ВА — волчаночный антикоагулянт.
Note: INR — international normalized ratio, vWF:Ag — von Willebrand factor antigen, vWF:Rco — von Willebrand factor ristocetin cofactor activity, RIPA — ristocetin-induced platelet aggregation, vWF:FVIIIB — von Willebrand factor : factor VIII binding activity, vWF:CB — von Willebrand factor : collagen-binding activity, dRVVT Screen/dRVVT Confirm — diluted Russell Viper Venom Time Screen/Confirm, SCT Screen/SCT Confirm — Silica Clotting Time Screen/Confirm, LA — lupus anticoagulant.
ВА — один из основных лабораторных маркеров тромбофилии, применяемых для диагностики АФС. Он может искусственно приводить к искажению результатов клоттинговых тестов: изолированному удлинению АЧТВ, снижению активности FVIII и, будучи неспецифическим ингибитором, некорректному определению титра ингибитора методом Бетесда. Исключить эффект ВА у больных приобретенной гемофилией можно с помощью отрицательного результата теста с разбавленным ядом гадюки Рассела (dilute Russell viper venom time, dRVTT), где змеиный яд используется для активации FX и FV, индуцируя свертывание крови в присутствии фосфолипидов и кальция. Поскольку коагуляция in vitro активируется, минуя FVIII, FIX, FXI и FXII внутреннего пути свертывания, исследования на основе dRVTT менее чувствительны к дефициту FVIII и наличию ингибитора к нему, чем на основе кварцевого активатора (Silica Clotting Time, SCT), которые напрямую активируют FXII [18]. Также снизить влияние ВA на активность FVIII и титра ингибитора к нему позволяют тесты на основе хромогенного субстрата (хромогенный метод определения активности FVIII и хромогенный метод определения титра ингибитора), которые обычно нечувствительны к действию неспецифического ингибитора [2][6][9]. Поэтому ВА необходимо рассматривать как приоритетный дифференциальный лабораторный показатель, особенно у больных без кровотечений. Приобретенная гемофилия и АФС — аутоиммунные состояния, лабораторные маркеры которых могут одновременно определяться у одного и того же больного [19][20][21]. По данным литературы [2], до 20 % больных с ингибитором FVIII выявляют в тестах на определение ВА положительный результат.
По данным литературы [2], 60–80 % больных приобретенной гемофилией достигают полной ремиссии заболевания. В первые 6 мес. необходим ежемесячный лабораторный контроль (АЧТВ, FVIII, ингибитор FVIII), далее каждые 2–3 мес. в течение года и каждые 6 мес. в течение 2–3 лет. Рецидив заболевания возникает в 15–20 % случаев, средний временной интервал до возникновения рецидива заболевания составляет 4–6 мес. Больные с низким титром ингибитора и высокой остаточной активностью FVIII имеют тенденцию к более быстрому достижению ремиссии, однако не все авторы отмечают такую закономерность [2][21][22].
При наблюдении за больными после успешной эрадикации ингибитора часто отмечается высокая активность FVIII. Поэтому у больных с повышенным риском тромботических осложнений и отягощенным анамнезом следует рассмотреть возможность проведения тромбопрофилактики с выполнением периодического лабораторного контроля за проводимой терапией [2][14][23].
Таким образом, квалифицированная диагностика приобретенной гемофилии является важной клинической задачей, требующей знания актуальных алгоритмов и применения современных лабораторных методик, что позволит осуществлять своевременное установление диагноза и контроль терапии. Описанные в статье дифференциальные подходы и новые лабораторные исследования нуждаются в стандартизации и внедрении в практику врачей профильных лабораторий.
Остается актуальным вопрос выявления лабораторных критериев прогноза течения заболевания, позволяющих с момента верификации диагноза выбирать правильную тактику лечения и проводить мониторинг. Кроме того, важно распространять знания об этом заболевании среди врачей лабораторной диагностики и клиницистов, которые впервые могут столкнуться с больными с приобретенной гемофилией.
Список литературы
1. Constantinescu C., Jitaru C., Pasca S., et al. Unexplained hemorrhagic syndrome? Consider acquired hemophilia A or B. Blood Rev. 2021; 53(6): 100907. DOI: 10.1016/j.blre.2021.100907.
2. Andreas T., Peter C., Paul K., et al. International recommendations on the diagnosis and treatment of acquired hemophilia A. Haematologica. 2020; 105(7): 1791–801. DOI: 10.3324/haematol.2019.230771.
3. Maria E.M., Ramiro N., Francisco J.R. Acquired haemophilia: Epidemiology, clinical presentation, diagnosis and treatment. Med Clín. 2017; 148(7): 314–22. DOI: 10.1016/j.medcle.2016.11.041.
4. Knoebl P., Marco P., Baudo F., et al. Demographic and clinical data in acquired hemophilia A: results from the European Acquired Haemophilia Registry (EACH2). J Thromb Haemost. 2012; 10(4): 622–31. DOI: 10.1111/j.1538-7836.2012.04654.x.
5. Franchini M., Vaglio S., Marano G., et al. Acquired hemophilia A: A review of recent data and new therapeutic options. Hematology. 2017; 22(9): 514–20. DOI: 10.1080/10245332.2017.1319115.
6. Al Mahmasani L., Finianos A., Bou-fakhredin R., et al. Acquired hemophilia A: When an overlooked autoimmune disorder causes significant bleeding. Expert Opin Orphan Drugs. 2020; 8(2-3): 79–89. DOI: 10.1080/21678707.2020.1740682.
7. Галстян Г.М., Налбандян С.А., Сабиров К.Р. и др. Тактика лечения больной приобретенной гемофилией: непрерывная инфузия рекомбинантного активированного фактора свертывания VII и эрадикация ингибитора. Гематология и трансфузиология. 2022; 67(2): 282–94. DOI: 10.35754/0234-5730-2022-67-2-282-294.
8. Tiede A., Kemkes-Matthes B., Knöbl P. Should emicizumab be used in patients with acquired hemophilia A? J Thromb Haemost. 2021; 19(3): 637–44. DOI: 10.1111/jth.15208.
9. Tiede A., Werwitzke S., Scharf R.E. Laboratory diagnosis of acquired hemophilia A: Limitations, consequences and challenges. Semin Thromb Hemost. 2014; 40(7): 803–11. DOI: 10.1055/s-0034-1390004.
10. Favaloro E.J., Lippi G. Preanalytical issues that may cause misdiagnosis in haemophilia and von Willebrand disease. Haemophilia. 2018; 24(2): 198–210. DOI: 10.1111/hae.13396.
11. Lippi G., Favaloro E.J. Preanalytical issues in hemostasis and thrombosis testing. Methods Mol Biol. 2017; 1646: 29–42. DOI: 10.1007/978-1-4939-7196-1_2.
12. Tay Za K., Jayaranee S. Practice and performance of lupus anticoagulant tests: A single centre experience. Malays J Pathol. 2020; 42(1): 51–7.
13. Потылицина В.В., Самойленко В.В., Лобанова С.М. и др. К вопросу использования методов фактор-параллелизма и индекса циркулирующего антикоагулянта в алгоритме диагностики дефицита факторов свертывания. Клиническая лабораторная диагностика. 2019; 64(2): 83–8. DOI: 10.18821/0869-2084-2019-64-2-83-88.
14. Coppola A., Franchini M., Tripodi A., et al. Acquired haemophilia A: Italian Consensus Recommendations on diagnosis, general management and treatment of bleeding. Blood Transfus. 2022; 20(3): 245–62. DOI: 10.2450/2022.0238-21.
15. Baig M.A., Swamy K.B., Comparative analysis of chromogenic vs clot. based one stage APTT assay for determination of factor VIII level. Indian J Pathol Microbiol. 2021; 64(1): 123–7. DOI: 10.4103/IJPM.IJPM_900_19.
16. Novembrino C., Anzoletti M.B., Mancuso M.E., et al. Evaluation of an automated chromogenic assay for Factor VIII clotting activity measurement in the patients affected by hemophilia A. Haemophilia. 2019; 25(3): 521–6. DOI: 10.1111/hae.13746.
17. Miller CH. Laboratory testing for factor VIII and IX inhibitors in haemophilia: A review. Haemophilia. 2018; 24(2): 186–97. DOI: 10.1111/hae.13424.
18. Долгов В.В., Вавилова Т.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. М., Тверь: Триада; 2019: 400.
19. Casas Patarroyo C.P., Agudelo López P.C.D, Galvez K., et al. Adequate diagnosis of acquired hemophilia A. Rev Med Chil. 2019; 147(3): 334–41. DOI: 10.4067/S0034-98872019000300334.
20. Seethala S., Collins N.P. Jr., Comerci G. Jr. An unusual etiology for elevation of activated partial thromboplastin time (aPTT) in SLE: Acquired hemophilia and lupus anticoagulant. Case Rep Hematol. 2013; 2013: 521785. DOI: 10.1155/2013/521785.
21. Ames P.R., Graf M., Archer J., et al. Prolonged activated partial thromboplastin time: Difficulties in discriminating coexistent Factor VIII inhibitor and lupus anticoagulant. Clin Appl Thromb Hemost. 2015; 21(2): 149–54. DOI: 10.1177/1076029614541516.
22. Tiede A., Klamroth R., Scharf R.E., et al. Prognostic factors for remission of and survival in acquired hemophilia A (AHA): Results from the GTH-AH 01/2010 study. Blood. 2015; 125(7): 1091–7. DOI: 10.1182/blood-2014-07-587089.
23. Werwitzke S., Geisen U., Nowak-Göettl U., et al. Diagnostic and prognostic value of factor VIII binding antibodies in acquired hemophilia A: Data from the GTH-AH 01/2010 study. Thromb Haemost. 2016; 14(5): 940–7. DOI: 10.1111/jth.13304.
Об авторах
А. А. СуренковРоссия
Суренков Алексей Алексеевич, врач централизованной клинико-диагностической лаборатории
125167, Москва
Е. Б. Орел
Россия
Орел Елена Борисовна, руководитель группы патологии гемостаза централизованной клинико-диагностической лаборатории
125167, Москва
Н. И. Зозуля
Россия
Зозуля Надежда Ивановна, доктор медицинских наук, заведующая клинико-диагностическим отделением гематологии и нарушений гемостаза
125167, Москва
В. Н. Двирнык
Россия
Двирнык Валентина Николаевна, кандидат медицинских наук, заведующая централизованной клинико-диагностической лабораторией
125167, Москва
Рецензия
Для цитирования:
Суренков А.А., Орел Е.Б., Зозуля Н.И., Двирнык В.Н. Особенности клинико-лабораторной диагностики редкой коагулопатии — приобретенной гемофилии. Гематология и трансфузиология. 2022;67(4):535-550. https://doi.org/10.35754/0234-5730-2022-67-4-535-550
For citation:
Surenkov A.A., Orel E.B., Zozulya N.I., Dvirnyk V.N. Features of clinical and laboratory diagnosis of rare coagulopathy – acquired hemophilia. Russian journal of hematology and transfusiology. 2022;67(4):535-550. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-535-550











































