Перейти к:
ПОВТОРНАЯ ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ ГЕМОБЛАСТОЗАМИ
https://doi.org/10.35754/0234-5730-2019-64-1-35-48
Аннотация
Введение. Основными причинами неудач трансплантации аллогенных гемопоэтических стволовых клеток (аллоТГСК) являются рецидивы злокачественных заболеваний системы крови и несостоятельность трансплантата. В этих случаях как один из вариантов лечения может рассматриваться проведение повторной алло-ТГСК.
Целью исследования стала оценка эффективности, общей и бессобытийной выживаемости в зависимости от причины и сроков проведения повторной алло-ТГСК, а также определение влияния смены донора на результаты повторной алло-ТГСК.
Больные и методы. В исследование включено 24 больных (12 мужчин, 12 женщин) острыми миелоидными лейкозами (ОМЛ) (n = 14), острыми лимфобластными лейкозами (ОЛЛ) (n = 4), миелопролиферативными заболеваниями (МПЗ) (n = 3) и миелодиспластическим синдромом (МДС) (n = 3), которым была проведена повторная алло-ТГСК в ФГБУ «НМИЦ гематологии» Минздрава России. Возраст больных был от 18 до 56 лет (медиана возраста — 32 года). У 11 больных была выполнена вторая алло-ТГСК по поводу рецидива гемобластоза, у 13 — вследствие недостаточности трансплантата. У половины больных (n = 12) повторная алло-ТГСК выполнена менее чем через 6 месяцев после первой алло-ТГСК.
Результаты. После второй алло-ТГСК восстановление донорского кроветворения отмечено у 18 из 24 (75 %) больных, у 3 больных констатирована несостоятельность трансплантата, у 3 — ранний рецидив острого лейкоза. После приживления трансплантата 9 из 18 (50 %) больных умерли в первые 100 дней после алло-ТГСК вследствие инфекционных осложнений и/или токсичности, находясь в ремиссии гемобластоза, еще 3 больных умерли в более поздние сроки от прогрессии гемобластоза. Общая летальность составила 61,5 %. Медиана продолжительности жизни и бессобытийного течения у больных после повторной алло-ТГСК составила 13,05 и 10,59 мес. соответственно. Трехлетняя общая выживаемость (ОВ) и бессобытийная выживаемость (БСВ) составили 38,5 и 27,6 % соответственно. Выявлены значимые различия в ОВ у больных с более длительным (>6 мес.) интервалом между проведением первой и второй алло-ТГСК. Смена донора не оказала значимого влияния на ОВ и БСВ.
Для цитирования:
Кузьмина Л.А., Конова З.В., Паровичникова Е.Н., Дроков М.Ю., Васильева В.А., Попова Н.Н., Савченко В.Г. ПОВТОРНАЯ ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ ГЕМОБЛАСТОЗАМИ. Гематология и трансфузиология. 2019;64(1):35-48. https://doi.org/10.35754/0234-5730-2019-64-1-35-48
For citation:
Kuzmina L.A., Konova Z.V., Parovichnikova E.N., Drokov M.Y., Vasilyeva V.A., Popova N.N., Savchenko V.G. SECOND ALLOGENEIC HEMATOPOIETIC STEM CELL TRANSPLANTATION IN PATIENTS WITH HEMATOLOGICAL MALIGNANCIES. Russian journal of hematology and transfusiology. 2019;64(1):35-48. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-35-48
Введение
Трансплантация аллогенных гемопоэтических стволовых клеток крови (алло-ТГСК) как метод, позволяющий не только достичь длительной полной ремиссии злокачественных заболеваний системы крови, но и в некоторых случаях добиться биологического излечения, уже давно стала стандартом терапии большинства ге- мобластозов [1]. Однако алло-ТГСК не всегда оказывается эффективной. Основными причинами неудач этого метода лечения являются рецидивы заболевания и несостоятельность (неприживление/отторжение) трансплантата. По данным разных авторов, частота развития рецидивов варьирует в зависимости от варианта гемобластоза, цитогенетических факторов риска, статуса заболевания перед ТГСК и может достигать 50 % [2—4]. Прогноз у таких больных крайне неблагоприятен, особенно при развитии рецидива в первые полгода после алло-ТГСК. При этом возможности терапии могут быть резко ограничены, что обусловлено вероятной резистентностью опухолевых клеток к химиотерапии, а также тяжелым соматическим статусом больного, связанным с накопленной токсичностью, инфекционными осложнениями и/или реакцией «трансплантат против хозяина» (РТПХ) [2, 5]. В настоящее время для лечения посттрансплантационных рецидивов заболевания наиболее часто используют адоптивную иммунотерапию трансфузиями донорских лимфоцитов (ТДЛ) с предшествующей химиотерапией или без нее [6—10] и повторную алло-ТГСК [11—14]. К сожалению, эффективность этих методов остается невысокой. По данным зарубежных ретроспективных исследований последних лет, двухлетняя общая выживаемость больных, у которых в качестве терапии рецидивов заболевания после алло-ТГСК были использованы ТДЛ, составила от 16 до 29 % [8, 15—17]. В многоцентровом исследовании EBMT, включавшем 2632 больных, при выполнении повторной алло-ТГСК общая выживаемость (ОВ) больных в течение одного года составила 40 %, в течение 5 лет — 20 %, безрецидивная выживаемость (БРВ) — 33 и 40 % соответственно [18].
Неприживление и отторжение трансплантата также ассоциированы с крайне неблагоприятным прогнозом, хотя встречаются реже, чем рецидивы заболевания. В среднем их частота составляет 5 %: при трансплантации от HLA-идентичных сиблингов — 1 %, при неродственной полностью совместимой трансплантации от 1 до 5 %, и 5—10 %, если донор был частично совместим [19—22]. Вероятность развития несостоятельности трансплантата зависит от многих факторов: основного диагноза и статуса заболевания на момент трансплантации, режима кондиционирования, наличия у реципиента анти-HLA антител, источника трансплантата и его клеточности, совместимости в паре донор-реципиент, особенностей стромального микроокружения реципиента гемопоэтических стволовых клеток, а также инфекционного статуса больного перед алло-ТГСК [23].
Существуют несколько подходов к ведению больных с неприживлением трансплантата. При наличии заранее заготовленных стволовых клеток или костного мозга больного возможно выполнение аутологичной ТГСК. Широко применяются дополнительные инфузии гемопоэтических стволовых клеток без предшествующего кондиционирования [24, 25], стимуляция гемопоэза посредством гранулоцитарного колониестимулирующего фактора (Г-КСФ) или гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) [26—28], но эти подходы наиболее эффективны в отношении дисфункции трансплантата на фоне 100 % «донорской химеры» в костном мозге больного [24—28]. В рамках терапии первичного неприживления или отторжения трансплантата большинство авторов рекомендуют рассматривать повторную алло-ТГСК от того же или другого донора [29, 30]. Однако данные литературы, в которых представлены результаты этого подхода, весьма противоречивы, ОВ больных варьирует от 11 до 70 % [31—37].
Таким образом, посттрансплантационные рецидивы и прогрессия заболевания, а также несостоятельность трансплантата после алло-ТГСК являются жизнеугрожающими осложнениями и показаниями к проведению повторной алло-ТГСК. К сожалению, учитывая, как правило, тяжелый соматический статус больных, такая терапия может быть ассоциирована с высокой летальностью, связанной с лечением [38]. В последнее время, во многом благодаря совершенствованию режимов предтрансплантационного кондиционирования, имму- носупрессивной, сопроводительной и антибактериальной терапии, все большее количество исследователей склоняется к тому, что этот метод является потенциально наиболее эффективным в решении проблемы неудач после первой алло-ТГСК [39, 40].
Целью настоящего исследования стала оценка эффективности, ОВ и БСВ в зависимости от причины выполнения и сроков проведения повторной ал- ло-ТГСК, а также определение влияния смены донора на результаты повторной алло-ТГСК.
Больные и методы
В исследование было включено 24 больных (12 мужчин и 12 женщин) злокачественными заболеваниями системы крови: острыми миелоидными лейкозами (ОМЛ) (п = 14), острыми лимфобластными лейкозами (ОЛЛ) (п = 4), миелопролиферативными заболеваниями (МПЗ) (п = 3) и миелодиспластическим синдромом (МДС) (п = 3), которым была проведена повторная алло-ТГСК в ФГБУ НМИЦ гематологии Минздрава России с ноября 2012 по июнь 2017 г. Медиана возраста больных на момент повторной алло-ТГСК составила 32 (18—56) года. В таблице 1 представлена общая характеристика больных в зависимости от причин выполнения повторной алло-ТГСК.
Первая ТГСК была выполнена от родственных HLA-идентичных доноров у 3 больных, у 11 больных — от неродственных полностью совместимых доноров, у 5 — от неродственных частично совместимых (1—2 различия), в двух случаях доноры были гаплоидентичны. В качестве источника трансплантата для первой алло-ТГСК в большинстве случаев (п = 19) использовался костный мозг, медиана клеточности составляла 3х108 миелокариоцитов (от 2х108 до 5,3х108 миелокарио- цитов), для 4 больных источником трансплантата послужили периферические стволовые клетки (5х106 CD34+ клеток), для одного больного были использованы стволовые клетки из пуповинной крови — 4,7х107 ядросодержащих клеток.
Для статистического анализа больные были разделены на группы в зависимости от причины выполнения повторной трансплантации (несостоятельность трансплантата и рецидив гемобластоза после первой алло-ТГСК), от временного интервала между первой и второй алло-ТГСК (менее и более 6 месяцев), а также в зависимости от того, выполнялась повторная ал- ло-ТГСК от того же донора или от другого.
Таблица 1. Характеристика больных, которым была выполнена повторная алло-ТГСК
Table 1. Characteristics of patients with second allo-HSCT
Временной интервал между первой и второй ал- ло-ТГСК составил менее 6 мес. у половины больных. В 11 случаях показанием для проведения второй ал- ло-ТГСК были рецидивы заболевания, в 13 случаях — неприживление/отторжение трансплантата. Неприживлением трансплантата считали отсутствие восстановления количества лейкоцитов периферической крови (лейкоциты более 1,0х109/л, нейтрофилы более 0,5х109/л) на +28 день алло-ТГСК и на +42 день трансплантации клеток пуповинной крови), в случае уменьшения количества нейтрофилов в периферической крови менее 0,5х109/л (в течение 3 дней) после пер - вичного приживления с доказанным донорским химе- ризмом констатировали отторжение трансплантата.
У 4 больных повторная алло-ТГСК была выполнена от родственного совместимого донора, у 13 — от неродственного совместимого донора, у 6 больных — от неродственного частично совместимого донора. Одному больному была выполнена алло-ТГСК от га- плоидентичного донора — отца, показанием к выполнению второй трансплантации у данного больного послужило неприживление трансплантата после алло-ТГСК от другого гаплоидентичного донора — матери.
У 14 больных была проведена вторая алло-ТГСК от того же донора, у 10 — от другого. При рецидиве заболевания смена донора выполнена у 7 из 11 больных, при несостоятельности — у 3 из 13 больных.
В качестве источника трансплантата при повторной алло-ТГСК у 20 больных использовались периферические стволовые клетки крови от 3х106 и до 7х106 CD34+ клеток на килограмм массы тела с медианой клеточно- сти 5х106/кг, у 4 — костный мозг, медиана клеточно- сти составляла 2,8х108/кг миелокариоцитов (от 1,52х108 до 5,2х108/кг).
Подавляющему большинству больных перед повторной алло-ТГСК было проведено кондиционирование в режиме пониженной интенсивности (п = 22). У 13 из 22 больных было выполнено кондиционирование с использованием мелфалана: 11 больным по программе флюдарабин + мелфалан (флюдарабин 150 мг/м2, мелфалан 140 мг/м2), одному — клофарабин + мелфалан (клофарабин 150 мг/м2, мелфалан 140 мг/м2), для одного из больных был выбран режим мелфалан — 140 мг/м2, у 3 больных использовали треосульфан-со- держащие режимы: 2 больным проводили кондиционирование по программе треосульфан + циклофосфан (треосульфан 30 г/м2, циклофосфан 120 мг/кг), одному — треосульфан + флударабин (треосульфан 30 г/м2, флударабин 150 мг/м2). Двум больным было выполнено кондиционирование в миелоаблативном режиме: кондиционирование по схеме мелфалан 200 мг/м2 было проведено одной больной, которой повторная ал- ло-ТГСК выполнена в связи с развитием несостоятельности трансплантата, одной больной с рецидивом заболевания перед второй алло-ТГСК было выполнено кондиционирование по программе флюдарабин + мел- фалан (флюдарабин 150 мг/м2, мелфалан 200 мг/м2). У 5 больных повторная алло-ТГСК была выполнена на фоне развернутой фазы злокачественного заболевания системы крови; с целью преодоления рефрактерно - сти опухолевых клеток к воздействию цитостатических препаратов были использованы модифицированные режимы кондиционирования: у 4 больных было проведено кондиционирование по программе HAM-RIC (цитарабин 18 г/м2, митоксантрон 20 мг/м2, флударабин 150 мг/м2, бусульфан 8мг/кг), одному больному — FLAMSA-RIC (цитарабин 6 г/м2, идарубицин 20 мг/м2, флударабин 150 мг/м2, бусульфан 8 мг/кг, гемтузумаб озогамицин 6 мг/м2).
Схемы иммуносупрессивной терапии (ИСТ) варьировали в зависимости от HLA-совместимости донора и реципиента, а также статуса гемобластоза перед второй алло-ТГСК. Для 9 больных был выбран режим циклоспорин А (ЦсА) в дозе 3 мг/кг/сут с -1 дня алло-ТГСК, метотрексат в дозе 15 мг/м2 в +1 день, 10 мг/м2 в +3, +6, +11 дни, микофенолата мофетил (ММФ) 2—3 г/сут с +1 дня после алло-ТГСК. Пяти боль - ным с целью индукции толерантности на +3 и +4 дни вводился циклофосфамид (ЦФ) в дозе 50 мг/кг/сут, далее проводилась терапия ММФ 2—3 г/сут с +5 дня после алло-ТГСК, двум больным профилактику РТПХ проводили по схеме ЦФ на +3, +4 дни, далее ЦсА с +5 дня, одна больная получала в качестве ИСТ только ММФ 3 г/сут с +1 дня после алло-ТГСК, двум больным проводилась ИСТ по схеме ЦФ + ЦсА + ММФ. Пяти больным, которым повторная алло-ТГСК выполнена на фоне развернутой фазы гемобластоза, проводилась только монотерапия циклофосфамидом. Антитимоци- тарный иммуноглобулин лошадиный (АТГам) в дозе 40 мг/кг был включен в режим профилактики РТПХ у 8 больных, антитимоцитарный иммуноглобулин кроличий (тимоглобулин) в дозе 7,5 мг/кг был использован у 2 больных.
По данным литературы [23], одной из причин несостоятельности трансплантата является повреждение стромального микроокружения, обусловленного как воздействием химиотерапевтических препаратов, так и непосредственно лейкозными клетками. С целью восстановления кроветворного микроокружения 7 больным с несостоятельностью трансплантата в день повторной алло-ТГСК от того же донора, после получения информированного согласия, внутрикостно в губчатую ткань задних верхних остей подвздошных костей вводились мультипотентные мезенхимные стромальные клетки (ММСК). ММСК индивидуально наращивались для больного от собственного донора костного мозга в ФГБУ «НМИЦ гематологии». Протокол исследования одобрен локальным этическим комитетом.
Статистический анализ. ОВ и БСВ рассчитывали по методу Каплана — Майера. При расчете БСВ за событие принимали рецидив, отторжение и смерть больного, при расчете ОВ — смерть больного от любых причин. Больные, живущие в состоянии ремиссии на момент анализа данных, цензурированы 16.10.2017. Сравнение показателей выживаемости в группах выполняли при помощи log-rank теста. Статистически значимыми считали различия при p < 0,05.
Результаты
ОВ больных после повторной алло-ТГСК составила 38,5 %, БСВ — 27,6 %, медиана продолжительности жизни и бессобытийного течения — 13,05 и 10,59 месяца соответственно (рис. 1).
Медиана восстановления числа лейкоцитов периферической крови составила 23 дня (в интервале от 13 до 34), медиана восстановления количества тромбоцитов крови (тромбоциты более 20х109/л) — 27 дней (от 15 до 50 дней). У 3 больных после повторной алло-ТГСК была констатирована несостоятельность трансплантата, еще у 3 больных — рецидив заболевания.
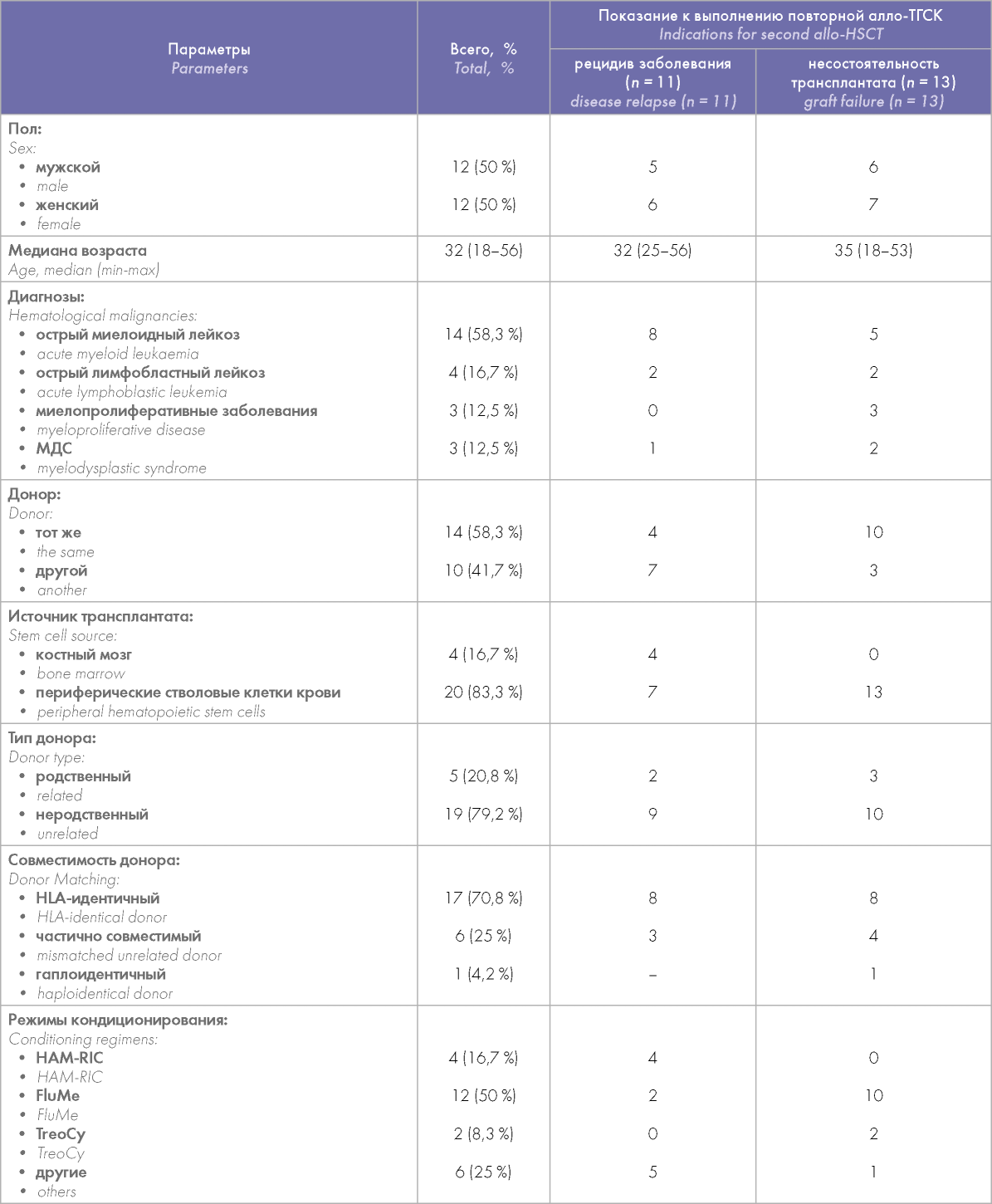
ОВ больных, которым была выполнена повторная алло-ТГСК в связи с несостоятельностью трансплантата, оказалась выше, чем ОВ при алло-ТГСК, выполненной в связи с рецидивом (45,7 против 34 %), хоть различия и не достигли статистически значимых величин (р = 0,2). Медиана ОВ у больных с несостоятельностью трансплантата составила 20,6 мес., у больных с рецидивами заболевания — лишь 4,8 мес. Семи больным с несостоятельностью трансплантата в день повторной алло-ТГСК были введены ММСК, у 5 больных отмечалось восстановление донорского кроветворения, однако у 2 больных в последующем было выявлено отторжение трансплантата из-за тяжелых инфекционных осложнений (рецидивирующей ЦМВ-инфекции), у 2 больных было констатировано неприживление трансплантата после второй алло-ТГСК.
Кумулятивная вероятность БСВ также оказалась выше у больных с несостоятельностью трансплантата (33 %), медиана БСВ — 16,8 мес. против 3,7 мес. для больных с рецидивами заболевания (рис. 2).
Кондиционирование в миелоаблативном режиме было проведено лишь 2 больным: одной больной была выполнена повторная алло-ТГСК в связи с отторжением трансплантата, однако приживление трансплантата не было достигнуто, что потребовало выполнения трансплантации аутологичных гемопоэтических стволовых клеток. В дальнейшем у этой больной было отмечено восстановление собственного («хозяйского») кроветворения, в течение 2,5 года у нее сохраняется ремиссия ОМЛ. Другой больной алло-ТГСК с кондиционированием в миелоаблативном режиме была проведена учитывая рефрактерный рецидив ОЛЛ, восстановление числа лейкоцитов периферической крови было зафиксировано на +31 день, однако на +2,5 месяца больная умерла от инфекционных осложнений.

Рисунок 1. Общая выживаемость (ОВ) (А) и бессобытийная выживаемость (БСВ) больных (Б), которым была выполнена повторная алло-ТГСК
Figure 1. Overall survival (OSj (Aj and event-free survival (EFSj (Бj, rates in patients after second allogeneic hematopoietic stem cell transplantation (allo-HSCT)
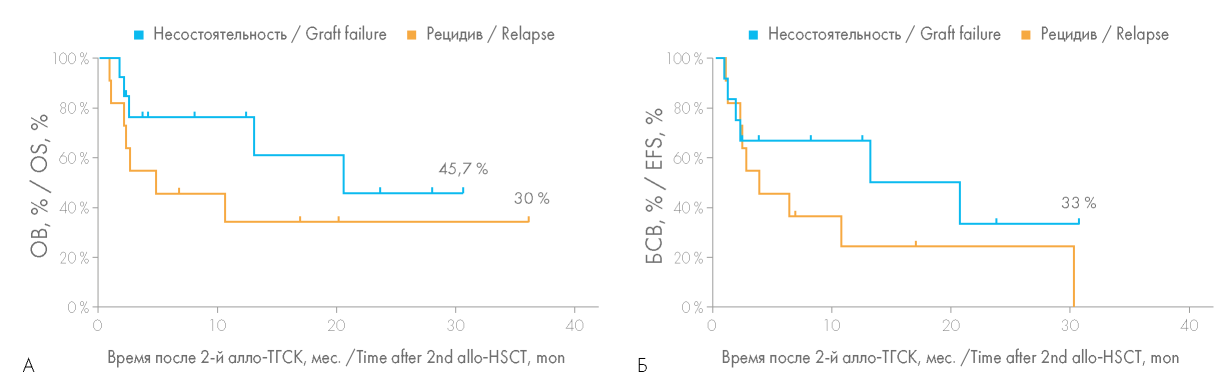
Рисунок 2. Сравнение общей выживаемости (ОВ) (А) и бессобытийной выживаемости (БСВ) (Б) больных, которым была выполнена повторная алло-ТГСК в связи несостоятельностью трансплантата и по причине рецидива заболевания после первой алло-ТГСК
Figure 2. Comparison of the overall survival (OS) (A) and event-free survival (EFS) (Б) rates in patients after second allogeneic hematopoietic stem cell transplantation (allo-HSCTj due to either graft failure or disease relapse after the first allo-HSCT
Учитывая накопленную токсичность, часто тяжелый соматический статус, наличие инфекционных осложнений на момент второй алло-ТГСК, 22 из 24 больных было проведено кондиционирование в режиме пониженной интенсивности/токсичности, 11 больным (10 больных с несостоятельностью трансплантата и 1 больная с рецидивом гемобластоза) кондиционирование проводилось по программе флударабин + мел- фалан. Приживление трансплантата было отмечено у 9 больных. Вероятность ОВ у этой группы больных составила 47 %, медиана ОВ — 20,59 мес.
У 5 больных с рецидивом заболевания на момент начала кондиционирования с целью преодоления ре- фрактерности опухолевых клеток к воздействию цито- статических препаратов были использованы модифицированные режимы кондиционирования. У одного больного была использована программа FLAMSA- RIC, впоследствии у него был отмечен повторный рецидив через 30 мес. после второй алло-ТГСК. Четырем больным было проведено кондиционирование по программе HAM-RIC. Медиана ОВ и БСВ в этой группе составили 2,5 и 2,3 мес. соответственно. Один больной умер в связи с инфекционными осложнениями на сроке +10 месяцев, еще один больной умер через месяц после второй алло-ТГСК от острой сердечной недостаточности. Один больной умер от рефрактерного течения ОМЛ через 4 недели после повторной алло-ТГСК (в миелограмме на +26 день выявлялось 16 % бластных клеток), у одной больной был констатирован рецидив ОМЛ через 6 месяцев после алло-ТГСК.
На момент начала кондиционирования перед повторной алло-ТГСК 18 из 24 больных имели тяжелый соматический статус и инфекционные осложнения. В большинстве случаев повторная алло-ТГСК в короткие сроки (менее 6 мес.) выполнялась по жизненным показаниям в связи с первичным неприживлением трансплантата, на фоне агранулоцитоза и панцитопении, при развитии жизнеугрожающих инфекционных осложнений.
При проведении статистического анализа были выявлены значимые различия в ОВ у больных с более длительным (более 6 мес.) интервалом между проведением первой и второй алло-ТГСК (рис. 3). Ретроспективно медиана ОВ у больных, которым была выполнена вторая алло-ТГСК более чем через 6 мес. после первой алло-ТГСК, составила 20,6 мес., тогда как при меньшем временном интервале — лишь 2,5 мес. (р = 0,0452). Однако БСВ не зависела от увеличения интервала между первой и второй алло-ТГСК: медиана БСВ в группе «>6 мес.» составила 10,6 мес., в группе «<6 мес.» — 2,2 мес., данные различия не достигли статистической значимости (р = 0,1760).
Большое значение имела оценка целесообразности смены донора аллогенных гемопоэтических стволовых клеток при выполнении повторной алло-ТГСК. Несмотря на отсутствие статистически значимых различий (р = 0,0926), ОВ при выполнении повторной алло-ТГСК от того же донора была несколько выше, чем в случае выбора другого донора (50,8 против 21,9 %) (рис. 4). Практически для всех больных, которым была выполнена повторная алло-ТГСК от того же донора, причиной выполнения повторной алло-ТГСК послужило первичное неприживление трансплантата, что обусловливало необходимость получения трансплантата в кратчайшие сроки, невозможность проведения длительного поиска другого донора. В этой группе больных вероятность ОВ достигла 59 %, медиана продолжительности жизни 20,6 мес., при этом вероятность БСВ составила 50 % (рис. 5).
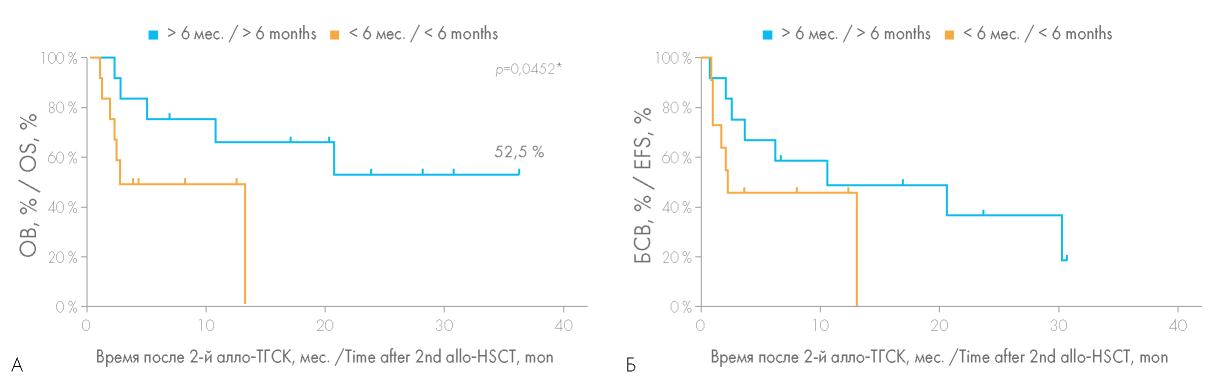
Рисунок 3. Общая выживаемость (ОВ) (А) и бессобытийная выживаемость (БСВ) (Б) больных в зависимости от временного интервала между первой и второй алло-ТГСК
Figure 3. Overall survival (OS) (A) and event-free survival (EFS) (Б) rates depending on the time interval between the first and second allo-HSCT
Рисунок 4. Сравнение общей выживаемости (ОВ) (А) и бессобытийной выживаемости (БСВ) (Б) больных при выполнении повторной алло-ТГСК от того же или другого донора
Figure 4. Comparison of the overall survival (OS) (A) and event-free survival (EFS) (Б) rates depending on whether a second allo-HSCT was performed from the same or another donor
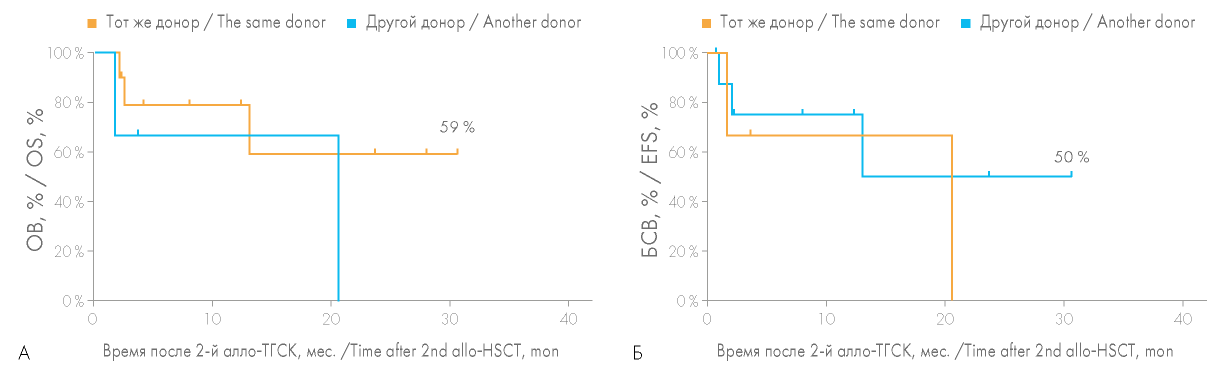
Рисунок 5. Сравнение общей выживаемости (ОВ) (А) и бессобытийной выживаемости (БСВ) (Б) больных при выполнении повторной алло-ТГСК от того же или другого донора у пациентов, которым была выполнена повторная алло-ТГСК по причине несостоятельности трансплантата после первой алло-ТГСК
Figure 5. Comparison of the overall survival (OS) (A) and event-free survival (EFS) (Б) rates for patients after second allo-HSCT from the same or another donor due to graft failure after the first allo-HSCT
Медиана продолжительности жизни больных, которым была выполнена повторная алло-ТГСК от другого донора по поводу рецидива, составила 10,6 мес., тогда как при алло-ТГСК от того же донора, — лишь 2,2 мес. Однако на вероятность ОВ и БСВ смена доно ра в группе больных с рецидивом гемобластоза не повлияла (рис. 5).
Вероятность развития острой РТПХ (оРТПХ) после второй алло-ТГСК составила 29 % (рис. 6). оРТПХ была констатирована у 7 из 24 больных: 3 больных из группы несостоятельности трансплантата и 4 больных из группы рецидива заболевания. При сравнении групп больных вероятность развития оРТПХ оказалась выше в группе рецидивов и составила 45 % против лишь 15 % в группе с несостоятельностью трансплантата, однако статистически эти различия были незначимы (р = 0,1874) (рис. 7). Учитывая выполнение второй алло-ТГСК на фоне рецидива гемобластоза, ИСТ у этих больных была редуцирована, что увеличило вероятность развития оРТПХ в этой группе: 3 больным в качестве индукции толерантности на +3, +4 дни вводился цикло- фосфамид, в случае трансплантации от родственного HLA-идентичного донора 1 больная получала микофенолата мофетил в дозе 3 г/сут. Вероятность развития оРТПХ после второй алло-ТГСК в случае выполнения алло-ТГСК от другого донора оказалась выше, чем при алло-ТГСК от того же донора (50 и 15 % соответственно). Повторная алло-ТГСК от другого донора была выполнена 10 больным, среди которых у 5 отмечено развитие оРТПХ, из них 3 больным в качестве профилактики РТПХ проводилась монотерапия циклофосфамидом.
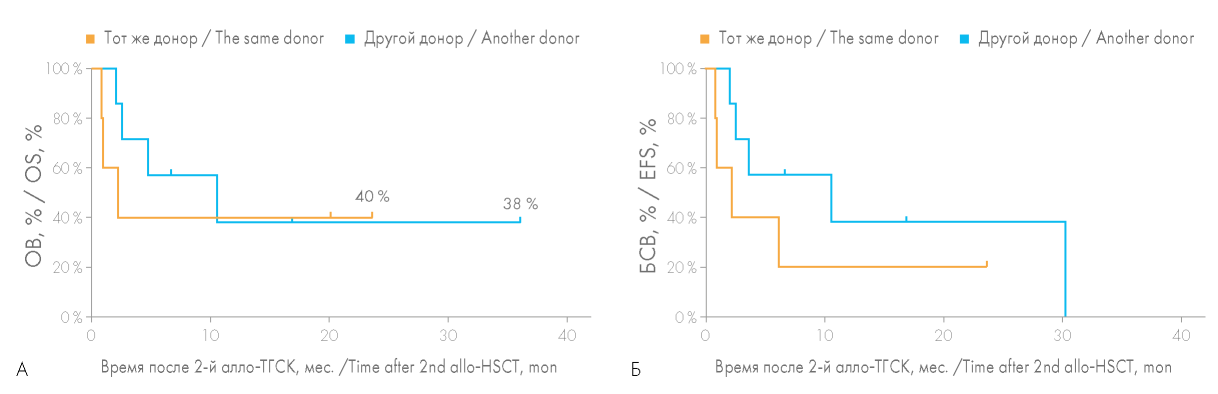
Рисунок 6. Сравнение общей выживаемости (ОВ) (А) и бессобытийной выживаемости (БСВ) (Б) больных при выполнении повторной алло-ТГСК от того же или другого донора у пациентов, которым была выполнена повторная алло-ТГСК по причине рецидива основного заболевания после первой алло-ТГСК
Figure 6. Comparison of the overall survival (OS) (A) and event-free survival (EFS) (Б) rates for patients after second allo-HSCT from the same or another donor due to the disease relapse after the first allo-HSCT
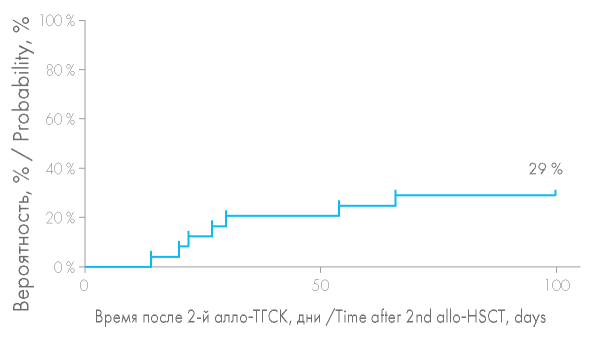
Рисунок 7. Вероятность развития острой реакции «трансплантат против хозяина» (оРТПХ) после повторной алло-ТГСК
Figure 7. Probability of acute graft-versus-host disease (aGVHD) after second allo- HSCT
Посттрансплантационная летальность составила 61,5 %. 6 больных умерли вследствие тяжелых инфекционных осложнений на фоне восстановления кроветворения или полной ремиссии гемобластоза, у двух из них инфекционные осложнения развились на фоне оРТПХ и терапии преднизолоном. Причиной смерти одного больного стал острый коронарный синдром, возникший через 20 мес. после алло-ТГСК, на момент смерти этот больной находился в ремиссии ОЛЛ, у него было 100 % донорское кроветворение. У 2 больных, которым повторная алло-ТГСК была выполнена в связи с первичным неприживлением трансплантата, не было отмечено восстановления числа лейкоцитов и после второй алло-ТГСК, и они умерли от инфекционных осложнений, возникших во время длительного периода гранулоцитопении. У 3 больных причиной летального исхода стала прогрессия гемобластоза, показанием к выполнению повторной алло-ТГСК этим больным явились резистентные к химиотерапии рецидивы заболевания.
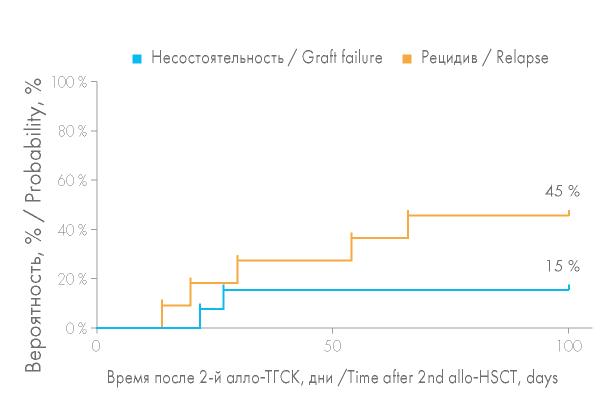
Рисунок 8. Вероятность развития острой реакции «трансплантат против хозяина» (оРТПХ) после повторной алло-ТГСК в зависимости от причины выполнения второй алло-ТГСК
Figure 8. Probability of acute graft-versus-host disease (aGVHD) after second allo- HSCT depending on the reason for second allo-HSCT
Ко времени анализа результатов 12 (50 %) больных на разных сроках после повторной алло-ТГСК живы, у 3 из них проводится паллиативная терапия в связи с резистентным течением заболевания, у 8 больных сохраняется полная ремиссия на фоне донорского кроветворения, и одна больная находится в ремиссии ОМЛ, несмотря на отторжение трансплантата и восстановление собственного кроветворения (по данным молекулярного исследования химеризма — 100 % ДНК реципиента).
Обсуждение
В настоящее время ТГСК остается одним из немно - гих методов, позволяющих излечить злокачественные заболевания системы крови, однако в случае неудачи ТГСК, в том числе при развитии несостоятельности трансплантата, отмечается крайне высокая летальность. Варианты дальнейшей терапии весьма ограничены, и повторная алло-ТГСК, особенно при сохранении панцитопении, агранулоци- тоза, может являться терапией выбора в кратчайшие сроки при констатации первичного неприживления трансплантата.
В настоящей работе проанализированы 24 случая повторных алло-ТГСК, выполненных в ФГБУ НМИЦ гематологии Минздрава России. ОВ больных после повторной алло-ТГСК составила 38,5 %, БСВ — 27,6 %. Схожие результаты были получены и другими исследователями. В 2015 г. был опубликован ретроспективный анализ вторых трансплантаций, выполненных больным с несостоятельностью трансплантата в клинике Университета Миннесоты. С 2000 по 2013 г. в исследование были включены более 200 человек, однолетняя ОВ составила 44 % [38]. В многоцентровом исследовании EBMT, в которое были включены 2632 больных и анализировались результаты повторной алло-ТГСК, выполненной в связи с рецидивом заболевания, были получены результаты, сопоставимые с результатами, полученными в настоящем исследовании: ОВ в течение 1 года после второй трансплантации составила 40 %, в течение 5 лет — 20 %, БСВ — 33 и 15 % соответственно [18].
Из полученных в настоящей работе данных следует: смена донора незначительно влияет на результаты проведения повторной алло-ТГСК, что подтверждается многими публикациями [50—56]. Таким образом, длительный поиск и активация другого неродственного донора представляется неоправданной, особенно если причиной выполнения повторной алло-ТГСК является первичное неприживление трансплантата, сопровождающееся панцитопенией, агранулоцитозом и высоким риском инфекционных осложнений. В этом случае может быть оправдано проведение алло-ТГСК от другого альтернативного донора, в первую очередь гаплоидентичного, при этом в качестве источника трансплантата лучше использовать гемопоэтические стволовые клетки, так как это дает возможность заготовить большее количество клеток-предшественников и добиться быстрого восстановления гемопоэза.
Необходимо признать, что вторая алло-ТГСК сопряжена с высоким риском развития жизнеугрожающих осложнений, во многом обусловленных необходимостью проведения предтрансплантационного кондиционирования, иммуносупрессии на фоне тяжелого соматического статуса больного и инфекционных осложнений, чем и обусловлена столь высокая летальность больных (61,5 %), преимущественно в ранние сроки (первые 100 дней) после трансплантации, в том числе при восстановлении кроветворения.
Таким образом, на сегодня повторная алло-ТГСК как метод, позволяющий восстановить донорское кроветворение и добиться длительной стойкой ремиссии основного заболевания, все чаще используется в случае неудачи первой алло-ТГСК. Благодаря выполнению повторной алло-ТГСК, по данным ряда многоцентровых исследований, удается достичь 30—40 % ОВ больных [18, 35—40]. В нашем исследовании были получены схожие результаты — ОВ составила 38,5 %. Однако высокая летальность, связанная с лечением, остается нерешенной проблемой, поскольку в большинстве случаев повторная алло-ТГСК выполняется в качестве «терапии спасения» на фоне длительной панцитопении, агранулоцитоза, тяжелых инфекционных осложнений или при возникновении рецидива заболевания. Необходимы дальнейшие клинические исследования по совершенствованию режимов кондиционирования, противовирусной и противогрибковой профилактики, сопроводительной и иммуносупрессивной терапии, а также проведение фундаментальных и клинических исследований, которые могут позволить прогнозировать неприживление трансплантата или добиться быстрого восстановления гемопоэза при проведении повторной алло-ТГСК.
Список литературы
1. Савченко В.Г., Любимова Л.С., Грибанова Е.О., Кузьмина Л.А. Трансплантация костного мозга больным острыми лейкозами в полной ремиссии и хроническим миелолейкозом в хронической фазе. Терапевтический архив. 1999; 71(7): 27–32.
2. Rautenberg C., Germing U., Haas R., et al. Relapse of Acute Myeloid Leukemia after Allogeneic Stem Cell Transplantation: Prevention, Detection, and Treatment. Int. J. Mol. Sci. 2019; 20 (1): 228–48. DOI: 10.3390/ijms20010228
3. Giebel S., Labopin M., Potter M., et al. Comparable results of autologous and allogeneic haematopoietic stem cell transplantation for adults with Philadelphiapositive acute lymphoblastic leukaemia in first complete molecular remission: An analysis by the Acute Leukemia Working Party of the EBMT. Eur J Cancer. 2018; 96: 73–81. DOI: 10.1016/j.ejca.2018.03.018
4. Schmid C., Wreede L.C., Biezen A., et al. Outcome after relapse of myelodysplastic syndrome and secondary acute myeloid leukemia following allogeneic stem cell transplantation: a retrospective registry analysis on 698 patients by the Chronic Malignancies Working Party of the European Society of Blood and Marrow Transplantation. Haematologica. 2018; 103(2): 237–45. DOI: 10.3324/ haematol.2017.168716
5. Porter D.L., Alyea E.P., Antin J.H., et al. NCI First International Workshop on the Biology, Prevention, and Treatment of Relapse after allogeneic hematopoietic stem cell transplantation: report from the Committee on treatment of relapse after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2010;16:1467–503. DOI: 10.1016/j.bbmt.2010.08.001
6. Levine J.E., Braun T., Penza S.L., et al. Prospective trial of chemotherapy and donor leukocyte infusions for relapse of advanced myeloid malignancies after allogeneic stem-cell transplantation. J Clin Oncol..2002; 20: 405–12. DOI: 10.1200/JCO.20.2.405
7. Choi S.J., Lee J.H., Kim S., et al. Treatment of relapsed acute myeloid leukemia after allogeneic bone marrow transplantation with chemotherapy followed by GCSF-primed donor leukocyte infusion: A high incidence of isolated extramedullary relapse. Leukemia. 2004; 18: 1789–97.
8. Schmid C., Labopin M., Nagler A., et al. Donor lymphocyte infusion in the treatment of first hematological relapse after allogeneic stem-cell transplantation in adults with acute myeloid leukemia: A retrospective risk factors analysis and comparison with other strategies by the EBMT Acute Leukemia Working Party. J Clin Oncol..2007; 25: 4938–45. DOI: 10.1200/JCO.2007.11.6053
9. Lubbert M., Bertz H., Wasch R., et al. Efficacy of a 3-day, low-dose treatment with 5-azacytidine followed by donor lymphocyte infusions in older patients with acute myeloid leukemia or chronic myelomonocytic leukemia relapsed after allografting. Bone Marrow Transplant. 2010; 45: 627–32.
10. Loren A.W., Porter D.L. Donor leukocyte infusions for the treatment of relapsed acute leukemia after allogeneic stem cell transplantation. Bone Marrow Transplant. 2008; 41(5): 483–93. DOI: 10.1038/sj.bmt.1705898
11. Martino R., Badell I., Brunet S., et al. Second bone marrow transplantation for leukemia in untreated relapse. Bone Marrow Transplant. 1994; 14: 589–93.
12. Mrsíc M., Horowitz M.M., Atkinson K., et al. Second HLA-identical sibling transplants for leukemia recurrence. Bone Marrow Transplant. 1992; 9: 269–75.
13. Radich J.P., Sanders J.E., Buckner C.D., et al. Second allogeneic marrow transplantation for patients with recurrent leukemia after initial transplant with totalbody irradiation-containing regimens. J Clin Oncol. 1993; 11: 304–13.
14. Chiang K.Y., Weisdorf D.J., Davies S.M. et al. Outcome of second bone marrow transplantation following a uniform conditioning regimen as therapy for malignant relapse. Bone Marrow Transplant. 1996; 17: 39–42.
15. Guièze R., Damaj G., Pereira B., et al. Management of myelodysplastic syndrome relapsing after allogeneic-hematopoietic stem cell transplantation: a study by the French society of bone marrow transplantation and cell therapies. Biol Blood Marrow Transplant. 2016; 22(2): 240–7. DOI: 10.1016/j.bbmt.2015.07.037
16. Schmid C., Labopin M., Nagler A., et al. Acute leukaemia working party of the European group for blood and marrow transplantation (EBMT). Treatment, risk factors, and outcome of adults with relapsed AML after reduced intensity conditioning for allogeneic stem cell transplantation. Blood. 2012; 119(6): 1599–606.
17. Schroeder T, Rachlis E, Bug G., et al. Treatment of acute myeloid leukemia or myelodysplastic syndrome relapse after allogeneic stem cell transplantation with azacitidine and donor lymphocyte infusions — a retrospective multicenter analysis from the German cooperative transplant study group. Biol Blood Marrow Transplant. 2015; 21(4): 186–93. DOI: 10.1038/bmt.2015.221
18. Wolff S.N. Second hematopoietic stem cell transplantation for the treatment of graft failure, graft rejection or relapse after allogeneic transplantation. Bone Marrow Transplant. 2002; 29: 545–52. DOI: 10.1038/sj.bmt.1703389
19. Olsson R., Remberger M. Graft failure in the modern era of allogeneic hematopoietic SCT. Bone Marrow Transplantation. 2013; 48: 537–43. DOI: 10.1038/ bmt.2013.32
20. Davies S.M., Kollman C., Anasetti C., et al. Engraftment and survival after unrelated-donor bone marrow transplantation: a report from the National Marrow Donor Program. Blood. 2000; 96 (13): 4096–102.
21. Anasetti C., Amos D., Beatty P.G., et al. Effect of HLA compatibility on engraftment of bone marrow transplants in patients with leukemia or lymphoma. N Engl J Med. 1989; 320: 197–204. DOI: 10.1056/ NEJM198901263200401
22. Rondón G., Saliba R., Khouri I., et al. Long Term Follow Up Of Patients Who Experienced Graft failure Post Allogeneic Progenitor Cell Transplantation. Results of a Single Institution Analysis Biol Blood Marrow Transplant. 2008; 14(8): 859– 66. DOI: 10.1016/j.bbmt.2008.05.005
23. Mattsson J., Ringdén O., Storb A. Graft Failure after Allogeneic Hematopoietic Cell Transplantation. Biol Blood Marrow Transplant. 2008; 14(Suppl 1): 165–70. DOI: 10.1016/j.bbmt.2007.10.025
24. Remberger M., Ringden O., Ljungman P., et al. Booster marrow or blood cells for graft failure after allogeneic bone marrow transplantation. Bone Marrow Transplant. 1998; 22: 73–8. DOI: 10.1038/sj.bmt.1701290
25. Larocca A., Piaggio G., Podesta M., et al. Boost of CD34+-selected peripheral blood cells without further conditioning in patients with poor graft function following allogeneic stem cell transplantation. Haematologica. 2006; 91: 935–40.
26. Bittencourt H., Rocha V., Filion A., et al. Granulocyte colony-stimulating factor for poor graft function after allogeneic stem cell transplantation: 3 days of G-CSF identifies long-term responders. Bone Marrow Transplantation. 2005; 36: 431–5. DOI: 10.1038/sj.bmt.1705072
27. Nemunaitis J., Singer J.W., Buckner C.D., et al. Use of recombinant human granulocyte-macrophage colony-stimulating factor in graft failure after bone marrow transplantation. Blood. 1990; 76: 245–53.
28. Weisdorf D.J., Verfaillie C.M., Davies S.M., et al. Hematopoietic growth factors for graft failure after bone marrow transplantation: a randomized trial of granulocyte-macrophage colony-stimulating factor (GM-CSF) versus sequential GM-CSF plus granulocyte-CSF. Blood. 1995; 85: 3452–6.
29. Remberger M., Mattsson J., Olsson R., et al. Second allogeneic hematopoietic stem cell transplantation: a treatment for graft failure. Clin Transplant. 2011; 25: 68–76. DOI: 10.1111/j.1399-0012.2010.01324.x
30. Schriber J., Agovi M., Ho V., et al. Second unrelated donor hematopoietic cell transplantation for primary graft failure. Biol Blood Marrow Transplant. 2005; 16: 1099–106. DOI: 10.1016/j.bbmt.2010.02.013
31. Kanda J., Horwitz M.E., Long G.D., et al. Outcomes of a 1-day nonmyeloablative salvage regimen for patients with primary graft failure after allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2012; 47: 700–5. DOI: 10.1038/bmt.2011.158
32. Sumi M., Shimizu I., Sato K., et al. Graft failure in cord blood transplantation successfully treated with short-term reduced-intensity conditioning regimen and second allogeneic transplantation. Int J Hematol. 2010; 92: 744–50. DOI: 10.1007/s12185-010-0714-6
33. Ayas M., Eapen M., Le-Rademacher J., et al. Second Allogeneic Hematopoietic Cell Transplantation for Patients with Fanconi Anemia and Bone Marrow Failure. Biol Blood Marrow Transplant. 2015; 21(10): 1790–5. DOI: 10.1016/j. bbmt.2015.06.012
34. Horan J.T., Carreras J., Tarima S., et al. Risk factors affecting outcome of second HLA-matched sibling donor transplantations for graft failure in severe acquired aplastic anemia. Biol Blood Marrow Transplant. 2009; 15: 626–31.
35. Arfons L.M., Tomblyn M., Rocha V., et al. Second hematopoietic stem cell transplantation in myeloid malignancies. Curr Opin Hematol. 2009; 16: 112–23. DOI: 10.1097/MOH.0b013e3283257a87
36. Byrne B.J., Horwitz M., Long G.D., et al. Outcomes of a second non-myeloablative allogeneic stem cell transplantation following graft rejection. Bone Marrow Transplant. 2008; 41: 39–43.
37. Fernandes J., Rocha V., Robin M., et al. Second transplant with two unrelated cord blood units for early graft failure after haematopoietic stem cell transplantation. Br J Haematol. 2007; 137: 248–51. DOI: 10.1111/j.1365-2141.2007.06562.x
38. Lund T.C., Liegel J., Bejanyan N., et al. Second allogeneic hematopoietic cell transplantation for graft failure: Poor outcomes for neutropenic graft failure. Am. J. Hematol. 2015; 90: 892–6. DOI: 10.1016/j.bbmt.2014.11.242
39. Andreola G., Labopin M., Beelen D., et al. Long-term outcome and prognostic factors of second allogeneic hematopoietic stem cell transplant for acute leukemia in patients with a median follow-up of greater than or equal to 10 years. Bone Marrow Transplant. 2015; 50(12): 1508–12. DOI: 10.1038/bmt.2015.193
40. Ruutu T., de Wreede L.C., van Biezen A., et al. Second allogeneic transplantation for relapse of malignant disease: retrospective analysis of outcome and predictive factors by the EBMT. Bone Marrow Transplantation. 2015; 9: 1–9.
Об авторах
Л. А. КузьминаРоссия
Кузьмина Лариса Анатольевна, кандидат медицинских наук, заведующая отделением трансплантации костного мозга
З. В. Конова
Россия
Конова Зоя Викторовна, врач-гематолог отделения трансплантации костного мозга
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, заведующая отделом химиотерапии гемобластозов, депрессий кроветворения и ТКМ
М. Ю. Дроков
Россия
Дроков Михаил Юрьевич, кандидат медицинских наук, руководитель сектора по изучению иммунных воздействий и осложнений после ТКМ
В. А. Васильева
Россия
Васильева Вера Алексеевна, кандидат медицинских наук, заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга с дневным стационаром
Н. Н. Попова
Россия
Попова Наталья Николаевна, врач-гематолог отделения трансплантации костного мозга
В. Г. Савченко
Россия
Савченко Валерий Григорьевич, академик Российской академии наук, профессор, доктор медицинских наук, генеральный директор
Рецензия
Для цитирования:
Кузьмина Л.А., Конова З.В., Паровичникова Е.Н., Дроков М.Ю., Васильева В.А., Попова Н.Н., Савченко В.Г. ПОВТОРНАЯ ТРАНСПЛАНТАЦИЯ АЛЛОГЕННЫХ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У БОЛЬНЫХ ГЕМОБЛАСТОЗАМИ. Гематология и трансфузиология. 2019;64(1):35-48. https://doi.org/10.35754/0234-5730-2019-64-1-35-48
For citation:
Kuzmina L.A., Konova Z.V., Parovichnikova E.N., Drokov M.Y., Vasilyeva V.A., Popova N.N., Savchenko V.G. SECOND ALLOGENEIC HEMATOPOIETIC STEM CELL TRANSPLANTATION IN PATIENTS WITH HEMATOLOGICAL MALIGNANCIES. Russian journal of hematology and transfusiology. 2019;64(1):35-48. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-35-48











































