Перейти к:
ИСПОЛЬЗОВАНИЕ МЕТОДА ПРОТОЧНОЙ ЦИТОМЕТРИИ ДЛЯ КОНТРОЛЯ СОДЕРЖАНИЯ ОСТАТОЧНЫХ ЛЕЙКОЦИТОВ В ПЛАЗМЕ КРОВИ
https://doi.org/10.35754/0234-5730-2019-64-1-66-72
Аннотация
Введение. Иммунологическая и инфекционная безопасность компонентов крови является основным критерием качества трансфузионной терапии. Внедрение методов фильтрации крови способствует разработке методов валидации контроля остаточных лейкоцитов в продуктах крови. Необходим простой в исполнении и надежный метод подсчета остаточных лейкоцитов в продуктах крови.
Целью данного исследования была сравнительная характеристика использования проточного цитометра и гематологического анализатора для контроля содержания остаточных лейкоцитов в плазме крови.
Материалы и методы. В исследовании сравнили два метода подсчета остаточных лейкоцитов в 191 образце донорской плазмы, производимой в ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России, при помощи проточного цитометра (Navios Beckman Coulter) с использованием коммерческого набора реагентов LeukoSure и гематологического анализатора Sysmex XT-4000i.
Результаты. Все проанализированные образцы плазмы соответствуют требованиям технического регламента. Большая часть образцов имела очень низкие количества остаточных лейкоцитов. Использование проточного цитометра Navios Beckman Coulter позволило определить в 83 % образцах количество лейкоцитов ≤15 кл в мкл, использование автоматического гематологического анализатора Sysmex XT-4000i для подсчета остаточных лейкоцитов в данном диапазоне ограничено чувствительностью прибора и отсутствием аттестованных контрольных материалов с низким содержанием лейкоцитов. Результаты текущего исследования показали, что подсчет остаточных лейкоцитов плазмы крови, оцененный с помощью проточного цитометра Navios Beckman Coulter, дает приемлемые результаты, он также наилучшим образом подходит для образцов с минимальным количеством клеток до 15 единиц в мкл.
Заключение. Значительная вариабельность содержания остаточных лейкоцитов в образцах плазмы крови свидетельствует о целесообразности проверки содержания лейкоцитов во всех компонентах крови.
Для цитирования:
Козырева В.С., Шилова А.Н., Шкода О.В. ИСПОЛЬЗОВАНИЕ МЕТОДА ПРОТОЧНОЙ ЦИТОМЕТРИИ ДЛЯ КОНТРОЛЯ СОДЕРЖАНИЯ ОСТАТОЧНЫХ ЛЕЙКОЦИТОВ В ПЛАЗМЕ КРОВИ. Гематология и трансфузиология. 2019;64(1):66-72. https://doi.org/10.35754/0234-5730-2019-64-1-66-72
For citation:
Kozyreva V.S., Shilova A.N., Shkoda O.S. FLOW CYTOMETRY FOR MEASURING RESIDUAL LEUKOCYTES IN BLOOD PLASMA. Russian journal of hematology and transfusiology. 2019;64(1):66-72. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-66-72
Введение
Потребление донорской крови и ее компонентов про - должает увеличиваться, что неизбежно ведет к росту посттрансфузионных осложнений. Развитие высокотехнологичной медицинской помощи обуславливает повышение требований к качеству компонентов крови. Предупреждение большинства нежелательных трансфузионных последствий заключается в повышении качества трансфузионных сред [1]. Иммунологическая и инфекционная безопасность компонентов крови является основным критерием качества трансфузионной терапии. Лейкоциты, их фрагменты и продуцируемые ими цитокины обуславливают посттрансфузионные осложнения. Переливание реципиенту свободных от лейкоцитов продуктов крови предотвращает HLA- аллоиммунизацию, фебрильную посттрансфузионную реакцию, реакцию «трансплантат против хозяина», острое трансфузионное поражение легких, передачу цитомегаловирусной инфекции, вируса Эпштейна — Барр, вируса Т-клеточного лейкоза человека, резко снижает вероятность передачи гепатотропных вирусов, иммуномодуляцию и передачу прионов (возбудителя болезни Крейтцфельдта — Якоба) [2].
В соответствии с техническим регламентом, утвержденным постановлением правительства от 26 января 2010 года № 29 [3], определены приемлемые характеристики качества различных трансфузионных сред: в эритроцитсодержащих компонентах, полученных методом афереза, должно содержаться не более 1х106 лейкоцитов в одной дозе, для концентрата тромбоцитов — не более 0,05х109 лейкоцитов в одной дозе, для плазмы — не более 0,1х109 лейкоцитов в литре. В соответствии с требованиями Совета Европы [4] компонент крови для трансфузии после удаления лейкоцитов должен содержать менее 1х106 клеток для профилактики посттрансфузионных реакций, обусловленных «остаточными лейкоцитами» [5]. Фильтрация компонентов крови необходима, что, в свою очередь, стимулирует разработку методов валидации контроля остаточных лейкоцитов. Согласно требованиям стандарта качества [5], концентрации лейкоцитов должны находиться в области значений, которые могут быть определены только на приборах с высокой разрешающей способностью. Гемоцитометрия Nageotte была первым практическим методом для подсчета остаточных клеток в компонентах крови и считалась подходящей для рутинного контроля качества [6—8]. Описанный в 1990-х годах данный способ определения с использованием метода световой микроскопии и гемоцитометра большого объема (счетной камеры Nageotte) не позволяет провести экспертную оценку качества фильтрации в силу недостаточной чувствительности метода и характеризуется высокой вариабельностью получаемых результатов [6—8]. Метод Nageotte слишком трудоемкий и неуместен в качестве метода выбора, когда нужно тестировать большое количество образцов [9].
Для преодоления этих трудностей были разработаны альтернативные методы подсчета: автоматизированный объемный капиллярный цитометр [10], проточные цитометрические методы [11, 12] и методы полимеразной цепной реакции [13]. В нескольких исследованиях [10, 14, 15] сравнили количество лейкоцитов, подсчитанных автоматическими методами, с результатами подсчета лейкоцитов, полученными с помощью гемоцитометрии Nageotte. Использование многократных разбавлений показало, что точность ге- моцитометра Nageotte была низкой при малых концентрациях остаточных клеток, а результаты были ниже по сравнению с результатами, полученными с помощью автоматизированных методов [6, 16]. Большое количество исследований посвящено сравнению гемоцитометрии Nageotte с различными автоматизированными методами подсчета, основанными на технологии проточной цитометрии [17]. Использование гематологических анализаторов для подсчета остаточных лейкоцитов крайне ограничено в связи с недостаточной чувствительностью анализа и отсутствием контрольных материалов. А.И. Костин и соавт. [1] отмечают при подсчете лейкоцитов в эритроцитсодержащих компонентах сходство результатов подсчета лейкоцитов до фильтрации обоими методами и допускают возможность использования обычного гематологического анализатора, прошедшего процедуру валидации, при необходимости определения количества лейкоцитов в эритроцитсодержащих компонентах, не подвергавшихся лейкоредукции. Авторы [1] отмечают, что количество остаточных лейкоцитов было выше рекомендованного экспертами Совета Европы [4].
Целью данного исследования была сравнительная характеристика использования проточного цитометра и гематологического анализатора для контроля содержания остаточных лейкоцитов в плазме крови.
Материалы и методы
В качестве анализируемой трансфузионной среды была выбрана плазма крови. Выбор плазмы крови в качестве анализируемой трансфузионной среды был обусловлен тем, что плазма крови — один из самых широко востребованных компонентов крови, при этом стандарты качества в отношении «остаточных лейкоцитов» для плазмы стали применяться относительно недавно по сравнению с эритроцитсодержащими компонентами крови и концентратами тромбоцитов [18].
Для исследования использован 191 образец донорской плазмы крови, произведенный в ФГБУ «НМИЦ им. акад. Е.Н. Мешалкина» Минздрава России, г. Новосибирск.
Для подсчета «остаточных лейкоцитов» в плазме кро - ви на проточном цитометре Navios Beckman Coulter (США) использовали набор реагентов Beckman Coulter LeukoSure (США). Образец плазмы крови лизиро- вали и проводили через процедуру повышения проницаемости мембран с использованием оригинального лизирующего реагента LeukoSure, Beckman Coulter (США). При помощи РНКазы удаляли РНК, и красящий реагент, содержащий йодид пропидия, связывался только с ДНК. Ядросодержащие клетки в образце флуоресцировали с интенсивностью пропорциональной содержанию ДНК. Зрелые эритроциты и тромбоциты, не содержащие ДНК, не связывают краситель. Непосредственно перед анализом добавляли 100 мкл гомогенизированных флуоросфер LeukoSure, осторожно перемешивали, пробирки загружали в карусель для автоматического анализа. Для анализа использовалось фиксированное количество — 10 000 клеток: после того как на проточном цитометре проанализировали 10 000 клеток, протокол измерения останавливали. В регион обнаружения были включены только неповрежденные лейкоциты. При помощи проточного цитометра Navios Beckman Coulter измеряли флуоресценцию каждой помеченной клетки. Так как зрелые тромбоциты и «красные клетки» крови не содержат
ДНК, то помеченные клетки представляли собой лейкоцитарный компонент образца.
Процедура лизиса и окрашивания, настройка проточного цитометра и создание протоколов измерения проходили согласно инструкции производителя к комплекту реагентов. Линейность измерения лейкоцитов, заявленная производителем, определена диапазоном от 0 до 400 клеток в 1 мкл образца. Контроль качества измерений содержания лейкоцитов в плазме крови проводили с использованием двух уровней контрольных материалов, Leuko-Trol Platelet Control Cells Low/ High Beckman Coulter в каждой аналитической серии. Контрольные материалы для оценки качества измерения остаточных лейкоцитов соответствовали следующим диапазонам измерений: 0,5-4,5 клетки в 1 мкл и 14,5-25,5 клетки в 1 мкл соответственно.
В этих же образцах плазмы крови содержание лейкоцитов определяли при помощи автоматического гематологического анализатора Sysmex XT-4000i (Япония) согласно стандартному протоколу работы на автоматическом гематологическом анализаторе. В данном гематологическом анализаторе для подсчета количества лейкоцитов используется также принцип флуоресцентной проточной цитометрии. Проба направляется в проточную кювету. Образец подсвечивается лучом полупроводникового лазера, который может разделять клетки посредством трех различных сигналов: прямо рассеянный свет (прямое рассеяние/FSC), боковой рассеянный свет (боковое рассеяние/SSC), боковой флуоресцентный свет (боковая флуоресценция/SFL). Интенсивность прямого рассеяния указывает на объем клетки. Боковое рассеяние предоставляет информацию о содержимом клетки: о ядре и гранулах. Боковая флуоресценция указывает на количество ДНК и РНК в клетке. Клетки со схожими физико-химическими свойствами формируют кластер на графическом изображении, известном как диаграмма рассеивания.
Линейность измерения содержания лейкоцитов в режиме анализа биологической жидкости, заявленная производителем, определена в диапазоне 0,05х103 до 10,000х103 клеток в 1 мкл образца. В связи с тем что нет коммерческих контрольных материалов, разработанных для контроля остаточных лейкоцитов и аттестованных для автоматического гематологического анализатора Sysmex XT-400, контроль качества измерений содержания лейкоцитов в образцах плазмы крови проводили с использованием трех уровней контрольных материалов: Liquichek Hematology Control (X) Levels 1, 2 and 3 Bio-Rad. Контрольные материалы для оценки качества измерения остаточных лейкоцитов соответствовали следующим диапазонам измерений: (3,0- 4,6)х103 клеток в 1 мкл, (6,3-8,3)х103 клеток в 1 мкл и (16,7-20,9)х103 клеток в 1 мкл соответственно.
Статистическая обработка результатов произведена с использованием статистических критериев в программе Statistica 6.0. Полученные результаты измерения количества остаточных лейкоцитов методом проточной цитометрии проверены на нормальность распределения при помощи метода Колмогорова — Смирнова. Результаты представлены в виде медианы, межквартильного интервала (25 и 75 % квартили).
Результаты
Количество лейкоцитов в анализируемых образцах плазмы, определенных при помощи проточного цитометра и гематологического анализатора, представлено в таблице 1.
Обращала на себя внимание неоднородность распределения количества остаточных лейкоцитов в различных образцах донорской плазмы (рис. 1). 98,95 % анализируемых образцов донорской плазмы имели количество остаточных лейкоцитов менее 100 кл/мкл. 2 образца донорской плазмы содержали лейкоциты 140 и 217 кл/мкл соответственно. Большая часть (83 %) анализируемых образцов плазмы имела количество остаточных лейкоцитов меньше либо равное 15 кл/мкл, из них 20 % имело нулевое содержание остаточных лейкоцитов, определенное методом проточной цитометрии.
Количество лейкоцитов 0,05х103 кл/мкл соответствовало нижней границе линейности измерения анализатора в режиме биологической жидкости. Соответственно результаты измерения количества лейкоцитов, находящиеся ниже предела линейности (85 % образцов), не могли быть оценены достоверно.
При оценке остаточного количества лейкоцитов повышенного внимания заслуживали образцы с малым количеством лейкоцитов, поскольку в связи с повышающимися требованиями к компонентам крови приоритет должен быть отдан использованию образцов с наименьшим содержанием остаточных лейкоцитов.
Имелась значимая корреляция (r = 0,96718, p = 0,95) между количеством остаточных лейкоцитов, определенных при помощи проточного цитометра, и количеством лейкоцитов, определенных при помощи гематологического анализатора (рис. 2).
Таблица 1. Количество остаточных лейкоцитов в плазме донорской крови, определенное при помощи проточного цитометра и автоматического гематологического анализатора
Table 1. Use of a flow cytometer and a hematology analyzer for counting residual leucocytes in donor plasma
Проточный цитометр, количество лейкоцитов, кл/мкл Flow cytometer, WBC cells/μΙ | Гематологический анализатор, количество лейкоцитов, кл/мкл Hematology analyzer, WBC cells/μΙ |
|---|---|
2,000 (1,00;5,00) | 10,000 (0,00;10,00) |
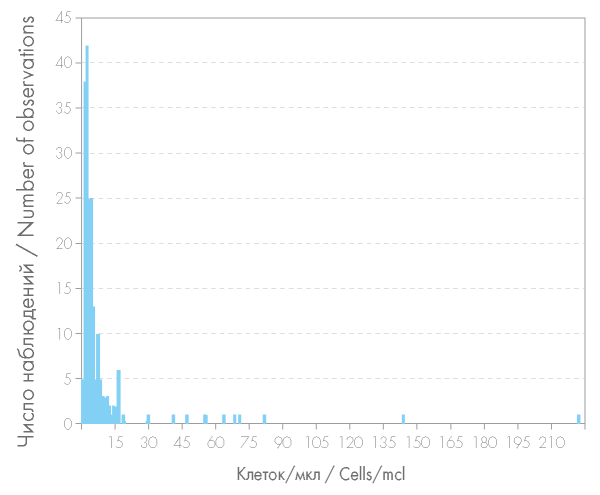
Рисунок 1. Содержание остаточных лейкоцитов в плазме донорской крови, определенное при помощи проточного цитометра
Figure 1. Residual leucocytes content in donor plasma determined by a flow cytometer
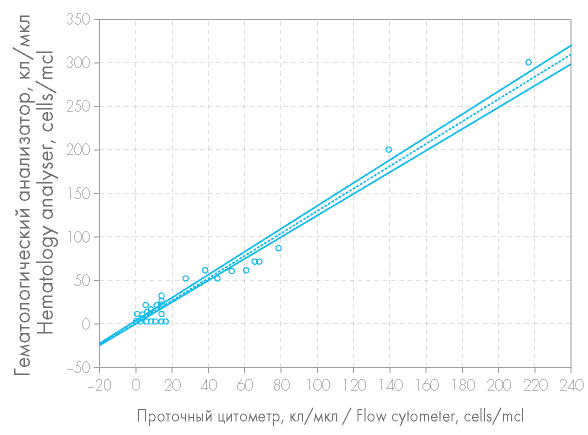
Рисунок 2. Корреляция значений количества лейкоцитов, измеренных при помощи проточного цитометра и гематологического анализатора (г = 0,96718, p = 0,95)
Figure 2. Correlation between WBC estimated by a flow cytometer and a hematology analyser (r = 0,96718, p = 0,95)
Обсуждение
Развитие технологий афереза позволяет производить плазму, практически не содержащую клеток крови, что, в свою очередь, требует наличия простого, объективного и точного метода подсчета остаточных клеток крови. В данном исследовании сравнили использование автоматического гематологического анализатора Sysmex XT-4000i и проточной цитометрии (Navios) с коммерческим набором для подсчета остаточных лейкоцитов в плазме крови. В отсутствие метода «золотого стандарта», учитывая, что не проводили эксперименты по разбавлению, основной целью было выяснить соответствие между этими методами и преимущества использования в реальных условиях работы лаборатории.
Обнаружена сильная корреляция значений количества лейкоцитов, измеренных при помощи проточного цитометра Navios и гематологического анализатора Sysmex XT-400 (г=0,96718, p=0,95), что свидетельствует о хорошей сопоставимости методов и, вероятно, возможной взаимозаменяемости в условиях работы лаборатории.
Согласно анализу на гематологическом анализаторе, все компоненты донорской плазмы соответствовали техническому регламенту, но пороговые значения прибора не позволяли точно оценить низкие значения концентраций клеток после лейкоредукции.
Лейкоциты в плазме крови способны к активации во время хранения и секреции цитокинов и факторов роста, что, в свою очередь, может вызвать трансфузионные реакции у реципиента [19, 20]. Относительно большое количество остаточных лейкоцитов (до 100 кл в мкл) допускается согласно техническому регламенту [3], но адаптации Европейского совета [4] рекомендуют использовать продукты плазмы с наименее возможным содержанием остаточных клеток. С учетом того, что отдается предпочтение использованию образцов с минимальным содержанием остаточных клеток, предпочтительнее использовать проточную цитометрию с коммерческим набором реагентов для подсчета остаточных лейкоцитов в продуктах крови. Кроме того, наличие аттестованных контрольных материалов с диапазонами значений низких концентраций лейкоцитов свидетельствует в пользу выбора метода проточной цитометрии для рутинной оценки количества остаточных клеток в продуктах крови, так как позволяет сделать выводы о воспроизводимости и правильности проводимых измерений. К недостаткам данного метода можно отнести высокую стоимость по сравнению с использованием гематологического анализатора и наличие технической подготовки оператора прибора при настраивании протоколов. Оба метода не являются трудоемкими и могут использоваться для большого потока исследований.
Таким образом, для полноценного удаления лейкоцитов из трансфузионных сред с целью снижения риска трансфузионных осложнений необходим правильный контроль качества компонентов крови в отношении количества остаточных лейкоцитов. Результаты настоящего исследования показали, что подсчет остаточных лейкоцитов плазмы крови для проверки на соответствие техническому регламенту возможен как при использовании технологии проточной цитометрии, так и при использовании автоматического гематологического анализатора. Применение метода проточной цитометрии позволяет с высокой точностью производить подсчет остаточных лейкоцитов в компонентах крови за счет улавливания наименьших значений. Использование проточного цитометра с коммерческим анализом набора лучше подходит для образцов с минимальным количеством клеток до 15 клеток в мкл по сравнению с использованием гематологического анализатора.
Значительная вариабельность содержания остаточных лейкоцитов в образцах плазмы крови свидетельствует о целесообразности проверки содержания лейкоцитов во всех компонентах крови.
Список литературы
1. Костин А.И., Майорова О.А., Ложкин А.В. и др. К вопросу о контроле качества эритроцитсодержащих компонентов крови, обедненных лейкоцитами. Трансфузиология. 2011; 12(2): 12–33.
2. Максимов В.А. Инфекционная безопасность донорской крови и ее компонентов. Санэпидемконтроль. Охрана труда. 2009; 3.
3. Постановление Правительства РФ от 26 января 2010 г. № 29 «Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии» (с изменениями и дополнениями).
4. Council of Europe Publishing. Strasbourg, France. Guide to the preparation use and quality assurance of blood components, 7th edition. 2001. 127–32.
5. Зарубин М.В., Саратова О.Е., Веревкина Л.Н., Жибурт Е.Б. Стратификация плазмы по содержанию лейкоцитов. Актуальные вопросы трансфузиологии и клинической медицины. 2015; 1: 67–70.
6. Dzik S., Moroff G., Dumont L. A multicenter study evaluating three methods for counting residual WBCs in WBC-reduced blood components: Nageotte haemocytometry, flow cytometry, and microfluorimetry. Transfusion. 2000; 40: 513–20.
7. Van Der Meer P.F., Gratama J.W., Van Delden C.J., et al. Comparison of five platforms for enumeration of residual leucocytes in leucoreduced blood components. Br J Haematol. 2001; 115: 953–62.
8. Dzik W.H., Ragosta A., Cusack W.F. Flow-cytometric method for counting very low numbers of leukocytes in platelet products. Vox Sang. 1990; 59: 153–9.
9. Palmer D.S., Birch P., O’Toole J., et al. Flow cytometric determination of residual white blood cell levels in preserved samples from leukoreduced blood products. Transfusion. 2008; 48(1): 118–28.
10. Adams M.R., Johnson D.K., Busch M.P., et al. Automated volumetric capillary cytometry for counting white cells in white cell-reduced plateletpheresis components. Transfusion. 1997; 37: 29–37.
11. Wenz B., Burns E.R., Lee V., Miller W.K. A rare-event analysis model for quantifying white cells in white cell-depleted blood. Transfusion. 1991; 31: 156–9.
12. Barclay R., Walker B., Allan R., et al. Flow cytometric determination of residual leucocytes in filter-depleted blood products: an evaluation of Becton-Dickinson’s Leuco COUNT system. Transfus Sci. 1998; 19: 399–403.
13. Lee T.H., Stromberg R.R, Heitman J., et al. Quantification of residual white cells in filtered blood components by polymerase chain reaction amplification of HLA DQ-A DNA. Transfusion 1994; 34: 986–94.
14. Dumont L.J., Dumont D.F. Enhanced flow cytometric method for counting very low numbers of white cells in platelet products. Cytometry. 1996; 26: 311–6.
15. Dzik W.H., Rebulla P. Multicenter evaluation of methods for counting residual white cells in leukocyte-depleted red blood cells. Vox Sang. 1994; 66: 25–32.
16. van der Meer P.F., Gratama J.W., van Delden C.J., et al. Comparison of five platforms for enumeration of residual leucocytes in leucoreduced blood components. Br. J. Haematol. 2001; 115: 953–62.
17. Kyriakou E., Nearchakos N., Bonovas S. Comparison between Nageotte and flow cytometric counting of residual leucocytes in freshly prepared leucocytereduced red blood cell components. Transfus Apher Sci. 2018. DOI: 10.1016/j. transci.2018.06.002 [Epub ahead of print]
18. Masse M. Universal leukoreduction of cellular and plasma components: process control and performance of the leukoreduction process. Tranfus Clin Biol. 2001; 8: 297–302.
19. Muylle L. The role of cytokines in blood transfusion reactions. Blood Rev. 1995; 9: 77–83.
20. Sedlmayr P., Blaschitz A., Wilders-Truschnig M., et al. Platelets contain interleukin-1 alpha and beta which are detectable on the cell surface after activation. Scand J Immunol. 1995; 42: 209–14.
Об авторах
В. С. КозыреваРоссия
Козырева Виктория Сергеевна*, врач клинической лабораторной диагностики лаборатории клинической иммунологии отделения лабораторной диагностики
тел.: +7 (913)757-64-03; 630050, г. Новосибирск, ул. Речкуновская, 15
А. Н. Шилова
Россия
Шилова Анна Николаевна, доктор медицинских наук, заведующий отделением лабораторной диагностики
О. В. Шкода
Россия
Шкода Ольга Сергеевна, врач КЛД лаборатории клинической иммунологии отделения лабораторной диагностики
Рецензия
Для цитирования:
Козырева В.С., Шилова А.Н., Шкода О.В. ИСПОЛЬЗОВАНИЕ МЕТОДА ПРОТОЧНОЙ ЦИТОМЕТРИИ ДЛЯ КОНТРОЛЯ СОДЕРЖАНИЯ ОСТАТОЧНЫХ ЛЕЙКОЦИТОВ В ПЛАЗМЕ КРОВИ. Гематология и трансфузиология. 2019;64(1):66-72. https://doi.org/10.35754/0234-5730-2019-64-1-66-72
For citation:
Kozyreva V.S., Shilova A.N., Shkoda O.S. FLOW CYTOMETRY FOR MEASURING RESIDUAL LEUKOCYTES IN BLOOD PLASMA. Russian journal of hematology and transfusiology. 2019;64(1):66-72. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-1-66-72











































