Перейти к:
ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ НЕЙТРОФИЛОВ: НОВЫЕ АНТИМИКРОБНЫЕ Х АРАКТЕРИСТИКИ И ДИАГНОСТИЧЕСКИЕ ТЕХНОЛОГИИ
https://doi.org/10.35754/0234-5730-2019-64-2-211-221
Аннотация
Введение. Нейтрофилы — наиболее многочисленная субпопуляция циркулирующих в крови лейкоцитов, они составляют первую линию защиты врожденного звена иммунной системы.
Цель обзора: обобщить основные концепции фенотипической и функциональной гетерогенности нейтрофилов.
Основные сведения. В дополнение к антимикробным функциям нейтрофилов современные представления об этом пуле клеток крови отражают несколько новых стратегий захвата и уничтожения микроорганизмов: фагоцитоз и внутриклеточную деградацию, дегрануляцию и образование внеклеточных нейтрофильных ловушек после обнаружения микроорганизмов. Нейтрофилы рассматривают как фенотипически гетерогенный пул со значительной функциональной вариабельностью. В патологических условиях они могут дифференцироваться в дискретные субпопуляции с различными фенотипическими и функциональными характеристиками. Они способны входить во взаимодействие с макрофагами, природными киллерами, дендритными и мезенхимальными стволовыми клетками, B- и T-лимфоцитами или тромбоцитами, проявлять разновекторные свойства по отношению к раковым опухолям. Нейтрофилы представляют собой фенотипический гетерогенный пул клеток крови. Они обладают высокой морфологической и функциональной вариабельностью, являются модуляторами как воспаления, так и активных эффекторов иммунных реакций. Актуальна проблема поиска молекулярных маркеров, позволяющих эффективно дифференцировать фенотипы нейтрофилов, установить степень их диагностической специфичности при различных патологиях.
Ключевые слова
Для цитирования:
Андрюков Б.Г., Богданова В.Д., Ляпун И.Н. ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ НЕЙТРОФИЛОВ: НОВЫЕ АНТИМИКРОБНЫЕ Х АРАКТЕРИСТИКИ И ДИАГНОСТИЧЕСКИЕ ТЕХНОЛОГИИ. Гематология и трансфузиология. 2019;64(2):211-221. https://doi.org/10.35754/0234-5730-2019-64-2-211-221
For citation:
Andryukov B.G., Bogdanova V.D., Lyapun I.N. PHENOTYPIC HETEROGENEITY OF NEUTROPHILS: NEW ANTIMICROBIC CHARACTERISTICS AND DIAGNOSTIC TECHNOLOGIES. Russian journal of hematology and transfusiology. 2019;64(2):211-221. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-211-221
Нейтрофилы, или полиморфнонуклеарные нейтрофилы (ПМН) (polymorphonuclear neutrophils, PMN), являются наиболее многочисленным пулом лейкоцитов и основными клеточными компонентами врожденной иммунной системы человеческого организма и обладают как противоинфекционной, так и провоспалительной функцией [1—4]. Традиционно считалось, что нейтрофилы являются относительно гомогенной популяцией терминально дифференцированных лейкоцитов, что эти клетки, в отличие от лимфоцитов и моноцитов, обладают ограниченной универсальностью и пластичностью [1]. Однако полученные в последние годы данные показали, что ПМН представляют собой фенотипический гетерогенный пул и обладают высокой морфологической и функциональной вариабельностью [2, 3], что позволяет рассматривать нейтрофилы в качестве как важных модуляторов воспаления, так и активных эффекторов иммунных реакций [3, 4].
Еще в 1920 г. высказывались сомнения насчет гомогенности этого лейкоцитарного пула, основанные на сведениях, что циркулирующие нейтрофилы могут демонстрировать значительные различия в функциях, таких как фагоцитоз, синтез белка и окислительный обмен (цит. по [2]). Однако до недавнего времени лишь ограниченное количество исследований касалось фенотипических различий ПМН, и только благодаря обнаружению высокоспецифичных нейтрофильных маркеров стало возможным разделить эту субпопуляцию клеток на подмножества [2—4].
Целью настоящего обзора является обобщить основные концепции фенотипической и функциональной гетерогенности нейтрофилов с позиции их функций и роли в развитии физиологических и патологических реакций. Особое внимание будет уделено диагностической и иммуномодулирующей стратегиям.
Нейтрофилы: созревание и жизненный цикл
В нормальных условиях нейтрофилы образуются в костном мозге из морфологически неидентифицируемых гемопоэтических стволовых клеток, способных пролиферировать и дифференцироваться в белые и красные кровяные клетки и клетки — предшественники миелопоэза (гранулоцитарно-макрофагальная колониеобразующая единица (КОЕ-ГМ) гранулоци- тарная колониеобразующая единица (КОЕ-Г) [3, 5—7]. Деление и созревание этих клеток стимулируются факторами роста (интерлейкинами, гранулоцитарно- макрофагальным колониестимулирующим фактором (ГМ-КСФ) и гранулоцитарным КСФ — основными цитокинами, регулирующим гранулопоэз в норме через рецептор гранулоцитарного колониестимулирующего фактора, что приводит к формированию миелоидных пулов делящихся клеток (миелобластов, промиелоцитов и миелоцитов) и нейтрофилов, которые в процессе дифференцировки утратили способность к делению (метамиелоцитов, палочкоядерных и сегментоядерных гранулоцитов). Неделящийся пул составляет основную массу гранулоцитарного костномозгового резерва, превышающий по численности клетки, циркулирующие в периферической крови, в 30—70 раз [5, 8, 9]. Основные функции костномозгового резерва — поддерживать гомеостаз гранулоцитов («гомеостатический гранулопоэз»), циркулирующих в крови, и мобилизовать дополнительное количество клеток («экстренный гранулопоэз») при возникающей необходимости (воспаление, инфекции, рак и другие) [10, 11]. О значении гранулопоэза для организма говорит тот факт, что клетки миелоидных пулов занимают около 2/3 объема костного мозга [10].
Для поддержания гомеостаза уровня нейтрофилов других клеток в периферической крови пролиферация и дифференцировка клеток-предшественников жестко регулируется и контролируется несколькими внутренними и внешними факторами. Например, в нишах костного мозга гемопоэтические стволовые клетки сохраняются посредством взаимодействия мембранных β-интегринов с остеобластами и внеклеточным матриксом [4, 12, 13].
После созревания ПМН попадают в периферический кровоток (5х1010—1011 клеток в сутки), мигрируют в ткани, где они выполняют свои антимикробные функции. Соответственно, эквивалентное количество стареющих нейтрофилов должно быть удалено из кровообращения для сохранения гомеостаза. Нейтрофильный гомеостаз в периферической крови строго регулируется благодаря многокомпонентному механизму поддержания баланса между ростом ПМН, их дифференцировкой и элиминацией [4, 12]. Этот баланс обеспечивает выполнение этими клетками многочисленных функций с помощью фенотипической пластичности [3, 13]. Нарушение гомеостаза периферических нейтрофилов влияет на врожденный и адаптивный иммунитет, может привести к возникновению опасных для жизни инфекций, аутоиммунным или онкологическим заболеваниям.
На протяжении всей их жизни нейтрофилы по мере созревания претерпевают фенотипические переходы, которые могут быть продиктованы местным микроокружением в кровообращении и периферических тканях. Во время развития и созревания нейтрофилы проходят ряд последовательных стадий до формирования генерации зрелых нейтрофилов [12, 13]. Гранулопоэтическая популяция нейтрофилов в костном мозге делится на 3 различных пула: стволовых клеток, митотический и постмитотический. Пул стволовых клеток состоит из недифференцированных полипотентных клеток-предшественников. Митотический пул представлен миелоидными клетками-предшественниками, такими как миелобласты, промиелоциты, метамиелоциты и миелоциты. Постмитотический пул состоит из метамиелоцитов и палочкоядерных нейтрофилов. Наконец, зрелые нейтрофилы являются полностью дифференцированной клеточной генерацией, которая выходит из костного мозга и циркулирует в периферической крови.
По мере созревания и на разных стадиях диффе- ренцировки в цитоплазме нейтрофилов появляются гранулы (азурофильные, специфические и желати- назные) и секреторные пузырьки, которые содержат антимикробные пептиды и ферменты: эластазы, мие- лопероксидазы, кателицидины, дефензины и матрикс- ные металлопротеиназы, являющиеся эффективным инструментом для реализации антибактериальных стратегий ПМН [2, 10, 12].
Гранулярный аппарат нейтрофилов необходим для выполнения ими своей роли при врожденном иммунном ответе. Биологические молекулы, входящие в состав гранул, реагируют на окружающие сигналы, стимулирующие миграцию нейтрофилов к очагу инфекции и фагоцитоз вторгающихся микробов, инициируют генерацию активных форм кислорода из НАДФН-оксидазы, протеаз и антимикробных пептидов, которые, действуя совместно, создают агрессивную внутрифагосомальную среду и вызывают микробную эрадикацию [10, 13—16].
Важность образования активных форм кислорода проявляется при хронических гранулематозных заболеваниях с дефектной окислительной функцией ПМН. Для этих пациентов характерны частые рецидивирующие бактериальные и грибковые инфекции [4, 12, 14].
Являясь важными эффекторами иммунной системы, нейтрофилы ведут постоянный мониторинг организма, выявляя признаки микробных инфекций. После их обнаружения они мигрируют через эндотелий кровеносных сосудов в очаг инфекции или воспаления с помощью механизма, известного как каскад адгезии лейкоцитов (в котором принимают также участие селектины, лиганды и интегрины), и убивают вторгшиеся микроорганизмы [2, 5, 15, 16].
Миграция нейтрофилов в ткани имеет решающее значение для защиты от микробных инфекций. Важность этой функции проявляется у больных с дефектами адгезии этих клеток, что приводит к нарушению их миграции через эндотелий кровеносных сосудов. Такие больные страдают от множественных бактериальных инфекций из-за неспособности нейтрофилов к фагоцитозу [17, 18].
После выполнения своей функции в тканях нейтро- филы подвергаются апоптозу или элиминируются посредством фагоцитоза резидентными макрофагами и дендритными клетками. Запрограммированная гибель нейтрофилов — апоптоз — критичный процесс, модулирующий их количество и функции, запуская каскад противовоспалительных реакций и снижения продукции нейтрофилов [3, 17, 19—21].
В настоящее время признаны три основные проти- вомикробные стратегии нейтрофилов: фагоцитоз, дегрануляция, и формирование нейтрофильных внеклеточных ловушек (neutrophil extracellular traps, NETs) (рис. 1). NETs представляют собой защитный механизм, впервые описанный как средство улавливания и уничтожения бактерий и других патогенов [11, 22, 23]. Осуществляя такого рода внеклеточный киллинг микроорганизмов, нейтрофилы погибают через NETosis [11, 24].
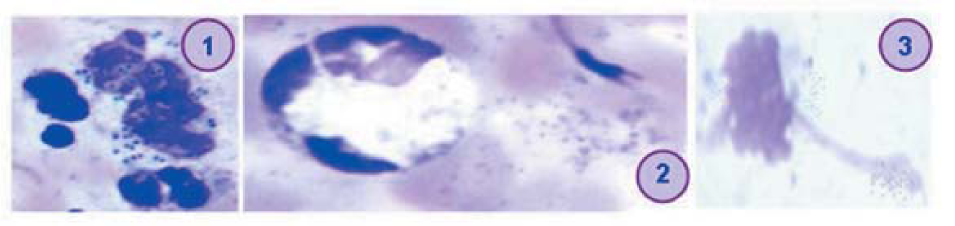
Рисунок 1. Антибактериальные стратегии нейтрофилов: 1 — фагоцитоз; 2 — дегрануляция; 3 — нейтрофильные ловушки (рисунок авторов, световая микроскопия)
Figure 1. Anfibacferial strategies of neutrophils: I — phagocytosis; 2 — degranulation; 3 — neutrophilic traps (the authors' picture, light microscopy)
Для выпуска сети активированные нейтрофилы претерпевают драматические морфологические изменения. Через минуты после активации они сплющиваются и крепко прикрепляются к субстрату. В течение следующего часа ядро теряет свои дольки, происходит деконденсация хроматина, а внутренние и внешние ядерные мембраны постепенно отделяются друг от друга. Одновременно гранулы распадаются. Через 1 ч ядерная оболочка дезагрегируется в везикулы, а нук- леоплазма и цитоплазма образуют гомогенную массу. Наконец, клетки округляются и, по-видимому, сжимаются до тех пор, пока клеточная мембрана не разрывается, а внутренняя часть клетки выбрасывается во внеклеточное пространство, образуя NETs [25].
Эти противомикробные стратегии до настоящего времени считались единственной функцией нейтро- филов. Однако недавние исследования биологии этих клеток показали, что они обладают разнообразным набором функциональных реакций, которые выходят за рамки простого уничтожения микроорганизмов [17, 18, 25].
Широкий спектр функциональных ответов нейтро- филов индуцируется активацией транскрипции и изменениями в экспрессии поверхностных молекул и их активности. Эти фенотипические изменения обычно обнаруживаются только в подгруппе нейтрофилов, что позволяет предположить наличие гетерогенных фенотипов этих клеток [3, 17, 19, 26].
Гетерогенность нейтрофилов
Теория гетерогенности нейтрофилов зародилась более 50 лет назад, когда была предложена концепция маргинального пула нейтрофилов [4, 19, 27], либо прикрепленных к сосудам, либо находящихся полностью вне циркуляционного русла. Они могут быть мобилизованы при стимуляции [5, 28]. Эксперименты проводились с использованием радиоактивной метки нейтрофилов и помогли определить в качестве резервуаров для них селезенку, печень и костный мозг, так как требуется меньше времени для прохождения через эти органы. Вопрос о легких в качестве резервуара для нейтрофилов остается открытым [12, 26, 29]. При оценке гетерогенности нейтрофилов могут быть исследованы такие параметры, как функции клеток, маркеры клеточной поверхности, зрелость, плотность и локализация. Концепция подмножества нейтрофилов справедлива при заболевании раком, инфекционном процессе, аутоиммунитете, воспалении и репарации [27, 28].
В нормальных условиях нейтрофилы остаются в кровообращении всего несколько часов, прежде чем начинают мигрировать в ткани [30]. В течение этого времени нейтрофилы, по-видимому, меняют свой фенотип. Наблюдения каждые 4 часа за циркулирующими у здоровых мышей нейтрофилами в течение дня, показали, что эти клетки меняют свою морфологию и фенотип [21, 30, 31].
Известно много описанных фенотипов нейтрофилов, но в литературе приводится отличная друг от друга информация, поскольку в каждом опыте исследовались разные функции, использовались различные методы изучения, виды ткани, биомаркеры [32, 33].
J.M. Adrover и соавт. [22] обратили внимание на циркадные ритмы изменения функционализации нейтрофилов. Недавно вышедшие из костного мозга нейтрофилы («свежие» клетки) претерпевали несколько метаболических изменений, которые накапливались до начала миграции из кровотока в ткани. Авторы назвали эти изменения в фенотипе гранулоцитов в отсутствие воспаления старением [22].
Нейтрофилы считаются дифференцированными клетками, которые прогрессируют от незрелых форм в костном мозге до циркуляции зрелых неактивных клеток. При последующей активации во время воспалительных состояний они перемещаются из сосудов в ткани и выполняют свои функции (например фагоцитоз, производство активных форм кислорода и уничтожение бактерий) [34]. Нейтрофилы могут быстро изменять свои характеристики и манеру поведения по мере активации, созревания или изменения внешней среды [35]. Кроме того, активность нейтро- филов в ответ на различные медиаторы при остром или хроническом воспалительном процессе может продлить жизнь клетки, дать возможность произвести альтернативные эффекторные и иммунорегуляторные молекулы [34, 35].
Наконец, нейтрофилы играют совершенно полярные роли в различных врожденных иммунных реакциях, возникающих в ответ на стерильную травму, инфекцию, рак, а также в реакциях аутоиммунитета. Поэтому неудивительно, что нейтрофилы с многочисленными разновекторными функциями были идентифицированы в последние годы в разных условиях [33, 36, 37].
Такая пластичность функций нейтрофилов, отмеченная и российскими учеными [32], побудила исследователей изучить область фенотипической и функциональной гетерогенности нейтрофилов, как это было сделано для лимфоцитов [38]. Появилась возможность вычленить регуляторные, супрессорные, провоспали- тельные, воспалительные, противоопухолевые, про- опухолевые и гибридные субпопуляции нейтрофилов [39]. Помимо классического антагонистического участия в антимикробных реакциях, нейтрофилы также играют значительную роль в модуляции различных типов раковых опухолей.
Фенотипическая гетерогенность нейтрофилов при раке
В вопросах влияния на опухолевый процесс нейтрофилы в течение длительного времени были обделены вниманием исследователей по сравнению с другими иммунокомпетентными клетками [39, 40]. Одной из причин этого, по-видимому, является небольшая продолжительность жизни гранулоцитов, которая, как считалось, слишком мала (в среднем 7 ч в циркулирующей крови и еще около 5 суток в тканях), чтобы влиять на прогрессию рака [41].
Однако в публикации М. Kurashige и соавт. [41] были подтверждены результаты экспериментальных исследований Y. Sawanobori и соавт. [42] с использованием молекулярных маркеров, которые позволили пересмотреть и эти фундаментальные положения [41, 42].
Экспериментальные исследования, выполненные на животных, показали, что продолжительность жизни тканевых нейтрофилов увеличивается на несколько дней в опухолях, микроокружение которых способствует их выживанию как локально, так и системно. Установлено, что средний период продолжительности жизни циркулирующих нейтрофилов у больных раком увеличен до 5,4 дня [44, 45], что более чем в 20 раз больше, чем было обнаружено ранее [44], и расценено исследователями как следствие передачи сигналов опухолевыми цитокинами на Г-КСФ [42].
Использование современных молекулярно-генетических инструментов позволило получить новые данные об участии ПМН на всех стадиях процесса канцерогенеза: от инициации опухолевого генотипа до инвазивного роста и метастазирования злокачественной опухоли [39, 40, 46]. По результатам этих исследований установили ведущую роль нейтрофилов в канцерогенезе, связанную с их способностью изменять поведение других иммунокомпетентных клеток в развитии опухолевого процесса [46].
Изменения функций нейтрофилов и их фенотипическая гетерогенность при раке являются в настоящее время наиболее изученными и наиболее интересными метаморфозами. Эти клетки крови играют важную и противоречивую роль в развитии раковых опухолей, что отражено в ряде современных обзоров [39, 40, 43, 46-49].
Этот функциональный дуализм нейтрофилов по отношению к опухолям в течение длительного времени был предметом споров, в которых оппоненты приводили убедительные доказательства в пользу как про-, так и противоопухолевой роли этих гранулоцитов. Это привело к возникновению гипотезы о неоднородности популяции ПМН и существовании нескольких субпопуляций, функции которых при раковых опухолях могут значительно отличаться. На всех этапах развития рака нейтрофилы формируют разные клеточные фенотипы, которые выполняют разновекторные функции. Установлено, что эти гранулоциты в организме опосредуют про- (клеточный фенотип N2) и противоопухолевые реакции (фенотип N1), которые вызывают прогрессию или ингибирование опухолевых клеток [47, 48].
С одной стороны, клетки N2 способствуют росту опухоли [39, 47], ангиогенезу — новообразованию в опухоли сети кровеносных сосудов [49] и активируют метастазирование опухолевых клеток [48], индуцируя иммунодепрессию [40] и инициируя подготовку тканей к раковой колонизации — создание предметастатической ниши [50]. С другой стороны, клетки N1 проявляют противоопухолевую активность, уничтожая раковые клетки непосредственно [51, 52] либо через антителозависимую цитотоксичность, ограничивающую распространение опухоли [33, 40, 46].
Индукция этих фенотипов ПМН регулируется сигналами, исходящими от раковых или стромаль- ных клеток из микроокружения опухоли, связана как с местными, так и системными реакциями и в настоящее время является предметом пристального внимания и изучения исследователей [33, 39, 46, 49].
Мы сосредоточимся на регуляции поведения ПМН сигналами, исходящими из микроокружения опухоли, а также на диагностическом и терапевтическом потенциале гетерогенных фенотипов миелоидных клеток. Чем же обусловлен этот функциональный дуализм нейтрофилов по отношению к раковым опухолям? В последние годы установлено, что вектор про- опухолевой активности этих клеток зависит от двух условных типов подмножеств ПМН в зависимости от их плотности: высокой (HDN, от англ. high density neutrophils), обеспечивающих противоопухолевую защиту организма (соответствует фенотипу N1), и низкой (LDN, low density neutrophils) — с проопухолевой и иммунодепрессирующей активностью (соответствует фенотипу N2), а также отношением этих клеточных фенотипов [53-56].
В практике выделения нейтрофильных кластеров HDN и LDN для последующего изучения их функциональных характеристик применяются несколько протоколов, включающих в себя сбор и очистку клеток крови человека или мыши [53, 55, 56] (рис. 2). В основе всех методов — выделение гранулоцитов путем градиентного центрифугирования разведенной периферической крови (1:5) с полисахаридами соответствующей плотности (Histopaque-1077, перколл или фи- колл — 3 мл). Кровь забирается с гепаринатом лития, эритроциты перед центрифугированием лизируются. Центрифугирование проводится при 1600 g в течение 20 мин (1000 g /30 мин) [53, 57].
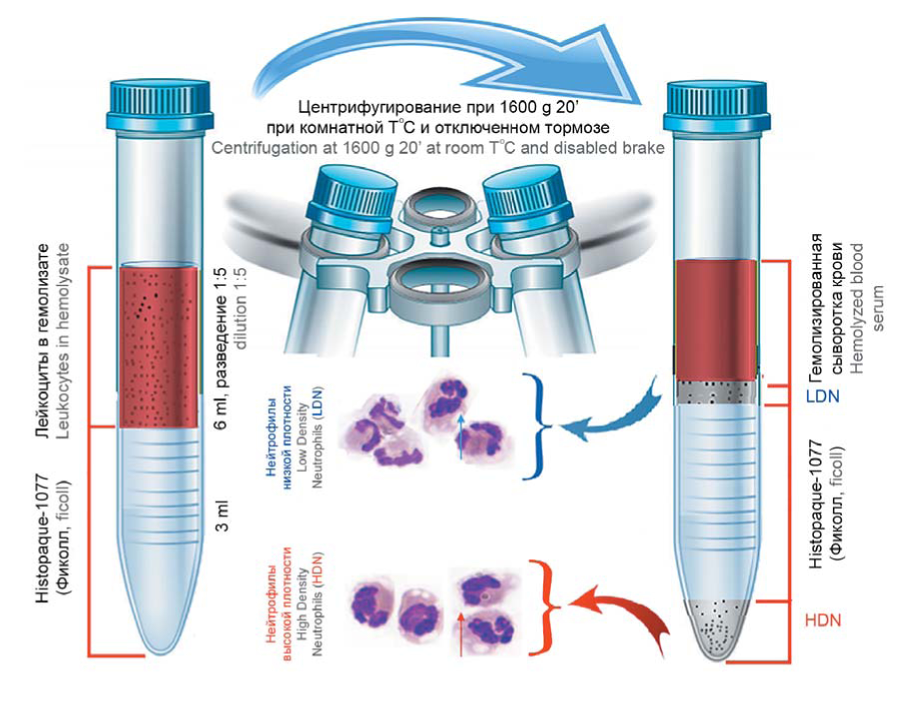
Рисунок 2. Выделение нейтрофилов высокой (HDN) и низкой (LDN) плотности из периферической крови методом градиентного центрифугирования (рисунок авторов, пояснения в тексте)
Figure 2. Isolation of neutrophils of a high (HDN) and low (LDN) density from peripheral blood by gradient centrifugation (the authors' picture, explanations in the text)
От вариаций протоколов зависит чистота выделенных клеточных фракций HDN и LDN, которые могут быть дополнительно обогащены при использовании специфических нейтрофильных антител, магнитных бус и разделительных колонок [53, 55, 56].
В последние годы интерес к субпопуляциям высокой и низкой плотности в контексте их проопухолевой активности значительно увеличился, появляется все больше данных о важной роли этих клеточных фенотипов в биологии опухолевого роста, а также механизмах регуляции раковыми клетками индукции N2-нейтрофилов [39, 53, 58, 59].
В связи с этим концепции о терминальной дифференцировке ПМН и их функциях, ограниченных антимикробной защитой и участием в воспалениях, постепенно пересматриваются [39, 47-49, 53, 59, 60]. Например, было установлено [53, 59], что у здоровых мышей более 95 % нейтрофилов в крови представлены клетками высокой плотности (N1), в то время как при возникновении злокачественной опухоли (рак молочной железы, легких, мезотелиома) у них возникала активная генерация нейтрофилов низкой плотности (N2), которые становились доминирующей циркулирующей субпопуляцией. При этом в костном мозге было достаточно много HDN, и увеличение соотношения субпопуляций в пользу LDN не было следствием простого медуллярного истощения клеток высокой плотности [53].
Аналогичная картина наблюдалась и у больных опухолями различной локализации. При этом и у мышей, и у людей доминирующая субпопуляция LDN была неоднородной и состояла из зрелых и незрелых клеток, в то время как фенотип HDN был однородным и представлен только зрелыми клетками [49, 53].
Механизмы, с помощью которых опухоли индуцируют N2-нейтропоэз, до конца не изучены, хотя в ряде исследований была показана активация клеток-пред- шественников гранулопоэза (ГМ-КСФ и Г-КСФ) и прогностическое значение отношения численности LDN- кластера гранулоцитов к лимфоцитам при нескольких типах злокачественных новообразований [51, 52].
Недавние исследования R. Kanamaru и соавт. [9] показали, что внеклеточные ловушки (NETs), высвобожденные нейтрофилами LDN-кластера, выделенными из перитонеального лаважа у больных, прооперированных по поводу рака желудка, не только не уничтожали свободные раковые клетки, но и активировали их пролиферацию после прикрепления к NETs [9].
Один из механизмов индукции образования N2-нейтрофилов, выявленный указанными исследователями, связан со стимулирующим влиянием микроокружения опухоли, точнее, с трансформирующим фактором роста-β, который индуцирует созревание в костном мозге и миграцию в ткани проопухолевого фенотипа нейтрофилов N2, изменяя локальное соотношение гранулоцитов N2:N1 в пользу первых.
Функциональная дифференциация нейтрофилов приводит к появлению различных фенотипов под влиянием конкретных опухолевых факторов, среди которых наиболее изученными являются трансформирующий фактор роста-β, Г-КСФ и интерферон-β.
Таким образом, в дополнение к классическим антимикробным стратегиям, в последние годы был охарактеризован ряд других функций нейтрофилов, что вызвало большой интерес врачей и биологов в мире. Многочисленные свидетельства того, что разные фенотипы нейтрофилов обнаружены в различных тканях и при различных патологических состояниях, позволяют предположить, что действительно существуют подмножества нейтрофилов [39, 47—49, 53, 59]. Однако отсутствие прямых экспериментальных доказательств, основанных на многократных исследованиях, не дает основания утверждать о наличии гетерогенных подгрупп нейтрофилов. Поэтому большинство практикующих врачей и гематологов считают этот клеточный пул относительно гомогенной популяцией с минимальным фенотипическим и функциональным разнообразием [48, 49, 57, 58]. Среди причин этого заблуждения тот факт, что исследования нейтрофилов все еще в значительной степени определяются их морфологией [59, 60].
Недавно выявленные с помощью градиентного центрифугирования факты наличия нейтрофилов разной плотности и их разновекторного участия в физиологических и патологических состояниях организма, возможно, вызовут смену парадигмы о функциональной гомогенности нейтрофилов [50].
Пока же приведенные в обзоре результаты исследований вызывают ряд вопросов относительно фенотипической специализации нейтрофилов. Бывают ли эти клетки запрограммированными на определенный фенотип уже до выхода из костного мозга в периферическую кровь, или высокая пластичность позволяет им трансформироваться в определенные субпопуляции уже в тканях? Возможно ли перепрограммировать уже имеющиеся фенотипы? По-прежнему остается актуальной проблема поиска надежных молекулярных маркеров, позволяющих эффективно дифференцировать фенотипы нейтрофилов, установить степень их диагностической специфичности при различных патологиях. И, наконец, обозначить перспективы определения нейтрофилов как терапевтической стратегии в иммунопатологии. В любом случае, полученные результаты выявляют потенциальные направления, на которые могут быть направлены терапевтические и диагностические стратегии усиления противоопухолевой нейтрофильной активности для раннего выявления и ограничения опухолевого роста.
Список литературы
1. de Oliveira S., Rosowski E.E., Huttenlocher A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 2016; 16(6): 378. DOI: 10.1038/nri.2016.49
2. Wang J., Hossain M., Thanabalasuriar A., et al. Visualizing the function and fate of neutrophils in sterile injury and repair. Science. 2017; 358(6359): 111–6. DOI: 10.1126/science.aam9690
3. Jones H. R., Robb C. T., Perretti M., et al. The role of neutrophils in inflammation resolution. Seminars in immunology. Academic Press. 2016; 289(2): 137–45. DOI: 10.1016/j.smim.2016.03.007
4. Kaur M., Singh D. Neutrophil chemotaxis caused by chronic obstructive pulmonary disease alveolar macrophages: the role of CXCL8 and the receptors CXCR1/CXCR2. Journal of Pharmacology and Experimental Therapeutics. 2013; 347(1): 173–80. DOI: 10.1124/jpet.112.201855
5. Андрюков Б.Г., Сомова Л.М., Дробот Е.И., Матосова Е.В. Антимикробные стратегии нейтрофилов при инфекционной патологии. Клин. лаб. диагностика. 2016; 12(61): 825–33. DOI: 10.18821/0869-2084-2016-61- 12-825-833
6. Wirths S., Stefanie Bugl S., Kopp H.-G. Steady-state neutrophil homeostasis is a demand-driven process. Cell Cycle. 2013; 12(5): 709–10. DOI: 10.4161/cc.23859
7. Cain D.W., Ueda Y., Holl T.M., et al. A comparison of “steady-state” and “emergency” granulopoiesis: evidence of a single pathway for neutrophil production. The Journal of Immunology, 2009; 182 (1): 87–95.
8. Cowland J.B., Borregaard N. Granulopoiesis and granules of human neutrophils. Immunological reviews. 2016; 273(1): 11–28. DOI: 10.1111/imr.12440/
9. Kanamaru R., Ohzawa H., Miyato H., et al. Neutrophil Extracellular Traps Generated by Low Density Neutrophils Obtained from Peritoneal Lavage Fluid Mediate Tumor Cell Growth and Attachment. J Vis Exp. 2018; 138. DOI: 10.3791/58201
10. Witko-Sarsat V., Pederzoli-Ribeil M., Hirsch E., et. al. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 2011; 32: 117–24. DOI: 10.1016/j.it.2011.01.001
11. Luo D., McGettrick H.M., Stone P.C., et al. The roles of Integrins of Human Neutrophils after their migration through endothelium into intestinal matrix. PLOS One. 2015; 10(2): e0118593. DOI: 10.1371/journal.pone.0118593
12. Steinberg B.E., Grinstein S. Unconventional roles of the NADPH oxidase: signaling, ion homeostasis, and cell death. Science’s STKE. 2007; 2007(379): pe11. DOI: 10.1126/stke.3792007pe11
13. Marini O., Costa S., Bevilacqua D., et al. Mature CD10+ and immature CD10-neutrophils present in G-CSF-treated donors display opposite effects on T cells. Blood. 2016; 04: 713206. DOI: 10.1182/blood-2016-04-713206
14. Dopico X. C., Evangelou M., Ferreira R. C., et al. Widespread seasonal gene expression reveals annual differences in human immunity and physiology. Nature communications. 2015; 6: 7000. DOI: 10.1038/ncomms8000
15. Kim M. H., Yang D., Kim M., et al. A late-lineage murine neutrophil precursor population exhibits dynamic changes during demand-adapted granulopoiesis. Scientific reports. 2017; 7: 39804. DOI: 10.1038/srep39804
16. Garlichs C.D., Eskafi S., Cicha I., et al. Delay of neutrophil apoptosis in acute coronary syndromes. Journal of leukocyte biology. 2004; 75(5): 828–35. DOI: 10.1189/jlb.0703358
17. Summers C., Singh N. R., White J. F., et al. Pulmonary retention of primed neutrophils: a novel protective host response, which is impaired in the acute respiratory distress syndrome. Thorax. 2014; thoraxjnl-2013-204742. DOI: 10.1136/ thoraxjnl-2013-204742
18. Матосова Е.В., Андрюков Б.Г. Морфофункциональная характеристика защитных механизмов нейтрофилов при бактериальных инфекциях и их вклад в патогенез провоспалительных реакций. Гематология и трансфузиология. 2017; 62(4): 223–9. DOI: 10.18821/0234-5730-2017-62-4-223-229
19. Jorgensen I., Rayamajhi M., Miao E.A. Programmed cell death as a defence against infection. Nature reviews immunology. 2017; 17(3): 151. DOI: 10.1038/ nri.2016.147
20. Jorgensen I., Lopez J.P., Laufer S.A., et al. IL-1β, IL-18, and eicosanoids promote neutrophil recruitment to pore-induced intracellular traps following pyroptosis. European journal of immunology. 2016; 46(12): 2761–6. DOI: 10.1002/ eji.201646647
21. Rodriguez F.M., Novak I.T.C. What about the neutrophil’s phenotypes? Hematol Med Oncol. 2017; 2: 1–6. DOI: 10.15761/HMO.1000130
22. Adrover J.M., Nicolás-Ávila J.A., Hidalgo A. Aging: a temporal dimension for neutrophils. Trends Immunol. 2016; 37: 334–45. DOI: 10.1016/j.it.2016.03.005
23. Brinkmann V., Zychlinsky A. Neutrophil extracellular traps: is immunity the second function of chromatin? J Cell Biol. 2012; 198(5): 773–83. DOI: 10.1083/ jcb.201203170
24. Silvestre-Roig C., Hidalgo A., Soehnlein O. Neutrophil heterogeneity: implications for homeostasis and pathogenesis. Blood. 2016 127:2173-2181 DOI: 10.1182/blood-2016-01-688887
25. Horckmans M., Ring L., Duchene J., et al. Neutrophils orchestrate postmyocardial infarction healing by polarizing macrophages towards a reparative phenotype. Eur Heart J. 2017; 38: 187–97. DOI: 10.1093/eurheartj/ehw002
26. Hellebrekers P., Vrisekoop N., Koenderman L. Neutrophil phenotypes in health and disease. Eur J Clin Invest. 2018; 48 Suppl 2: e12943. DOI: 10.1111/ eci.12943
27. Sagiv J.Y., Voels S., Granot Z. Isolation and Characterization of Low- vs HighDensity Neutrophils in Cancer. Methods Mol Biol. 2016; 1458: 179–93. DOI: 10.1007/978-1-4939-3801-8_13
28. Kuhns D.B., Priel D.A.L., Chu J., et al. Isolation and Functional Analysis of Human Neutrophils. Curr Protoc Immunol. 2015; 111: 7.23.1–16. DOI: 10.1002/0471142735.im0723s111
29. Deniset J.F., Kubes P. Neutrophil heterogeneity: Bona fide subsets or polarization states? J Leukoc Biol. 2018; 103(5): 829–38. DOI: 10.1002/JLB.3RI0917- 361R
30. Mortaz E., Alipoor S.D., Adcock I.M., et al. Update on Neutrophil Function in Severe Inflammation. Front Immunol. 2018; 9: 2171. DOI: 10.3389/ fimmu.2018.02171
31. Bekkering S., Torensma R. Another look at the life of a neutrophil. World J Hematol 2013; 2(2): 44–58. DOI: 10.5315/wjh.v2.i2.44
32. Нестерова И.В., Колесникова Н.В., Чудилова Г.А. и др. Новый взгляд на нейтрофильные гранулоциты: переосмысление старых догм. Часть 1. Инфекция и иммунитет. 2018; 7(3): 219–30. DOI: 10.15789/2220-7619- 2017-3-219-230
33. Galdiero M. R., Bonavita E., Barajon I., et al. Tumor associated macrophages and neutrophils in cancer. Immunobiology. 2013; 218(11): 1402–10. DOI: 10.1016/j.imbio.2013.06.003
34. Lai Guan Ng. Neutrophil: A mobile fertilizer J Exp Med. 2019; 216(1): 4–6. DOI: 10.1084/jem.20182059
35. Mishalian I., Granot Z., Fridlender Z.G. The diversity of circulating neutrophils in cancer. Immunobiology. 2017; 222(1): 82–8. DOI: 10.1016/j. imbio.2016.02.001
36. McCracken J.M., Allen L.A.H. Regulation of Human Neutrophil Apoptosis and Lifespan in Health and Disease. J Cell Death. 2014; 7: 15–23. DOI: 10.4137/ JCD.S11038
37. Je Lin Sieow, Sin Yee Gun, Siew Cheng Wong The Sweet Surrender: How Myeloid Cell Metabolic Plasticity Shapes the Tumor Microenvironment. Front Cell Dev Biol. 2018; 6: 168. DOI: 10.3389/fcell.2018.00168
38. Sionov R.V., Fridlender Z.G., Granot Z. The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron. 2014; 8(3):125–58.
39. Coffelt S.B., Wellenstein M.D., de Visser K.E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 2016; 16(7): 431. DOI: 10.1038/nrc.2016.52/
40. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. Neutrophils: important contributors to tumor progression and metastasis. Cancer Metastasis Rev. 2015; 34(4): 735–51. DOI: 10.1007/s10555-015-9594-9
41. Kurashige M., Kohara M., Ohshima K., et al. Origin of cancer-associated fibrobla sts and tumor-associated macrophages in humans after sex-mismatched bone marrow transplantation. Commun Biol. 2018; 1: 131.
42. Sawanobori Y., Ueha S., Kurachi M., et al. Chemokine-mediated rapid tur nover of myeloid-derived suppressor cells in tumor-bearing mice. Blood. 2008; 111(12): 5457–66. DOI: 10.1182/blood-2008-01-136895
43. Granot Z., Henke E., Comen E.A., et al. Tumor entrained neutrophils inhibit seeding in the premetastatic lung. Cancer Cell. 2011; 20(3): 300–14.
44. Shaul M.E., Levy L., Sun J., et al. Tumor-associated neutrophils display a distinct N1 profile following TGFβ modulation: A transcriptomics analysis of pro- vs. antitumor TANs. Oncoimmunology. 2016; 5(11): e1232221. DOI: 10.1080/2162402X.2016.1232221
45. Skendros P., Mitroulis I., Ritis K. Autophagy in Neutrophils: From Granulopoiesis to Neutrophil Extracellular Traps. Front Cell Dev Biol. 2018; 6: 109.
46. Rosales C. Neutrophil: A Cell with Many Roles in Inflammation or Several Cell Types? Front Physiol. 2018; 9: 113. DOI: 10.3389/fphys.2018.00113
47. Uribe-Querol E., Rosales C. Neutrophils in Cancer: Two Sides of the Same Coin. J Immunol Res. 2015; 2015: 983698. DOI: 10.1155/2015/983698
48. Sag iv J. Y., Michaeli J., Assi S., et al. Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell reports. 2015; 10(4): 562–73. DOI: 10.1016/j.celrep.2014.12.039
49. Lee W., Ko S.Y., Mohamed M.S., et al. Neutrophils facilitate ovarian cancer premetastatic niche formation in the omentum. J Exp Med. 2019; 216(1): 176–94. DOI: 10.1084/jem.20181170
50. Granot Z, Jablonska J. Distinct Functions of Neutrophil in Cancer and Its Regulation. Mediators Inflamm. 2015; 701067. DOI: 10.1155/2015/701067
51. Lopez-Lago M.A., Posner S., Thodima V.J., et al. Neutrophil chemokines secreted by tumor cells mount a lung antimetastatic response during renal cell carcinoma progression. Oncogene, 2013; 32(14): 1752–60.
52. Hong C.W. Current Understanding in Neutrophil Differentiation and Heterogeneity. Immune Netw. 2017; 17(5): 298–306.
53. Liu Y., Yue Hu, Gu F., et al. Phenotypic and clinical characterization of low density neutrophils in patients with advanced lung adenocarcinoma. Oncotarget. 2017; 8(53): 90969–78. DOI: 10.18632/ oncotarget. 18771
54. Carmona-Rivera C., Kaplan M.J. Low-density granulocytes: a distinct class of neutrophils in systemic autoimmunity. Semin. Immunopathol. 2013; 35: 455–63. DOI: 10.1007/s00281-013-0375-7
55. Wright H. L., Makki F. A., Moots R. J., et al. Low-density granulocytes: functionally distinct, immature neutrophils in rheumatoid arthritis with altered properties and defective TNF signaling. Journal of leukocyte biology. 2017; 101(2): 599–611. DOI: 10.1189/jlb.5A0116-022R.
56. Hallett M. B. The Neutrophil: Cellular Biochemistry and Physiology. CRC Press; 2017.
57. Erpenbeck L., Schön M.P. Neutrophil extracellular traps: protagonists of cancer progression? Oncogene. 2017; 36(18): 2483. DOI: 10.1038/onc.2016.406
58. Porta C., Sica A., Riboldi E. Tumor-associated myeloid cells: new understandings on their metabolic regulation and their influence in cancer immunotherapy. FEBS J. 2018; 285(4): 717–33. DOI: 10.1111/febs.14288
59. Khadge S., Sharp J.G., McGuire T.R., et al. Immune regulation and anticancer activity by lipid inflammatory mediators. Int Immunopharmacol. 2018; 65: 580–92. DOI: 10.1016/ j. intimp.2018.10.026
Об авторах
Б. Г. АндрюковРоссия
Андрюков Борис Георгиевич, заслуженный врач РФ, доктор медицинских наук, ведущий научный сотрудник лаборатории молекулярной микробиологии
профессор департамента фундаментальных наук
тел.: +7(924)230-46-47; 690087, г. Владивосток, ул. Сельская, д. 1.
В. Д. Богданова
Россия
Богданова Валерия Дмитриевнa, специалитет «Медицинская биохимия»
И. Н. Ляпун
Россия
Ляпун Ирина Николаевна, кандидат биологических наук, научный сотрудник лаборатории молекулярной микробиологии
Рецензия
Для цитирования:
Андрюков Б.Г., Богданова В.Д., Ляпун И.Н. ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ НЕЙТРОФИЛОВ: НОВЫЕ АНТИМИКРОБНЫЕ Х АРАКТЕРИСТИКИ И ДИАГНОСТИЧЕСКИЕ ТЕХНОЛОГИИ. Гематология и трансфузиология. 2019;64(2):211-221. https://doi.org/10.35754/0234-5730-2019-64-2-211-221
For citation:
Andryukov B.G., Bogdanova V.D., Lyapun I.N. PHENOTYPIC HETEROGENEITY OF NEUTROPHILS: NEW ANTIMICROBIC CHARACTERISTICS AND DIAGNOSTIC TECHNOLOGIES. Russian journal of hematology and transfusiology. 2019;64(2):211-221. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-2-211-221











































