Перейти к:
ИЗМЕНЕНИЯ В КЛЕТКАХ-ПРЕДШЕСТВЕННИЦАХ СТРОМАЛЬНОГО МИКРООКРУЖЕНИЯ КОСТНОГО МОЗГА БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В ДЕБЮТЕ ЗАБОЛЕВАНИЯ И В ХОДЕ ЛЕЧЕНИЯ
https://doi.org/10.35754/0234-5730-2019-64-4-424-435
Аннотация
Введение. У больных хроническим миелолейкозом (ХМЛ) изменены свойства клеток-предшественниц стромального микроокружения — мультипотентные мезенхимальные стромальные клетки (ММСК) и колониеобразующие единицы фибробластов (КОЕф).
Цель — сравнительное изучение клеток-предшественниц стромального микроокружения ММСК и КОЕф, полученных из костного мозга больных ХМЛ в дебюте заболевания, через год после начала лечения и на длительных сроках лечения ингибиторами тирозиновых киназ (ИТК).
Материалы и методы. Были проанализированы характеристики ММСК и концентрация КОЕф в костном мозге больных ХМЛ, а также относительный уровень экспрессии генов (REL), связанных с дифференцировкой и участвующих в регуляции кроветворения. Анализ проводили в дебюте заболевания, через год после начала лечения, через 3–8 лет и через 9–16 лет терапии ИТК. В качестве контроля использовали ММСК и КОЕф здоровых доноров.
Результаты. Концентрация КОЕф в дебюте заболевания не отличалась от таковой у доноров, однако в колониях из КОЕф был увеличен относительный уровень экспрессии генов, относящихся к дифференцировке. Через год после начала лечения ИТК концентрация КОЕф снижалась в 4 раза, а затем увеличивалась и достигала нормальных значений через 8 лет приема ИТК. Суммарная клеточная продукция ММСК не была изменена в дебюте заболевания, но снижалась через год приема ИТК с последующим восстановлением. В ММСК больных была изменена экспрессия многих генов: экспрессия REL LIF была увеличена в 10, а JAG1 — в 2 раза, экспрессия REL LIF снижалась по мере лечения, но всегда оставалась выше, чем в ММСК доноров, а экспрессия JAG1 нормализовывалась. В ММСК больных, достигших глубокого молекулярного ответа (ГМО) в течение 17 месяцев лечения, экспрессия REL LIF в дебюте заболевания была в три раза ниже, чем у тех, кто не достиг ГМО за 50 месяцев, а JAG1 не отличался от доноров.
Заключение. Изменения в стромальных клетках предшественницах связаны не только с влиянием опухолевых клеток, но и с лечением ИТК. Нормальный уровень экспрессии JAG1 и сниженный уровень экспрессии LIF в ММСК больных ХМЛ в дебюте заболевания могут быть предикторами достижения ГМО.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Финансирование: исследование не имело спонсорской поддержки.
Ключевые слова
Для цитирования:
Петинати Н.А., Шипунова И.Н., Бигильдеев А.Е., Сац Н.В., Челышева Е.Ю., Шухов О.А., Петрова А.Н., Туркина А.Г., Дризе Н.И. ИЗМЕНЕНИЯ В КЛЕТКАХ-ПРЕДШЕСТВЕННИЦАХ СТРОМАЛЬНОГО МИКРООКРУЖЕНИЯ КОСТНОГО МОЗГА БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В ДЕБЮТЕ ЗАБОЛЕВАНИЯ И В ХОДЕ ЛЕЧЕНИЯ. Гематология и трансфузиология. 2019;64(4):424–435. https://doi.org/10.35754/0234-5730-2019-64-4-424-435
For citation:
Petinati N.A., Shipunova I.N., Bigildeev A.E., Sats N.V., Chelysheva E.Yu., Shukhov O.A., Petrova A.N., Turkina A.G., Drize N.I. CHANGES IN STROMAL PROGENITOR CELLS DERIVED FROM BONE MARROW IN PATIENTS WITH CHRONIC MYELOGENOUS LEUKAEMIA AT THE ONSET OF THE DISEASE AND DURING TREATMENT. Russian journal of hematology and transfusiology. 2019;64(4):424–435. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-424-435
Введение
Кроветворение обеспечивается стволовыми кроветворными клетками (СКК). СКК локализуются в костномозговых нишах, где происходит их регуляция [1]. Костномозговая ниша состоит из множества компонентов: остеобласты, остеокласты, адипоциты, эндотелиальные клетки, обильные хемокиновыми рецепторами 12-го типа ретикулярные клетки (C-X-C chemokine receptor type 12-abundant reticular cells — CAR cells), швановские клетки, мезенхимальные стволовые клетки [2]. В состав кроветворного микроокружения также входят потомки мезенхимальных стволовых клеток — мультипотентные мезенхимальные стромальные клетки (ММСК) и их производные колониеобразующие единицы фибробластов (КОЕ-Ф) [3]. Клеточные элементы ниши регулируют кроветворение, в свою очередь, качественные изменения в кроветворении влияют на компоненты кроветворного микроокружения. Показано, что у больных острыми лейкозами происходят значительные изменения в компонентах ниши. В костном мозге больных острыми лейкозами концентрация КОЕ-Ф некоторые свойства ММСК, экспрессия генов в этих стромальных клетках-предшественниках изменены [4—7]. У больных хроническим миелоидным лейкозом (ХМЛ) уменьшена частота встречаемости ММСК в костном мозге [8] и увеличена экспрессия некоторых генов [9].
В настоящее время более 90 % больных ХМЛ благодаря клинической эффективности ингибиторов тирозинкиназ (ИТК) выживают, имея хорошее качество жизни [10]. Наличие лейкозных стволовых клеток (ЛСК) обуславливает развитие лейкоза. ЛСК имеют очень много таких же свойств, как у СКК: они резистентны к действию цитостатиков за счет повышенной способности удалять из клетки чужеродные вещества, т.е. обладают множественной лекарственной устойчивостью [11]. Повышенная лекарственная устойчивость ЛСК определяет резистентность их к терапии [12]. Немногие ЛСК, оставшиеся после терапии, вызывают рецидив заболевания примерно у 50 % больных ХМЛ после отмены ИТК [13]. Функционирование и устойчивость ЛСК связаны со стромальным микроокружением костного мозга, поддерживающим и защищающим ЛСК [14] Опухолевые клетки-предшественницы при ХМЛ измененно взаимодействуют с микроокружением костного мозга, и их состояние непрерывной пролиферации может происходить из-за разрегулированных функций важных молекул межклеточной адгезии на поверхности ЛСК [15, 16]. В работе W.A. Sands и соавт. [17] было показано, что ЛСК могут изменять нишу, секретирующую различные костимулирующие молекулы и супрессирующие цитокины, которые нацелены на метаболические пути и облегчают уход от иммунного надзора и индукцию резистентности к химиотерапевтическим препаратам. Эти цитокины включают CXCL12, фактор роста стволовых клеток 1 (stem cell factor-1, SCF-1), интерлейкин-6 (ИЛ-6), несколько факторов роста, таких как фактор роста опухоли бета (transforming growth factor beta, TGF-β), основной фактор роста фибробластов (basic fibroblast growth factor, bFGF) и фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF). Во время лейкогенеза злокачественные клоны постепенно становятся независимыми от физиологического контроля ниши [10]. Более того, ММСК экспрессируют различные факторы, участвующие в поддержании ЛСК как в хронической фазе заболевания, так и при наличии глубокого молекулярного ответа (ГМО) [9].
Цель работы — сравнительное изучение клеток- предшественниц стромального микроокружения ММСК и КОЕф, полученных из костного мозга больных ХМЛ в дебюте заболевания, через год после начала лечения и на длительных сроках лечения ИТК.
Материалы и методы
Больные и доноры костного мозга
В исследование были включены 73 больных: 18 больных в дебюте ХМЛ (12 из них также были обследованы через год), 32 — через 3—8 лет и 23 — через 9—16 лет после начала лечения ИТК. Данные больных представлены в таблице 1.
Таблица 1. Характеристики больных, включенных в исследование
Table 1. Characteristics of CML patients included in the study
Группы Groups | Мужчины/ Медиана возраста, женщины (разброс), лет Males/Females Median age, (range), years | Время лечения ИТК, медиана, лет Median duration of TKI treatment, years | |
|---|---|---|---|
Больные ХМЛ в дебюте заболевания и через 1 год терапии Patients before treatment and 1 year after the TKI treatment | 10/8 | 40,5 (19-74) | 0-1 |
ГМО и лечение 3-8 лет DMR and TKI treatment for 3-8 years | 19/13 | 34,5 (23-63) | 5 |
ГМО и лечение 9-16 лет DMR and TKI treatment for 9-16 years | 10/13 | 53 (32-80) | 11 |
Все больные и доноры подписали информированное согласие на забор костного мозга. Исследование было одобрено этическим комитетом ФГБУ «НМИЦ гематологии» МЗ РФ. Образцы костного мозга получали в момент рутинных диагностических пункций костного мозга. Все больные после длительного лечения ИТК имели ГМО, пункции костного мозга выполнялись в связи с планируемой отменой ИТК.
Поскольку характеристики ММСК и КОЕф зависят от возраста, в качестве контроля для ММСК и КОЕф больных в дебюте заболевания, больных через 1 и 3—8 лет после начала терапии использовали ММСК и КОЕф из костного мозга 60 здоровых доноров (24 мужчины и 36 женщин), в возрасте от 20 до 78 лет (медиана 49 лет), для больных через 9—16 лет после начала терапии использовали ММСК и КОЕф из костного мозга 43 здоровых доноров лет (21 мужчина, 21 женщина) в возрасте от 31 до 78 лет (медиана 50 лет).
Мультипотентные мезенхимальные стромальные клетки
ММСК выделяли из 3—5 мл костного мозга больных и здоровых доноров. Для выделения мононуклеаров костный мозг смешивали с равным объемом среды аМЕМ media (ICN), содержащей 0.2 % метилцеллюлозы (1500 cP, Sigma-Aldrich). Через 40 мин большинство эритроцитов и гранулоцитов оседали, в то время как мононуклеарные клетки оставались в суспензии. Затем верхнюю фракцию (суспензию) отбирали и центрифугировали в течение 10 мин при 450 G. Клеточный осадок ресуспендировали в стандартной среде для культивирования, состоящей из среды aMEM с 10 % эмбриональной телячьей сыворотки (ЭТС) Hyclone, 2 мМ L-глутамина (ICN), 100 ЕД/мл пенициллина (Ferein) и 50 мкг/мл стрептомицина (Ferein). Клетки культивировали по 3 х 106 клеток на флакон T25 см2 (Corning- Costar). После формирования конфлюэнтного монослоя клетки отмывались 0,02 % ЭДТА (ICN) в физиологическом растворе (Sigma-Aldrich), а затем обрабатывались трипсином (ICN). Клетки рассаживали по 4 х 103 клеток на см2 площади флакона. Культуры при 37 °C в атмосфере с 5 % CO2.
ММСК были иммунофенотипированы [18] для определения поверхностных молекул [19] (рис. 1А) и получены данные по дифференцировке клеток in vitro в остеобласты и адипоциты стандартным методом [20] (рис. 1Б).
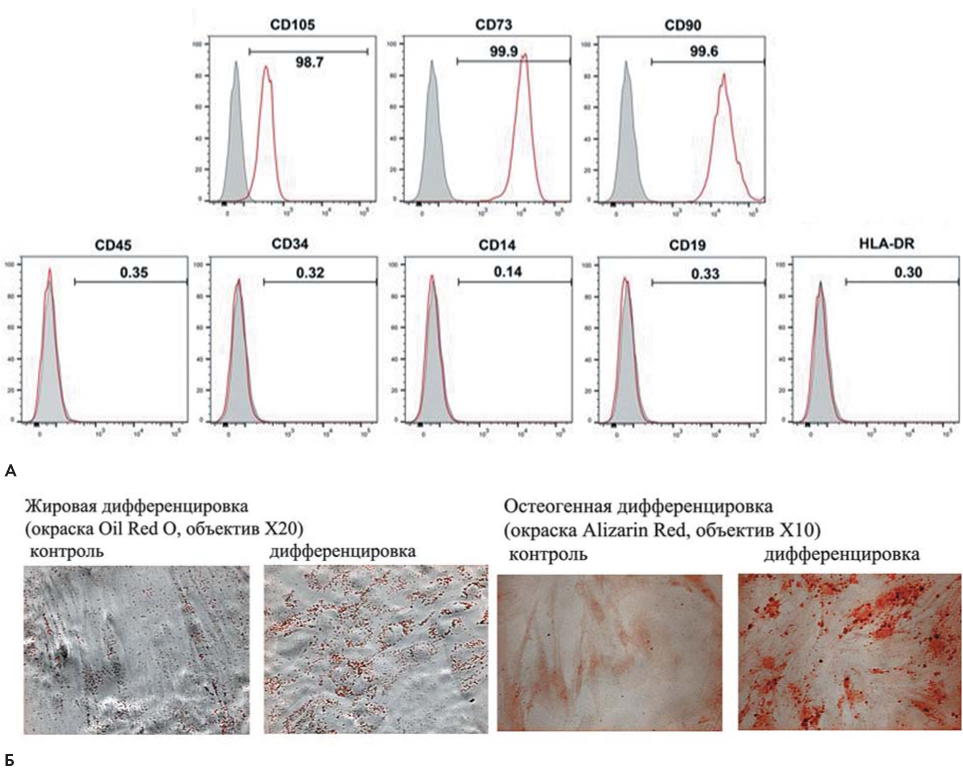
Рисунок 1. Характеристики ММСК: А — иммунофенотип ММСК, экспрессированы антигены CD105, CD73, CD90; не экспрессированы маркеры кроветворных клеток CD45, CD34, CD14, CD19 и HLA-DR; Б — дифференцировка ММСК в остеогенном и адипогенном направлениях
Figure 1. Characteristics of MMSCs. A. Immunophenotype of MMSCs, antigens CD105, CD73, CD90 are expressed; hematopoietic cell markers CD45, CD34, CD14, CD19 and HLA-DR are not expressed. Б. Differentiation of multipotent MSCs in osteogenic and adipogenic directions
Анализ колониеобразующих единиц фибробластов (КОЕф) из костного мозга
Для анализа КОЕф ядросодержащие клетки полученных образцов костного мозга культивировали по 106 и 5 х 105 на флакон с площадью дна 25 см2 в среде альфа-MEM с 20 % ЭТС (Hyclone, США), 2 мМ L-глутамина (ICN, США), 100 ед/мл пенициллина («Ферейн», Россия), 50 мкг/мл стрептомицина («Ферейн», Россия) в течение 14 дней. Подсчет колоний производили под бинокулярной лупой (Opton, Германия) после окрашивания в 1 % кристаллвиолете на 20 % метаноле.
Определение относительного уровня экспрессии генов
Определение уровня экспрессии генов проводилось методом обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени (модификация Taq-Man) на приборе Rotor-Gene (Corbett, Australia). Для выделения РНК был использован стандартный протокол с небольшими модификациями [21]. Для построения первых цепей ДНК после гибридизации мРНК со смесью поли-Т-праймеров и случайных гексамеров использовали обратную транскриптазу (M-MLV, Promega) в соответствии с рекомендациями производителя. Для нормализации образцов использовали гены «домашнего хозяйства» BACT (бета-актин) и GAPDH (глицеральдегид-3-фосфат дегидрогеназа), относительный уровень экспрессии генов рассчитывали методом ΔΔCt: [22].
Статистический анализ. Данные представлены в виде среднее ± стандартная ошибка среднего. Достоверность различий средних значений определялась с помощью критерия Манна—Уитни для распределений, отличных от нормального и A-критерия Стьюдента для нормальных распределений (достоверными считались прир < 0,05).
Результаты
Концентрация КОЕф и ростовые характеристики ММСК
Изучили концентрацию КОЕф и ростовые характеристики ММСК больных ХМЛ в дебюте заболевания и в течение терапии ИТК до 16 лет. В дебюте заболевания и в самом начале лечения концентрация КОЕф в костном мозге больных не отличалась от таковой у доноров (табл. 2). Через год после начала лечения концентрация КОЕф снижалась почти в 4 раза, а затем постепенно увеличивалась в группе больных, которые получали терапию более 8 лет. В этой группе больных концентрация КОЕф в костном мозге не отличалась от концентрации в костном мозге здоровых доноров. Суммарная продукция ММСК за 4 пассажа достоверно снижалась в 2 раза через год после начала терапии, а затем постепенно увеличивалась и не отличалась от таковой у доноров. У больных в дебюте заболевания время до Р0, т.е. достижения конфлюентного монослоя после установления культуры, было достоверно увеличено, что указывало на уменьшение концентрации стромальных предшественников в костном мозге. Далее время до Р0 постепенно уменьшалось и после 8 лет лечения не отличалось от такового у доноров. Время удвоения популяции ММСК было в 2 раза больше в дебюте заболевания по сравнению с ММСК доноров и оставалось увеличенным в течение года лечения ИТК, после еще нескольких лет лечения оно нормализовалось и не отличалось от доноров соответственного возраста.
Таблица 2. Концентрация КОЕ-Ф и культуральные характеристики ММСК больных ХМЛ до начала и во время лечения
Table 2. Concentration of CFU-Fs and the cultural characteristics of MMSCs in CML patients prior to and during TKI treatment
Характеристики Characteristics | Доноры (n = 60) (M = 42 года) Donors (n = 60) (M = 42 years) | Больные до лечения (n = 18) Patients prior to treatment | Лечение ИТК в течение 1 года дебют (n = 18) 1 year of TKI treatment (n = 18) | Лечение ИТК меньше 8 лет (n = 32) Less than 8 years of TKI treatment (n = 32) | Доноры (n = 43) (M = 49 лет) Donors (n = 43) (M = 49 years) | Лечение ИТК больше 8 лет (n = 23) More than 8 years of TKI treatment (n = 23) |
|---|---|---|---|---|---|---|
Концентрация КОЕф на 106 клеток костного мозга Concentration of CFU-Fs per 106 bone marrow cells | 16,2 ± 2,8 | 17,1 ± 4,6 | 4,9 ± 1,2* | 11,9 ± 2,6 | 171 ± 3,7 | 14,2 ± 2,8 |
Суммарная продукция MМСК за 3 пассажа, x 106 Cumulative production of MMSCs during 3 passages, x106 | 10,9 ± 1,2 | 74 ± 1,8 | 6,5 ± 0,8* | 13,5 ± 1,8 | 77 ± 1 | 8,6 ± 1,4 |
Время до Р0, дней Time before P0, days | 14,4 ± 0,4 | 17,9 ± 0,9* | 17,6 ± 0,8* | 14,7 ± 0,7 | 14,5 ± 0,5 | 15,2 ± 0,6 |
Время удвоения популяции, дней Population doubling time, days | 2,9 ± 0,2 | 6 ± 0,8* | 5 ± 0,5* | 2,7 ± 0,2 | 3,1 ± 0,2 | 3,5 ± 0,3 |
Примечание. М — медиана возраста; * — обозначает р< 0,05 при сравнении с соответствующей группой доноров при помощи f-критерия Стъюдента для независимых выборок.
Note. М — median age; * — denotes p <0.05 when compared to the corresponding donor group using the Student's t-test for independent samples.
Анализ экспрессии генов в КОЕф и ММСК
Экспрессия многих генов изменялась в КОЕф в дебюте заболевания. К ним относятся гены, связанные с хрящевой, жировой и костной дифференцировками (SOX9, PPARG и BGLAP, SPP1), экспрессия которых достоверно повышалась. Это означает, что КОЕф были индуцированы к дифференцировке и, скорее всего, обеспечивали взрослыми стромальными клетками костный мозг более интенсивно, что, в свою очередь, связано с повреждением стромального микроокружения опухолевыми клетками. Экспрессия генов, связанных с пролиферацией предшественников, сильно не изменялась. Экспрессия ВМР4 была значительно повышена, и достоверно отличалась от таковой у доноров.
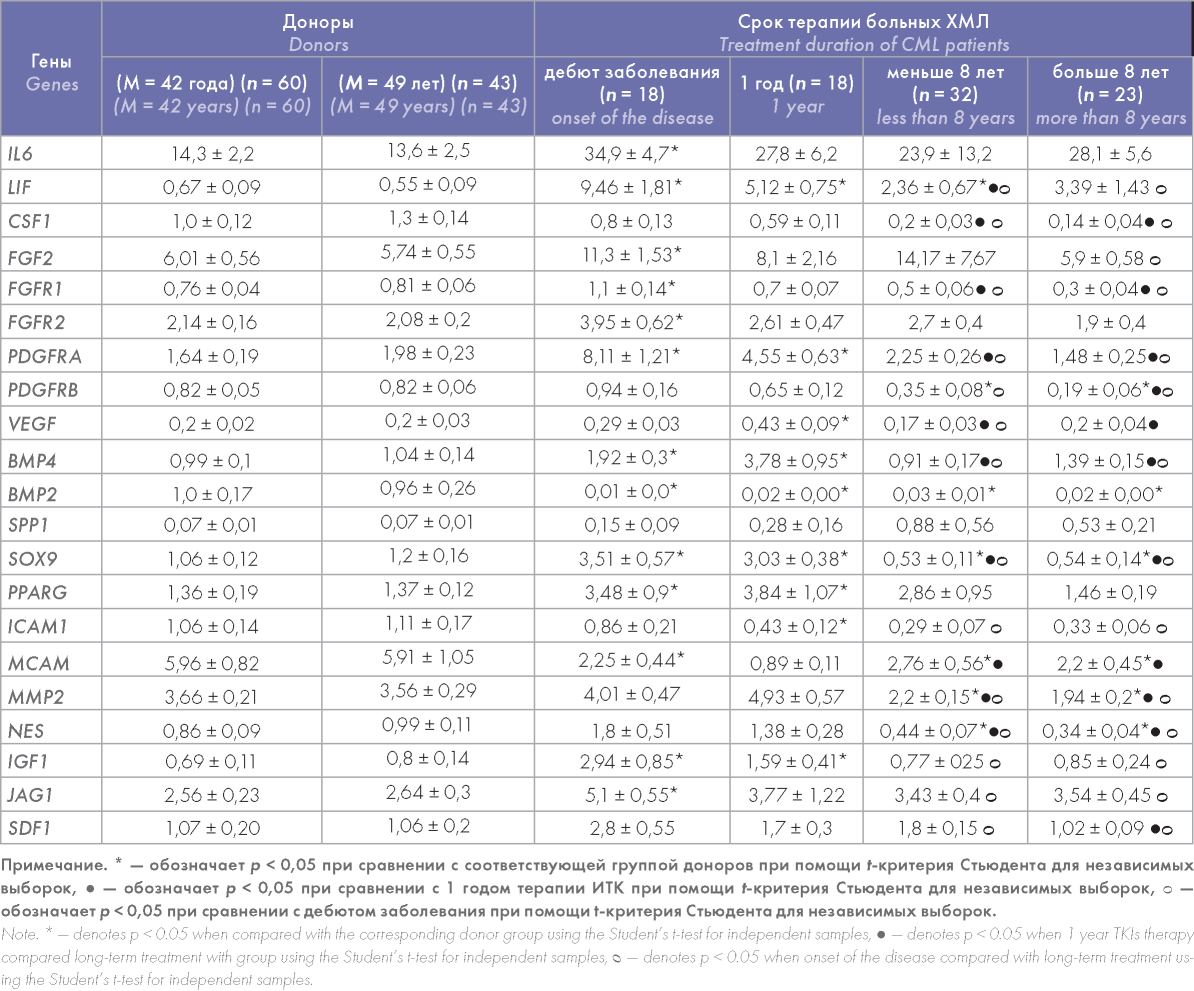
Анализ относительного уровня экспрессии генов в ММСК больных ХМЛ показал, что в дебюте заболевания стромальные клетки-предшественницы были активированы по сравнению с таковыми у доноров. Относительный уровень экспрессии генов факторов, регулирующих кроветворные клетки и ЛСК (IL6 и LIF), был достоверно повышен в 2,5 и 14 раз соответственно (табл. 4). По мере лечения экспрессия генов этих факторов постепенно снижалась, однако уровень экспрессии IL6 все равно оставался выше, чем у доноров. Некоторые факторы роста ММСК (FGF2, его рецепторы — FGFR1, FGFR2, рецептор фактора роста из тромбоцитов — PDGFRA) были повышены в дебюте заболевания, тогда как экспрессия фактора роста сосудистого эндотелия — VEGF, опухолевого фактора роста 1 и 2 — TGFB1 и TGFB2 не были изменены (табл. 4). Среди изученных молекул адгезии достоверное снижение в 2 раза было отмечено только для МСАМ, остальные молекулы не были изменены. Экспрессия генов, участвующие в дифференцировке ММСК (SPP1, SOX9, PPARG), была повышена в дебюте заболевания. Относительный уровень экспрессии PPARG оставался повышенным через год после начала лечения, а затем постепенно нормализовался. Экспрессия гена маркера костной дифференцировки (SPP1) постепенно повышалась по мере лечения, экспрессия маркера хрящевой (SOX9) дифференци- ровки была увеличена в дебюте заболевания и в течение года лечения, однако при длительном лечении ИТК достоверно снижалась в 2 раза по сравнению с таковыми у доноров. Экспрессия генов, характерных для ММСК (NES, JAG1 и IGF1), была повышена в дебюте заболевания и постепенно нормализовалась при длительном лечении за исключением NES, уровень экспрессии которого достоверно уменьшался по сравнению с таковым у доноров.
Таким образом, у больных ХМЛ профиль экспрессии генов изменен в дебюте заболевания и только частично нормализуется даже при длительной терапии.
Таблица 3. Изменение относительного уровня экспрессии некоторых генов в КОЕ-Ф больных ХМЛ
Table 3. Changes in the REL of some genes in CFU-F in CML patients
Группы Groups | BGLAP | SPP1 | PPARG | SOX9 | FGFR1 | FGFR2 | VEGF | FGF2 | BMP4 |
|---|---|---|---|---|---|---|---|---|---|
Доноры (η = 60) Donors (n = 60) | 1,0 ± 0,2 | 6,3 ± 2,1 | 1,7 ± 0,5 | 0,1 ± 0,03 | 0,8 ± 0,1 | 0,4 ± 0,2 | 1,1 ± 0,3 | 5,3 ± 2,1 | 0,3 ± 0,1 |
ХМЛ дебют (η = 18) Primary CML patients (n = 18) | 2,9 ± 0,3* | 16,6 ± 3,8* | 6,9 ± 1,7* | 1,3 ± 0,4* | 0,7 ± 0,04 | 0,4 ± 0,2 | 0,95 ± 0,1 | 73 ± 2,5 | 1,1 ± 0,3* |
Примечание. * — р < 0,05 при сравнении с соответствующей группой доноров при помощи f-критерия Стъюдента для независимых выборок.
Note. * — p < 0.05 when compared with the corresponding donor group using the Student's t-test for independent samples.
Таблица 4. Относительный уровень экспрессии некоторых генов в ММСК больных ХМЛ до начала и в процессе лечения
Table 4. Relative expression level of some genes in the MMSCs of CML patients prior to and during TKI treatment
Анализ ММСК у больных в зависимости от достижения ГМО
При анализе ММСК у больных в дебюте заболевания в зависимости от дальнейшего достижения ими ГМО были обнаружены закономерности. У больных, не достигших ГМО в течение 4-х лет, была меньше концентрация КОЕф в костном мозге, суммарная клеточная продукция за 4 пассажа также была меньше, а время до Р0 увеличено (табл. 5). Все эти изменения не достоверны, однако прослеживалась тенденция, указывающая на более значительное повреждение стромальных клеток-предшественниц у группы больных, не достигших ГМО. В ММСК больных, достигших ГМО, относительный уровень экспрессии 3-х генов, отвечающих за регуляцию кроветворных клеток, был в 2 раза ниже, чем в ММСК больных, не достигших ГМО (табл. 5).
Таким образом, в работе выявлены существенные различия в стромальных клетках-предшественницах больных в зависимости от их ответа на лечение ИТК и достижения ГМО.
Таблица 5. Характеристики ММСК у больных в зависимости от достижения ими ГМО
Table 5. Characteristics of MMSCs in patients at the onset of the disease depending on the DMR achievement
Достижение ГМО DMR | + | - | |
|---|---|---|---|
Количество больных Number of patients | 5 | 8 | |
Длительность терапии ИТК в момент анализа Time of TKI treatment at the moment of analysis | 17З ± 3,2 | 50,2 ± 1,6 | |
Концентрация КОЕф в костном мозге на 106 клеток CFU-F concentration per 106 bone marrow cell | 29,5 ± 5,0 | 10,6 ± 3,6 | |
Суммарная продукция ММСК, x 106 Cumulative MMSCs production for 4 passages, x 106 | 14,5 ± 2,0 | 5,3 ± 1,7 | |
Время до РO, дней Time to PO, days | 15,6 ± 0,2 | 18,9 ± 1,4 | |
Достоверные отличия в REL генов в ММСК* Significant differences in REL in MMSCs | Jag1 | 3,6 ± 0,1* | 6,0 ± 0,7 |
TGFb1 | 0,6 ± 0,3* | 1,7 ± 0,2 | |
LIF | 4,6 ± 1,9* | 12,5 ± 2,7 | |
Примечание. * — обозначает р < 0,05 при сравнении групп больных достигших ГМО и не достигших при помощи t-критерия Стьюдента для независимых выборок.
Note. * — indicates p < 0.05 when compared MSCs from patients with DMR with the patients without DMR using the Student's t-test for independent samples.
Обсуждение
Известно, что не только строма костного мозга определяет кроветворение, но и качество кроветворения влияет на стромальные клетки [23, 24]. Как опухолевые клетки, так и ИТК могут оказывать влияние на строму больных ХМЛ. Было показано [25], что ММСК больных ХМЛ в дебюте заболевания и в течение года лечения ИТК лучше поддерживают кроветворные клетки-предшественники, чем ММСК доноров и больных острыми лейкозами.
Целью настоящей работы было изучение стромальных клеток-предшественниц у больных ХМЛ в дебюте заболевания и по мере лечения ИТК. Известно, что стромальные и мезенхимальные клетки у этих больных не затронуты опухолевым клоном [26]. Исследование концентрации КОЕф, основных характеристик ММСК, паттерна экспрессии некоторых генов, участвующих в дифференцировке стромальных клеток и поддержании кроветворения, определяют изменения в стромальных предшественниках. В работе показано, что концентрация КОЕф и суммарная клеточная продукция ММСК не отличаются от таковых у доноров в дебюте заболевания. Через год после начала лечения концентрация КОЕф в костном мозге больных уменьшалась в 4 раза, а суммарная клеточная продукция ММСК уменьшалась в 2 раза, что указывает на повреждающее влияние ИТК на стромальные предшественники. Далее, по мере длительного лечения, концентрация КОЕф и пролиферативный потенциал ММСК восстанавливались. Вероятно, стромальные клетки постепенно адаптируются к ингибированию тирозиновых киназ. Анализ REL генов, участвующих в мезенхимальной дифференцировке КОЕф, выявил достоверное увеличение экспрессии генов-маркеров костной (BGLAP и SPP1), хрящевой (SOX9) и жировой (PPARG) дифференцировок. КОЕф больных в дебюте заболевания оказались более дифференцированными, чем у доноров. При этом в дебюте заболевания уменьшалась концентрация ММСК, что совпадает с данными других авторов [27, 28]. Опухолевые клетки адаптируют ниши костного мозга и, вероятно, индуцируют образование новых кроветворных территорий для опухолевых стволовых клеток. После длительного лечения у больных восстанавливаются количественные показатели стромальных клеток-предшественниц. В ММСК больных изменен профиль экспрессии некоторых генов. В дебюте заболевания в ММСК больных достоверно повышена экспрессия генов, участвующих в регуляции кроветворения, — IL6, LIF, CSF1, IGF1, JAG1 и SDF1; ростовых факторов для ММСК — FGF2, FGFR1, FGFR2, PDGFRA, BMP4 генов, участвующих в дифференцировке ММСК — SOX9, PPARG. Повышение экспрессии SDF1 — гена цитокина, отвечающего за попадание кроветворных клеток в строму костного мозга, JAG1 — гена белка, регулирующего пролиферацию и дифференцировку стволовых кроветворных клеток, указывает на повышенную способность ММСК поддерживать кроветворение, что подтверждается данными об улучшении способности ММСК больных поддерживать кроветворные клетки предшественницы доноров [25]. При этом экспрессия генов молекул адгезии также связанных с хомингом СКК (MCAM и ICAM1) снижена в ММСК больных и не восстанавливается до уровня ММСК доноров по мере лечения. В работе D. Aggoune и соавт. [9] была показана повышенная экспрессия других генов, относящихся к статусу «стволовости» ММСК — NANOG, FOXO3 по сравнению с ММСК доноров. К этим генам в нашей работе можно добавить LIF и IGF1. По мере лечения, в зависимости от его длительности, экспрессия всех этих генов уменьшалась и в некоторых случаях достигала таковой в ММСК доноров. Восстановление ростовых характеристик ММСК после длительного лечения можно объяснить частичной нормализацией экспрессии FGF2, FGFR1, FGFR2, PDGFRA, BMP4 и генов, относящихся к дифференцировке, — SOX9, PPARG. Очевидно, что изменения в экспрессии генов не однозначны и затрагивают различные свойства ММСК. Суммарно можно заключить, что концентрация КОЕф и основные характеристики ММСК восстанавливаются после многих лет терапии ИТК. Вероятно, ИТК не оказывают фатального влияние на ростовые характеристики клеток-предшественниц стромального микроокружения.
Было показано, что ЛСК и СКК по-разному регулируются стромальным микроокружением костного мозга [29], однако по большинству характеристик эти клетки совпадают [30]. Анализ ММСК в 2-х группах больных в дебюте заболевания, достигших ГМО менее чем за 1,5 года и не достигших ГМО более чем за 4 года, выявил существенные изменения в экспрессии генов, участвующих в регуляции СКК. В ММСК группы больных, достигших ГМО, REL LIF был в 2 раза ниже, чем в общей группе, и в 3 раза ниже, чем в группе больных, не достигших ГМО, а REL JAG1 и TGFB1 был в 2 раза ниже. Очевидно, что ЛСК лучше поддерживаются ММСК с более высоким уровнем экспрессии этих регуляторных генов. Такие ЛСК более успешно выживают под действием ИТК, что не дает возможности получить ГМО у этих больных.
У больных увеличение количества ЛСК связано с изменением регуляции в сигнальном пути ВМР (костного морфогенетического белка), которое сохраняется у больных, резистентных к терапии ИТК [31, 32]. Сигналы BMP контролируют стволовые клетки в нишах. Белки семейства ВМР (BMP2 и BMP4) важны как для нормального кроветворения, так и при опухолевой трансформации. Факторы семейства BMP, первоначально описанные при формировании кости, оказались связанными с биологией большого числа органов и систем, от эмбриональных до взрослых тканей, и участвуют в пролиферации, дифференцировке и апоптозе стволовых клеток. Клетки опухолевого микроокружения — основные источники растворимых ВМР. И наоборот, ЛСК отображают измененные рецепторы и сигнальные элементы BMP [33, 34]. Показано, что ВМР 4 вовлечен в развитие резистентности к ИТК [35]. Разницы в экспрессии ВМР2 и ВМР4 в этих двух группах больных обнаружено не было. Однако в ММСК больных в дебюте заболевания ВМР2 достоверно ниже, чем у доноров, а ВМР4 — выше и в ММСК, и в КОЕф. Через год после начала лечения экспрессия обоих генов либо еще больше снижается, либо увеличивается.
Таким образом, важность стромального микроокружения для функционирования и сохранения ЛСК у больных ХМЛ не вызывает сомнений. Исследование стромальных клеток-предшественниц у этих больных в дебюте заболевания может иметь прогностическое значение.
Список литературы
1. Taichman R.S. Blood and bone: two tissues whose fates are intertwined to create the hematopoietic stem-cell niche. Blood. 2005; 105: 2631–9.
2. Kumar S., Geiger H. HSC Niche Biology and HSC Expansion ex vivo. Trends Mol. Med. 2017; 23: 799–819.
3. Morrison S.J., Scadden D.T. The bone marrow niche for haematopoietic stem cells. Nature. 2014; 505: 327–34.
4. Chen Q., Yuan Y., Chen T. Morphology, differentiation and adhesion molecule expression changes of bone marrow mesenchymal stem cells from acute myeloid leukemia patients. Mol. Med. Rep. 2014; 9: 293–8.
5. Shipounova I.N., Petrova T.V., Svinareva D.A. et al. Alterations in hematopoietic microenvironment in patients with aplastic anemia. Clin. Transl. Sci. 2009; 2: 67–74.
6. Shipounova I.N., Petinati N.A., Bigildeev A.E. et al. Alterations of the bone marrow stromal microenvironment in adult patients with acute myeloid and lymphoblastic leukemias before and after allogeneic hematopoietic stem cell transplantation. Leuk. Lymphoma. 2017; 58: 408–17.
7. Zhao Z.-G., Liang Y., Li K. et al. Phenotypic and functional comparison of mesenchymal stem cells derived from the bone marrow of normal adults and patients with hematologic malignant diseases. Stem. Cells Dev. 2007; 16: 637–48.
8. Estrada-González P.K., Gómez-Ceja L., Montesinos J.J. et al. Decreased frequency, but normal functional integrity of mesenchymal stromal cells derived from untreated and Imatinib-treated chronic myeloid leukemia patients. Leuk. Res. 2014; 38: 594–600.
9. Aggoune D., Sorel N., Bonnet M-L. et al. Bone marrow mesenchymal stromal cell (MSC) gene profiling in chronic myeloid leukemia (CML) patients at diagnosis and in deep molecular response induced by tyrosine kinase inhibitors (TKIs). Leuk. Res. 2017; 60: 94–102.
10. Arrigoni E., Del Re M., Galimberti S. et al. Concise Review: Chronic Myeloid Leukemia: Stem Cell Niche and Response to Pharmacologic Treatment. Stem. Cells Transl. Med. 2018; 7: 305–14.
11. Guzman M.L., Swiderski C.F., Howard D.S., et al. Preferential induction of apoptosis for primary human leukemic stem cells. Proc. Natl. Acad. Sci. U S A. 2002; 99 (25): 16220–5.
12. Horne G., Jackson L., Helgason V., Holyoake T. Stem Cell Guardians — Old and New Perspectives in LSC Biology. Curr. Drug Targets. 2017; 18: 405–13.
13. Rea D., Mahon F-X. How I manage relapse of chronic myeloid leukaemia after stopping tyrosine kinase inhibitor therapy. Br. J. Haematol. 2018; 180: 24–32.
14. Bhatia R. Novel approaches to therapy in CML. Hematol Am Soc Hematol Educ Progr. 2017; 2017: 115–20.
15. Bhatia R., McGlave P.B., Dewald G.W. et al. Abnormal function of the bone marrow microenvironment in chronic myelogenous leukemia: role of malignant stromal macrophages. Blood. 1995; 85: 3636–45.
16. Camacho V., McClearn V., Patel S., Welner R.S. Regulation of normal and leukemic stem cells through cytokine signaling and the microenvironment. Int. J. Hematol. 2017; 105: 566–77.
17. Sands W.A., Copland M., Wheadon H. Targeting self-renewal pathways in myeloid malignancies. Cell Commun. Signal. 2013; 11: 33.
18. Dominici M., Le Blanc K., Mueller I. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006; 8: 315–7.
19. Fong T.A., Mosmann T.R. Alloreactive murine CD8+ T cell clones secrete the Th1 pattern of cytokines. J. Immunol. 1990; 144: 1744–52.
20. Свинарева Д.А., Шипунова И.Н., Ольшанская И.В. и др. Основные свойства мезенхимальных стромальных клеток донорского костного мозга: поверхностные маркеры. Терапевтический архив. 2010; 82: 52–6.
21. Chomczynski P., Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nat. Protoc. 2006; 1 (2): 581–5. DOI: 10.1038/nprot.2006.83
22. Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative CT method. Nat. Protoc. 2008; 3: 1101–8.
23. Frisch B.J., Ashton J.M., Xing L. et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 2012; 119: 540–50.
24. Lane SW. Bad to the bone. Blood. 2012; 119: 323–5.
25. Sorokina T., Shipounova I., Bigildeev A. et al. The ability of multipotent mesenchymal stromal cells from the bone marrow of patients with leukemia to maintain normal hematopoietic progenitor cells. Eur. J. Haematol. 2016; 97: 245–52.
26. Maniatis A.K., Amsel S., Mitus W.J., Coleman N. Chromosome pattern of bone marrow fibroblasts in patients with chronic granulocytic leukaemia. Nature. 1969; 222: 1278–9.
27. DiIanni M., Moretti L., Del Papa B. et al. Chronic myeloproliferative disorders: the bone marrow stromal component is not involved in the malignant clone. Leukemia. 2007; 21: 377–8.
28. Estrada-González P.K., Gómez-Ceja L. et al. Decreased frequency, but normal functional integrity of mesenchymal stromal cells derived from untreated and Imatinib-treated chronic myeloid leukemia patients. Leuk. Res. 2014; 38: 594–600.
29. Zhang B., Ho Y.W., Huang Q. et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 2012; 21: 577–92.
30. Dick J.E. Stem cell concepts renew cancer research. Blood. 2008; 112: 4793–807.
31. Toofan P., Irvine D., Hopcroft L. et al. The role of the bone morphogenetic proteins in leukaemic stem cell persistence. Biochem. Soc. Trans. 2014; 42: 809–15.
32. Gerber J.M., Gucwa J.L., Esopi D. et al. Genome-wide comparison of the transcriptomes of highly enriched normal and chronic myeloid leukemia stem and progenitor cell populations. Oncotarget. 2013; 4(5): 715–28.
33. Laperrousaz B., Jeanpierre S., Sagorny K. et al. Primitive CML cell expansion relies on abnormal levels of BMPs provided by the niche and on BMPRIb overexpression. Blood. 2013; 122: 3767–77.
34. Zylbersztejn F., Flores-Violante M., Voeltzel T. et al. The BMP pathway: A unique tool to decode the origin and progression of leukemia. Exp. Hematol. 2018; 61: 36–44.
35. Grockowiak E., Laperrousaz B., Jeanpierre S., et al. Immature CML cells implement a BMP autocrine loop to escape TKI treatment. Blood. 130: 2860–71.
Об авторах
Н. А. ПетинатиРоссия
Петинати Наталия Арнольдовна*, кандидат медицинских наук, старший научный сотрудник лаборатории физиологии кроветворения
И. Н. Шипунова
Россия
Шипунова Ирина Николаевна, кандидат биологических наук, старший научный сотрудник лаборатории физиологии кроветворения
А. Е. Бигильдеев
Россия
Бигильдеев Алексей Евгеньевич, доктор биологических наук, старший научный сотрудник лаборатории физиологии кроветворения
Н. В. Сац
Россия
Сац Наталья Владимировна, кандидат биологических наук, старший научный сотрудник лаборатории физиологии кроветворения
Е. Ю. Челышева
Россия
Челышева Екатерина Юрьевна, кандидат медицинских наук, старший научный сотрудник научно-консультативного отделения химиотерапии миелопролиферативных заболеваний
О. А. Шухов
Россия
Шухов Олег Александрович, кандидат медицинских наук, научный сотрудник отделения, врач-гематолог
тел.: +7(495)612-16-36
А. Н. Петрова
Россия
Петрова Анна Николаевна, аспирант научно-консультативного отделения химиотерапии миелопролиферативных заболеваний, врач-гематолог
А. Г. Туркина
Россия
Туркина Анна Григорьевна, доктор медицинских наук, профессор, руководитель научно-консультативного отделения химиотерапии миелопролиферативных заболеваний
Н. И. Дризе
Россия
Дризе Нина Иосифовна, доктор биологических наук, заведующая лабораторией физиологии кроветворения
Рецензия
Для цитирования:
Петинати Н.А., Шипунова И.Н., Бигильдеев А.Е., Сац Н.В., Челышева Е.Ю., Шухов О.А., Петрова А.Н., Туркина А.Г., Дризе Н.И. ИЗМЕНЕНИЯ В КЛЕТКАХ-ПРЕДШЕСТВЕННИЦАХ СТРОМАЛЬНОГО МИКРООКРУЖЕНИЯ КОСТНОГО МОЗГА БОЛЬНЫХ ХРОНИЧЕСКИМ МИЕЛОЛЕЙКОЗОМ В ДЕБЮТЕ ЗАБОЛЕВАНИЯ И В ХОДЕ ЛЕЧЕНИЯ. Гематология и трансфузиология. 2019;64(4):424–435. https://doi.org/10.35754/0234-5730-2019-64-4-424-435
For citation:
Petinati N.A., Shipunova I.N., Bigildeev A.E., Sats N.V., Chelysheva E.Yu., Shukhov O.A., Petrova A.N., Turkina A.G., Drize N.I. CHANGES IN STROMAL PROGENITOR CELLS DERIVED FROM BONE MARROW IN PATIENTS WITH CHRONIC MYELOGENOUS LEUKAEMIA AT THE ONSET OF THE DISEASE AND DURING TREATMENT. Russian journal of hematology and transfusiology. 2019;64(4):424–435. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-424-435











































