Перейти к:
АГРЕГАЦИЯ ТРОМБОЦИТОВ И ИХ РАЗМЕРЫ ПРИ ОЖОГОВОЙ БОЛЕЗНИ У ДЕТЕЙ
https://doi.org/10.35754/0234-5730-2019-64-4-462-470
Аннотация
Введение. Одним из основных факторов патогенеза ожоговой болезни являются нарушения микроциркуляции и гемостаза, причиной которых служит повышение агрегации тромбоцитов. Механизмы усиления агрегации тромбоцитов малоизучены. Основные результаты получены у взрослых больных в раннем периоде ожоговой болезни, поскольку у больных детского возраста аналогичные данные отсутствуют. Имеются данные о связи размеров тромбоцитов (MPV) с их функциональными возможностями.
Цель — исследование спонтанной и АДФ-индуцированной агрегации тромбоцитов в зависимости от их размеров при ожоговой болезни у детей.
Материалы и методы. У детей в возрасте от 3 до 17 лет с площадью ожога от 10 до 70 % поверхности тела изучали агрегацию и размеры тромбоцитов в раннем периоде и до выписки. Спонтанную агрегацию тромбоцитов исследовали в условиях искусственного сдвигового потока, а АДФ-индуцированную агрегацию — турбидиметрическим методом. Изучение размеров тромбоцитов проводили кондуктометрическим методом.
Результаты. У детей при ожоговой болезни спонтанная агрегация тромбоцитов значительно возрастает. Впервые оценили интегральную оптическую плотность образовывающихся агрегатов, их площадь и периметр. Эти показатели оставались повышенными даже при полном закрытии ожоговых ран. Изменения АДФ-индуцированной агрегации тромбоцитов носили при ожоговой болезни разнонаправленный характер. Средний объем тромбоцитов (MPV) возрастал в остром периоде ожоговой болезни, снижался в периоде токсемии и нормализовался к моменту выписки больных. Изменения MPV не отражались на динамике агрегационных свойств тромбоцитов. Отсутствовала зависимость степени агрегации от выраженности гиперфибриногенемии. В крови ожоговых больных имелось большое количество активированных тромбоцитов, что являлось причиной усиления их спонтанной агрегации, не требовавшей участия экзогенных индукторов.
Заключение. У детей после термической травмы наблюдалось усиление спонтанной агрегации тромбоцитов, сохранявшееся до полного закрытия ожоговых ран. Причиной усиления спонтанной агрегации тромбоцитов являлось значительное увеличение количества активированных тромбоцитов.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Финансирование: исследование не имело спонсорской поддержки.
Для цитирования:
Левин Г.Я., Поповичева А.Н., Соснина Л.Н., Шереметьев Ю.А. АГРЕГАЦИЯ ТРОМБОЦИТОВ И ИХ РАЗМЕРЫ ПРИ ОЖОГОВОЙ БОЛЕЗНИ У ДЕТЕЙ. Гематология и трансфузиология. 2019;64(4):462–470. https://doi.org/10.35754/0234-5730-2019-64-4-462-470
For citation:
Levin G.Ya., Popovicheva A.N., Sosnina L.N., Sheremetyev Yu.A. AGGREGATION AND SIZE OF PLATELETS IN CHILDREN WITH BURN DISEASE. Russian journal of hematology and transfusiology. 2019;64(4):462–470. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-462-470
Введение
Нарушения микроциркуляции и гемостаза развиваются с первых часов после тяжелой термической травмы и определяют патогенез ее острых периодов [1]. Важной причиной этих нарушений является изменение функциональных свойств тромбоцитов, прежде всего повышение их агрегационной способности [2]. Агрегация тромбоцитов при ожоговой болезни исследовалась, в основном, с помощью экзогенных индукторов [3—5]. При этом она изучалась у взрослых больных и, главным образом, лишь в острый период ожоговой болезни. Механизмы изменения агрегации тромбоцитов при ожоговой болезни остаются недостаточно изученными.
Степень активации тромбоцитов при ожоговой болезни может быть велика за счет резкого повышения содержания в крови агонистов агрегации. Кроме плазменных факторов определенную роль в повышении агрегационных свойств тромбоцитов могут играть изменения их морфологии, в частности изменение их среднего объема (mean platelet volume, MPV). Считается, что маленькие тромбоциты имеют более низкие функциональные возможности, а большие тромбоциты являются метаболически и ферментативно более активными [6]. Однако вопрос о том, является ли средний объем тромбоцитов полезным маркером в оценке их функционального состояния при ожоговой болезни, остается открытым до настоящего времени. В литературе имеются лишь единичные сообщения об изменении спонтанной агрегации тромбоцитов [2] и их среднего объема при тяжелых ожогах у взрослых больных [7].
Изучение функциональных свойств тромбоцитов у больных детского возраста при ожоговой болезни не проводилось.
Цель работы — исследование спонтанной и АДФ- индуцированной агрегации тромбоцитов в зависимости от их размеров при ожоговой болезни у детей
Материалы и методы
На проведение данной работы было получено разрешение локально-этического комитета федерального государственного бюджетного учреждения высшего образования «Приволжский медицинский исследовательский университет» Минздрава России (ФГБОУ ВО ПМИУ). Информированное согласие на участие в исследовании было получено от родителей всех детей. В исследование были включены 28 больных ожогового центра ФГБОУ ВО ПМИУ обоих полов в возрасте от 3 до 17 лет с ожогами площадью от 10 до 70 % поверхности тела. Проведена серия наблюдений в период лечения больных от 3 суток после термической травмы до полного закрытия ожоговых ран и выписки больного.
Согласно принятой классификации [8], выделяли следующие периоды ожоговой болезни:
- ожоговый шок — до 3 сут;
- острая ожоговая токсемия — 3—9 сут;
- септикотоксемия — с 9-х суток до полного заживления ран;
- период реконвалесценции (до восстановления двигательных функций и возможности самообслуживания).
Полученные результаты сравнивались с соответствующими показателями 18 условно здоровых детей обоих полов того же возраста.
Кровь забирали на 3—8, 12-16-е сутки после травмы и после закрытия ожоговых ран (20-е сутки и более). Забор крови осуществляли утром, натощак, путем венепункции локтевой вены в вакуумные пробирки, содержащие 3,8 % цитрат натрия (в соотношении 9:1) и К ЭДТА (для подсчета количества тромбоцитов и их среднего объема). Плазму, обогащенную тромбоцитами (ПОТ), получали путем центрифугирования цитратной крови в течение 7 мин при 800 об./мин. Бедную тромбоцитами плазму получали путем центрифугирования оставшейся крови в течение 20 мин при 3000 об./мин.
Спонтанную агрегацию тромбоцитов исследовали на реоскопе, сконструированном по принципу [9], в нашей модификации [10]. Для этого тромбоциты помещали между двумя плоскопараллельными пластинами, вращающимися навстречу друг другу, что приводило к спонтанной агрегации тромбоцитов в условиях искусственного сдвигового потока с видеозаписью процесса агрегации. ПОТ (количество тромбоцитов предварительно стандартизовали до концентрации 200—250 х 109 /л помещали между двумя плоскопараллельными пластинами и создавали поток со скоростью сдвига 40 с-1. Далее производили видеозапись процесса агрегации в течение 400 с, а также его дискретную микрофотосъемку с интервалом в 20 с после начала агрегации. Компьютерную обработку полученных данных осуществляли с помощью специально разработанной программы, рассчитывающей плотность ρ (усл. ед.), площадь S (усл. ед.) и периметр П (усл. ед.) агрегатов, которые дают представление об их объеме и размере, время появления максимальных агрегатов.
Индуцированную АДФ (2 х 10-5 М) агрегацию тромбоцитов изучали турбидиметрическим методом Born [11] на лазерном анализаторе марки 230LA-2 производства НПФ «Биола» (Россия). Исследование проводили с использованием ПОТ (количество тромбоцитов предварительно стандартизовали до концентрации 200—250 х 109/л. Процесс АДФ-индуцированной агрегации тромбоцитов оценивали по степени (максимальная амплитуда агрегатограммы Ма, процент светопропускания) и скорости агрегации (амплитуда агрегатограммы через 35 с после добавления индуктора, процент светопропускания).
Концентрацию фибриногена определяли по методу Клаусса. Количество тромбоцитов и их MPV определяли кондуктометрическим методом на гематологическом анализаторе Abacus Junior 30 ND (Diatron, Hungary) в течение 1 часа после венепункции.
Статистический анализ. Полученные результаты представлены как выборочное среднее ± стандартная ошибка среднего. Количественные показатели прошли проверку на нормальность распределения с использованием критерия Шапиро—Уилка (пакет программ Statistica 6.0). Результаты исследования обработаны методами непараметрической статистики с применением критериев Манна—Уитни и парных сравнений Уилкоксона. Для изучения взаимосвязей между изучаемыми параметрами применяли корреляционный анализ (метод Спирмена). Различия считались статистически значимыми прир < 0,05.
Результаты
Скорость спонтанной агрегации тромбоцитов значительно возрастала при ожоговой болезни (табл. 1). Если у здоровых детей к 40-й секунде после помещения ПОТ в условия искусственного сдвигового потока лишь в единичных случаях начинали образовываться мелкие агрегаты, то в остром периоде ожоговой болезни у всех больных в этих условиях уже образовалось большое количество агрегатов, количество которых осталось повышенным и до конца периода токсемии (табл. 1). Кроме того, впервые регистрировали и оценивали интегральную оптическую плотность образовавшихся агрегатов, их площадь и периметр, которые позволяли представить их объем и размер. Значительно увеличивались эти параметры как в остром периоде ожоговой болезни, так и через 12—16 суток после травмы. Важной особенностью агрегации является то, что эти показатели агрегации оставались увеличенными даже при полном закрытии ожоговых ран, при выписке больных (табл. 2).
Таблица 1. Влияние термической травмы на скорость спонтанной агрегации тромбоцитов (количество агрегатов, усл. ед.)
Table 1. Influence of a thermal injury on the rate of spontaneous platelet aggregation (number of aggregates, unit)
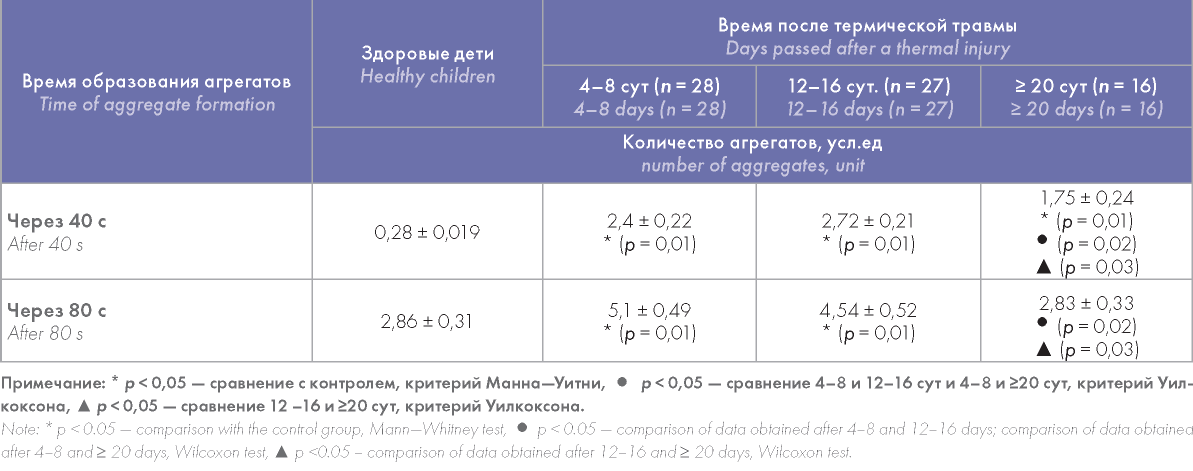
Таблица 2. Влияние термической травмы на плотность (ρ), площадь (S) и периметр (П) агрегатов тромбоцитов
Table 2. Influence of a thermal injury on the density (pj, area (S) and perimeter (П) of platelet aggregates

Изменялся при ожогах и характер спонтанной агрегации тромбоцитов. Если у здоровых детей образование крупных агрегатов начиналось через 206,0 ± 14,2 с, то после 3—8 дней ожога оно происходило значительно раньше — через 115,1 ± 12,4 с (р < 0,05). Даже при выписке больных образование крупных агрегатов оставалось ускоренным и наблюдалось через 160,5 ± 15,1 с (р < 0,05). Три крупных агрегата образовались лишь у 20 % здоровых детей. При ожоге у 77 % больных три крупных агрегата образовались в период от 3 до 8 дней после ожоговой травмы и у 80 % обожженных — в период от 12 до 16 суток после ожога. В эти же сроки после ожога у 61 и 41 % детей образовались 4, а у 15 % детей — до шести крупных тромбоцитарных агрегатов (рис. 1). При выписке у 37,5 % детей сохранялась способность к образованию до трех крупных агрегатов, что было выше этого показателя у здоровых детей.

Рисунок 1. Спонтанная агрегация тромбоцитов (через 400 с после начала агрегации)
Figure 1. Spontaneous platelet aggregation (400 s after the onset of aggregation)
Примечание. а — здоровый ребенок В., 16 лет; б — больной П., 5 лет, площадь ожога 40 % поверхности тела, 16-е сутки после ожога.
Note. а — healthy child V., 16 years old; б — patient P., 5 years old, with burns covering 40 % of the body surface, 16th day after the thermal injury.
Изучение АДФ-индуцированной агрегации тромбоцитов показало, что ожоги вызывают разнонаправленные изменения этого показателя. Скорость АДФ- индуцированной агрегации у 60 % больных во все периоды ожоговой болезни была ниже аналогичного показателя у здоровых детей, а у 45 % больных степень была выше, чем у здоровых. Статистически значимых различий между показателями АДФ-индуцированной агрегации тромбоцитов у здоровых детей и при ожогах не обнаружено.
Значительно изменялась при ожоговой болезни у детей и концентрация тромбоцитов. В раннем постшоковом периоде (третьи сутки после ожоговой травмы) концентрация тромбоцитов (248,4 ± 17,65 х 109 /л) была существенно ниже (р < 0,05), чем к восьмому дню после ожога. Более высокая концентрация тромбоцитов сохранялась и к моменту выписки больных, хотя и в меньшей степени, чем в период поздней токсемии (табл. 3). Эти данные согласуются с ранее полученными результатами у взрослых больных с ожоговой болезнью [12].
Таблица 3. Влияние термической травмы на количество тромбоцитов и их средний объем (MPV)
Table 3. Influence of a thermal injury on the number of platelets and their mean volume (MPV)

Средний объем тромбоцитов возрастал в остром периоде ожоговой болезни и значительно снижался к 12—16-м суткам после травмы. К выписке средний объем тромбоцитов приближается к норме (табл. 3). Установлена достоверная обратная корреляция между концентрацией тромбоцитов и MPV через 3—8 суток после ожога (r = —0,39; р = 0,04).
Статистически достоверная зависимость количества тромбоцитов, их среднего объема и параметров агрегации от возраста и площади поражения больных не обнаружена. Однако это может быть связано с небольшим количеством больных в группах и требует дальнейшего исследования.
В остром периоде ожоговой болезни концентрация фибриногена значительно повышалась по сравнению со здоровыми детьми — до 6,21 ± 0,40 г/л (р < 0,05), а к 12—16 дням после ожога концентрация фибриногена составляла 4,51 ± 0,33 г/л (р < 0,05). При выписке концентрация фибриногена не отличалась от его уровня у здоровых детей и составляла 3,15 ± 0,19 г/л.
Обсуждение
В дополнение к их первичной гемостатической функции тромбоциты участвуют в патогенезе воспаления, инициируя и поддерживая воспалительные процессы путем секреции и высвобождения при агрегации многочисленных биологически активных веществ, таких как интерлейкин-1, фактор активации тромбоцитов, фактор тромбоцитов 4 [13]. В последнее время появилось достаточное количество исследований, указывающих на связь объема тромбоцитов (MPV) с рядом воспалительных состояний [14—16]. Однако каким образом отражаются изменения MPV на функциональных свойствах тромбоцитов, в частности на их агрегации, остается неизученным. Нами установлено, что уменьшение концентрации тромбоцитов и MPV в период ожоговой токсемии не сопровождается снижением спонтанной агрегации тромбоцитов. Не обнаружено корреляции между концентрацией тромбоцитов, MPV и всеми исследованными показателями агрегации тромбоцитов при ожоговой болезни у детей.
Таким образом, изменения размеров, количества тромбоцитов и их агрегационной способности при ожоговой болезни не зависят друг от друга. Можно предположить, что динамика концентрации тромбоцитов вызвана тем, что в период шока происходит максимальное потребление тромбоцитов за счет гиперкоагуляции, а в ряде случаев — диссеминированного внутрисосудистого свертывания [17, 18]. После выхода из состояния шока начинал преобладать тромбоцитоз, что соответствует литературным данным [12, 19, 20]. В этот период уменьшается MPV. Известно, что уменьшение MPV происходит при ряде воспалительных процессов и может быть маркером их активности [21, 22].
Механизмы, регулирующие объем тромбоцитов, остаются в значительной степени неясными. Уменьшенный объем тромбоцитов в период ожоговой токсемии может быть связан с тем, что большие активированные тромбоциты потребляются в первую очередь [23]. Кроме того, уменьшение MPV может происходить за счет микровезикуляции, которая возникает при ожоговой болезни [24, 25]. Согласно литературным данным [26], множественные микровезикулы (МВ) в крови имеют тромбоцитарное происхождение. Высвобождение МВ не только сопровождается уменьшением MPV. Сами МВ играют важную роль в патогенезе различных заболеваний, особенно сопровождающихся риском тромботических осложнений и воспалительных состояний [27, 28].
Таким образом, усиление спонтанной агрегации тромбоцитов при ожоговой болезни у детей не связано с изменением MPV. Наиболее важным фактором гиперагрегации тромбоцитов является гиперфибрино- генемия [2]. По нашим данным, концентрация фибриногена значительно повышена в острый период ожоговой болезни. При выписке концентрация фибриногена в среднем не отличается от этого показателя у здоровых детей. Однако корреляции между концентрацией фибриногена и показателями агрегации тромбоцитов при ожоговой болезни у детей не обнаружено. Это свидетельствует о том, что в механизме гиперагрегации тромбоцитов важную роль играет наличие в крови ожоговых больных большого количества индукторов агрегации.
Важную роль в агрегации тромбоцитов при ожоговой болезни может играть тромбинемия. При этом спонтанная агрегация тромбоцитов осуществляется за счет взаимодействия рецепторов тромбоцитов GPIb с тромбином, который, имея два центра связывания, может служить мостиком между тромбоцитами [29, 30].
Таким образом, при наличии в плазме крови ожоговых больных большого количества индукторов агрегации тромбоцитов, прежде всего тромбина, активными (высокоаффинными) становятся многие рецепторы, в том числе PAR1 и PAR4. Активация рецепторов стимулирует передачу сигнала внутрь клетки, что ведет к активации фосфолипазы С, мобилизации Ca2+, активации протеинкиназы С и, как следствие, к активации интегринов и агрегации тромбоцитов [31, 32]. При термической травме это, вероятнее всего, и происходит.
Для проверки этого положения проведены следующие исследования [33]. Кровь стабилизировали эти- лендиаминтетрауксусной кислотой (4,8 мкмоль/л), блокируя тем самым один из конечных путей активации тромбоцитов — увеличение концентрации внутриклеточного Ca2+. При этом спонтанная агрегация донорских тромбоцитов полностью предотвращалась. В этих условиях агрегация тромбоцитов ожоговых больных снижалась, но полностью не блокировалась.
Это подтверждало наличие большого количества активированных тромбоцитов в крови больных ожоговой болезнью (рис. 1).
В основе механизма агрегации тромбоцитов лежит взаимодействие GPIIb/IIIa со своими лигандами. Однако при ожоговой болезни значительный вклад в этот процесс вносят и иные пути активации и агрегации тромбоцитов, осуществляемые при непосредственном участии других рецепторов и лигандов [34].
Таким образом, при ожоговой болезни у детей происходило значительное увеличение скорости, степени и характера спонтанной агрегации тромбоцитов, сохранявшейся повышенной и к периоду выписки больных. При ожоговой болезни у детей выявлены разнонаправленные изменения АДФ-индуцированной агрегации тромбоцитов, статистически не отличающиеся от аналогичных показателей у здоровых детей. При ожоговой болезни у детей не обнаружено зависимости повышенной агрегации тромбоцитов от их измененного среднего объема (MPV) и развивающейся гиперфибриногене- мии. В крови больных ожоговой болезнью обнаружено большое количество активированных тромбоцитов.
Список литературы
1. Lippi G., Ippolito L., Cervellin G. Disseminated intravascular coagulation in burn injury. Semin. Thromb. Hemost. 2010; 36(4): 429–36. DOI: 10.1055/s0030-1254051
2. Levin G..Y., Egorihina M.N. The role of fi brinogen in aggregation of platelets in burn injury. Burns. 2010; 36(6): 806–10.
3. Шписман М.Н., Тютрин И.И., Евескин М.Ш. Инструментальная диагностика нарушений гемокоагуляционного гомеостаза при ожоговом шоке. Бюллетень сибирской медицины. 2003; (4): 103–10.
4. Bekyarova G. Relationship between enhanced platelet aggregation and oxidative alteration of erythrocytes in the early phase after thermal injury. Pathophysiology. 1998; 5(1): 188.
5. Kamel A.H., Ahmed Y.A.A., Thabet N.M., EI-Haish M.K. Modulation by aspirin of platelet function in burn patients: clinical and laboratory assessment. Ann. Burns Fire Disasters. 1999; 3: 99–102.
6. Ranjith M.P., Divya R., Mehta V.K. et al. Signifi cance of platelet volume indices and platelet count in ischaemic heart disease. J. Clin. Pathol. 2009; 62(9): 830–3.
7. Sen S., Hsei L., Tran N. et al. Early clinical complete blood count changes in severe burn injuries. Burns. 2019; 45(1): 97–102. DOI: 10.1016/j.burns.2018.09.004
8. Кочетыгов Н.И. Ожоговая болезнь (очерки по патологической физиологии). — Л.: Медицина, 1973. — 247 с.
9. Schmid-Schönbein H., von Gosen J., Heinich L. et al. A counter-rotating “rheoscope chamber” for the study of the microrheology of blood cell aggregation by microscopic observation and microphotometry. Microvasc. Res. 1973; 6(3): 366–76.
10. Левин Г.Я., Модин А.П., Кудрицкий С.Ю., Соснина Л.Н. Устройство для исследования агрегации тромбоцитов. Патент РФ № 2278381; 2006.
11. Born G.V. Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature. 1962; 194: 927–9.
12. Marck R.E, Montagne H.L., Tuinebreijer W.E., Breederveld R.S. Time course of thrombocytes in burn patients and its predictive value for outcome. Burns. 2013; 39(4): 714–22. DOI: 10.1016/j.burns.2013.01.015
13. Chu S.G., Becker R.C., Berger P.B. et al. Mean platelet volume as a predictor of cardiovascular risk: a systematic review and metaanalysis. J. Thromb. Haemost. 2010; 8(1): 148–56.
14. Turhan O., Coban E., Inan D., Yalcin A.N. Increased mean platelet volume in chronic hepatitis B patients with inactive disease. Med. Sci. Monit. 2010; 16(4): CR202–5.
15. Sahin Ö.B., Bilen S., Ulusoy E.K. et al. Thrombopoietin and mean platelet volume in patients with ischemic stroke. Clin. Appl. Thromb. Hemost. 2013; 19(1): 92–5.
16. Albayrak Y., Albayrak A., Albayrak F. et al. Mean platelet volume: a new predictor in confi rming acute appendicitis diagnosis. Clin. Appl. Thromb. Hemost. 2011; 17(4): 362–6.
17. Glas G.J., Levi M., Schultz M.J. Coagulopathy and its management in patients with severe burns. J. Thromb. Haemost. 2016; 14(5): 865–74. DOI: 10.1111/ jth.13283
18. Mitra B., Wasiak J., Cameron P.A. et al. Early coagulopathy of major burns. Injury. 2013; 44(1): 40–3. DOI: 10.1016/j.injury.2012.05.010
19. Cao X.-Li, Ouyang Y.-Qi. Dynamic Changes of Blood Platelet of Burn Patients and Its Signifi cance. J Chenzhou Med Col. 2004; 03. http://en.cnki.com.cn/ Journal_en/E-E000-CZYG-2004-03.htm
20. Wei L., Liu F. Variation and clinical signifi cance of blood platelet count in serious burn children. J. Clin. Sur. 2005; 10. http://en.cnki.com.cn/Journal_en/EE066-LCWK-2005-10.htm
21. Kapsoritakis A.N., Koukourakis M.I., Sfi ridaki A. et al. Mean Platelet Volume: A Useful Marker of Infl ammatory Bowel Disease Activity. Am. J. Gastroenterol. 2001; 96(3): 776–81.
22. Öztürk Z.A., Dag M.S., Kuyumcu M.E. et al. Could platelet indices be new biomarkers for infl ammatory bowel diseases? Eur. Rev. Med. Pharmacol. Sci. 2013; 17(3): 334–41.
23. Collins C.E., Rampton D.S. Platelet dysfunction: a new dimension in infl ammatory bowel disease. Gut. 1995; 36(1): 5–8.
24. Midura E.F., Kuethe J.W., Rice T.C. et al. Impact of Platelets and Platelet-Derived Microparticleson Hypercoagulability Following Burn Injury Shock. 2016; 45(1): 82–7. DOI: 10.1097/SHK.0000000000000460
25. Porter J.R.S. Microvesicles as mediators of infl ammation in severe burn injury. MD Thesis. 2015. 223 p.
26. Зубаиров Д.М., Зубаирова Л.Д. Микровезикулы в крови. Функции и их роль в тромбообразовании. — М.: ГЭОТАР-Медиа, 2009. — 168 с.
27. Sabatier F., Darmon P., Hugel B. et al. Type1 and type2 diabetic patients display different patterns of cellular microparticles. Diabetes. 2002; 51(9): 2840–5.
28. Preston R.A, Jy W., Jimenez J.J. et al. Effects of severe hypertension on endothelial and platelet microparticles. Hypertension. 2003; 41(2): 211–7.
29. Stubbs M.T., Bode W. A player of many parts: the spotlight falls on thrombin’s structure. Thromb. Res. 1993; 69(1): 1–58.
30. Fenton J.W. 2nd. Thrombin functions and antithrombotic intervention. Thromb. Haemost. 1995; 74(1): 493–8.
31. Jackson S.P., Nesbitt W.S., Kulkarni S. Signaling events underlying thrombus formation. J. Thromb. Haemost. 2003; 1(7): 1602–12.
32. Ruf W., Dorfl eutner A., Riewald M. Specifi city of coagulation factor signaling. J. Thromb. Haemost. 2003; 1(7): 1495–503.
33. Левин Г.Я., Егорихина М.Н. Способ определения внутрисосудистой активации тромбоцитов. Патент РФ № 2416796; 2011.
34. Macfarlane S.R., Seatter M.J., Kanke T., Hunter G.D., Plevin R. Proteinaseactivated receptors. Pharmacol. Rev. 2001; 53(2): 245–82.
Об авторах
Г. Я. ЛевинРоссия
Левин Григорий Яковлевич, доктор медицинских наук, профессор, заслуженный деятель науки РФ, ведущий научный сотрудник, руководитель отделения гравитационной хирургии и гемодиализа Университетской клиники
А. Н. Поповичева
Россия
Поповичева Александра Николаевна, младший научный сотрудник отделения гравитационной хирургии и гемодиализа Университетской клиники
Л. Н. Соснина
Россия
Соснина Лариса Николаевна, младший научный сотрудник отделения гравитационной хирургии и гемодиализа Университетской клиники
Ю. А. Шереметьев
Россия
Шереметьев Юрий Александрович, доктор биологических наук, старший научный сотрудник отделения гравитационной хирургии и гемодиализа Университетской клиники
Рецензия
Для цитирования:
Левин Г.Я., Поповичева А.Н., Соснина Л.Н., Шереметьев Ю.А. АГРЕГАЦИЯ ТРОМБОЦИТОВ И ИХ РАЗМЕРЫ ПРИ ОЖОГОВОЙ БОЛЕЗНИ У ДЕТЕЙ. Гематология и трансфузиология. 2019;64(4):462–470. https://doi.org/10.35754/0234-5730-2019-64-4-462-470
For citation:
Levin G.Ya., Popovicheva A.N., Sosnina L.N., Sheremetyev Yu.A. AGGREGATION AND SIZE OF PLATELETS IN CHILDREN WITH BURN DISEASE. Russian journal of hematology and transfusiology. 2019;64(4):462–470. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-462-470











































