Перейти к:
Формирование когорты доноров антиковидной плазмы с высоким титром антител, нейтрализующих вирус SARS-CoV-2
https://doi.org/10.35754/0234-5730-2020-65-3-242-250
Аннотация
Введение. Трансфузии плазмы антиковидной патогенредуцированной (ПАП) рассматривается как один из методов лечения COVID-19.
Цель: проанализировать опыт формирования донорского резерва из реконвалесцентов COVID-19 для заготовки ПАП.
Материалы и методы. В ретроспективное исследование включено 493 реконвалесцента COVID-19, проходивших обследование в ГБУЗ «НИИ скорой помощи им. Н. В. Склифосовского ДЗМ» в качестве потенциальных доноров ПАП. Заготовку ПАП осуществляли методом плазмафереза. К процедуре плазмодачи допускали доноров, у которых в анамнезе была перенесенная инфекция COVID-19, подтвержденная выявлением методом полимеразной цепной реакции РНК SARS-CoV-2 в мазках из глотки, наличие медицинской документации, срок с момента разрешения заболевания не менее 14 суток. В качестве характеристики иммунологической состоятельности ПАП был выбран титр вируснейтрализующих антител (ВНА). Сопоставлены характеристики доноров (пол, возраст, давность с момента начала заболевания и регресса клинической симптоматики, особенности течения COVID-19) с титром ВНА.
Результаты. Эффективный титр ВНА (1:160 и более) выявлен у 21,10 % доноров, допустимый (1:80) — у 24,75 %. Значимыми предикторами высокого титра ВНА оказались: мужской пол донора, возраст старше 36 лет, наличие верифицированной вирусной пневмонии. Отсутствие значимой температурной реакции (38,5 °C) может рассматриваться как отрицательный маркер для привлечения потенциального донора.
Заключение. Для получения ПАП с высокими титрами ВНА оптимально привлечение в качестве доноров-реконвалесцентов мужчин, переболевших COVID-19 с клинической картиной вирусной пневмонии и значимой температурной реакцией.
Для цитирования:
Симарова И.Б., Костин А.И., Смирнова Ю.В., Ладыгина Е.А., Логунов Д.Ю., Должикова И.В., Ганчин В.В., Васин Е.А., Байков А.И., Буланов А.Ю., Боровкова Н.В., Петриков С.С. Формирование когорты доноров антиковидной плазмы с высоким титром антител, нейтрализующих вирус SARS-CoV-2. Гематология и трансфузиология. 2020;65(3):242-250. https://doi.org/10.35754/0234-5730-2020-65-3-242-250
For citation:
Simarova I.B., Kostin A.I., Smirnova J.V., Ladygina E.A., Logunov D.Yu., Dolzhikova I.V., Ganchin V.V., Vasin E.A., Baykov A.I., Bulanov A.Yu., Borovkova N.V., Petrikov S.S. Formation of a cohort of anticovid plasma donors with high-titer antibodies neutralizing SARS-CoV-2. Russian journal of hematology and transfusiology. 2020;65(3):242-250. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-242-250
Введение
В марте 2020 года Всемирная организация здравоохранения объявила пандемию новой инфекции, вызванной вирусом из семейства Coronaviridae: SARS- CoV-2 (Severe acute respiratory syndrome coronavirus —2). Новая коронавирусная инфекция получила название COVID-19. Наиболее тяжелым осложнением COVID-19 явилась пневмония, характеризующаяся атипичным течением и частым развитием острой дыхательной недостаточности. К настоящему моменту в мире инфицировано более 13 млн человек, из которых свыше 570 тысяч умерли [1]. COVID-19 — это не первая коронавирусная инфекция, эпидемия которой возникает в мире. Ранее, в 2003 году, состоялась эпидемия атипичной пневмонии, вызванная вирусом SARS-CoV, а в 2012 г. — MERS [2]. В период прошедших эпидемий при отсутствии специфических методов лечения одним из эффективных подходов явились трансфузии плазмы крови выздоровевших пациентов (плазмы реконвалесцентов). Лечение с помощью трансфузий плазмы, полученной от реконвалесцентов, представляет собой пассивную иммунизацию за счет введения антител к инфекционному агенту. Такой метод лечения имеет богатую историю, начиная с пандемии «испанки» более 100 лет назад [2][3][4][5][6][7]. Эффективность переливания плазмы реконвалесцентов была показана также при эпидемии гриппа H1N1 в 2009 году [4].
На сегодняшний день нет средств этиотропной терапии COVID-19 с доказанной эффективностью. Высокая летальность, ассоциированная с COVID-19, потребовала неотложных решений, и по аналогии с предыдущими инфекциями, вызванными корона-вирусом, группы экспертов из разных стран пришли к выводу о целесообразности применения плазмы реконвалесцентов (convalescent plasma, или реконвалесцентная плазма, или, согласно «Временным рекомендациям МЗ РФ» (версия 6), применяется плазма антиковидная патогенредуцированная — ПАП) с лечебной целью у больных с COVID-19 [8][9]. В ряде стран запущены программы по заготовке и клиническому использованию ПАП [8][9]. Основным параметром, обеспечивающим терапевтическую эффективности плазмы реконвалесцентов, является наличие и титр вируснейтрализующих антител (ВНА). В то же время в ряде работ показано, что выраженность иммунного ответа на COVID-19 различна, и антитела, нейтрализующие вирус, определяются не у всех переболевших [10]. В этой связи при получении плазмы с высокой терапевтической эффективностью актуальным является тщательный отбор доноров-реконвалесцентов.
Цель настоящей работы — анализ опыта формирования донорского резерва из реконвалесцентов COVID-19 для заготовки ПАП.
Материалы и методы
В рамках пилотного проекта Департамента здравоохранения города Москвы в ретроспективное исследование включено 493 реконвалесцента COVID-19, прошедших обследование в ГБУЗ «НИИ скорой помощи им. Н. В. Склифосовского ДЗМ» в качестве потенциальных доноров ПАП. Средний возраст доноров составил 36 лет (от 25 до 55 лет). Среди доноров были 271 (55 %) мужчина и 22 (45 %) женщины.
Заготовку ПАП осуществляли методом плазмафереза. Критериями отбора доноров были перенесенная инфекция COVID-19, подтвержденная выявлением методом полимеразной цепной реакции (ПЦР) РНК SARS-CoV-2 в мазках из глотки, наличие медицинской документации (с указанием на два отрицательных результата на ПЦР РНК SARS-CoV-2), срок с момента выписки из стационара не менее 14 суток. В качестве характеристики ПАП был выбран титр ВНА. Анализировали связь между характеристиками доноров (пол, возраст, давность с момента начала заболевания и регресса клинической симптоматики, особенности течения COVID-19) и титром ВНА.
Одной из наиболее важных характеристик ПАП является наличие ВНА к COVID-19. В связи с отсутствием при разработке программы заготовки ПАП зарегистрированных тест-систем для скрининга антител к SARS-CoV-2 в качестве критерия иммунологической состоятельности ПАП был выбран титр ВНА. Выполнение тестов осуществлялось в ФГБУ «НИЦЭМ им. Н. Ф. Гамалеи» МЗ РФ. Данный вирусологический метод основан на определении наличия или отсутствия цитопатического действия в культуре клеток в зависимости от титра ВНА анализируемой плазмы. Механизм нейтрализации основан на высокоспецифичном взаимодействии антител с поверхностным гликопротеином S вируса, который отвечает за интернализацию вируса: поверхностный гликопротеин S областью рецептор-связывающего домена взаимодействует с рецептором ангиотензин- превращающего фермента-2 (АПФ-2) на поверхности клеток, что запускает каскад реакций, приводящих к проникновению вирусных частиц в клетку. Реакцию нейтрализации ставили в варианте постоянной дозы вируса — разведения плазмы. Готовили разведения плазмы в культуральной среде ДМЕМ с 2 % инактивированной фетальной бычьей сывороткой, далее смешивали со 100 TCID50 (tissue culture infectious dose 50) вируса SARS-CoV-2, инкубировали 1 час при 37 °C, после чего добавляли к клеткам Vero E6 (посевная плотность 2 х 104 /клеток на лунку), затем клетки культивировали при температуре 37 °C и концентрации СО 5 % в течение 96 часов и производили учет развития цитопатического действия вируса на культуру клеток. За титр ВНА исследуемой плазмы принимали высшее ее разведение, при котором происходило подавление цитопатического действия в 2 лунках из 3. В соответствии с рекомендациями Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration — FDA) [10] титр ВНА 1:160 и более отнесли к высоким значениям, титр ВНА 1:80 — к промежуточным значениям. При определении в плазме ВНА в меньших титрах (1:40 и 1:20) их относили к низким значениям. Отсутствие ВНА в плазме соответствовало значениям от 1:20 и менее. ПАП с низкими титрами ВНА или без них для клинического использования не выдавалась.
Взятие крови на исследование титра ВНА осуществляли непосредственно перед проведением донорского плазмафереза. В рамках настоящего анализа оценивали зависимость ВНА от возраста, пола, особенностей течения заболевания (наличие или отсутствие проявлений легочного поражения, выраженность температурной реакции, результаты ПЦР диагностики SARS-CoV-2), времени от появления и регресса клинической симптоматики. Источником получения информации служила медицинская документация (выписной эпикриз) и результаты анкетирования доноров.
Статистическая обработка выполнена в среде Python. Данные описательной статистики представлены в виде среднее ± стандартное отклонение или медиана (межквартильный интервал). Проводился однофакторный и многофакторный дисперсионный анализ, ранговая регрессия и корреляция по методу Спирмена. Были использованы критерии Манна — Уитни и хи-квадрат.
Результаты
Высокий титр ВНА (1:160 и более) выявлен у 21,1 % доноров, промежуточный (1:80) — у 24,75 %.
Распределение доноров плазмы в зависимости от титра ВНА представлено на рисунке 1. У 78 доноров ВНА в плазме не выявлены, в 189 случаях титр ВНА был низкий (1:20—1:40), у 104 — промежуточный (1:80), у остальных 122 доноров титр ВНА высокий (1:160 и выше). Среди переболевших только у 24,7 % доноров в плазме определялись высокие титры ВНА, то есть только четверть потенциальных доноров ПАП может рассматриваться как эффективные доноры.
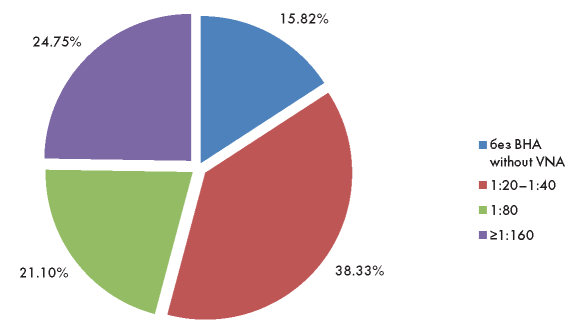
Рисунок 1. Распределение доноров в зависимости от титра ВНА в плазме крови
Figure 1. Distribution of donors depending on the VNA titer in blood plasma
Проведен анализ влияния демографических данных и клинического течения COVID-19 на титр ВНА. Полученные при анализе медицинской документации и дополнительного анкетирования данные представлены в таблице 1.
Таблица 1. Характеристика доноров
Table 1. Characteristics of donors
Показатель Parameter | Значение Value |
|---|---|
Интервал от начала заболевания до проведения плазмафереза, дней: |
|
нет данных | 18 |
35 (от 31 до 92) | 475 |
Interval from the disease onset to plasmapheresis, days: |
|
no data | 18 |
35 (from 31 to 92) | 475 |
Максимальная температура тела во время болезни: |
|
нет данных | 99 |
< 36,9 °C | 19 |
37,0-37,9 °C | 216 |
38,0-38,9 °C | 137 |
>39,0 °C | 22 |
Maximum body temperature during the course of the disease: |
|
no data | 99 |
< 36.9 ° C | 19 |
37.0-37.9 ° C | 216 |
38.0-38.9 ° C | 137 |
>39.0 ° C | 22 |
Пневмония: |
|
нет данных | 46 |
пневмонии не было | 300 |
пневмония была | 147 |
Pneumonia: |
|
no data | 46 |
absence | 300 |
presence | 147 |
РНК SARS-CoV-2 в дебюте заболевания: |
|
нет данных | 15 |
обнаружено | 475 |
не обнаружено | 3 |
SARS-CoV-2 RNA at the disease onset: |
|
no data | 15 |
found | 475 |
not found | 3 |
Назвать точную дату начала и окончания заболевания смогли 476 доноров, 18 — затруднились ответить на данный вопрос в анкете. Наличие температуры во время болезни смогли уточнить 394 донора, в 99 анкетах данные графы не были заполнены. Данные о наличии либо отсутствии пневмонии предоставили только 447 доноров, у 46 реконвалесцентов, перенесших COVID-19 в амбулаторных условиях, рентгенологическое исследование не проводилось.
Плазмаферез проводился в среднем через 14 дней с момента исчезновения симптоматики, что соответствовало завершению обсервационного периода. Период от начала заболевания до заготовки плазмы составил 35 дней (от 31 до 92 дней). Это связано с тем, что многие доноры с высоким титром ВНА приглашались повторно для проведения плазмафереза. У 15 доноров найти уточненные данные о дате первичного исследования на РНК вируса SARS-CoV-2 не удалось, у 475 доноров имелись данные о положительных мазках на РНК вируса SARS-CoV-2, у 3 — отрицательные. В связи с тем что в 475 (99 %) наблюдениях данной выборки имелся положительный результат теста на РНК вируса SARS- CoV-2, исследование корреляционной зависимости между титром ВНА и отсутствием-наличием у донора данного параметра не проводилось.
Период от начала заболевания и время, прошедшее с момента выздоровления, были одними из основных критериев отбора потенциального донора-реконва- лесцента для проведения плазмафереза. При однофакторном анализе взаимосвязи интервала от начала и окончания заболевания с величиной титра ВНА были обнаружены: отсутствие зависимости от периода после выздоровления до плазмафереза (коэффициент корреляции r = 0,058675, p = 0,2) и слабая, но достоверная зависимость титра ВНА в пробе крови донора перед донацией от продолжительности периода, который прошел с момента появления первых симптомов до плазмафереза (r = 0,13, p = 0,0042, 95 % доверительный интервал (ДИ) 0,041597—0,218293).
Для анализа зависимости содержания ВНА у донора от периода, прошедшего с дебюта новой коронавирусной инфекции до донации плазмы, все реконвалесценты были разделены на 5 групп в соответствии с количеством дней, прошедших от дебюта заболевания до плазмафереза: 1-я группа — до 20 дней, 2-я группа — 21—30 дней, 3-я группа — 31—40 дней, 4-я группа — 41—50 дней и 5-я группа — 51 и более дней. Выявлена меньшая вероятность заготовки плазмы с высоким титром ВНА, если плазмаферез проводился в интервале 21—40 дней с дебюта заболевания (табл. 2). Наибольшая доля плазмодач с высоким титром ВНА регистрировалась у доноров, которые были рекрутированы по истечении 41 дня с начала заболевания. В группе 1 было недостаточно наблюдений для проведения статистического анализа.
Таблица 2. Зависимость титра ВНА от периода с начала заболевания до плазмафереза
Table 2. Dependence of the VNA titer on the period from the disease onset to plasmapheresis
Группа Group | Дней от начала заболевания Days from the disease onset | Количество донаций Number of donations | Количество донаций с титром ≥1:160 Number of donations with the titer ≥1:160 |
|---|---|---|---|
1* | До 20 | 3 | 1 (33,3 %) |
2 | От 21 до 30 | 97 | 20 (20,6 %) |
3 | От 31 до 40 | 275 | 62 (22,5 %) |
4 | От 41 до 50 | 73 | 25 (34,2 %) |
5 | Более 51 | 27 | 13 (48,1 %) |
Примечание. * — в группе 1 недостаточно данных для оценки статистической значимости; между группами 2 и 4 p = 0,0235; между группами 2 и 5 p = 0,0022; между группами 3 и 4 p = 0,0194; между группами 3 и 5 p = 0,00161.
Note. * — no sufficient data in group 1 to assess the statistical significance; statistical significance between groups 2 and 4 p = 0.0235; statistical significance between groups 2 and 5 p = 0.0022; statistical significance between groups 3 and 4 p = 0.0194; statistical significance between groups 3 and 5 p = 0.00161.
При однофакторном анализе зависимости заготовки плазмы с высоким титром ВНА от возраста была выявлена слабая, но достоверная корреляция: коэффициент корреляции r = 0,13, p = 0,0032, 95 % ДИ 0,044—0,217 (табл. 3). Выявлено, что в средней возрастной группе (36—55 лет) вероятность заготовки плазмы с высоким ВНА выше, чем у более молодых доноров.
Таблица 3. Зависимость титра ВНА от возраста донора
Table 3. Dependence of the VNA titer on the donor's age
Группа Age group | n | С высоким титром With a high VNA titre | С низким титром With a lowVNA titre | Доля, % Share, % |
|---|---|---|---|---|
≤20 лет | 15 | 3 | 12 | 20,0 |
21-35 лет | 212 | 35 | 177 | 16,5 |
36-55 лет | 266 | 83 | 183 | 31,2 |
Результаты, полученные при изучении зависимости титра ВНА заготовленной плазмы от пола, наличия в анамнезе вирусной пневмонии и выраженности температурной реакции, представлены в таблице 4.
Таблица 4. Зависимость титров ВНА от пола и анамнестических данных донора
Table 4. Dependence of the VNA titer on the donor's gender and medical history
Параметр Parameter | n | Чувствительность Sensitivity | Специфичность Specificity | p (Манн — Уитни) p (Mann — Whitney) | p (хи квадрат) p (chi square) |
|---|---|---|---|---|---|
Пол (мужской) Gender (male) | 271 | 0,7213 | 0,5053 | <0,00001 | 0,00002 |
Пневмония Pneumonia | 447 | 0,5 | 0,7325 | <0,00001 | <0,00001 |
Температура >39,0 °C Body temperature >39.0 °C | 22 | 0,11 | 0,96 | 0,00118 | 0,00514 |
Температура 38,0-38,9 °C Temperature 38.0-38.9 °C | 159 | 0,54 | 0,64 | 0,00034 | 0,00103 |
Вероятность заготовки ПАП с высоким титром ВНА (1:160 и выше) от доноров-мужчин оказалась значительно выше, чем от доноров-женщин. При выявлении в анамнезе у донора верифицированной вирусной пневмонии вероятность заготовки плазмы с высоким титром повышалась в отличие от доноров без доказанной пневмонии в анамнезе. Однако данный критерий не имел достаточной прогностической ценности ввиду невысокой чувствительности. Наличие высокой температурной реакции во время болезни также оказалось специфичным, но недостаточно чувствительным критерием отбора доноров. При многофакторном анализе зависимости заготовки плазмы с высоким титром ВНА от отдельных донорских параметров (табл. 5) наибольшая связь выявлена с мужским полом донора, с возрастом донора и наличием верифицированной вирусной пневмонии, а также с наличием-отсутствием лихорадки. Интервал от начала заболевания до донации оказался менее значимым, чем в однофакторном анализе.
Таблица 5. Зависимость высокого титра ВНА от характеристик доноров
Table 5. Dependence of high BHA titers on donors' characteristics
Параметр Parameter | Коэффициент Coefficient | Стандартная ошибка Standard error | p |
|---|---|---|---|
Пол донора (мужской) Gender (male) | -0,91 | 0,27 | 0,0009 |
Верифицированная пневмония Verified pneumonia | 0,73 | 0,26 | 0,0055 |
Наличие-отсутствие лихорадки Presence/absence of fever | 0,47 | 0,19 | 0,0146 |
Возраст донора Age | 0,04 | 0,013 | 0,0007 |
Интервал от начала заболевания Interval from the disease onset | 0,025 | 0,015 | 0,093 |
Обсуждение
Как показало данное исследование, не у всех лиц, перенесших COVID-19, может быть выполнена эффективная донация ПАП. Чуть меньше половины заготовленной плазмы содержит промежуточные или высокие титры ВНА и, соответственно, может быть использовано для клинического применения в соответствии с рекомендациями FDA [10]. Таким образом, заготовка ПАП от всех реконвалесцентов COVID-19, высказавших желание быть донором иммунной плазмы, экономически нерентабельна из-за большого объема брака по показателю иммунной эффективности. Предварительное тестирование на ВНА с ожиданием результатов в течение нескольких дней тоже чревато ресурсными потерями. В этой связи необходимы простые и доступные критерии, позволяющие максимально отобрать потенциально эффективных доноров на ранних этапах.
Данные литературы по обсуждаемой проблеме ограничены. S. L. Klein и соавт. [11] сообщили о результатах донаций у 126 реконвалесцентов COVID-19. В исследованной группе было больше мужчин (56 %), чем женщин, средний возраст реконвалесцентов составил 42 года, плазму собирали в среднем через 43 дня (межквартильный интервал 38—48 дней) после первоначального теста ПЦР на SARS-CoV-2. Авторы не уточнили критерии отбора доноров, но привели информацию о том, что большинство из них перенесли заболевание в среднетяжелой форме, госпитализированных было менее 10 %. У всех реконвалесцентов исследование титра ВНА было произведено с использованием клеток Vero-E6-TMPRSS2. Была обнаружена зависимость содержания ВНА от демографических параметров. Таким образом, авторы выделили два наиболее значимых параметра — это мужской пол и старшая возрастная группа [11].
Результаты, полученные в настоящем исследовании, выявили схожие закономерности. Среди доноров, у которых была выполнена эффективная донация ПАП, больше мужчин — 55 %, интервал от начала заболевания до донации был несколько короче — 35 дней (31—92 дня). Также показано, что вероятность заготовки плазмы с высоким титром ВНА значимо больше у доноров мужчин в возрасте 36—55 лет по сравнению с более молодыми донорами. В отличие от исследования S. Klein и соавт. [11], настоящее исследование было проведено на группе из 493 доноров; кроме того, выявлен еще один независимый параметр, ассоциированный с высоким титром ВНА, — это наличие вирусной пневмонии в период заболевания.
Таким образом, наиболее значимыми критериями отбора доноров-реконвалесцентов для заготовки ПАП COVID-19 являются: мужской пол донора-реконвалес- цента и наличие верифицированной вирусной пневмонии, температурная реакция выше 39 °C во время заболевания.
Об авторах
И. Б. СимароваРоссия
Симарова Ирина Борисовна, врач — анестезиолог-реаниматолог ГБУЗ города Москвы; врач-трансфузиолог
А. И. Костин
Россия
Костин Александр Игоревич, кандидат медицинских наук, заведующий отделением производственной, клинической трансфузиологии и гравитационной хирургии крови
Ю. В. Смирнова
Россия
Смирнова Юлия Владимировна, трансфузиолог отделения производственной, клинической трансфузиологии и гравитационной хирургии крови
Е. А. Ладыгина
Россия
Ладыгина Елена Александровна, гематолог-трансфузиолог отделения производственной, клинической трансфузиологии и гравитационной хирургии крови
Д. Ю. Логунов
Россия
Логунов Денис Юрьевич, доктор биологических наук, член-корр. РАН, заместитель директора
И. В. Должикова
Россия
Должикова Инна Вадимовна, кандидат биологических наук, заведующая лабораторией
В. В. Ганчин
Россия
Ганчин Владимир Владимирович, заместитель генерального директора, директор Департамента развития первичного медицинского звена АНО
Е. А. Васин
Россия
Васин Евгений Анатольевич, аналитик
А. И. Байков
Россия
Байков Александр Игоревич, менеджер проектов
А. Ю. Буланов
Россия
Буланов Андрей Юльевич, доктор медицинских наук, заведующий отделением выездной реанимационной гематологической бригады
Н. В. Боровкова
Россия
Боровкова Наталья Валерьевна, доктор медицинских наук, заведующая отделением биотехнологий и трансфузиологии
С. С. Петриков
Россия
Петриков Сергей Сергеевич, член-корр. РАН, директор ГБУЗ города Москвы
Рецензия
Для цитирования:
Симарова И.Б., Костин А.И., Смирнова Ю.В., Ладыгина Е.А., Логунов Д.Ю., Должикова И.В., Ганчин В.В., Васин Е.А., Байков А.И., Буланов А.Ю., Боровкова Н.В., Петриков С.С. Формирование когорты доноров антиковидной плазмы с высоким титром антител, нейтрализующих вирус SARS-CoV-2. Гематология и трансфузиология. 2020;65(3):242-250. https://doi.org/10.35754/0234-5730-2020-65-3-242-250
For citation:
Simarova I.B., Kostin A.I., Smirnova J.V., Ladygina E.A., Logunov D.Yu., Dolzhikova I.V., Ganchin V.V., Vasin E.A., Baykov A.I., Bulanov A.Yu., Borovkova N.V., Petrikov S.S. Formation of a cohort of anticovid plasma donors with high-titer antibodies neutralizing SARS-CoV-2. Russian journal of hematology and transfusiology. 2020;65(3):242-250. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-242-250











































