Перейти к:
Продукция биопленок среди возбудителей инвазивного кандидоза у больных опухолевыми заболеваниями системы крови и у больных без опухолевых заболеваний системы крови
https://doi.org/10.35754/0234-5730-2020-65-3-281-290
Аннотация
Введение. Негативное влияние на результаты лечения инвазивного кандидоза может оказывать способность Candida spp. формировать биопленки на инвазивных медицинских устройствах у разных категорий больных.
Цель: оценить способность образовывать биопленки разных видов Candida, выделенных из клинически значимых образцов от больных опухолями системы крови и больных без опухолей системы крови.
Материалы и методы. Определение способности Candida spp. продуцировать биопленки проводили спектрофотометрическим методом с использованием соли тетразолия (XTT, Sigma-Aldrich, США). Изоляты Candida spp., имеющие значение оптической плотности от 0,1 и более, оценивали как образующие биопленки, менее 0,1 — как не способные к формированию биопленок.
Результаты. Было исследовано 428 Candida spp. (C. albicans n = 192, C. parapsilosis complex n = 121, C. krusei n = 40, C. tropicalis n = 38 и C. glabrata n = 37), из них 172 изолята были выделены от больных опухолями системы крови, 256 — от больных без опухолей системы крови, 361 — из гемокультуры, 67 — из других стерильных образцов. Способность формировать биопленки была определена у 41,8 % (n = 179) Candida spp., с одинаковой частотой у больных опухолями системы крови и больных без опухолей системы крови (41,9 и 41,8 % соответственно). Candida non-albicans чаще продуцировали биопленки в сравнении с C. albicans (52,5 % против 28,6 %, соответственно, р < 0,001). Значимо чаще продукция биопленок была у C. tropicalis (89, 5 %) и у C. krusei (75 %) в сравнении с C. parapsilosis (41,3 %), C. albicans (28,6 %) и C. glabrata (27 %, p < 0,05). Частота образования биопленок была высокой для C. krusei и C. tropicalis в обеих группах больных, в то время как C. albicans, выделенные от больных без опухолей системы крови, достоверно чаще продуцировали биопленки, чем в группе сравнения (34,1 % против 18 % соответственно, p = 0,03). Продукция биопленок была сопоставимой среди Candida spp., выделенных из гемокультуры (42,9 %) и из других стерильных образцов (35,8 %, р = 0,3).
Заключение. Способность к формированию биопленок различалась у разных видов Candida и преобладала у C. tropicalis и C. krusei. Продукция биопленок была выявлена с одинаковой частотой у больных опухолями и без опухолей системы крови.
Ключевые слова
Для цитирования:
Мальчикова А.O., Клясова Г.А. Продукция биопленок среди возбудителей инвазивного кандидоза у больных опухолевыми заболеваниями системы крови и у больных без опухолевых заболеваний системы крови. Гематология и трансфузиология. 2020;65(3):281-290. https://doi.org/10.35754/0234-5730-2020-65-3-281-290
For citation:
Malchikova A.O., Klyasova G.A. Biofi lm production among Candida spp. causing invasive candidiasis in patients with hematological malignancies and without hematological malignancies. Russian journal of hematology and transfusiology. 2020;65(3):281-290. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-281-290
Введение
Инвазивный кандидоз у больных опухолями системы крови характеризуется тяжелым течением, длительным пребыванием в стационаре, высокой летальностью, достигающей 40—50 %, и немалыми финансовыми затратами на лечение [1][2]. В этиологической структуре сепсиса на долю Candida spp. приходится 2,8-7,4 % [3][4][5]. Негативное влияние на процесс лечения инвазивного кандидоза может оказывать способность Candida spp. к формированию биопленок на сосудистых катетерах и других инвазивных медицинских устройствах, причем в последние годы частота детекции их в составе биопленок увеличилась. В исследовании Ж. Tumbarello и соавт. [6], включавшем 294 больных кандидемией в многопрофильном стационаре, было выявлено увеличение доли Candida spp. в составе биопленок с 36 до 67 % в период с 2000 по 2004 гг. В последующих работах этой группы исследователей (2005—2007 гг.) было доказано, что летальность при инфекциях, вызванных Candida spp. в составе биопленок, была статистически значимо выше в сравнении с возбудителями, не способными формировать биопленку, и составила 51,2 % против 31,7 % (р = 0,004) [2]. Не все противогрибковые препараты проявляют активность в отношении биопленок Candida spp. В исследовании C. Tascini и соавт. [7] была отмечена крайне высокая частота летальных исходов, которая достигала 77%, при кандидемии, вызванной продуцентами биопленок, если для лечения были использованы противогрибковые препараты группы азолов.
Количество публикаций, в которых были освещены результаты изучения способности формирования биопленок среди возбудителей инвазивного кандидоза, невелико, и в них, как правило, представлены неоднородные данные по продукции биопленок среди разных видов Candida. Эти исследования важны для выбора тактики ведения больных с инвазивным кандидозом. До недавнего времени полагали, что инвазивный кандидоз, а следовательно, и факт продукции биопленок среди Candida spp., наблюдается в основном у больных опухолями системы крови.
Целью исследования было оценить способность к образованию биопленок среди разных видов Candida, выделенных из клинически значимых образцов от больных опухолями системы крови и без опухолей системы крови с симптомами инвазивного кандидоза.
Материалы и методы
Источники и видовая идентификация изолятов. В проспективное многоцентровое исследование с 2005 по 2017 г. было включено 428 последовательно выделенных неповторяющихся изолятов Candida spp. из стерильных в норме образцов от больных опухолями системы крови (n = 172) и больных без опухолей системы крови (n = 256) с инвазивным кандидозом из 11 медицинских учреждений 10 городов России. Выделение и первичная идентификация грибов проводились в локальных микробиологических лабораториях учреждений, участвовавших в исследовании. Изоляты Candida spp. с заполненными индивидуальными регистрационными картами передавали в транспортных средах в лабораторию клинической бактериологии, микологии и антибиотической терапии ФГБУ «НМИЦ гематологии» Минздрава России. Окончательная видовая идентификация всех Candida spp. была проведена методом матрично-активированной лазерной десорбционной ионизационной времяпролетной массспектрометрии (MALDI-TOF MS) с использованием системы Microflex LT и программного обеспечения MALDI Biotyper Real Time Classification, версия 3.1 (Bruker Daltonics, Германия). В качестве критерия надежной видовой идентификации микроорганизмов использовали рекомендуемые значения коэффициента соответствия (Score) от 2,0 и выше. До проведения исследования изоляты хранили в холодильнике при температуре —70 °С в триптиказо-соевом бульоне с добавлением 20 % глицерина.
Определение способности к формированию биопленок. Определение способности Candida spp. продуцировать биопленки проводили спектрофотометрическим методом с использованием соли тетразолия — 2,3-бис- (2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино) карбонил]-2 Н-тетразолия (XTT, Sigma-Aldrich, США) согласно схеме, предложенной Pierce С. G. и модифицированной Tumbarello M. [2][8]. Вначале для проведения исследования готовили рабочие растворы. Соль тетразолия в количестве 0,25 г растворяли в 250 мл 0,01-М фосфатного буфера (Sigma-Aldrich, США), пропускали через фильтр с диаметром пор 0,22 мкм (Corning, США), разливали в стерильные сухие пробирки по 10 мл. Порошок менадиона (Sigma-Aldrich, США) растворяли в ацетоне (ЭКОС-1, Россия) до концентрации 1 мкМ и распределяли в стерильные сухие пробирки по 50 мкл. Приготовленные растворы в пробирках хранили при —70 °С в холодильнике.
При каждой детекции продукции биопленок использовали референтные штаммы C. parapsilosis ATCC 22019 в качестве положительного контроля, в качестве отрицательного контроля — штамм C. albicans без продукции биопленок, имеющийся в лаборатории клинической бактериологии, микологии и антибиотической терапии ФГБУ «НМИЦ гематологии» Минздрава России.
Для исследования культуру Candida spp. наносили на твердую питательную среду Yeast Peptone Dextrose Agar (YPD Agar, Sigma-Aldrich, США) и инкубировали в термостате при 37 °C в течение 18—24 ч. Параллельно готовили бульон YPD (Sigma- Aldrich, США). Для этого 12,5 г среды YPD растворяли в 250 мл дистиллированной воды, автоклавировали 15 мин при 121 °С и после охлаждения до комнатной температуры разливали по 20 мл в колбы Эрленмейера объемом 150 мл (Duran, Германия). Затем суточную культуру Candida spp. вносили микробиологической петлей в колбы Эрленмейера, помещали их в шейкер- инкубатор (BioSan, Латвия) и инкубировали при 30 °С и 160 об./мин в течение 12—16 ч. После инкубации всю взвесь Candida spp. (20 мл) переносили в стерильные сухие пробирки, центрифугировали при 3000 g в течение 5 мин, трижды отмывали холодным стерильным 0,1-М фосфатным буфером, удаляли надосадочную жидкость, добавляли к осадку дрожжевых грибов бульон Сабуро (Oxoid, Англия), содержащий 8 % глюкозы (Merck, Германия), и доводили дрожжевые клетки до количества 3×10 7 КОЕ/мл, постоянно осуществляя подсчет в камере Горяева. Далее по 100 мкл взвеси дрожжевых клеток последовательно переносили в ячейки от 1-го до 9-го рядов стерильного 96-луночного плоскодонного планшета в двух повторностях. Положительный и отрицательный контроли в объеме 100 мкл в двух повторностях добавляли в ячейки 10-го и 11-го рядов соответственно 96-луночного планшета. В ячейки 12-го ряда 96-луночного планшета суспензию не вносили и использовали как контроль фона. После инкубации 96-луночного планшета при 37 °С в течение 24 ч аккуратно пипеткой удаляли надосадочную жидкость из ячеек и трижды отмывали стерильным 0,15-М фосфатным буфером. Затем к 10 мл рабочего раствора соли тетразолия добавляли 1 мкл рабочего раствора менадиона, переносили полученную смесь по 100 мкл во все ячейки 96-луночного планшета, включая контрольные, и инкубировали при 37 °С в течении 5 ч в темноте.
Учет результатов выполняли спектрофотометрически с помощью микропланшетного ридера IMark (Bio-Rad, США) при длине волны 490 нм. Изоляты Candida spp., имевшие оптическую плотность (ОП) от 0,1 и более, оценивали как формирующие биопленки; менее 0,1 — не способные к формированию биопленок.
Статистический анализ. Для анализа результатов исследования была создана база данных. Статистическую обработку результатов проводили в программе IBM SPSS Statistics, версия 21. Различия между характеристиками оценивали с помощью точного критерия Фишера и считали статистически значимыми при степени вероятности безошибочного прогноза 95 % (р < 0,05).
Результаты
Способность к формированию биопленок была исследована у 428 Candida spp., включая C. albicans (n = 192), C. parapsilosis complex (n = 121), C. krusei (n = 40), C. tropicalis (n = 38) и C. glabrata (n = 37). Изоляты были выделены от больных опухолями системы крови (n = 172) и больных без опухолей системы крови (n = 256). Большинство больных без опухолей системы крови и инвазивным кандидозом (85 %) находились на лечении в отделениях реанимации и интенсивной терапии. Из гемокультуры было получено 86,3 % (n = 361) Candida spp., из других клинически значимых образцов — 15,7 % (n = 67), среди которых преобладали асцитическая жидкость (n = 36; 8,4 %), далее следовали биоптаты органов и тканей (n = 14; 3,3 %), спинномозговая жидкость (n = 9; 2,1 %), желчь (n = 5; 1,2 %) и суставная жидкость (n = 3; 0,7 %).
Значения ОП варьировали среди изолятов (рис. 1). Наиболее высокие значения медианы ОП были обнаружены у С. krusei (0,771), далее следовали C. tropicalis (0,206), C. parapsilosis complex (0,075), C. albicans (0,065) и C. glabrata (0,057). Значения ОП от 0,5 и более чаще определялись у С. krusei (40 %) в сравнении с C. glabrata (5,4 %), C. tropicalis (5 %), C. parapsilosis complex (1,7 %) и полностью отсутствовали у C. albicans (р < 0,05). Основная доля изолятов имела значения ОП в диапазоне от 0,1 до 0,499, и этот показатель чаще выявляли у C. tropicalis (84,2 %) в сравнении с C. parapsilosis complex (39,7 %), С. krusei (35 %), C. albicans (23,4 %) и C. glabrata (l8,9 %, р < 0,05).

Рисунок 1. Распределение значений оптической плотности среди изолятов Candida spp. Черными линиями показаны медианы значений оптической плотности
Figure 1. Distribution of optical density values among Candida spp. The black lines show the means values of optical density
Продукция биопленок была выявлена у 179 (41,8 %) из 428 Candida spp. с одинаковой частотой среди изо- лятов, выделенных от больных опухолями системы крови (41,9 %, 72 из 172) и больных без опухолей системы крови (41,8 %, 107 из 256). Способность к формированию биопленок была несколько выше среди Candida spp., выделенных из гемокультуры (42,9 %, 155 из 361), в сравнении с изолятами из других клинически значимых образцов (35,8 %, 24 из 67), но отличия были недостоверными (р > 0,05).
На рисунке 2 представлена частота образования биопленок среди C. albicans и Candida non-albicans, выделенных от больных исследуемых групп и из разных клинически значимых образцов. При анализе Candida spp., полученных от всех больных, чаще биопленки продуцировали Candida non-albicans в сравнении с C. albicans (52,5 % против 28,6 % соответственно, р < 0,001) в основном за счет Candida non-albicans, выделенных из гемокультуры (52,8 % против 28,3 % соответственно, р < 0,001), рисунок 2 А. Более выраженные отличия в способности образования биопленок среди Candida non-albicans и C. albicans были выявлены при выделении их от больных опухолями системы крови и составили 56,6 % против 18,2 %, а при исследовании изолятов из гемокультуры — 55,3 % против 17,2 %, р < 0,001 соответственно (рисунок 2 Б). Среди изолятов, выделенных из других клинически значимых образцов, отличий не было получено, вероятно, по причине небольшого числа исследуемых Candida spp. В группе больных без опухолей системы крови различия в частоте образования биопленок между Candida non-albicans и C. albicans были определены лишь среди изолятов, полученных из гемокультуры, и эти отличия были не столь выражены как в группе сравнения (50,4 % против 35,6 % соответственно, р = 0,04), рисунок 2 В.
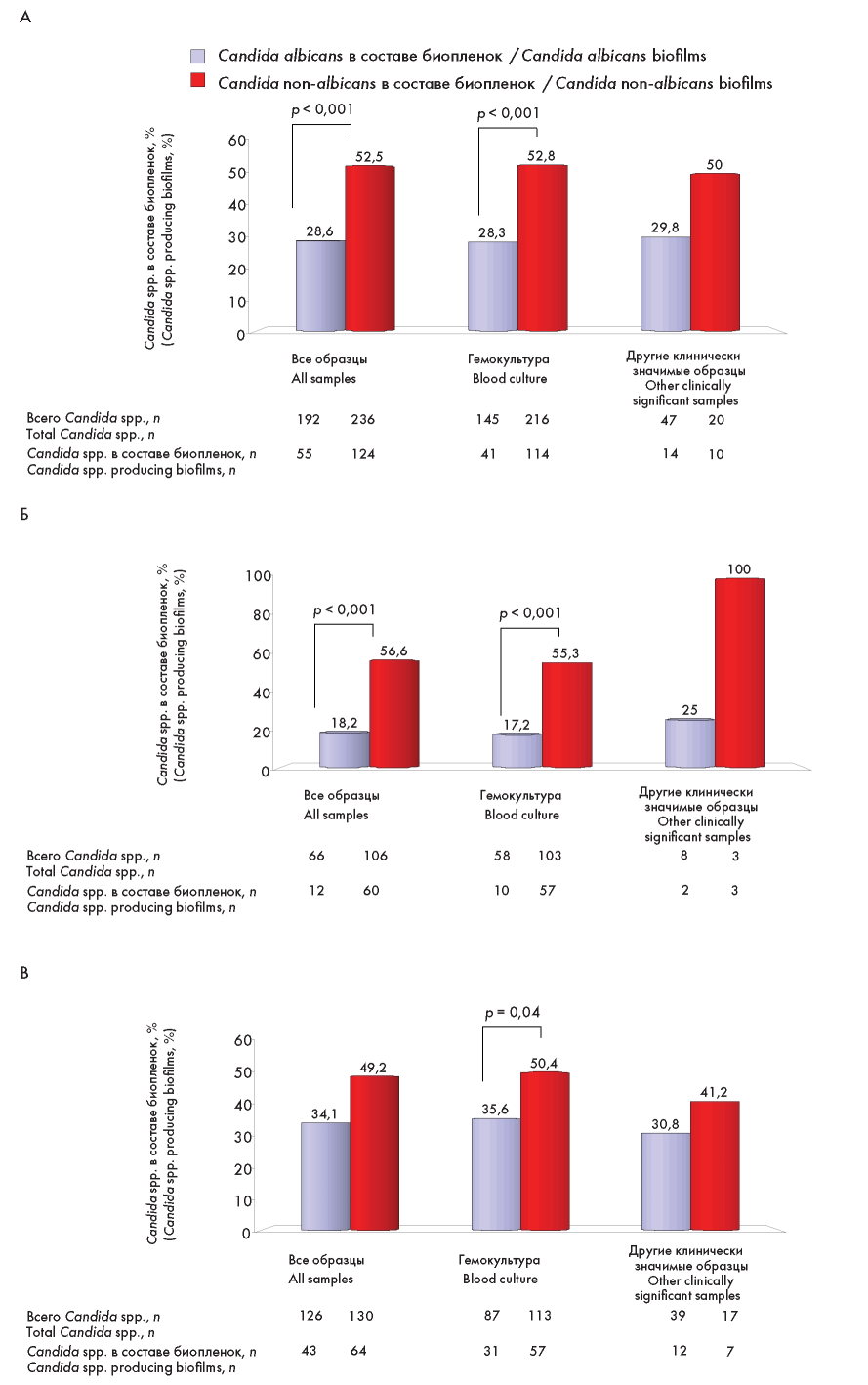
Рисунок 2. Частота образования биопленок среди C. albicans и Candida non-albicans: А — Candida spp., выделенные от всех больных; Б — Candida spp., выделенные от больных опухолями системы крови; В — Candida spp., выделенные от больных без опухолей системы крови
Figure 2. Incidence of biofilm formation among C. albicans and Candida non-albicans: А — Candida spp. isolated from all patients; Б — Candida spp. isolated from patients with hematological malignancies; В — Candida spp. isolated from patients without hematological malignancies
Во все анализируемые временные периоды образование биопленок преобладало у Candida non-albicans в сравнении с C. albicans (рис. 3). Значимое увеличение продукции биопленок с 45 до 60 % среди Candida non-albicans было отмечено в период с 2005 по 2017 г. (р = 0,001). Доля C. albicans в составе биопленок за этот период также возросла, но в меньше степени: с 19 % (2005—2007 гг.) до 29 % (2016-2017 гг., р > 0,05). В 2010-2011 гг. частота образования биопленок среди Candida non-albicans и C. albicans также была высокой, как в последний период исследования (2016-2017 гг.), и составила 60 и 37 % соответственно. При анализе видового распределения Candida spp. и частоты детекции продукции биопленок в исследуемые временные промежутки не было выявлено отличий. Возможно, регистрируемый всплеск продукции биопленок в 2010-2011 гг. был обусловлен использованием у больных в эти годы инвазивных устройств, к которым Candida spp. проявляют большую тропность, или более тяжелой когортой больных с инвазивным кандидозом.
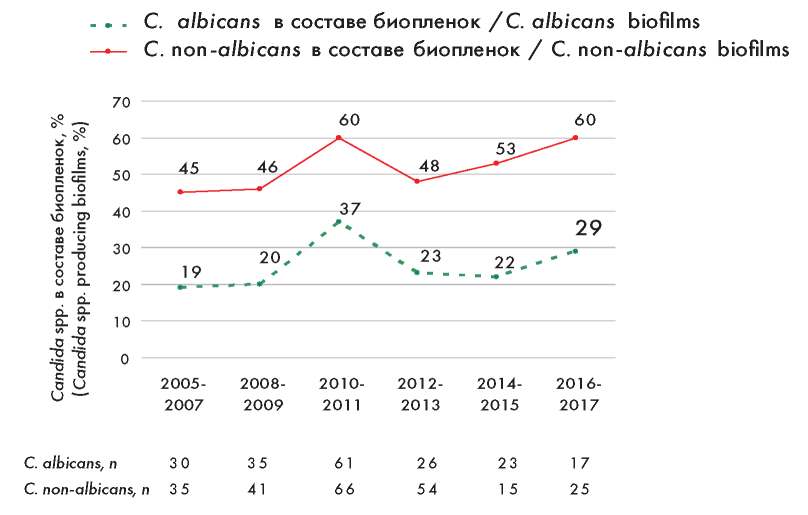
Рисунок 3. Способность к формированию биопленок среди С. albicans и Candida non-albicans в разные временные периоды
Figure 3. Biofilm-forming ability among С. albicans and Candida non-albicans at various periods
Исследуемые виды Candida имели разную способность к формированию биопленок (рис. 4). Образование биопленок определялось значимо чаще среди C. tropicalis (89,5 %, 34 из 38) и C. krusei (75 %, 30 из 40) в сравнении с C. parapsilosis complex (41,3 %, 50 из 121), C. albicans (28,6 %, 55 из 192) и C. glabrata (27 %, 10 из 37), р < 0,05. Продукция биопленок была минимальной у C. albicans (28,6 %) и C. glabrata (27 %).

Рисунок 4. Частота образования биопленок среди разных видов Candida
Figure 4. Biofilm production among different species of Candida
Продукция биопленок была сопоставимо высокой в анализируемых группах для C. tropicalis и C. krusei, ниже для C. parapsilosis complex и C. glabrata (рис. 5). Отличия в группах больных с инвазивным кандидозом по способности формирования биопленок были выявлены для C. albicans. Образование биопленок достоверно чаще было определено для C. albicans, выделенных от больных без опухолей системы крови и составило 34 % против 18,2 % в группе сравнения (р = 0,03).
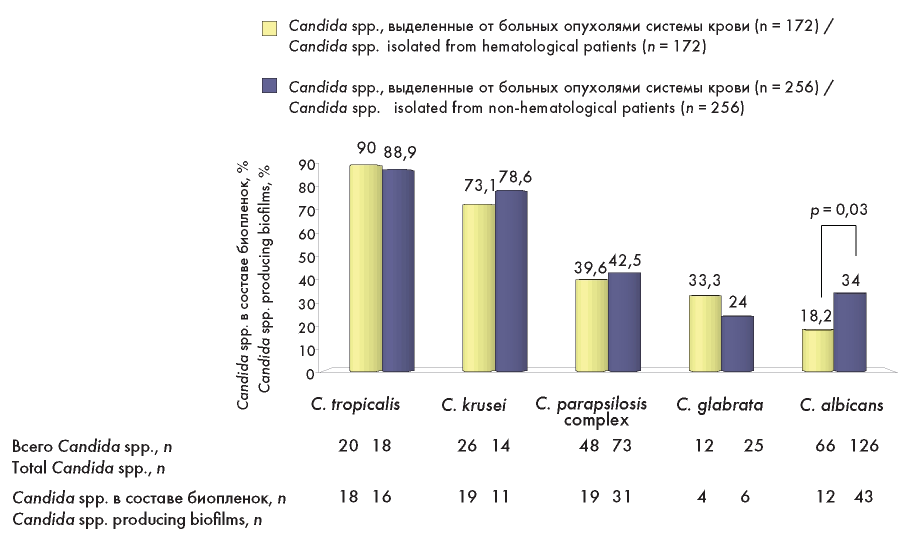
Рисунок 5. Способность к формированию биопленок среди разных видов Candida spp., выделенных от больных опухолями системы крови и от больных без опухолей системы крови
Figure 5. Biofilm-forming ability among different species of Candida, isolated from patients with hematological malignancies and patients without hematological malignancies
Обсуждение
Для возбудителей инвазивного кандидоза характерным является наличие факторов патогенности. Наиболее значимыми из них являются адгезины, благодаря которым происходит прикрепление Candida spp. к инвазивным устройствам и клеткам макроорганизма, наличие ферментов агрессии, таких как протеазы, липазы, присутствие морфологической гетерогенности, которая выражается в формировании дрожжевых клеток и псевдомицелия, а также способность к образованию биопленок на поверхностях инородных устройств и слизистых оболочек.
В настоящей работе частота детекции биопленок среди изолятов Candida spp., выделенных из клинически значимых образцов, составила 41,8 %. По результатам разных исследователей этот показатель был вариабельным. В исследовании ученых из Швеции продукция биопленок среди Candida spp., выделенных из гемокультуры, была определена у 58,8 % (231 из 393) изолятов; в исследовании из Турции — только у 20,2 % (20 из 99) [9][10].
Одинаковая частота выделения Candida spp. в составе биопленок была получена от больных опухолями системы крови и больных без опухолей системы крови и составила 41,9 и 41,8 % соответственно. Основная доля больных без опухолей системы крови (85 %) находилась в отделениях реанимации и интенсивной терапии. Сопоставимо высокая частота образования биопленок среди Candida spp. может быть связана с частым использованием инвазивных медицинских устройств в обеих группах больных. Полученные в настоящем исследовании данные подтверждены результатами других исследователей, в которых доля Candida spp. в составе биопленок, выделенных от больных опухолями системы крови, составила 46 % (n = 43), этот показатель был несколько выше от больных из отделений реанимации и достигал 58 % [11][12].
Продукция биопленок среди Candida spp., выделенных из гемокультуры, была выше и составила 42,9 % против 35,8 % среди изолятов, полученных из других клинически значимых образцов, но отличия были недостоверными (p > 0,05). Опубликованные результаты исследований по изучению способности к формированию биопленок среди Candida spp., как вызывающих инвазивный кандидоз, так и колонизирующих слизистые оболочки макроорганизма, оказались неоднородными. Продукция биопленок была изучена среди Candida spp., выделенных из гемокультуры (n = 101), мочи (n = 97), респираторного тракта (n = 89), ран (n = 41), асцитической жидкости (n = 12) и других образцов (n = 20) [13]. Было показано, что Candida spp., выделенные из гемокультуры, чаще образовывали биопленки в сравнении с изолятами из других образцов (57 % против 32 % соответственно, p < 0,0001). Другими исследователями была отмечена высокая частота формирования биопленок среди Candida spp., выделенных из гемокультуры (83,3 %) и со слизистой оболочки ротоглотки (81,8 %) [14].
Изоляты Candida non-albicans статистически значимо чаще образовывали биопленки в сравнении с C. albicans (52,5 % против 28,6 %, р < 0,001). Согласно данным других авторов, частота формирования биопленок среди Candida non-albicans, выделенных из гемокультуры, была также выше и варьировала от 54 до 77 %, в то время как этот показатель среди C. albicans составлял от 26,7 до 30,6 % (p < 0,05) [6][11][15].
Основными продуцентами биопленок были изоляты C. tropicalis (89,5 %) и C. krusei (75 %), реже — C. albicans (28,6 %) и C. glabrata (27 %). Сопоставимые результаты были получены в других работах, согласно которым частота детекции биопленок среди C. tropicalis и C. krusei также была высокой, и в некоторых исследованиях этот показатель достигал 100 % [9][16]. Вариабельные данные о способности к формированию биопленок были выявлены среди С. glabrata и C. albicans и варьировали у каждого из этих видов от 8 до 95 % [9][13].
Учитывая неоднородные данные о продукции биопленок среди разных видов Candida, можно полагать, что на этот процесс оказывают влияние не только наличие инвазивного устройства в макроорганизме, но и другие факторы, например материал, из которого они изготовлены, и длительность их использования [17]. В экспериментальных исследованиях было доказано, что образование биопленок среди C. albicans чаще было на латексе и реже — на полиуретане и силиконе [18][19]. В другой работе было показано, что C. parapsilosis, C. albicans и C. krusei обладали большей способностью к формированию биопленок на тефлоне, в то время как C. glabrata — на поливинилхлориде, а C. tropicalis — на полиуретане [20]. Авторы полагают, что на частоту образования биопленок среди Candida spp. может влиять и структура поверхности инвазивного устройства [18].
Различия в способности к формированию биопленок среди разных видов Candida могут быть обусловлены неоднородностью используемых методик ввиду присутствия отличий в используемой питательной среде для инкубации, а также в качестве применяемых планшет [17][20][21][22].
Таким образом, формирование биопленок было выявлено у 41,8 % возбудителей инвазивного кандидоза с одинаковой частотой у больных опухолями и без опухолей системы крови. Образование биопленок значимо чаще преобладало среди C. tropicalis (89,5 %) и C. krusei (75 %) в сравнении с C. parapsilosis complex (41,3 %), C. albicans (28,6 %) и C. glabrata (27 %, р < 0,05). Отличия в группах больных с инвазивным кандидозом по способности формирования биопленок были выявлены для C. albicans. Образование биопленок достоверно чаще было определено для C. albicans, выделенных от больных без опухолей системы крови, и составило 34 % против 18,2 % в группе сравнения (р = 0,03). Полученные результаты подтверждают необходимость удаления центрального венозного катетера у больных инвазивным кандидозом, особенно при повторном выделении Candida spp. из гемокультуры.
Список литературы
1. Клясова Г.А., Мальчикова А.О., Тандилова К.С. и др. Лечение кандидемий, вызванных Candida albicans и Candida non-albicans, у больных с опухолями системы крови. Терапевтический архив. 2019; 91(8): 84–92. DOI: 10.26442/ 00403660.2019.08.000385.
2. Tumbarello M., Fiori B., Trecarichi E.M. et al. Risk factors and outcomes of candidemia caused by biofi lm-forming isolates in a tertiary care hospital. PloS One. 2012; 7(3): e33705. DOI: 10.1371/journal.pone.0033705.
3. Клясова Г.А. Антимикробная терапия. В кн.: Программное лечение заболеваний системы крови: сборник алгоритмов диагностики и протоколов лечения заболеваний системы крови. Под ред. В.Г. Савченко. М.: Практика, 2012. С. 827–54.
4. Клясова Г.А., Сперанская Л.Л., Миронова А.В. и др. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования). Гематология и трансфузиология. 2007; 52(1): 11–8.
5. Puerta-Alcalde P., Cardozo C., Marco F. et al. Changing epidemiology of bloodstream infection in a 25-years hematopoietic stem cell transplant program: current challenges and pitfalls on empiric antibiotic treatment impacting outcomes. Bone Marrow Transplant. 2020; 55: 603–12. DOI:10.1038/s41409- 019-0701-3.
6. Tumbarello M., Posteraro B., Trecarichi E.M. et al. Biofi lm production by Candida species and inadequate antifungal therapy as predictors of mortality for patients with candidemia. JCM. 2007; 45(6): 1843–50. DOI: 10.1128/ JCM.00131-07.
7. Tascini C., Sozio E., Corte L. et al. The role of biofi lm forming on mortality in patients with candidemia: a study derived from real world data. Infect Dis. 2018; 50(3): 214–19. DOI: 10.1080/23744235.2017.1384956.
8. Pierce C. G., Uppuluri P., Tristan A.R. et al. A simple and reproducible 96-well plate-based method for the formation of fungal biofi lms and its application to antifungal susceptibility testing. Nat protoc. 2008; 3(9): 1494–500. DOI: 10.1038/ nport.2008.141.
9. Pannanusorn S., Fernandez V., Römling U. Prevalence of biofi lm formation in clinical isolates of Candida species causing bloodstream infection. Mycoses. 2013; 56(3): 264–72. DOI: 10.1111/myc.12014.
10. Gokce G., Cerikcioglu N., Yagci A. Acid proteinase, phospholipase, and biofi lm production of Candida species isolated from blood cultures. Mycopathologia. 2007; 164(6): 265–9. DOI:10.1007/s11046-007-9053-4.
11. Pongrácz J., Benedek K., Juhász E. et al. In vitro biofi lm production of Candida bloodstream isolates: any association with clinical characteristics? J Med Microbiol. 2016; 65(4): 272–7. DOI: 10.1099/jmm.0.000207.
12. Gangneux J.P., Cornet M., Bailly S. et al. Clinical impact of antifungal susceptibility, biofi lm formation and mannoside expression of Candida yeasts on the outcome of invasive candidiasis in ICU: an ancillary study on the prospective AmarCAND2 cohort. Front Microbiol. 2018; 9: 2907. DOI: 10.3389/ fmicb.2018.02907.
13. Shin J.H., Kee S.J., Shin M.G. et al. Biofi lm production by isolates of Candida species recovered from nonneutropenic patients: comparison of bloodstream isolates with isolates from other sources. J Clin Microbiol. 2002; 40(4): 1244–8. DOI: 10.1128/jcm.40.4.1244-1248.2002.
14. Girish Kumar C. P., Menon T. Biofi lm production by clinical isolates of Candida species. Med Mycol. 2006; 44(1): 99–101. DOI: 10.1080/13693780500338084.
15. Arora S., Dhuria N., Jindal N. et al. Speciation, biofi lm formation and antifungal susceptibility of Candida isolates. Int J Res Dev Pharm L Sci. 2017; 6: 2517–21. DOI: 10.21276/IJRDPL. 2278-0238.2017.6(2).2517-2521.
16. Sida H., Shah P., Pethani J. et al. Study of biofi lm formation as a virulence marker in Candida species isolated from various clinical specimens. Int J Med Sci Public Health. 2016; 5(5): 842–6. DOI:10.5455/ijmsph.2016.24082015139.
17. Jain N., Kohli R., Cook E. et al. Biofi lm formation by and antifungal susceptibility of Candida isolates from urine. Appl Environ Microbiol. 2007; 73(6): 1697– 703. DOI: 10.1128/AEM.02439-06.
18. Hawser S.P., Douglas L.J. Biofi lm formation by Candida species on the surface of catheter materials in vitro. Infect Immun. 1994; 62(3): 915–21. DOI: 10.1128/IAI.62.3.915-921.1994.
19. Radford D.R., Sweet S.P., Challacombe S.J., Walter J.D. Adherence of Candida albicans to denture-base materials with different surface fi nishes. J Dent. 1998; 26(7): 577–83. DOI: 10.1016/s0300-5712(97)00034-1.
20. Estivill D., Arias A., Torres-Lana A. et al. Biofi lm formation by fi ve species of Candida on three clinical materials. J Microbiol Methods. 2011; 86(2): 238–42. DOI: 10.1016/j.mimet.2011.05.019.
21. Krom B.P., Cohen J.B., Feser G.E.M., Cihlar R.L. Optimized candidal biofi lm microtiter assay. J Microbiol Methods. 2007; 68(2): 421–3. DOI: 10.1016/j.mimet.2006.08.003.
22. Frade J.P., Arthington‐Skaggs B.A. Effect of serum and surface characteristics on Candida albicans biofi lm formation. Mycoses. 2011; 54(4): 154–62. DOI: 10.1111/j.1439-0507.2010.01862.x
Об авторах
А. O. МальчиковаРоссия
Мальчикова Анна Олеговна, кандидат медицинских наук, научный сотрудник лаборатории клинической бактериологии, микологии и антибиотической терапии
Г. А. Клясова
Россия
Клясова Галина Александровна, доктор медицинских наук, профессор, заведующая лабораторией клинической бактериологии, микологии и антибиотической терапии
Рецензия
Для цитирования:
Мальчикова А.O., Клясова Г.А. Продукция биопленок среди возбудителей инвазивного кандидоза у больных опухолевыми заболеваниями системы крови и у больных без опухолевых заболеваний системы крови. Гематология и трансфузиология. 2020;65(3):281-290. https://doi.org/10.35754/0234-5730-2020-65-3-281-290
For citation:
Malchikova A.O., Klyasova G.A. Biofi lm production among Candida spp. causing invasive candidiasis in patients with hematological malignancies and without hematological malignancies. Russian journal of hematology and transfusiology. 2020;65(3):281-290. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-3-281-290











































