Перейти к:
Сравнительное исследование влияния транексамовой кислоты и экзогенного фибрин-мономера на фибринообразование в области травмы при стимуляции фибринолиза стрептокиназой
https://doi.org/10.35754/0234-5730-2021-66-4-556-566
Аннотация
Введение. Исследования по применению низких доз фибрин-мономера (ФМ) выявили наличие гемостатических свойств ФМ, реализующихся в условиях in vivo.
Цель — сопоставить морфологические последствия внутривенного введения транексамовой кислоты (ТК) и ФМ с гемостатическими и гемостазиологическими эффектами при гипофибриногенемии, обусловленной применением стрептокиназы, после дозированной травмы печени.
Материалы и методы. Эксперименты выполнены на 73 кроликах-самцах породы шиншилла, из которых были сформированы четыре группы. Изучали морфологическую картину фибринообразования в области нанесения травмы печени после спонтанной остановки кровотечения у животных. У трех групп исследование выполняли в условиях внутривенного введения плацебо, ТК или ФМ на фоне активации фибринолиза стрептокиназой. Учитывали количество тромбоцитов крови и концентрации фибриногена в плазме крови, а также результаты калиброванной тромбографии.
Результаты. Последовательное введение стрептокиназы и ТК сопровождалось уменьшением концентрации фибриногена на 29,6 % и сокращением объема кровопотери в 15,4 раза в сравнении с животными, у которых вместо ТК использовалось плацебо. Уменьшение кровопотери было связано с увеличением толщины тромботических отложений по краю раны, преимущественно состоявших из эритроцитов. Эти эффекты сочетались с ускорением образования тромбина в плазме венозной крови в тесте калиброванной тромбографии (по Peak thrombin с 65,4 нмоль/л в группе плацебо, до 109,6 нмоль/л в группе с ТК). Последовательное применение стрептокиназы и ФМ, несмотря на уменьшение содержания фибриногена на 23,3 %, также приводило к уменьшению объема кровопотери в 11,0 раз в сравнении плацебо. Уменьшение кровопотери ассоциировалось с потреблением тромбоцитов в венозной крови и с увеличением толщины тромботических отложений на раневой поверхности, где помимо эритроцитов определялось скопление масс фибрина.
Заключение. Механизмы системного гемостатического эффекта ТК и ФМ различаются, несмотря на близость достигаемых гемостатических эффектов в условиях стимуляции фибринолитической активности крови.
Ключевые слова
Для цитирования:
Момот А.П., Вдовин В.М., Орехов Д.А., Бобров И.П., Шахматов И.И., Момот Д.А., Теряев В.В., Чернусь В.Е. Сравнительное исследование влияния транексамовой кислоты и экзогенного фибрин-мономера на фибринообразование в области травмы при стимуляции фибринолиза стрептокиназой. Гематология и трансфузиология. 2021;66(4):556-566. https://doi.org/10.35754/0234-5730-2021-66-4-556-566
For citation:
Momot A.P., Vdovin V.M., Orekhov D.A., Bobrov I.P., Shakhmatov I.I., Момоt D.A., Terjaev V.V., Chernus’ V.Е. Comparative study of the effect of tranexamic acid and exogenous fibrin monomer on fibrin formation in the injury area during stimulation of fibrinolysis by streptokinase. Russian journal of hematology and transfusiology. 2021;66(4):556-566. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-4-556-566
Введение
С развитием теории клеточной модели гемокоагуляции [1] и формированием представлений об особенностях пространственной регуляции тромбиногенеза и фибриногенеза в условиях in vitro [2] возникли вопросы, касающиеся механизмов гемостатических реакций in vivo. Исходя из результатов исследований, направленных на изучение гемостатических и гемостазиологических эффектов низких доз фибрин-мономера (структурно — дезААВВ-фибриноген, ФМ) [3], можно констатировать наличие у данного производного фибриногена собственного гемостатического потенциала. Системный гемостатический эффект экзогенного ФМ в дозе 0,25 мг/кг наблюдался после нанесения дозированной травмы печени не только у животных из группы плацебо, но и при гипофибриногенемии, обусловленной применением стрептокиназы [4]. В этом случае интенсивность гемостатического эффекта у ФМ была сопоставима с таковой при введении транексамовой кислоты (ТК). ФМ в проведенных экспериментах применялся в дозе, близкой к его физиологическим значениям в плазме крови здоровых людей (менее 7,8 мкг/мл) [5]. Учитывая данное обстоятельство, можно предположить, что при равномерном разведении в кровотоке использованная доза ФМ вряд ли способна к образованию основы тромба на раневой поверхности. Однако, по данным морфологических исследований, было выявлено, что следствием системного введения ФМ является усиление фибринообразования в области раневой поверхности при формировании дозированной травмы печени [6], что пока не нашло своего объяснения. Для лучшего понимания механизмов этого феномена целесообразно оценить совокупность данных, включая анализ морфологической картины зоны повреждения. В качестве препарата сравнения может быть использована ТК [7],[8].
Цель настоящего исследования заключалась в сопоставлении морфологических, гемостатических и гемостазиологических последствий внутривенного введения ТК и ФМ при гипофибриногенемии, обусловленной применением стрептокиназы, после дозированной травмы печени.
Материалы и методы
Исследование выполнено на 73 здоровых кроликах самцах породы шиншилла массой 3,0–4,5 кг, содержавшихся в стандартных условиях вивария. Из животных методом блочной рандомизации были сформированы четыре экспериментальные группы (рис. 1).

Животным 1-й группы (n = 21) в краевую вену уха в/в при помощи иглы-катетера «Cathy» («HMD», Индия) вводили водный раствор плацебо (3,75 М раствор мочевины, соответствующий ее концентрации в растворе ФМ), в объеме 0,5 мл, затем через 1 час проводили лапаротомию и наносили стандартную травму печени в соответствии с имеющимися рекомендациями [9] в условиях общей анестезии препаратом Телазол («Зоэтис», Россия), в/в 10 мг/кг. Животным групп со 2-й по 4-ю для активации фибринолиза в начале эксперимента в/в вводили водный раствор стрептокиназы (РУП «Белмедпрепараты», Республика Беларусь) в дозе 150 000 МЕ/кг. Через 1 час животным указанных выше групп в/в вводили водные растворы следующих препаратов: во 2-й группе (n = 16) — плацебо, в 3-й группе (n = 12) — ТК (Транексам®, ФГУП «Московский эндокринный завод», Россия) в дозе 15 мг/кг, в 4-й группе (n = 24) — ФМ [10] в дозе 0,25 мг/кг. Спустя 1 ч после введения плацебо и ФМ животным 2-й и 4-й групп, а животным 3-й группы — через 30 мин выполняли стандартную травму печени в условиях общей анестезии препаратом Телазол. После нанесения травмы при помощи марлевых салфеток оценивали характер паренхиматозного кровотечения — по объему кровопотери в процентах от расчетного объема циркулирующей крови ( % ОЦК) с учетом массы тела животного, а также по темпу кровопотери в единицу времени (мг/с) [9],[11]. Для определения объема кровопотери использовали среднюю величину ОЦК, равную 7 % от массы тела животного [9]. Темп кровопотери рассчитывали путем произведения объема раневой кровопотери (в мг) на длительность кровопотери (в секундах) после полной остановки кровотечения. Эксперимент заканчивали в момент прекращения кровотечения из раны, либо после остановки сердечно-легочной деятельности у животного (летальный исход) вне зависимости от продолжающегося кровотечения. Животных выводили из эксперимента после полного прекращения кровотечения из раны, путем введения анестетика в летальной дозе (в 3–4 раза превышающей терапевтическую) [12].
Для исследования системы гемостаза кровь получали из краевой вены уха (самотеком) после флеботомии дважды — перед введением препаратов и нанесением травмы печени (рис. 1). Кровь помещали в пробирки с соответствующими стабилизаторами: для подсчета количества тромбоцитов — с калиевой солью этилендиаминтетрауксусной кислоты в объеме 0,25 мл, для изучения других параметров — в полистироловые, содержащие 0,11 М (3,8 %) раствор цитрата натрия (соотношение крови и стабилизатора — 9 : 1), в объеме 5,0 мл. Получение обедненной тромбоцитами плазмы крови проводили по общепринятой методике. Исследование гемокоагуляции предусматривало оценку количества тромбоцитов в венозной крови на гематологическом анализаторе «Drew-3» («Drew Scientifi c Inc.», Великобритания/США), концентрации фибриногена на коагулометре Thrombostat 2 («Behnk Electronik», Германия) с применением набора «ТехФибриноген-тест» («Технология-Стандарт», Россия). В качестве интегрального метода исследования системы гемостаза выполняли оценку генерации тромбина методом калиброванной тромбографии с использованием планшетного флуориметра «Fluoroskan Ascent» («ThermoFisher SCIENTIFIC», Финляндия), с программным обеспечением «Thrombinoscopeтм 3.0.0.26» и наборами реагентов фирмы «Thrombinoscope® bv» (Нидерланды) Учитывали следующие показатели теста: Lagtime — время инициации образования тромбина; ETP — эндогенный тромбиновый потенциал; Peak thrombin — пиковая концентрация тромбина; ttPeak — время достижения пиковой концентрации тромбина; V — скорость образования тромбина.
После остановки кровотечения для гистологического исследования у животных забирали ткань печени, включая всю раневую часть и фрагмент неповрежденной поверхности, с последующей фиксацией в 10%-ном растворе нейтрального формалина по Лилли. Проводку материала осуществляли по изопропиловому спирту с помощью автомата проводки карусельного типа «TISSUE-TEK VI PTM6» (фирма «Sakkura», Япония). Парафинизацию проводили при помощи станции парафиновой заливки «TISSUE-TEK TEC 5» («Sakkura», Япония). Гистологические срезы толщиной 4–5 мкм получали с использованием полуавтоматического роторного микротома «Accu-Cut SRM» («Sakkura», Япония), препараты окрашивали гематоксилином и эозином в автомате для автоматической окраски микропрепаратов «TISSUE-TEK Prisma» («Sakkura», Япония) и заключали под пленку в автомате для автоматического заключения микропрепаратов «TISSUE-TEK Film» («Sakkura», Япония). Для определения морфологической структуры фибрина в тканях, окраску подготовленных срезов проводили методом оранжевый-красный-голубой (ОКГ) по Д. Д. Зербино и Л. Л. Лукасевич [13] с применением набора реагентов для определения возраста фибрина (фирма ООО «БВС», Россия). Подсчет количества тромбоцитов при морфологических исследованиях осуществляли в крупных сосудах венозного или артериального типа, в пяти полях зрения при увеличении ×1000, под масляной иммерсией микроскопа с последующим расчетом среднего количества клеток. Микрофотографию проводили при помощи микроскопа «Leica DM 750 E200» с цифровой видеокамерой «Leica EC3» («Leica Microsystems CMS GmbH», Германия). Морфометрические измерения проводили с помощью лицензионного пакета морфометрических программ «ВидиоТест — Морфология 5.2» («ВидиоТест», Россия).
Работы на животных, одобренные локальным этическим комитетом ФГБОУ ВО АГМУ МЗ РФ (протокол № 12 от 12.11.2015), проводили в соответствии с Директивой 86/609/ЕЕС, Хельсинкской декларацией Всемирной медицинской ассоциации и «Правилами проведения работа с использованием экспериментальных животных».
Статистический анализ. Распределение признаков в выборках оценивали по критерию Шапиро — Уилка. В зависимости от распределения признаков применяли t-критерий Стьюдента, U-критерий Манна — Уитни или W-критерий Вилкоксона. Различия считали статистически значимыми при p ≤ 0,05. Обработку результатов проводили с помощью программы MedCalc Version 17.9.7 (лицензия BU556-Р12YT-BBS55-YAH5MUBE51). Данные представлены в виде медианы (Ме), 25-го и 75-го перцентилей (Ме [Q25÷Q75]).
Результаты
Для оценки морфологической картины после применения средств, обладающих системным гемостатическим действием (ТК и ФМ), были исследованы срезы раневой поверхности печени, полученные сразу после спонтанной остановки раневого кровотечения.
В группе плацебо (1-я группа) в области операционной раны определялись тонкие, гладкие, розоватого цвета, блестящие тромботические массы (рис. 2 А). При морфометрии толщина наложений составляла около 66 мкм (табл. 1).
Таблица 1. Показатели морфометрического исследования гистологических препаратов раны печени
Table 1. Parameters of the morphometric study of the histological preparations of liver wound

Примечание: п. з. — поле зрения, ТК — транексамовая кислота, ФМ — фибрин-мономер, Δ — разница показателей.
Note: VF — visual field, TXA — tranexamic acid, FM — fibrin-monomer, Δ — the difference of values.
При микроскопическом исследовании тромботические образования содержали тонкие нити фибрина волокнистой структуры (показаны стрелками на рис. 2 Б), располагающиеся, главным образом, параллельно раневой поверхности, образуя редкие анастомозы, а также неизмененные эритроциты. Наблюдаемая картина позволяет отнести тромботические образования в области раны (по критериям, предложенным Д. Д. Зербино и Л. Л. Лукасевич [13]) морфологически к смешанному виду тромба (фибрино-эритроцитарному).
При подсчете тромбоцитов в просвете крупных сосудов (показаны стрелками на рис. 2 В) их количество составило около 73 клеток в поле зрения (табл. 1).

Рисунок 2. Пример морфологической картины в области раны печени кролика 1-й группы (плацебо)
Примечание: здесь, а также на рисунках 3–5: А — тромботические отложения, окраска гематоксилином и эозином, увел. ×100, Б — нити фибрина в тромботических отложениях (показаны стрелками, F — фибрин), окраска на фибрин по ОКГ, увел. ×400, В — тромбоциты в просвете крупных сосудов в области раны (тромбоциты отмечены стрелками), окраска гематоксилином и эозином, увел. ×1000.
Figure 2. Morphological pattern of the liver wound of a rabbit of Group 1 (placebo)
Note. Here, as well as in Figures 3–5: A — thrombotic deposits, stained with hematoxylin and eosin, increased ×100, B — fibrin strands in thrombotic deposits (shown by arrows, F — fibrin), with fibrin by MSB, increased ×400, C — platelets in the lumen of large vessels in the injury area (platelets are marked with arrows), stained with hematoxylin and eosin, increased ×1000.
В группе животных со стимуляцией фибринолиза, получивших плацебо (2-я группа), в области травмы найдены менее заметные тромботические отложения (рис. 3 А), толщина которых составляла около 37 мкм (табл. 1). Основная часть этих отложений была представлена эритроцитами, границы между которыми определялись четко. При микроскопии раневой поверхности фибрин выглядел в виде тонких «нежных» волокон (отражено стрелками на рис. 3 Б), при этом толщина волокон фибрина уменьшилась в 1,4 раза (в сравнении с 1-й группой) (табл. 1). Найденные особенности тромботических отложений во 2-й группе позволили отнести их к тромбам эритроцитарного вида [13].
В синусоидных капиллярах в непосредственной близости от травмы были видны небольшие скопления тонких фибриновых волокон, а также единичные эритроциты с четкими границами между клетками. При подсчете тромбоцитов в просвете крупных сосудов (показаны стрелками на рис. 3 В) их количество составило 80 клеток в поле зрения (табл. 1).
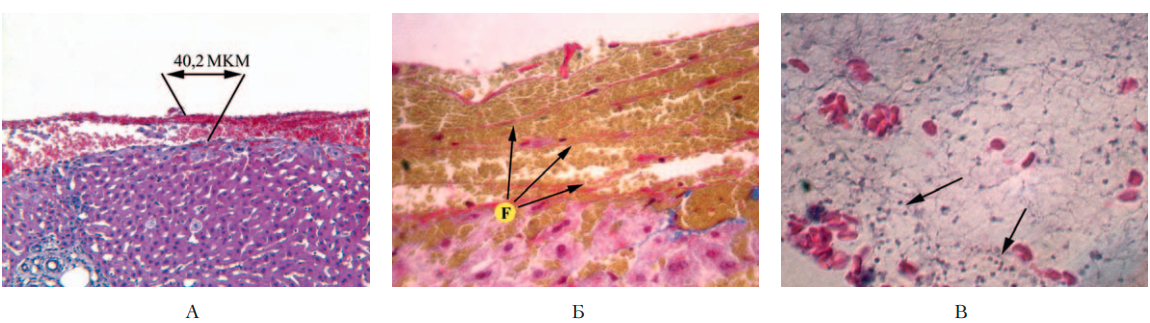
Рисунок 3. Пример морфологической картины в области раны печени кролика 2-й группы (стрептокиназа и плацебо)
Figure 3. Morphological pattern of the liver wound of a rabbit of Group 2 (streptokinase and placebo)
В группе животных, получивших ТК (3-я группа), толщина тромботических отложений была сравнительно больше (рис. 4 А), чем в 1-й и 2-й группах (в 1,5 и 2,6 раза соответственно, табл. 1) и составила 96 мкм. Тромботическая масса была представлена преимущественно неизмененными эритроцитами с четко определяемыми границами между этими клетками (рис. 4 А). Наличие волокнистого фибрина в данных отложениях, в отличие от 1-й группы, было не характерно, определялись лишь единичные «нежные» волоконца розового цвета (показаны стрелками на рис. 4 Б). Это позволило отнести связанные с травмой тромботические массы в 3-й группе также, как и во 2-й группе, к тромбам эритроцитарного вида [13]. Отмечено и увеличение толщины фибриновых нитей — в 1,3 раза в сравнении со 2-й группой (табл. 1).
В синусоидных капиллярах в непосредственной близости от зоны травмы были видны небольшие отложения тонких «нежных» фибриновых волокон (рис. 4 Б), а также эритроцитов в виде «монетных столбиков» с четкими границами между клетками. Там же, в просветах крупных сосудов, отмечалось меньшее количество тромбоцитов (показаны стрелками на рис. 4 В) в сравнении со 2-й группой, при подсчете их количество составило 58 клеток в поле зрения (табл. 1).

Рисунок 4. Пример морфологической картины в области раны печени кролика 3-й группы (стрептокиназа и транексамовая кислота)
Figure 4. Morphological pattern of the liver wound of a rabbit of Group 3 (streptokinase and TXA)
У животных, получивших ФМ (4-я группа), в области травмы определялись максимально выраженные тромботические отложения в сравнении с животными в других группах наблюдений (рис. 5 А), их толщина составила 334 мкм (табл. 1). Тромботические массы состояли преимущественно как из неизмененных, так и гемолизированных и агрегированных эритроцитов, а также фибрина. Последний определялся на большинстве участков в виде скопления масс и продольно расположенных волокон розового цвета (показаны стрелками на рис. 5 Б). Отмечено также увеличение толщины фибриновых нитей в сравнении с 1-й, 2-й и 3-й группами в 1,6, 2,2 и 1,7 раза соответственно (табл. 1). Данная морфологическая картина дала возможность отнести тромботические образования в области раны в 4-й группе к тромбам фибрино-эритроцитарного (смешанного) вида [13].
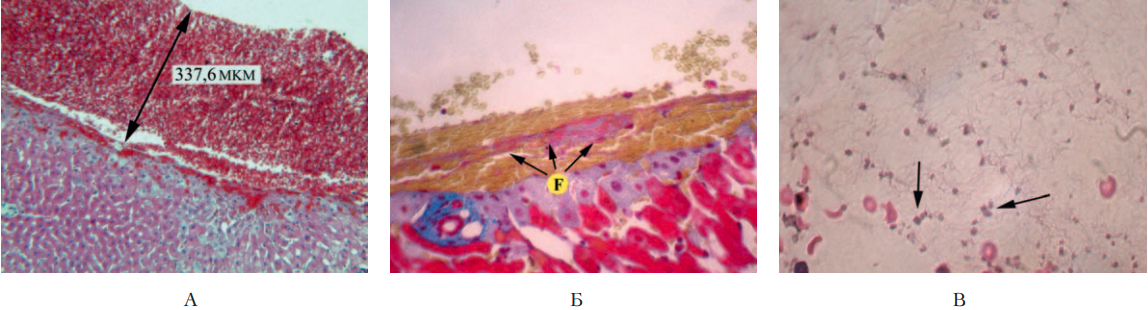
Рисунок 5. Пример морфологической картины в области раны печени кролика 4-й группы (стрептокиназа и ФМ)
Figure 5. Morphological pattern of the liver wound of a rabbit of Group 4 (streptokinase and FM)
В просвете крупных сосудов поблизости от зоны травмы были видны преимущественно неизмененные эритроциты. В расширенных синусоидных капиллярах отмечались скопления гемолизированных, агрегированных эритроцитов, определялись явления стаза и сладж-феномена эритроцитов, что может служить дополнительным свидетельством вовлечения этих клеток в реакции гемостаза [14],[15]. Количество тромбоцитов в просвете сосудов (показаны стрелками на рис. 5 В) было наименьшим по сравнению с другими группами наблюдений и составило 51 клетку в поле зрения (табл. 1).
Межгрупповые различия наблюдались не только по морфологической картине в области нанесения травмы, но и по показателям кровопотери, а также по особенностям гемостатического потенциала в венозной крови. Соответствующие результаты, полученные в группах наблюдений представлены в табл. 2 и 3.
Таблица 2. Объем посттравматической кровопотери у животных в разных экспериментальных группах
Table 2. Volume of posttraumatic blood loss in animals in different experimental groups

Примечание: ТК — транексамовая кислота, ФМ — фибрин-мономер, Δ — разница показателей.
Note: TXA — tranexamic acid, FM — fibrin monomer, — difference of values.
Таблица 3. Показатели системы гемостаза в экспериментальных группах животных
Table 3. Hemostatic system parameters in the experimental groups of animals
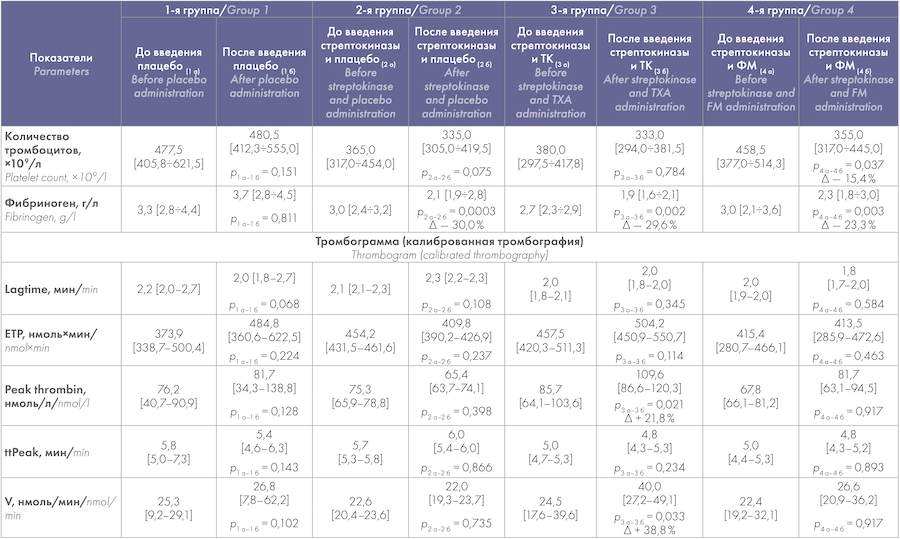
Примечание: ТК — транексамовая кислота, ФМ — фибрин-мономер, Δ — разница показателей.
Note: TXA — tranexamic acid, FM — fibrin monomer, — difference of values.
Обсуждение
Стимуляция фибринолиза стрептокиназой на фоне травмы приводила к уменьшению концентрации фибриногена (на 30,0 %) в связи с фибриногенолизом и к увеличению объема кровопотери (в 1,5 раза по сравнению с плацебо), нередко летального для выбранных животных (31,3 %) (табл. 2). Морфологическая картина в области нанесения травмы — формирование малозаметных тромботических масс, состоявших преимущественно из эритроцитов — в данном случае соответствовала значительной кровопотере.
Находилось в русле привычных представлений и то, что сочетанное применение стрептокиназыи ТК, несмотря на уменьшение концентрации фибриногена в плазме крови (на 29,6 %), сверхкомпенсированно (по объему кровопотери — с 15,4 до 1,0 % от ОЦК и по темпу кровопотери — с 20,0 до 5,3 мг/c) уменьшало посттравматическую кровопотерю. Исходя из данных морфологического исследования печени вблизи травмы последнее, по всей видимости, достигается увеличением толщины тромботических отложений по краю раны с низким содержанием фибрина и значительно большим — эритроцитов.
Новым в настоящей работе является то, что, несмотря на вызванное стрептокиназой уменьшение концентрации фибриногена на 23,3 %, использованный препарат ФМ также эффективно уменьшал как объем кровопотери — с 15,4 до 1,4 % от ОЦК, так и ее темп — с 20,0 до 5,9 мг/c. В данной группе наблюдений при микроскопии раневой поверхности определялись наиболее выраженные тромботические отложения с заметным присутствием в их составе не только эритроцитов, но и фибриновых образований.
Отмечено сопровождающее действие ТК усилению генерации тромбина в плазме крови (выявленное при анализе пика тромбина — Peak thrombin и скорости его образования — V), что не было свойственно препарату ФМ (табл. 3). Одним из последствий, связанных с использованием данного производного фибриногена, явилось значимое уменьшение количества тромбоцитов в венозной крови, а также в просветах сосудов по близости от края раны в сравнении с морфологическими данными в 3-й группе (табл. 1).
Следствием усиления/ускорения генерации тромбина в 3-й группе явилась значимо меньшая толщина фибриновых волокон в сравнении с 4-й группой. На это указывают ранее выполненные исследования in vitro, где описана обратная связь между толщиной волокон фибрина и интенсивностью образования тромбина [16],[17]. При добавлении низких концентраций тромбина к фибриногену образовывались массы, состоявшие преимущественно из толстых фибриновых волокон, увеличивавших пористость геля. Напротив, в присутствии высоких концентраций тромбина, сгустки включали в себя тонкие и короткие волокна фибрина, относительно устойчивые к фибринолизу.
Таким образом, механизмы системного гемостатического эффекта ТК и низкодозированного ФМ имеют значительные различия, несмотря на близость достигаемых гемостатических эффектов в условиях стимуляции фибринолиза.
Список литературы
1. Hoffman M., Monroe D.M. A cell-based model of hemostasis. Thromb Haemost. 2001; 85: 958–65. DOI: 10.1055/s-0037-1615947.
2. Бутылин А.А., Пантелеев М.А., Атауллаханов Ф.И. Пространственная динамика свертывания крови. Российский химический журнал. 2007; LI(1): 45–50.
3. Момот А.П., Вдовин В.М., Момот Д.А. и др. Новые возможности снижения кровопотери при системном введении низкой дозы фибринмономера. Клиническая физиология кровообращения. 2019; 16(4): 267–73. DOI: 10.24022/1814-6910-2019-16-4-267-273.
4. Вдовин В.М., Момот А.П., Орехов Д.А. и др. Минимизация посттравматического кровотечения при тромболитической терапии путем системного введения фибрин-мономера в эксперименте. Патология кровообращения и кардиохирургия. 2020; 24(1): 78–86. DOI: 10.21688/1681-3472-2020-1-78-86.
5. Kyoung-Jin P., Eui-Hoon K., Hee-Jin K., Sun-Hee K. Evaluation of the diagnostic performance of fibrin monomer in disseminated intravascular coagulation. Korean J Lab Med. 2011; 31(3): 143–7. DOI: 10.3343/kjlm.2011.31.3.143.
6. Вдовин В.М., Момот А.П., Орехов Д.А. и др. Влияние экзогенного фибринмономера на гемостатический потенциал и образование фибрина в области дозированной травмы печени в эксперименте. Российский физиологический журнал. 2020; 106(9): 1132–43. DOI: 10.31857/S0869813920070092.
7. Hunt B.J. The current place of tranexamic acid in the management of bleeding. Anaesthesia. 2015; 70(Suppl. 1): 50–3. DOI: 10.1111/anae.12910.
8. Ramirez R.J., Spinella P.C., Bochicchio G.V. Tranexamic acid update in trauma. Crit Care Clin. 2017; 33(1): 85–99. DOI: 10.1016/j.ccc.2016.08.004.
9. Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012: 944 с.
10. Момот А.П., Шахматов И.И., Ломаев И.С., Терехов С.С. Способ промышленного получения фибрин-мономера из плазмы крови. Патент РФ № 2522237. 2014; Бюл. № 19.
11. Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Изд. 2-е, перераб. и доп. М.: Медицина; 2005: 828 с.
12. Копаладзе Р.А. Методы эвтаназии экспериментальных животных. Этика, эстетика, безопасность персонала. Успехи физиологических наук. 2000; 31(3): 79–90.
13. Зербино Д.Д., Лукасевич Л.Л. Диссеминированное внутрисосудистое свертывание крови: Факты и концепции. М.: Медицина; 1989: 256 с.
14. Кузник Б.И. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии. Чита: Экспресс-издательство; 2010: 832 с.
15. Кузник Б.И., Стуров В.Г. Левшин Н.Ю. и др. Геморрагические и тромботические заболевания у детей и подростков. Новосибирск: Наука; 2018: 524 с.
16. Collet J.P., Park D., Lesty C., et al. Infl uence of fibrin network conformation and fibrin fiber diameter on fibrinolysis speed: dynamic and structural approaches by confocal microscopy. Arterioscler Thromb Vasc Biol. 2000; 20(5): 1354–61. DOI: 10.1161/01.atv.20.5.1354.
17. Wolberg A.S. Thrombin generation and fibrin clot structure. Blood Rev. 2007; 21(3): 131–42. DOI: 10.1016/j.blre.2006.11.001.
Об авторах
А. П. МомотРоссия
Момот Андрей Павлович, доктор медицинских наук, профессор, директор Алтайского филиала; профессор кафедры сестринского дела
656045, Барнаул;
656038, Барнаул
В. М. Вдовин
Россия
Вдовин Вячеслав Михайлович, кандидат медицинских наук, доцент, заведующий кафедрой патологической физиологии
656038, Барнаул
Д. А. Орехов
Россия
Орехов Дмитрий Андреевич, хирург
656055, Барнаул
И. П. Бобров
Россия
Бобров Игорь Петрович, доктор медицинских наук, старший научный сотрудник морфологической лаборатории
656038, Барнаул
И. И. Шахматов
Россия
Шахматов Игорь Ильич, доктор медицинских наук, профессор, заведующий кафедрой нормальной физиологии
656038, Барнаул
Д. А. Момот
Россия
Момот Дмитрий Андреевич, ассистент кафедры факультетской терапии
656038, Барнаул
В. В. Теряев
Россия
Теряев Вячеслав Витальевич, студент
656038, Барнаул
В. Е. Чернусь
Россия
Чернусь Владимир Евгеньевич, студент
656038, Барнаул
Рецензия
Для цитирования:
Момот А.П., Вдовин В.М., Орехов Д.А., Бобров И.П., Шахматов И.И., Момот Д.А., Теряев В.В., Чернусь В.Е. Сравнительное исследование влияния транексамовой кислоты и экзогенного фибрин-мономера на фибринообразование в области травмы при стимуляции фибринолиза стрептокиназой. Гематология и трансфузиология. 2021;66(4):556-566. https://doi.org/10.35754/0234-5730-2021-66-4-556-566
For citation:
Momot A.P., Vdovin V.M., Orekhov D.A., Bobrov I.P., Shakhmatov I.I., Момоt D.A., Terjaev V.V., Chernus’ V.Е. Comparative study of the effect of tranexamic acid and exogenous fibrin monomer on fibrin formation in the injury area during stimulation of fibrinolysis by streptokinase. Russian journal of hematology and transfusiology. 2021;66(4):556-566. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-4-556-566











































