Перейти к:
Тактика лечения больной приобретенной гемофилией: непрерывная инфузия рекомбинантного активированного фактора свертывания VII и эрадикация ингибитора
https://doi.org/10.35754/0234-5730-2022-67-2-282-294
Аннотация
Введение. Приобретенная гемофилия — редкое аутоиммунное заболевание, характеризующееся появлением ингибитора фактора свертывания VIII (FVIII), у женщин может ассоциироваться с беременностью.
Цель — представить клиническое наблюдение успешного лечения больной приобретенной гемофилией с помощью длительной непрерывной инфузии rFVIIa и эрадикации ингибитора, вакуум-ассистированной лапаротомии.
Основные сведения. Приведено клиническое наблюдение развития тяжелого геморрагического синдрома у беременной женщины после родоразрешения. Возникшее маточное кровотечение потребовало выполнения многократных хирургических вмешательств. При исследовании параметров гемостаза обращено внимание на удлинение активированного частичного тромбопластинового времени (АЧТВ), интервала CТ в тесте INTEM ротационной тромбоэластометрии. При дальнейшем обследовании выявлены уменьшенная плазменная активность FVIII и ингибитор FVIII. Наряду с хирургическим лечением геморрагический синдром был купирован с помощью рекомбинантного активированного фактора свертывания VII (rFVIIa) в течение 46 дней (непрерывная инфузия со скоростью 30 мкг/кг/ч, постепенное уменьшение до 9,6 мкг/кг/ч), а также дробные введения rFVIIa в дозе 80 мкг/кг перед оперативными вмешательствами. Эффективность терапии оценивали по изменениям CTINTEM и укорочению АЧТВ. Эрадикация ингибитора была достигнута терапией преднизолоном, ритуксимабом, азатиоприном, затем — циклофосфамидом.
Ключевые слова
Для цитирования:
Галстян Г.М., Налбандян С.А., Сабиров К.Р., Соболева О.А., Коваленко А.В., Горгидзе Л.А., Зоренко В.Ю. Тактика лечения больной приобретенной гемофилией: непрерывная инфузия рекомбинантного активированного фактора свертывания VII и эрадикация ингибитора. Гематология и трансфузиология. 2022;67(2):282-294. https://doi.org/10.35754/0234-5730-2022-67-2-282-294
For citation:
Galstyan G.M., Nalbandyan S.A., Sabirov K.R., Soboleva O.A., Kovalenko A.V., Gorgidze L.A., Zorenko V.Yu. Treatment tactics for a patient with acquired hemophilia: continuous infusion of recombinant activated coagulation factor VII and the inhibitor eradication. Russian journal of hematology and transfusiology. 2022;67(2):282-294. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-2-282-294
Введение
Появление ингибитора фактора свертывания (FVIII) у больных без гемофилии, или так называемая приобретенная гемофилия, выявляется с частотой от 1 до 1,48 случая на миллион населения в год [1–3]. Согласно данным Европейского регистра приобретенной гемофилии (European Acquired Haemophilia Registry, EACH2) [4], который в 2012 г. включал сведения о 510 больных из 117 центров 13 стран Европы, заболевание с одинаковой частотой встречалось среди мужчин и женщин (266 мужчин и 235 женщин), средний возраст больных при появлении ингибитора составил 73,9 года (межквартильный интервал (МКИ) — 61,4–80,4 года). В то же время отмечается еще один пик заболевания в возрасте 33,9 года, обусловленный появлением ингибитора FVIII во время беременности, среди этой возрастной группы ожидаемо преобладали женщины [4].
Появление ингибитора FVIII может осложнить течение различных заболеваний. Среди больных, включенных в регистр EACH2, у 59 (11,8 %) были опухолевые заболевания (у 40 больных — солидные опухоли, у 19 — заболевания системы крови), у 13 (2,6 %) — моноклональная гаммапатия неясного генеза; у 58 (11,6 %) — аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, синдром Шегрена, антифосфолипидный синдром и др.), у 42 (8,4 %) ингибиторная гемофилия была ассоциирована с беременностью, у 10 (5,3 %) — с приемом лекарственных препаратов, у 19 (3,8 %) — с инфекцией, у 7 (1,4 %) — с кожными заболеваниями, у 41 (8,2 %) — с другими заболеваниями, у 260 (51,9 %) больных не удалось установить заболевание, которое привело к выработке антител FVIII [4].
Ингибиторы FVIII подразделяют на два типа. Ингибиторы 1-го типа приводят к быстрой дозозависимой полной инактивации FVIII, встречаются обычно при тяжелой форме врожденной гемофилии А, осложнившейся выработкой ингибитора FVIII. Ингибиторы 2-го типа встречаются при приобретенной гемофилии, а также при легких формах врожденной гемофилии А, осложнившейся выработкой ингибитора FVIII, эти антитела не полностью инактивируют FVIII, при их действии сохраняется резидуальная активность FVIII [5][6]. Большинство антител при приобретенной гемофилии относятся к классу иммуноглобулинов (Ig) IgG1 и IgG4 и направлены против А2-, А3-и С2-доменов молекулы FVIII. Антитела против А3-домена нейтрализуют прокоагулянтную активность FVIII, блокируя его взаимодействие с FIXa, антитела против С2-домена нарушают связь FVIII с фосфолипидами и фактором фон Виллебранда (vWF), в то время как антитела к А2- и А3-доменам нарушают взаимосвязь FVIII с FX и FIXa [7]. С1-домен во многом определяет иммуногенность FVIII, его функциональная роль заключается в связи FVIII с мембранами клеток, FX и vWF [8]. Антитела к А2-, С1-и С2-доменам обнаружили у 23, 78 и 68 % больных с приобретенной гемофилией А, а у больных с ингибиторной формой врожденной гемофилии А антитела к этим доменам нашли, соответственно в 52, 57, и 81 % случаев [8]. Титр ингибитора устанавливают с помощью теста смешивания и измеряют в Бетезда единицах (БЕ) [9]. Диагноз ингибиторной гемофилии устанавливают при титре ингибитора ≥ 0,6 БЕ/мл. Различают формы ингибиторной гемофилии с низким < 5 БЕ/мл (низкореагирующим) титром ингибитора и высоким (высокореагирующим) титром ингибитора, т. е. ≥ 5 БЕ/мл [10].
Появление ингибитора кардинально меняет клиническую картину заболевания. В отличие от врожденной гемофилии, у больных приобретенной гемофилией гемартрозы встречаются редко, всего в 1,1 % случаев [4], в 70–80 % случаев возникают тяжелые, угрожающие жизни кровотечения, которые могут привести к летальному исходу [2][4]. У 77,4 % больных возникают спонтанные кровотечения, у 8,4 % больных — после травмы, у 8,2 % — после хирургического вмешательства, у 3,6 % — во время родов. В 53 % случаев имеется кожный геморрагический синдром, в 50,2 % — межмышечные, ретроперитонеальные и другие гематомы, в 1,1 % — кровоизлияния в ЦНС [4].
Лечение при выявлении ингибитора FVIII проводится с целью купировать геморрагический синдром и добиться эрадикации ингибитора.
По данным регистра EACH2, в результате лечения 72,6 % больных достигли полной ремиссии, т. е. после лечения у них не выявлялся ингибитор FVIII, и плазменная активность FVIII была > 70 % без иммуносупрессивной терапии (ИСТ), у 12,6 % достигнута частичная ремиссия, т. е. у них не выявлялся ингибитор FVIII, и плазменная активность FVIII была > 70 %, но только при проведении ИСТ, а у 9,4 %, несмотря на ИСТ, персистировало заболевание, т. е. сохранялась плазменная активность FVIII < 70 % [4]. Выживаемость больных приобретенной гемофилией, по данным регистра EACH2, составила 61,2 %, а 27,9 % больных умерли через 75 (МКИ — 25–240) дней после выявления ингибитора FVIII. Причем лишь у 17,2 % больных непосредственной причиной смерти стало развитие фатальных кровотечений, остальные больные умерли от прогрессии основного заболевания и осложнений ИСТ [4]. Факторами риска летального исхода, по данным мультивариантного анализа, были старший возраст, наличие онкологического заболевания, невозможность добиться эрадикации ингибитора. Пол, инициальный титр ингибитора и активность FVIII в плазме не влияли на исход заболевания [4].
Цель настоящей работы — представить клиническое наблюдение успешного лечения больной ингибиторной формой гемофилии с помощью длительной непрерывной инфузии rFVIIa и эрадикации у нее ингибитора FVIII с помощью ИСТ.
Клиническое наблюдение
Женщина, 34 лет, в июне 2021 г. поступила в городской родильный дом одного из регионов России в связи с начавшимися родами на 39-й неделе первой беременности. До беременности гинекологических заболеваний у нее не было, беременность протекала без особенностей. Родоразрешение через естественные родовые пути прошло без осложнений, родилась здоровая девочка, и женщина спустя 5 дней была выписана из стационара. Однако через 2 недели она была госпитализирована повторно в связи с жалобами на кровянистые выделения из наружных половых путей. При госпитализации концентрация гемоглобина крови составила 80 г/л, тромбоциты — 454 × 10 9/л, лейкоциты — 9,8 × 10 9/л, в коагулограмме — активированное частичное тромбопластиновое время (АЧТВ) 52 с, фибриноген — 4,7 г/л, протромбин по Квику (ПК) — 114 %. В связи с маточным кровотечением ей было выполнено лечебно-диагностическое выскабливание полости матки, при гистологическом исследовании аспирата обнаружены остатки плацентарной ткани. Однако кровотечение сохранялось, и спустя 3 дня было выполнено повторное выскабливание полости матки, которое, однако, не остановило кровотечение. Спустя неделю в связи с сохраняющимся кровотечением ей была выполнена лапаротомия по Пфанненштилю, надвлагалищная ампутация матки с маточными трубами. К этому времени концентрация гемоглобина уменьшалась до 49 г/л, тромбоциты — 311 × 10 9/л, АЧТВ — 63 с, ПК — 98 %, фибриноген — 3,4 г/л. Проводились трансфузии эритроцитной массы 1020 мл, 6765 мл свежезамороженной плазмы (СЗП), 10 доз криопреципитата. Еще спустя два дня в связи с охраняющимся кровотечением (гемоглобин — 46 г/л, тромбоциты — 170 × 10 9/л, АЧТВ — 64 с, ПК — 91 %, фибриноген — 3,6 г/л) выполнены нижняя срединная лапаротомия, перевязка внутренних подвздошных артерий с двух сторон, ревизия брюшной полости, культи шейки матки, дренирование брюшной полости. На следующий день в связи с продолжающимся кровотечением однократно введен rFVIIa в дозе 90 мкг/кг (гемоглобин — 46 г/л, тромбоциты — 134 × 10 9/л, АЧТВ — 64 с, ПК — 261 %, фибриноген — 2,2 г/л), выполнена повторная лапаротомия, удалены яичники с обеих сторон, для осуществления хирургического гемостаза брюшная полость тампонирована, ушита кожа лапаротомного доступа. Во время операции было травмировано дно мочевого пузыря, образовавшийся дефект ушит. Больной перелиты: эритроцитная масса 1250 мл, СЗП 2000 мл, 18 доз криопреципитата. Несмотря на проводимую терапию сохранялось удлинение АЧТВ, удлинение интервала СT по данным ротационной тромбоэластометрии (РОТЭМ) в тестах INTEM до 491 с и HEPTEM до 502 с, при нормальных показателях остальных тестов (FIBTEM, EXTEM). Только после этого была заподозрена приобретенная гемофилия, больная была консультирована по телефону специалистами ФГБУ «НМИЦ гематологии» Минздрава России, исследована плазменная активность FVIII, которая составила 0,7 %, титр ингибитора FVIII составил 50 БЕ. Таким образом, диагноз приобретенной гемофилии был подтвержден, и для дальнейшего лечения больная была транспортирована в ФГБУ «НМИЦ гематологии» Минздрава России.
Таблица 1. Лечение приобретенной гемофилии [11–14]
Table 1. Treatment of acquired hemophilia A [11–14]
|
Лечение/Treatment |
Дозы/Dosage |
Комментарии/Comments |
|
Лечение геморрагического синдрома/Treatment of hemorrhagic syndrome |
||
|
Шунтирующие препараты Bypassing agents |
|
|
|
аКПК/APCC |
50–100 МЕ/кг каждые 8–12 ч 50–100 IU every 8–12 h |
Эффективен, невозможно лабораторно оценить эффективность, возможны тромботические осложнения Effective, the effectiveness is impossible to evaluate at laboratory, high risk of thrombotic complications |
|
rFVIIa |
90–120 мкг/кг каждые 2–3 ч 90–120 mcg/kg every 2–3 h |
Эффективен, невозможно лабораторно оценить эффективность, короткий период полужизни (2 ч), возможны тромботические осложнения Effective, the effectiveness is impossible to evaluate in a laboratory, short half-life |
|
Увеличение FVIII в циркуляции Increase of circulating FVIII |
|
|
|
Рекомбинантный свиной FVIII Recombinant porcine FVIII |
50–100 МЕ/кг под контролем активности FVIII в крови, каждые 4 ч 50–100 IU/kg, FVIII levels measured every 4 h |
Безопасен, эффективен, возможна оценка по активности FVIII, возможна выработка ингибитора. Нет в РФ Safe, effective, possible to evaluate by FVIII activity measurement, inhibitor production is possible. Absent in Russian Federation |
|
Человеческий FVIII Human FVIII |
При титре ингибитора < 5 БЕ: 20 МЕ/кг на 1 БЕ/мл + 40 мкг/кг в/в If inhibitor titer < 5 BU: 20 IU/kg for every 1 BU/ml + 40 mcg/kg IV |
Только при низком титре ингибитора Only at low inhibitor titer |
|
Десмопрессин Desmopressin |
При титре ингибитора < 5 БЕ/мл: 0,3 мкг/кг в/в или п/к каждые 8–12 ч If inhibitor titer < 5 BU: 0,3 mcg/kg IV or SQ every 8–12 h |
Эффективен при небольших кровотечениях, титре ингибитора < 2 БЕ/мл и базальной активности FVIII > 5 %, уменьшается эффективность после 4–5 доз Effective for minor bleeding, inhibitor titer < 2 BU/mL, and basal FVIII activity > 5 %, efficacy decreases after 4–5 doses |
|
Имитация FVIII Imitation of FVIII |
|
Не одобрен для приобретенной гемофилии, имеются отдельные исследования, может быть применен при неэффективности rFVIIa и аКПК Not approved for acquired hemophilia, separate studies are available, may be used when rFVIIa and aPCC fail |
|
Эмицизумаб Emicizumab |
3 мг/кг п/к еженедельно 3 mg/kg SQ every week |
|
|
Эрадикация ингибитора FVIII/Eradication of inhibitor FVIII |
||
|
ИСТ/IST |
|
|
|
Преднизолон Prednisone |
1 мг/кг/сут. 1 mcg/kg/d |
Первая линия терапии, эффективен при FVIII < 1 % и ингибиторе < 20 БЕ/мл First line therapy if FVIII < 1 % and inhibitor < 20 BU |
|
Циклофосфамид Cyclophosphamide |
1–2 мг/кг/сут. в течение 5 нед. 1–2 mcg/kg/d for 5 weeks |
Возможны побочные эффекты Possible side effects |
|
Циклоспорин Cyclosporine |
200–300 мг/сут. 200–300 mg/d |
|
|
Большие дозы ВВИГ/hdIVIg |
0,4 г/кг/сут. в течение 5 сут. или 1 г/кг в течение 2 дней 0,4 g/kg/d for 5 d or 1 g/kg during 2 days |
Сочетают с ИСТ, ИИТ Combination with IST, ITI |
|
Иммуноадсорбция Immunoadsorption |
Удаляет ингибитор Removes inhibitor |
Быстро, но временно Fast but temporary |
|
ИИТ/ITI |
Концентрат FVIII в больших дозах High dose of FVIII |
Длительно, дорого Long, expensive |
|
RTX |
375 мг/м 2 раз в неделю 4 недели 375 mg/m 2 once a week for 4 weeks |
Нет рандомизированных исследований, 2–3 линии терапии, сочетают с ИСТ No randomized trials, 2–3 lines of therapy, combine with IST |
Notes: APCC — activated prothrombin complex concentrate, hdIVIg — high-dose intravenous immunoglobulin, IST — immunosupressive therapy, ITI — induction of immune tolerance, RTX — rituximab.
При поступлении состояние больной было тяжелым. Уровень сознания — 15 баллов по шкале комы Глазго. Предъявляла жалобы на боль в животе при пальпации, слабость. Кожные покровы и видимые слизистые были субиктеричные. Имелись множественные постпункционные гематомы. Температура тела — 38,5 °C. Дыхание самостоятельное, проводилось при аускультации во все отделы, было ослаблено в нижних отделах с обеих сторон. Живот был увеличен в объеме за счет вздутия, болезненный и напряженный в гипогастрии, где имелись швы от нижней срединной лапаротомии и доступа по Пфанненштилю, между швами были марлевые тампоны, пропитанные кровью. АД — 145/84 мм рт. ст., синусовая тахикардия с частотой сердечных сокращений до 115 в 1 мин. По данным лабораторных исследований: гемоглобин — 46 г/л, тромбоциты — 229 × 10 9/л, лейкоциты — 13,1 × 10 9/л, прокальцитонин — 0,48 моль/л, С-реактивный белок — 249 мг/л, отмечалась умеренная гипопротеинемия (общий белок — 59 г/л), остальные биохимические показатели (электролиты, билирубин, трансаминазы, креатинин, мочевина) и показатели кислотно-основного состояния были в пределах нормы. В коагулограмме: АЧТВ — 106 с, активность FVIII — 0,7 %, титр ингибитора FVIII — 52 БЕ/мл, тромбиновое время — 18 с, ПК — 155 %, фибриноген — 2,4 г/л, антитромбин III — 88,2 %. По данным РОТЭМ — гипокоагуляция по внутреннему пути (рис. 1). Одновременно у больной в исследовании с использованием разведенного яда гадюки Рассела был выявлен положительный волчаночный антикоагулянт в тесте с ядом гадюки Рассела.
При компьютерной томографии (КТ) визуализировалась полость малого таза, заполненная тампонами, а также массивная гематома, располагавшаяся в нижнем этаже брюшной полости, латеральных каналах, а также в забрюшинном пространстве в области правой тазовой кости (рис. 2 А).
Выполнено срочное оперативное вмешательство. Сняты швы с кожи, эвакуированы фрагменты инфицированной гематомы передней брюшной стенки и полости малого таза объемом 200 мл, удалены пять марлевых тампонов, выявлен пельвиоперитонит, нагноение лапаротомной раны (рис. 2 Б). Непосредственно перед операцией и спустя 2 часа после ее начала введен rFVIIа в дозе 80 мкг/кг.
В связи с наличием плотных организованных сгустков, невозможностью одномоментной санации брюшной полости было принято решение о необходимости этапных санаций с применением вакуум-ассистированной лапаростомии (рис. 3).

Рисунок 1. РОТЭМ до начала лечения. A–Б — в тесте INTEM, отражающем внутренний путь свертывания, интервал СТ удлинен до 650 с (норма — до 240 с), в тесте EXTEM, отражающем внешний путь свертывания, — нормокоагуляция. РОТЭМ во время проведения гемостатической терапии rFVIIa. В — интервал CT в тесте INTEM укоротился до 483 с, но по-прежнему превышал нормальные значения. Г — в тесте EXTEM нормокоагуляция
Figure 1. ROTEM parameters prior to treatment. A–B — prolonged CT to 650 s (reference ranges up to 240 s) in the INTEM (intrinsic coagulation pathway) and no changes in the EXTEM (extrinsic coagulation pathway). ROTEM parameters during hemostatic therapy with rFVIIa. C — shortened, but still not referent CT in the INTEM. D — no changes in the EXTEM

Рисунок 2. Гематома брюшной полости при поступлении. А — КТ органов брюшной полости; синие стрелки — хирургическая марля, красная стрелка — организованные сгустки крови. Б — вид при лапаротомии
Figure 2. Abdominal hematoma on admission. A — abdominal CT scan; blue arrows — surgical gauze, a red arrow — organized blood clots. B — view during laparotomy
Проводились программные санации брюшной полости. Спустя неделю после госпитализации у больной отмечено резкое уменьшение диуреза, но при этом по аспирационной системе из брюшной полости отмечено поступление 3000 мл прозрачной жидкости, в которой концентрация креатинина составила 3335 мкмоль/л (референсные значения для сыворотки крови — 60–102 мкмоль/л), что позволило заподозрить поступление мочи в брюшную полость. Была выполнена КТ брюшной полости и малого таза с внутривенным контрастным усилением, выявлен дефект стенки мочевого пузыря. При цистоскопии диагностирована несостоятельность швов дна мочевого пузыря, очаговый некроз стенки мочевого пузыря. Некроз был иссечен, дефект ушит по Карпенко. Через 2 дня диагностирована несостоятельность шва мочевого пузыря. Для предотвращения поступления мочи в брюшную полость были последовательно выполнены дренирование мочеточников стентами Бендера (8 Fr), выведенными через уретру, затем окклюзия мочеточников баллонными катетерами (6 Fr, объем баллона — 0,4 мл). Однако в течение суток произошла обструкция просвета катетеров сгустками крови, и моча вновь стала поступать по мочеточникам мимо баллонов в мочевой пузырь и брюшную полость. В связи с этим было выполнено бужирование устьев каждого из мочеточников и установка в них катетеров Фолея (12 Fr), дистальные концы катетеров были позиционированы в средней трети мочеточников, баллоны раздуты, а сами катетеры выведены наружу через уретру, что позволило прекратить поступление мочи в мочевой пузырь и брюшную полость. Поскольку сохранялся риск обструкции катетеров и мочеточников сгустками крови, дополнительно под ультразвуковой навигацией выполнена двусторонняя чрескожная нефростомия, при помощи системы стилет-троакар установлены полиуретановые катетеры размером 10 Fr. Это позволило полностью изолировать брюшную полость от поступления мочи, которая стала поступать как по нефростомам, так и по установленным в мочеточники катетерам.
После эвакуации инфицированных сгустков и регресса явлений перитонита, прекращения геморрагического синдрома удалось выполнить раннее фасциальное закрытие доступа от нижней срединной лапаротомии. Однако полному закрытию лапаротомной раны препятствовало развитие свища мочевого пузыря и постепенное отторжение некротических секвестров забрюшинной клетчатки. Продолжалась вакуум-ассистированная лапаротомия через доступ по Пфанненштилю.
Поскольку планировались повторные оперативные вмешательства, встал вопрос о тактике длительной гемостатической терапии. Было решено начать постоянную непрерывную инфузию rFVIIa (препарат «Коагил», Россия), которую прекращали на время оперативных вмешательств, перед началом которых болюсно вводили rFVIIа в дозе 80 мкг/кг. После окончания операции в случае геморрагического синдрома повторяли однократно болюсное введение, а затем вновь начинали непрерывную инфузию rFVIIa. Согласно инструкции производителя [15][16], rFVIIa остается стабильным в растворенном состоянии при комнатной температуре не более 3 часов. Чтобы сохранить активность растворенного препарата при постоянной инфузии, содержимое ампул в дозе 2,4 мг после растворения водой для инъекций разбавляли в 20 мл 0,9 %-ного раствора натрия хлорида и проводили в/в инфузию со скоростью 30 мкг/кг/час (1,5 мг/ч), меняя шприцы каждые 1,5–2 часа. Для контроля за гемостазом мониторировали параметры РОТЭМ (тест INTEM, отражающий внутренний путь свертывания), тромбоэластографии (ТЭГ) (периоды R, К), АЧТВ, активность FVIII, титр ингибитора FVIII. Проводимая тактика позволила купировать геморрагический синдром. Это проявлялось не только клинически, но и в укорочении АЧТВ до 60–65 с. Постепенно скорость инфузии rFVIIa уменьшали с 30 мкг/кг/ч до 25 мкг/кг/ч, 20 мкг/кг/ч, 15 мкг/кг/ч, 9,6 мкг/кг/ч. Кроме того, постепенно уменьшали и дозу дробно вводимого перед операциями rFVIIa, и спустя 20 дней после поступления повторные оперативные вмешательства выполняли уже без дробного введения rFVIIa (рис. 4).
Другим направлением лечения была эрадикация ингибитора. С этой целью с первого дня больная начала получать преднизолон в дозе 1 мг/кг/сут. (50 мг/сут.), а с четвертого дня после поступления — ритуксимаб по схеме 375 мг/м 2 раз в 7 дней. В совокупности это привело к постепенному уменьшению титра ингибитора, увеличению активности FVIII в плазме до 3–8 %.
После введения 5-й дозы ритуксимаба у больной сохранялся ингибитор FVIII в титре 3 БЕ/мл, плазменная активность FVIII составляла 4 %, АЧТВ оставалось удлиненным до 66 с. К терапии был добавлен азатиоприн в дозе 100 мг/сут. внутрь. Такое сочетание иммуносупрессивных препаратов, по данным литературы [17], эффективно при приобретенной гемофилии, ассоциированной с положительным волчаночным антикоагулянтом. На 10-й день терапии азатиоприном сохранялся ингибитор в титре 0,78 БЕ/мл, АЧТВ сократилось до 43 с, активность FVIII повысилась до 33 %.
Терапию азатиоприном пришлось прекратить из-за развития у больной панкреатита, пареза кишечника. Была начата терапия циклофосфамидом в/в в дозе 200 мг/сут. в течение 5 дней, после чего активность FVIII в плазме составила 102 %, ингибитор FVIII перестал определяться, отмечалась нормализация CT в тесте INTEM (рис. 5).
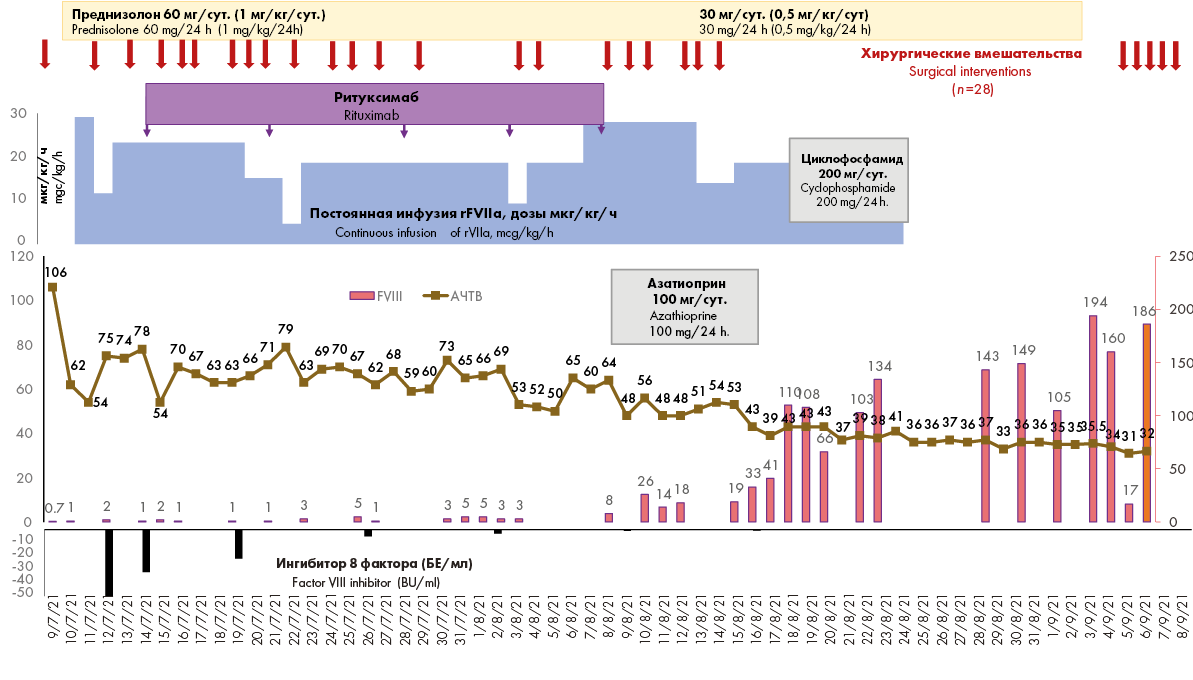
Рисунок 4. Тактика лечения больной А. RTX — ритуксимаб, ЦФ — циклофосфамид
Figure 4. Patient A., treatment tactics. RTX — rituximab, CP — cyclophosphamide

Рисунок 5. Нормализация показателей после исчезновения ингибитора FVIII на 52-й день лечения
Figure 5. Normalization of ROTEM parameters after FVIII inhibitor eradication on day 52 of treatment
Терапия rFVIIa и циклофосфамидом была прекращена, начато постепенное уменьшение дозы преднизолона. ИСТ осложнилась лейкопенией < 1 × 10 9/л, сохранявшейся в течение 10 дней. Период лейкопении протекал без инфекционных осложнений. Суммарно больная получила 960 мг (800 флаконов по 1,2 мг) в виде непрерывной инфузии и 90 мг (75 флаконов) в виде болюсной инфузии rFVIIa в течение 46 дней.
В ФГБУ «НМИЦ гематологии» больной было выполнено 28 оперативных вмешательств, в том числе санационные лапаротомии, двусторонняя нефростомия, окклюзия мочеточников, процедуры дермотензии. Одновременно проводили антимикробную терапию (меропенем, полимиксин, флуконазол) в соответствии с выявленными микроорганизмами.
После купирования геморрагического синдрома в течение месяца проводили реабилитационные мероприятия. В последующем удалены катетеры Фолея из мочеточников, и больная была выписана из стационара с нефростомическими дренажами и дренажем брюшной полости. Спустя еще два месяца удалены все дренажи, восстановлена удовлетворительная резервуарная функция мочевого пузыря. При исследовании системы гемостаза: АЧТВ — 37 с, ПК — 94 %, фибриноген — 4,3 г/л, антитромбин III — 108 %, FVIII — 89 %, ингибитор FVIII не выявлялся.
Обсуждение
Приобретенная гемофилия, ассоциированная с беременностью, встречается в 7–11 % случаев всех форм приобретенной гемофилии [4][18][19]. Крайне редко ингибитор FVIII выявляют во время беременности [20]. Анализ опубликованных за 40 лет (1937–1977 гг.) 30 наблюдений приобретенной гемофилии, ассоциированной с беременностью, показал, что лишь в 1 случае приобретенная гемофилия проявилась во время беременности, в остальных случаях — после родов [21]. У большинства женщин геморрагический синдром появлялся после родов в течение от 1 до 4 мес., медиана — 60 дней [18–21]. Первые проявления геморрагического синдрома были разными. Согласно Итальянскому регистру, среди 20 женщин с приобретенной гемофилией, ассоциированной с беременностью, у 70 % геморрагический синдром проявился послеродовыми кровотечениями и гематомами, у 20 % послеродовое кровотечение послужило причиной гистерэктомии, у 5 % кровотечение возникло после экстракции зуба, еще у 5 % первыми проявлениями нарушения свертывания крови были постинъекционные гематомы [20]. В настоящем наблюдении геморрагический синдром появился у женщины после неосложненных родов через 2 недели после выписки из роддома. Появление ингибитора FVIII совпало у нее с выявлением волчаночного антикоагулянта. Одновременное выявление волчаночного антикоагулянта и антител к FVIII — нечастое явление. При анализе 9282 больных системной красной волчанкой приобретенная гемофилия была выявлена только у 6 (0,06 %) больных [22]. Скорее даже выявление волчаночного антикоагулянта рассматривается как критерий исключения при подозрении на приобретенную гемофилию, поскольку он также может удлинять АЧТВ [11]. По данным европейского регистра, системная красная волчанка была выявлена лишь у 5 (1 %) из 501 больного приобретенной гемофилией [4]. Еще реже выявляется ассоциация антител к FVIII и фосфолипидам (волчаночного антикоагулянта), ассоциированных с беременностью. В 256 отделениях Великобритании за 2 года были диагностированы 172 случая приобретенной гемофилии, из них лишь 3 были ассоциированы с беременностью, и лишь в 1 случае выявлен также волчаночный антикоагулянт [3].
Особенностью настоящего наблюдения является также тот факт, что диагноз приобретенной гемофилии был заподозрен лишь через 3 недели после возникновения геморрагического синдрома, когда уже были выполнено множество операций. Более того, проводимая трансфузионная терапия СЗП и криопреципитатом способствовали нарастанию титра ингибитора, поскольку при приобретенной гемофилии противопоказано введение трансфузионных сред, содержащих FVIII.
Основным вопросом, который возник после подтверждения диагноза приобретенной гемофилии, был выбор метода лечения геморрагического синдрома. В периоперационном периоде для лечения геморрагического синдрома могут успешно применяться шунтирующие препараты, такие как rFVIIa или антиингибиторный коагулянтный комплекс [13][23]. Применение препаратов шунтирующего действия оказывает существенное влияние на стоимость терапии. По сравнению с антиингибиторным коагулянтным комплексом «FEIBA» применение фактора rFVIIa не требует дополнительных расходов или оказывается даже экономически выгодным [23]. Оценка эффективности применения rFVIIa при периоперационных кровотечениях у больных с ингибиторами факторов свертывания показала, что общая эффективность составила 84 %, а частота тромботических осложнений — 0,025 % [23]. Потому для лечения нарушений гемостаза был выбран rFVIIa. Однако его болюсное введение в рекомендуемой дозе 90–120 мкг/кг каждые 2–3 часа [13] в течение почти полутора месяцев было практически невозможно, в том числе и по экономическим соображениям. Такой режим был выбран только для оперативных вмешательств. Вне оперативных вмешательств была применена непрерывная инфузия rFVIIa. Имеются отдельные сообщения о применении подобной тактики лечения при ингибиторной гемофилии. Сообщается [24] о 7 больных с ингибиторной гемофилией из 5 госпиталей стран Бенилюкса, у которых было суммарно 9 ситуаций, когда возникли показания к гемостатической терапии (4 кровотечения и 5 хирургических вмешательств). Постоянная инфузия rFVIIa проводилась с целью достижения концентрации в плазме rFVIIa 10 Ед./мл и укорочения протромбинового времени на 3 с по сравнению с нормальными значениями. Это достигалось начальной болюсной инъекцией rFVIIa в дозе 90 мкг/кг и последующей непрерывный инфузией rFVIIa в дозе от 30 до 6 мкг/кг/ч (в среднем, 17 мкг/кг/ч). В 8 из 9 случаев (89 %) лечение было признано эффективным, в 1 (11 %) случае — частично эффективным [24]. В систематическом обзоре [25] проанализированы случаи применения постоянной инфузии rFVIIa у больных ингибиторной гемофилией с 1995 по 2016 гг. Всего выявлены сообщения о 241 больном, у которых были 453 кровотечения, 223 хирургических вмешательств и 46 эпизодов кровотечений при хирургических вмешательствах. Постоянная инфузия rFVIIa в дозе 50 мкг/кг/ч, которую начинали после болюсной инъекции 90 мкг/кг, была столь же эффективна, как и лечение только болюсными инъекциями rFVIIa. Эффективность при постоянной инфузии rFVIIa была достигнута в 80 %, частичная эффективность — в 20 % случаев [25].
В настоящем наблюдении не было возможности оценивать плазменную концентрацию rFVIIa [25], но при постоянной инфузии rFVIIa нужен был какой-то ориентир, чтобы оценить ее эффективность. В более раннем исследовании [26] было показано, что введение rFVIIa не приводит к нормализации АЧТВ, но с помощью ROC-анализа установлено, что укорочение АЧТВ после введения rFVIIa на 17 с и более или на 22 % и более от исходной величины ассоциируется с нормализацией времени реакции R и максимальной амплитуды на ТЭГ, протромбиновое время оказалось менее чувствительным показателем. Именно поэтому поддержание АЧТВ в пределах 50–60 с достаточно для обеспечения гемостаза (исходно было более 100 с). Подобная тактика позволила, достигнув клинической эффективности, сэкономить значительное количество rFVIIa. Если бы был использован рекомендуемый режим введения rFVIIa по 90 мкг/кг каждые 3 часа в течение 46 дней, то за 46 дней должны были бы израсходовать 1656 мг препарата, в то время как было использовано 1048 мг препарата, т. е. на 37 % меньше при сохраненной эффективности. Использование малых доз для разведения препарата позволило сохранить активность препарата, поскольку разведенном виде он вводился не более 3 часов.
Помимо лечения геморрагического синдрома, не менее сложной задачей у больной была эрадикация ингибитора FVIII. В качестве первой линии терапии для этого применяют глюкокортикостероидные гормоны (ГКС) [11]. Согласно исследованиям, проведенным в 1980-х годах, терапия только ГКС позволила добиться эрадикации ингибитора лишь у 30 % больных [27][28]. Согласно данным регистра EACH2 [29], полное удаление ингибитора FVIII при терапии только ГКС было достигнуто у 83 (58 %) из 142 больных, среднее время до эрадикации ингибитора составило 34 дня, однако у 15 (18 %) больных позже развились рецидивы, это означает, что стабильная ремиссия при терапии только ГКС была только у 48 % больных. Добавление к ГКС циклофосфамида позволило увеличить частоту достижения ремиссии до 60–80 % [27–29] и уменьшить до 12 % частоту рецидивов [29]. В настоящем наблюдении больная с первого дня получала преднизолон в дозе 1 мг/кг, но при этом в плазме у нее сохранялись ингибитор FVIII, низкая активность FVIII. От назначения циклофосфамида вначале было решено воздержаться из-за риска инфекционных осложнений, в связи с чем к терапии ГКС был добавлен ритуксимаб. Согласно данным EACH2 [29], добавление ритуксимаба не увеличивало частоту и не укорачивало время достижения ремиссии, но значительно (от 0 до 3 %) уменьшало частоту рецидивов. В то же время авторы кокрейновского обзора [30], в который были включены 2702 опубликованные работы по применению ритуксимаба для лечения приобретенной гемофилии, не нашли ни одного рандомизированного контролируемого исследования и поэтому не смогли сделать вывод об эффективности ритуксимаба. Авторы [30], однако, отмечают результаты отдельных работ, в которых частота ответа достигала более 90 %, а частота полной ремиссии — 78,6 %, при этом время до достижения ремиссии составляло 8,3 недели. Отмечают, что ремиссия после лечения ритуксимабом достигается медленнее, чем при лечении другими препаратами.
В настоящем наблюдении также был назначен ритуксимаб, но поскольку одновременно определялся и волчаночный антикоагулянт, к терапии был добавлен азатиоприн, т. к. имеются наблюдении об успешном лечении подобного сочетания у больных приобретенной гемофилией [17]. Наличие пареза кишечника не позволило продолжить терапию азатиоприном, и он был заменен на парентеральную форму циклофосфамида. В результате достигнута полная ремиссия: нормализовалась активность FVIII, достигнута эрадикация ингибитора. Ремиссия сохраняется уже более полугода.
Таким образом, возможны различные подходы к лечению приобретенной гемофилии, причем направленные как на лечение геморрагического синдрома, так и на эрадикацию ингибитора. Длительная постоянная инфузия rFVIIa позволяет достичь приемлемого гемостаза и значимо уменьшить потребление препарата. В качестве ежедневного контроля за терапией может быть использовано частичное укорочение АЧТВ, а для оценки эффективности ИСТ — увеличение активности FVIII в плазме крови и исчезновение ингибитора.
Список литературы
1. Collins P., Macartney N., Davies R., et al. A population based, unselected, consecutive cohort of patients with acquired haemophilia A. Br J Haematol. 2004; 124(1): 86–90. DOI: 10.1046/j.1365-2141.2003.04731.x.
2. Delgado J., Jimenez-Yuste V., Hernandez-Navarro F., et al. Acquired haemophilia: Review and meta-analysis focused on therapy and prognostic factors. Br J Haematol. 2003; 121(1): 21–35. DOI: 10.1046/j.1365-2141.2003.04162.x.
3. Collins P.W., Hirsch S., Baglin T.P., et al. Acquired hemophilia A in the United Kingdom: A 2-year national surveillance study by the United Kingdom Haemophilia Centre Doctors’ organisation. Blood. 2007; 109(5): 1870–7. DOI: 10.1182/blood-2006-06-029850.
4. Knoebl P., Marco P., Baudo F., et al. Demographic and clinical data in acquired hemophilia A: Results from the European Acquired Haemophilia Registry (EACH2). J Thromb Haemost. 2012; 10(4): 622–31. DOI: 10.1111/j.1538-7836.2012.04654.x.
5. Ma A.D., Carrizosa D. Acquired factor VIII inhibitors: Pathophysiology and treatment. Hematology Am Soc Hematol Educ Program. 2006; 432–7. DOI: 10.1182/asheducation-2006.1.432.
6. Witmer C., Young G. Factor VIII inhibitors in hemophilia A: Rationale and latest evidence. Ther Adv Hematol. 2013; 4(1): 59–72. DOI: 10.1177/2040620712464509.
7. Oh J., Lim Y., Jang M.J., et al. Characterization of anti-factor VIII antibody in a patient with acquired hemophilia A. Blood Res. 2013; 48(1): 58–62. DOI: 10.5045/br.2013.48.1.58.
8. Kahle J., Orlowski A., Stichel D., et al. Frequency and epitope specificity of antifactor VIII C1 domain antibodies in acquired and congenital hemophilia A. Blood. 2017; 130(6): 808–16. DOI: 10.1182/blood-2016-11-751347.
9. Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. М. – Тверь: Триада; 2005.
10. Зозуля Н.И., Кумскова М.А., Полянская Т.Ю. и др. Гемофилия. Клинические рекомендации. Национальное гематологическое общество. 2018; 1–47.
11. Mazzucconi M.G., Baldacci E., Ferretti A., et al. Acquired haemophilia A: An intriguing disease. Mediterr J Hematol Infect Dis. 2020; 12(1): e2020045. DOI: 10.4084/MJHID.2020.045.
12. Franchini M., Lippi G. Acquired factor VIII inhibitors. Blood. 2008; 112(2): 250–5. DOI: 10.1182/blood-2008-03-143586.
13. Tiede A., Collins P., Knoebl P., et al. International recommendations on the diagnosis hemophilia and a treatment of acquired hemophilia A. Haematologica. 2020; 105(7): 1791–801. DOI: 10.3324/haematol.2019.230771.
14. Esteves Pereira M., Bocksrucker C., Kremer Hovinga J.A., et al. Immunoadsorption for the treatment of acquired hemophilia: New observational data, systematic review, and meta-analysis. Transfus Med Rev. 2021; 35(2): 125–34. DOI: 10.1016/j.tmrv.2021.01.001.
15. Novo Nordisk. NovoSeven Prescribing Information (FDA Approved). 2014; 1–31.
16. Christensen A., Jensen J.T., Nøhr A.M., Cooper D.L. Room-temperature-stable recombinant activated coagulation factor VII recombinant: Chemical and microbiologic stability over 24 hours during continuous in vitro infusion. Clin Ther. 2011; 33(12): 1997–2001. DOI: 10.1016/j.clinthera.2011.10.023.
17. Gupta D., Chatterjee T., Sharma A., et al. Rare case of acquired haemophilia and lupus anticoagulant. Indian J Hematol Blood Transfus. 2014; 30(3): 197–200. DOI: 10.1007/s12288-012-0204-5.
18. Bossi P., Cabane J., Ninet J., et al. Acquired hemophilia due to factor VIII inhibitors in 34 patients. Am J Med. 1998; 105(5): 400–8. DOI: 10.1016/s0002-9343(98)00289-7.
19. Michiels J.J. Acquired hemophilia A in women postpartum: Clinical manifestations, diagnosis, and treatment. Clin App Thromb Hemost. 2000; 6(2): 82–6. DOI: 10.1177/107602960000600206.
20. Baudo F., De Cataldo F., Bari S.M., et al. Acquired factor VIII inhibitors in pregnancy: Data from the Italian Haemophilia Register relevant to clinical practice. BJOG. 2003; 110(3): 311–4. DOI: 10.1016/s1470-0328(03)01935-9.
21. Voke J., Letsky E. Pregnancy and antibody to factor VIII. J Clin Pathol. 1977; 30(10): 928–32. DOI: 10.1136/jcp.30.10.928.
22. Cao X.Y., Li M.T., Zhang X., et al. Characteristics of acquired inhibitors to factor VIII and von Willebrand factor secondary to systemic lupus erythematosus. J Clin Rheumatol. 2021; 27(5): 201–5. DOI: 10.1097/RHU.0000000000001284.
23. Kozek-Langenecker S.A., Afshari A., Albaladejo P., et al. Руководство по лечению тяжелого периоперационного кровотечения: рекомендации Европейского общества анестезиологов. Гематология и трансфузиология. 2021; 66(1): 88–160.
24. Mauser-Bunschoten E.P., De Goede-Bolder A., Wielenga J.J., et al. Continuous infusion of recombinant factor VIIa in patients with haemophilia and inhibitors: Experience in the Netherlands and Belgium. Neth J Med. 1998; 53(6): 249–55. DOI: 10.1016/S0300-2977(98)00111-9.
25. Rajpurkar M., Cooper D.L. Continuous infusion of recombinant activated factor VII: A review of data in congenital hemophilia with inhibitors and congenital factor VII deficiency. J Blood Med. 2018; 9: 227–39. DOI: 10.2147/JBM.S184040.
26. Галстян Г.М., Полеводова О.А., Терехова И.В. и др. Применение тромбоэластографии, теста генерации тромбина и клоттинговых тестов для оценки эффективности гемостатической терапии рекомбинантным активированным фактором VII у больных с ингибиторной формой гемофилии. Российский журнал детской гематологии и онкологии. 2017; 4(4): 33–8. DOI: 10.17650/2311-1267-2017-4-4-33-38.
27. Spero J.A., Lewis J.H., Hasiba U. Corticosteroid therapy for acquired F VIII:C inhibitors. Br J Haematol. 1981; 48(4): 635–42. DOI: 10.1111/j.1365-2141.1981.00635.x.
28. Green D., Lechner K. A survey of 215 non-hemophilic patients with inhibitors to Factor VIII. Thromb Haemost. 1981; 45(3): 200–3.
29. Collins P., Baudo F., Knoebl P., et al. Immunosuppression for acquired hemophilia A: Results from the European Acquired Haemophilia Registry (EACH2). Blood. 2012; 120(1): 47–55. DOI: 10.1182/blood-2012-02-409185.
30. Remmington T., Smith S. Rituximab for eradicating inhibitors in people with acquired haemophilia A. Cochrane Database Syst Rev. 2021; 8(8): CD011907. DOI: 10.1002/14651858.CD011907.pub3.
Об авторах
Г. М. ГалстянРоссия
Галстян Геннадий Мартинович, доктор медицинских наук, заведующий отделением реанимации и интенсивной терапии; профессор кафедры анестезиологии и реаниматологии
125167, Москва; 117997, Москва
С. А. Налбандян
Россия
Налбандян Сирануш Ашотовна, аспирант отделения реанимации и интенсивной терапии
125167, Москва
К. Р. Сабиров
Россия
Сабиров Кирилл Рустемович, хирург отделения хирургии
125167, Москва
О. А. Соболева
Россия
Соболева Ольга Алексеевна, хирург отделения хирургии
125167, Москва
А. В. Коваленко
Россия
Коваленко Алексей Васильевич, уролог отделения хирургии
125167, Москва
Л. А. Горгидзе
Россия
Горгидзе Лана Анзоровна, кандидат биологических наук, старший научный сотрудник клинической лабораторной диагностики экспресс-лаборатории отделения реанимации и интенсивной терапии
125167, Москва
В. Ю. Зоренко
Россия
Зоренко Владимир Юрьевич, доктор медицинских наук, заведующий травматолого-ортопедическим отделением
125167, Москва
Рецензия
Для цитирования:
Галстян Г.М., Налбандян С.А., Сабиров К.Р., Соболева О.А., Коваленко А.В., Горгидзе Л.А., Зоренко В.Ю. Тактика лечения больной приобретенной гемофилией: непрерывная инфузия рекомбинантного активированного фактора свертывания VII и эрадикация ингибитора. Гематология и трансфузиология. 2022;67(2):282-294. https://doi.org/10.35754/0234-5730-2022-67-2-282-294
For citation:
Galstyan G.M., Nalbandyan S.A., Sabirov K.R., Soboleva O.A., Kovalenko A.V., Gorgidze L.A., Zorenko V.Yu. Treatment tactics for a patient with acquired hemophilia: continuous infusion of recombinant activated coagulation factor VII and the inhibitor eradication. Russian journal of hematology and transfusiology. 2022;67(2):282-294. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-2-282-294











































