Перейти к:
Интенсивная терапия жизнеугрожающих осложнений у реципиентов аллогенных гемопоэтических стволовых клеток
https://doi.org/10.35754/0234-5730-2022-67-3-308-327
Аннотация
Введение. Жизнеугрожающие осложнения, возникающие при трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК), оказывают существенное влияние на краткосрочный и отдаленный прогноз у реципиентов гемопоэтических стволовых клеток (алло-ГСК).
Цель — определить структуру жизнеугрожающих осложнений, факторы, способствующие их возникновению, а также краткосрочный и отдаленный прогноз у реципиентов алло-ГСК, перенесших эти осложнения.
Материалы и методы. В ретроспективное исследование включены все больные в возрасте старше 18 лет, которым с 01.01.2012 по 01.01.2022 была выполнена алло-ТГСК. Больные были разделены на две группы: I группа — больные, у которых в перитрансплантационном периоде развились жизнеугрожающие осложнения, и они были госпитализированы в ОРИТ; II группа — больные, которым при проведении алло-ТГСК госпитализация в ОРИТ не потребовалась. В группе больных, переведенных в ОРИТ, регистрировали структуру, сроки развития критических состояний и результаты их лечения, определяли факторы риска их развития и факторы неблагоприятного прогноза.
Результаты. Перевод в ОРИТ потребовался 174 (26,7 %) из 652 реципиентов алло-ГСК. Факторами риска развития жизнеугрожающих осложнений были: выполнение алло-ТГСК у больных острыми лейкозами, у которых не была достигнута полная ремиссия (отношение рисков (ОР) = 2,10; 95%-ный доверительный интервал (95% ДИ): 1,28–3,44; p = 0,003), выполнение алло-ТГСК без кондиционирования у больных с аплазией кроветворения после циторедуктивной химиотерапии (ОР = 30,63; 95% ДИ: 8,787–107,04; p < 0,001), несостоятельность (ОР = 2,51, 95% ДИ: 1,58–3,97; p < 0,001) и гипофункция трансплантата (ОР = 2,85, 95% ДИ: 1,6–5,05; p < 0,001), острая реакция «трансплантат против хозяина» (РТПХ) (ОР = 2,04, 95% ДИ: 1,459–2,85; p < 0,001). Основными причинами перевода в ОРИТ явились сепсис и/или септический шок (СШ) (27,9 %), острая дыхательная недостаточность (23,9 %), неврологические нарушения (17,7 %). Вид и этапы трансплантации влияли на сроки и структуру критических синдромов. Летальность в ОРИТ с учетом повторных госпитализаций составила 59,8 %. Факторами неблагоприятного исхода в ОРИТ были: развитие критических состояний после +30 дня, потребность в проведении искусственной вентиляции легких и вазопрессорной терапии. Общая выживаемость (ОВ) реципиентов, переведенных в ОРИТ, при сроке наблюдения 9 лет составила 13,8 %. Среди осложнений перитрансплантационного периода сепсис и/или СШ, возникшие на ранних сроках после алло-ТГСК, характеризовались наиболее благоприятным отдаленным прогнозом (ОВ — 43,8 %). ОВ больных, выписанных из ОРИТ, была хуже, чем ОВ больных, которые не переводились в ОРИТ (34,6 % против 58,3 %; p = 0,0013). Заключение. Поскольку на разных сроках алло-ТГСК более чем у четверти реципиентов алло-ГСК возникают угрожающие жизни осложнения, трансплантационные центры должны иметь в своем составе специализированное ОРИТ. Сепсис и СШ, возникшие в ранней фазе до приживления трансплантата, сопровождались более благоприятным отдаленным прогнозом, чем другие жизнеугрожающие осложнения. Отдаленный прогноз у реципиентов аллоГСК, у которых развились критические состояния, хуже, чем у реципиентов, которые не поступали в ОРИТ.
Ключевые слова
Для цитирования:
Щекина А.Е., Галстян Г.М., Дроков М.Ю., Кузьмина Л.А., Денисова Е.Н., Арапова Н.М., Троицкая В.В., Паровичникова Е.Н. Интенсивная терапия жизнеугрожающих осложнений у реципиентов аллогенных гемопоэтических стволовых клеток. Гематология и трансфузиология. 2022;67(3):308-327. https://doi.org/10.35754/0234-5730-2022-67-3-308-327
For citation:
Shchekina A.E., Galstyan G.M., Drokov M.Y., Kuzmina L.A., Denisova E.N., Arapova N.M., Troitskaya V.V., Parovichnikova E.N. Intensive care of life-threatening complications in allogeneic hematopoietic stem cell recipients. Russian journal of hematology and transfusiology. 2022;67(3):308-327. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-308-327
Введение
Несмотря на успехи, достигнутые при лечении заболеваний системы крови с применением трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК), летальность, связанная с трансплантацией, остается значимой проблемой [1]. По данным Европейского общества трансплантации костного мозга (European Society for Blood and Marrow Transplantation, EBMT) [2], летальность вне рецидива составляет 9,5 % при сроке наблюдения после алло-ТГСК 1 год. Основными причинами летальности вне рецидива после алло-ТГСК являются: инфекционные осложнения, реакция «трансплантат против хозяина» (РТПХ) и органная токсичность [2]. Для лечения жизнеугрожающих осложнений, возникших в перитрансплантационном периоде, около 14–34 % реципиентов аллогенных гемопоэтических стволовых клеток (алло-ГСК) нуждаются в госпитализации в отделение реанимации и интенсивной терапии (ОРИТ) [3][4]. В предыдущих исследованиях сообщалось о высокой летальности реципиентов алло-ГСК в ОРИТ, достигавшей 47–68 %, и низкой 1-летней общей выживаемости (ОВ) реципиентов алло-ГСК, которым потребовался перевод в ОРИТ, составившей 16–19 % [5][6]. Совершенствование алло-ТГСК, принципов противомикробной терапии, сопроводительной терапии и мониторинга позволили улучшить прогноз у реципиентов алло-ГСК, у которых возникли критические состояния [7]. В сравнительных исследованиях было показано, что за 15-летний период с конца 1990-х гг. летальность в ОРИТ уменьшилась c 52 до 30 % [8], а 1-летняя ОВ увеличилась с 23 до 39 % [9]. Однако подходы к госпитализации в ОРИТ, возможности интенсивной терапии критических состояний у реципиентов алло-ГСК в разных трансплантационных центрах разные [10], что сказывается на результатах лечения. Даже в передовых трансплантационных центрах летальность в ОРИТ варьирует от 35 до 51 %, а 1-летняя ОВ — от 16 до 25 % [11][12]. Данные о результатах интенсивной терапии критических состояний у реципиентов алло-ТГСК, за исключением отдельных состояний [13][14], в российских трансплантационных центрах отсутствуют. Лишь немногие зарубежные авторы сообщают об отдаленном прогнозе у этих больных [7][9]. Не разработаны общепринятые критерии перевода в ОРИТ и клинические рекомендации, посвященные лечению критических состояний у реципиентов алло-ГСК.
Цель настоящей работы — определить структуру жизнеугрожающих осложнений, факторы, способствующие их возникновению, а также краткосрочный и отдаленный прогноз у реципиентов алло-ГСК, перенесших эти осложнения.
Материалы и методы
В ретроспективное исследование включены все больные в возрасте от 18 лет и старше, которым в период с 01.01.2012 по 01.01.2022 в ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России (НМИЦ гематологии) была выполнена алло-ТГСК. Все больные были разделены на две группы: I группа — больные, у которых в перитрансплантационном периоде развились жизнеугрожающие осложнения, и они были госпитализированы в ОРИТ; II группа — больные, которым при проведении алло-ТГСК госпитализация в ОРИТ не потребовалась.
Информация о демографических, клинических и лабораторных показателях получена из электронной внутрибольничной медицинской информационной системы и архива истории болезней. Учитывали пол, возраст, гематологическое заболевание, явившееся показанием к алло-ТГСК, статус заболевания на момент выполнения алло-ТГСК (полная ремиссия (ПР), отсутствие ПР), дату алло-ТГСК, типы доноров (родственный совместимый донор (РСД), неродственный совместимый донор (НСД), неродственный частично совместимый донор (НЧСД), гаплоидентичный донор (ГИД)), источник гемопоэтических стволовых клеток (стволовые клетки крови (СКК) или костный мозг (КМ)), режимы кондиционирования (миелоаблативное кондиционирование — myeloablative conditioning, MAC, кондиционирование пониженной интенсивности — reduced intensity conditioning, RIC), режимы иммуносупрессии и профилактики РТПХ, инцидентность РТПХ, несостоятельность и гипофункцию трансплантата. В I группе регистрировали причину госпитализации в ОРИТ, сроки развития критических синдромов, сроки пребывания в ОРИТ, потребность в проведении различных методов жизнеобеспечения (искусственной вентиляции легких (ИВЛ), неинвазивной вентиляции легких (НИВЛ), заместительной почечной терапии (ЗПТ), вазопрессорной терапии), результаты лечения в ОРИТ, причины смерти в ОРИТ. Причины и сроки госпитализации в ОРИТ, результаты лечения в ОРИТ (летальность в ОРИТ) анализировали для каждого реципиента алло-ГСК и для каждой повторной госпитализации в ОРИТ. Отдаленные результаты лечения (ОВ) анализировали для каждого реципиента алло-ГСК, госпитализированного в ОРИТ.
Основные понятия. Первой госпитализацией в ОРИТ считали первое поступление в ОРИТ, начиная с периода кондиционирования. Повторной госпитализацией в ОРИТ считали вторую и последующую госпитализации в ОРИТ после выписки из ОРИТ. При госпитализации в ОРИТ больной мог иметь несколько критических синдромов, однако причиной госпитализации считали те состояния, которые послужили непосредственным поводом для наблюдения и лечения в условиях ОРИТ. К посттрансплантационному периоду отнесены события, произошедшие от момента трансфузии трансплантата до даты последнего контакта с больным или его смерти [15]; перитрансплантационный период включал события, произошедшие от момента начала предтрансплантационного кондиционирования, и события посттрансплантационного периода. Под летальностью вне рецидива понимали смерти, которые произошли без предшествующего рецидива, и рассматривали их как конкурирующие события рецидиву [16].
Критические синдромы, явившиеся причинами перевода в ОРИТ, устанавливали ретроспективно: сепсис, септический шок (СШ), острая дыхательная недостаточность (ОДН), неврологические нарушения, кардиальные нарушения (аритмии, инфаркт миокарда, гидроперикард), остановка сердца, желудочно-кишечное кровотечение (ЖКК), острая печеночная недостаточность (ОПечН), острое повреждение почек (ОПП), гипотония вследствие дегидратации, острая надпочечниковая недостаточность, тромботическая микроангиопатия (ТМА). Диагнозы сепсис и СШ устанавливали в соответствии с международными критериями [17]. К ОДН относили гипоксемию, критериями которой были уменьшение соотношения парциального напряжения кислорода в артериальной крови (PaO2) к фракции вдыхаемого кислорода (FiO2) (PaO2/FiO2) < 300, а также гиперкапнию (PaСO2 > 50 мм рт. ст.) [18]. ОПечН определяли на основании клинических рекомендаций Европейской ассоциации изучения печени (European Association for the Study of the Liver, EASL) [19]. ОПП диагностировали по критериям Инициативы по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGO) [20]. ТМА диагностировали согласно критериям ТМА B. Cho и соавт. [21]. К неврологическим нарушениям относили угнетение или изменения сознания, остро возникшую очаговую, общемозговую или менингеальную неврологическую симптоматику, судорожный синдром. Несостоятельность и гипофункцию трансплантата устанавливали в соответствии с критериями EBMT [22].
Статистический анализ. Статистический анализ данных проводили с использованием статистического пакета R и графической оболочки RStudio, а также пакетов ggplot2, survival, survminer, cmprsk, dplyr. Для описания данных были использованы методы описательной статистики. В таблицах данные представлены в виде медианы и межквартильного интервала (МКИ). Для анализа таблиц сопряженности более чем 2×2 был использован критерий χ 2, для анализа таблиц 2×2 — точный тест Фишера. Для оценки общей выживаемости был использован метод Каплана — Мейера. Для сравнения кривых применялся лог-ранк-тест. Для анализа влияния перенесенных критических состояний, для лечения которых потребовался перевод в ОРИТ, на отдаленные результаты лечения реципиентов алло-ГСК и сравнения их с группой больных, которые не госпитализировались в ОРИТ, использовали лэндмарк-анализ, где за время лэндмарка принимали медиану госпитализации в ОРИТ. При оценке кумулятивной частоты госпитализации в ОРИТ был использован метод конкурирующих рисков. В качестве конкурирующего риска рассматривалась смерть, для сравнения двух и более кривых был использован тест Грея. Анализ прогностических факторов в событийном анализе проводили с использованием модели пропорциональных рисков Кокса, в которой для каждой независимой переменной была выбрана опорная группа в качестве группы сравнения для вычисления отношения рисков. Порог статистической значимости р во всех тестах был принят равным 0,05.
Результаты
Характеристика реципиентов алло-ГСК и факторы риска перевода в ОРИТ
За период с 01.01.2012 по 01.01.2022 было проведено 744 алло-ТГСК у 652 больных (344 женщины, 308 мужчин), медиана возраста которых была 36 лет (МКИ — 27–45 лет) (табл. 1). Госпитализация в ОРИТ потребовалась 174 (26,7 %) реципиентам алло-ГСК (82 женщины, 92 мужчины) с медианой возраста 37 лет. Причем 36 больных поступали в ОРИТ два раза, 11 больных — 3 раза, 4 больных — 4 раза. Всего было 226 госпитализаций в ОРИТ.
Общая вероятность госпитализации в ОРИТ реципиентов алло-ГСК в течение всего времени наблюдения после первой алло-ТГСК составила 30,8 %, вероятность госпитализации в ОРИТ в течение первых 100 дней с момента первой алло-ТГСК — 10,5 %. В течение первого года после алло-ТГСК наблюдался наибольший прирост кумулятивной частоты госпитализации в ОРИТ, который в дальнейшем оставался на плато (рис. 1A). Летальность вне рецидива для всех реципиентов алло-ТГСК составила 37,5 %. Кривая вероятности летальности вне рецидива была схожа с кривой вероятности госпитализации в ОРИТ (рис. 1 Б).
Среди 53 больных острыми лейкозами, которым алло-ТГСК была выполнена вне ремиссии, в ОРИТ были переведены 24 (45 %) человека, т. е. почти половина, в то время как среди 419 больных, которым алло-ТГСК была выполнена в полной ремиссии, — 104 (24,8 %) больных (р = 0,03), среди 110 реципиентов алло-ГСК от неродственных частично совместимых доноров в ОРИТ перевели 38 (34,5 %) больных, в то время как частота перевода в ОРИТ реципиентов алло-ГСК от родственных совместимых доноров составила 17,7 % (n = 38/215, р = 0,001); из 220 больных, у которых развилась острая РТПХ, 84 (38,1 %) были переведены в ОРИТ, а среди 432 больных, у которых не было острой РТПХ, в ОРИТ перевели в 2 раза меньше — 90 (20,8 %) человек (р < 0,001) (табл. 1).
Согласно данным многофакторного анализа (рис. 2), значимыми факторами риска перевода больных в ОРИТ были: выполнение алло-ТГСК у больных острыми лейкозами, у которых не была достигнута ремиссия, по сравнению с больными, у которых алло-ТГСК была выполнена в состоянии ремиссии (отношение рисков (ОР) = 2,10; 95%-ный доверительный интервал (95% ДИ): 1,28–3,44; p = 0,003); выполнение алло-ТГСК без предшествующего кондиционирования (по причине аплазии кроветворения после проведения противорецидивных курсов) по сравнению с RIC (ОР = 30,63; 95% ДИ: 8,787–107,04; p < 0,001), развитие острой РТПХ по сравнению с теми, у кого не было острой РТПХ (ОР = 2,04; 95% ДИ: 1,459–2,85; p < 0,001), несостоятельность (ОР = 2,51; 95% ДИ: 1,58–3,97; p < 0,001) и гипофункция трансплантата (ОР = 2,85; 95% ДИ: 1,6–5,05; p < 0,001) по сравнению с отсутствием таких нарушений. Выполнение алло-ТГСК от неродственных частично совместимых доноров почти в 2 раза увеличивало риск по сравнению с родственными совместимыми донорами, однако статистически незначимо в данной модели (ОР = 1,74; 95% ДИ: 0,947–3,19; p = 0,075). Использование режимов профилактики РТПХ без включения АТГ или циклофосфамида в посттрансплантационном периоде (ПТ-ЦФ) и без αβTCR-деплеции уменьшало риск госпитализации в ОРИТ (ОР = 0,35; 95% ДИ: 0,159–0,78; p = 0,01).
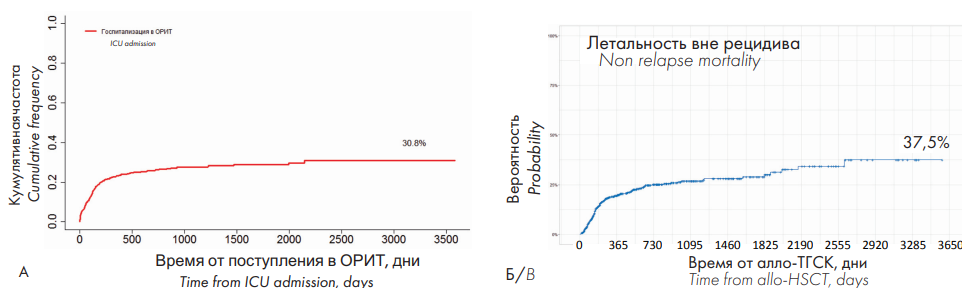
Рисунок 1. A — общая вероятность госпитализации в ОРИТ для реципиентов алло-ГСК; Б — летальность вне рецидива для реципиентов алло-ГСК
Figure 1. A — ICU admission rate for allo-HSCs recipients; B — non-relapse mortality rate for allo-HSCs recipients
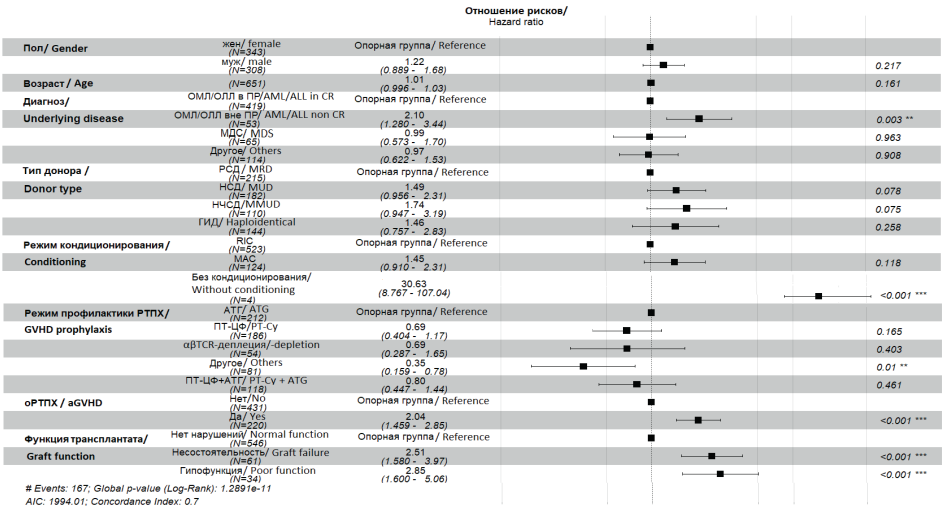
Рисунок 2. Факторы риска госпитализации в ОРИТ после алло-ТГСК (модель пропорциональных рисков Кокса)
Примечание: аббревиатуры — см. табл. 1.
Figure 2. Risk factors of ICU admission after allo-HSCT (Cox proportional hazards model)
Note: abbreviations — see Table 1.
Сроки и причины госпитализации в ОРИТ
Учитывали сроки и причины всех госпитализаций в ОРИТ (n = 226), включая 51 повторную госпитализацию. Медиана времени от выполнения первой алло-ТГСК до госпитализации в ОРИТ составила 100 дней (МКИ — 28–192 дней). Наибольшее количество госпитализаций в ОРИТ состоялось в первый год после выполнения первой алло-ТГСК — 83 %, причем 44 % — в течение первых 100 дней. В течение года после первой трансплантации реципиенты алло-ГСК, полученных от гаплоидентичных доноров, поступили в ОРИТ в более ранние сроки с медианой +30 дней (МКИ — 6–85 дней) по сравнению с реципиентами алло-ГСК, полученных от других типов доноров: от родственных совместимых доноров — +108 дней (МКИ — 4–140 дней) (p = 0,046), от неродственных совместимых доноров — +96 дней (МКИ — 45–172 дней) (p < 0,001), от неродственных частично совместимых доноров — +87 дней (МКИ — 34–145 дней) (p = 0,033).
Выявлены также различия в сроках госпитализации в ОРИТ в зависимости от режимов профилактики РТПХ (p < 0,0001). При попарном сравнении в случаях, когда для профилактики РТПХ использовали режимы, содержавшие АТГ (n = 91), госпитализации в ОРИТ происходили в более поздние сроки (медиана — +149 день; МКИ — 93–360 дней), чем когда использовались режимы профилактики РТПХ на основе ПТ-ЦФ (n = 51) (медиана — +52 день; МКИ — 16–319 дней) (p < 0,0001), и когда для профилактики РТПХ применялась αβTCR-деплеция (n = 22) (медиана — +56 день; МКИ — 6–131 день) (p = 0,012). Госпитализации в ОРИТ после алло-ТГСК, при которых для профилактики РТПХ применялся режим, содержавший ПТ-ЦФ в сочетании с АТГ (n = 31), также происходили в более поздние сроки (медиана — +166 день; МКИ — 105–394 дня) в сравнении с госпитализациями в ОРИТ после алло-ТГСК, при которых для профилактики РТПХ применялись режимы на основе только ПТ-ЦФ (n = 51) (медиана — +52 день; МКИ — 16–319 дней) (p = 0,016).
Главными причинами перевода в ОРИТ были сепсис и/или СШ (27,9 %), ОДН (23,9 %), неврологические нарушения (17,7 %), которые возникали значимо чаще, чем все остальные причины (p = 0,045) (табл. 2).
Таблица 1. Характеристика госпитализированных и негоспитализированных в ОРИТ реципиентов алло-ГСК
Table 1. ICU admitted and ICU non-admitted allo-HSC recipients’ characteristics
|
Характеристика Characteristics |
Реципиенты, госпитализированные в ОРИТ ICU admitted allo-HSC recipients |
Реципиенты, негоспитализированные в ОРИТ ICU non-admitted allo-HSC recipients |
p |
|
n = 174 (26,7 %) |
n = 478 (73,3 %) |
|
|
|
Возраст, годы, Ме (МКИ) Age, years, Me (IQR) |
37 (29–48) |
36 (27–44) |
0,1 |
|
Женский пол/Female, n (%) |
82 (47,1) |
262 (54,8) |
0,098 |
|
Диагноз/Underlying disease, n (%) |
|
|
|
|
ОМЛ/ОЛЛ в ПР/AML/ALL in CR |
104 (59,8) |
315 (65,9) |
0,179 |
|
ОМЛ/ОЛЛ вне ПР/AML/ALL in non CR |
24 (13,8) |
29 (6,1) |
0,003 |
|
МДС/MDS |
16 (9,2) |
49 (10,3) |
0,79 |
|
Другое/Other |
30 (17,2) |
85 (17,8) |
0,95 |
|
Тип донора/Donor type, n (%) |
|
|
|
|
РСД/MRD |
38 (21,8) |
177 (37,0) |
< 0,01 |
|
НСД/MUD |
61 (35,1) |
122 (25,5) |
0,021 |
|
НЧСД/MMUD |
38 (21,8) |
72 (15,1) |
0,057 |
|
ГИД/Haploidentical |
37 (21,3) |
107 (22,4) |
0,847 |
|
Источник трансплантата/Graft source, n (%) |
|
|
|
|
КМ/BM |
68 (39,1) |
200 (41,8) |
0,596 |
|
СКК/PBSC |
106 (60,9) |
277 (57,9) |
0,55 |
|
Пуповинная кровь/Umbilical cord |
0 (0) |
1 (0,2) |
0,571 |
|
Кондиционирование/Conditioning, n (%) |
|
|
|
|
RIC |
137 (78,7) |
387 (81,0) |
0,587 |
|
MAC |
33 (19,0) |
91 (19,0) |
0,91 |
|
Без кондиционирования/Without conditioning |
4 (2,3) |
0 (0) |
0,006 |
|
Профилактика РТПХ/GVHD prophylaxis, n (%) |
|
|
|
|
АТГ/ATG |
70 (40,2) |
142 (29,7) |
0,015 |
|
ПТ-ЦФ + АТГ/PT-Cy + ATG |
41 (23,6) |
77 (16,1) |
0,037 |
|
ПТ-ЦФ/PT-Cy |
38 (21,8) |
149 (31,2) |
0,024 |
|
αβTCR-деплеция/αβTCR-depletion |
14 (8,0) |
40 (8,4) |
0,997 |
|
Другое/Other |
11 (6,3) |
70 (14,6) |
0,007 |
|
Острая РТПХ/Acute GVHD, n (%) |
84 (48,3) |
136 (28,5) |
<0,01 |
|
Функция трансплантата/Graft function, n (%) |
|
|
0,17 |
|
Несостоятельность трансплантата/Graft failure |
36 (20,7) |
20 (4,2) |
|
|
Гипофункция трансплантата/Poor graft function |
19 (10,9) |
11 (2,3) |
Notes: AML — acute myeloid leukemia, ALL — acute lymphoblastic leukemia, MDS — myelodysplastic syndrome, CR — complete remission, MRD — matched related donor, MUD — matched unrelated donor, MMUD — mismatched unrelated donor, BM — bone marrow, PBSC — peripheral blood stem cell, RIC — reduced intensity conditioning, MAC — myeloablative conditioning, GVHD — graft-versus-host disease, ATG — antithymocyte globulin, PT-Cy — post-transplant cyclophosphamide.
Таблица 2. Госпитализации в ОРИТ (n = 226) в зависимости от причин и периодов алло-ТГСК
Table 2. ICU admissions (n = 226) by ICU admission reasons and periods of allo-HSCT
|
Причина перевода ICU admission reason |
Периоды алло-ТГСК, дни Periods of allo-HSCT, days |
Всего Total, n |
|||
|
Конд./Cond. |
0 — +30 |
+30 — +100 |
> +100 |
||
|
Сепсис/СШ/Sepsis/Septic shock, n (%) |
3 (5) |
17 (27) |
15 (24) |
28 (44) |
63 |
|
Гипоксемическая ОДН/Hypoxemic ARF, n (%) |
2 (4) |
10 (19) |
13 (25) |
29 (54) |
54 |
|
Гиперкапническая ОДН/Hypercapnic ARF, n (%) |
0 (0) |
0 (0) |
0 (0) |
7 (100) |
7 |
|
Неврологические нарушения/Neurological disorders |
|
|
|
|
|
|
Инфекция ЦНС/CNS infection, n (%) |
0 (0) |
2 (11) |
0 (0) |
15 (88) |
17 |
|
Геморрагический инсульт/Intracranial hemorrhage, n (%) |
0 (0) |
2 (29) |
3 (42) |
2 (29) |
7 |
|
Ишемический инсульт/Ischemic stroke, n (%) |
1 (33) |
0 (0) |
2 (67) |
0 (0) |
3 |
|
Нейротоксичность/Neurotoxicity, n (%) |
0 (0) |
2 (67) |
0 (0) |
1 (33) |
3 |
|
Прочее/Other, n (%) |
1 (10) |
1 (10) |
3 (30) |
5 (50) |
10 |
|
Кардиологические нарушения/Cardiac disorders |
|
|
|
|
|
|
Аритмии/Arrhythmia, n (%) |
0 (0) |
7 (58) |
1 (8) |
4 (34) |
12 |
|
Инфаркт миокарда/MI, n (%) |
0 (0) |
0 (0) |
0 (0) |
1 (100) |
1 |
|
Гидроперикард/Pericardial effusion, n (%) |
0 (0) |
0 (0) |
1 (33) |
2 (67) |
3 |
|
Остановка сердца/Cardiac arrest, n (%) |
0 (0) |
2 (20) |
2 (20) |
6 (60) |
10 |
|
ЖКК/GI bleeding, n (%) |
0 (0) |
0 (0) |
2 (15) |
11 (85) |
13 |
|
ОПечН/ALF, n (%) |
0 (0) |
1 (10) |
4 (40) |
5 (50) |
10 |
|
ОПП/AKI, n (%) |
0 (0) |
0 (0) |
2 (40) |
3 (60) |
5 |
|
ТМА/TMA, n (%) |
0 (0) |
0 (0) |
1 (33) |
2 (67) |
3 |
|
Гиповолемия/Hypovolemia, n (%) |
0 (0) |
0 (0) |
0 (0) |
4 (100) |
4 |
|
Надпочечниковая недостаточность/Adrenal insufficiency, n (%) |
0 (0) |
0 (0) |
1 (100) |
0 (0) |
1 |
|
Всего/Total, n (%) |
7 (3) |
44 (20) |
50 (22) |
125 (55) |
226 |
Notes: Cond. — conditioning, ARF — acute respiratory failure, MI — myocardial infarction, CNS — central nervous system, GI — gastrointestinal, ALF — acute liver failure, AKI — acute kidney injury, TMA — thrombotic microangiopathy.
Во время проведения кондиционирования поступило 7 больных, все они находились в состоянии миелотоксического агранулоцитоза, причиной их перевода в ОРИТ в 3 случаях был СШ, в 2 — неврологические нарушения (тромбоз синусов головного мозга; острый психоз), в 2 — ОДН, вызванная пневмонией. Причем один из больных с пневмонией, вызванной Pseudomonas aeruginosa, поступил в ОРИТ на –3-й день предтрансплантационного кондиционирования, после перевода у него развился СШ, который послужил причиной смерти в день поступления. Алло-ТГСК ему не выполнена, поэтому он не был включен в дальнейший анализ.
В ранней фазе до приживления (от дня 0 до +30 дня) было 44 госпитализации, 4 из них — в день трансфузии алло-ГСК. Одна больная поступила в связи с развитием судорожного синдрома, возникшего сразу после трансфузии первой порции костномозговой взвеси. Трое больных переведены в ОРИТ непосредственно перед плановой трансфузией алло-ГСК: двое находились в состоянии сепсиса, вызванного Pseudomonas aeruginosa, у одной больной была пневмония, приведшая к ОДН, и инфекция кровотока, вызванная Klebsiella pneumoniae. Всем больным, несмотря на жизнеугрожающие осложнения, были выполнены алло-ТГСК (эти клинические наблюдения были описаны ранее [23]). В ранней фазе до приживления в более чем в половине случаев причинами перевода в ОРИТ явились инфекционные осложнения: в 17 (38,6 %) из 44 случаев — сепсис/СШ и в 10 (22,7 %) из 44 — пневмонии, приведшие к развитию ОДН, реже — неврологические осложнения, аритмии. На развитие осложнений, возникших в эту фазу, оказали влияние тип донора и режим профилактики РТПХ: среди реципиентов с СШ было 8 человек, перенесших гапло-ТГСК, среди них у 5 реципиентов до развития СШ была выполнена αβTCR-деплеция, 6 больных — после алло-ТГСК от неродственных доноров и только 3 больных — алло-ТГСК от родственных совместимых доноров. Из 7 больных, которые были переведены в связи с аритмией, 5 перенесли гапло-ТГСК, и у 3 из них в качестве профилактики РТПХ применяли циклофосфамид (больные поступили в ОРИТ после +3 дня).
В ранней фазе после приживления (от +30 дня до +100 дня) было 50 госпитализаций в ОРИТ, основными причинами которых были также инфекционные осложнения, а именно, сепсис/СШ (30 %; n = 15/50) и ОДН вследствие пневмонии (26 %; n = 13/50), а также неврологические нарушения (16 %; n = 8/50). Более редкими причинами были ОПечН (веноокклюзионная болезнь, РТПХ с поражением печени, инфекция), аритмии, гидроперикард, внезапная остановка сердца, ОПП, ЖКК, острая надпочечниковая недостаточность, ТМА (табл. 2).
Структура причин госпитализаций в ОРИТ (n = 125) в поздней фазе после приживления изменилась: увеличилась доля ОДН как основной причины поступления в ОРИТ, причем поражения легких в этой фазе возникали не только вследствие инфекции, но и РТПХ с поражением легких (7 из 35 случаев). Чаще стали переводиться больные в связи с ЖКК, обусловленными РТПХ с поражением кишечника (11 случаев, медиана госпитализации в ОРИТ — +141 день). Сепсис стал второй главной причиной перевода в ОРИТ (28 случаев), доля неврологических нарушений не изменилась. Редкими причинами госпитализации в ОРИТ были кардиальные нарушения, ОПечН, ОПП, гиповолемия, ТМА (2 случая у больных с РТПХ кишечника и инфекционными осложнениями).
Краткосрочные результаты лечения критических синдромов у реципиентов алло-ГСК в ОРИТ
В респираторной поддержке в виде НИВЛ или ИВЛ во время первой госпитализации в ОРИТ нуждались 131 (75,3 %) из 174 реципиентов алло-ГСК (рис. 3). Показаниями для начала респираторной поддержки были ОДН и нарушения сознания. Основными причинами ОДН были пневмонии, кардиогенный отек легких, РТПХ легких, трансфузионные реакции. У большинства больных одновременно было несколько показаний для проведения респираторной поддержки. У 66 (50,4 %) из 131 больного респираторная поддержка была начата в день поступления в ОРИТ. В течение всего времени пребывания в ОРИТ НИВЛ проводили 34 больным из 174 (19,5 %): у 9 больных удалось избежать интубации трахеи, и им проводили только НИВЛ, у 8 (88,9 %) из них она завершена успешно; у 25 больных, у которых НИВЛ была неэффективна, выполнена интубация трахеи и начата ИВЛ, только 6 (24 %) из этих 25 больных были выписаны из ОРИТ. Всего ИВЛ за все время наблюдения в ОРИТ проводили 97 (55,7 %) из 174 больных, лишь у 19 из 97 (19,6 %) удалось выполнить отлучение от ИВЛ. Всего респираторная поддержка (НИВЛ и ИВЛ) в ОРИТ была завершена успешно только у 27 (20,6 %) из 131 больного, ее получавшего. Двум реципиентам алло-ГСК в связи с рефрактерной гипоксемией на фоне тотального легочного поражения в раннем посттрансплантационном периоде проводили экстракорпоральную мембранную оксигенацию (ЭКМО), 1 из них был отлучен от ЭКМО, однако умер впоследствии от кардиальных осложнений.

Рисунок 3. Респираторная поддержка у реципиентов алло-ГСК в ОРИТ. НИВЛ — неинвазивная вентиляция легких, ИВЛ — искусственная вентиляция легких, ОРИТ — отделение реанимации и интенсивной терапии
Figure 3. Respiratory support in allo-HSCs recipients. NIV — noninvasive ventilation, MV — mechanical ventilation, ICU — intensive care unit
Терапию вазопрессорами (норадреналин, адреналин, терлипрессин) с момента поступления в ОРИТ получили 58 из 174 больных (33,3 %), показаниями к ее проведению были СШ, острая сердечная недостаточность, остановка сердца, ЖКК. У 26 (44,8 %) из них она была завершена успешно, и больные в последующем были выписаны из ОРИТ. По мере наблюдения в ОРИТ больным начинали или возобновляли лечение вазопрессорами в случае дальнейшего или повторного ухудшения, при прогрессии синдрома полиорганной недостаточности, в том числе при развитии терминальных состояний. Всего за время пребывания в ОРИТ вазопрессоры получили 103 больных (59,2 %), только 29 (28,1 %) из них были выписаны из ОРИТ, что хуже, чем при возникновении потребности в терапии вазопрессорами с первых суток наблюдения в ОРИТ (p = 0,045), и хуже, чем без потребности в вазопрессорах (выписаны 66 (92,9 %) из 71 больного) (p < 0,001).
ЗПТ в режиме гемодиализа, продленной веновенозной гемодиафильтрации проводили по почечным (олигурия, анурия, азотемия, гиперкалиемия) и внепочечным (сепсис, метаболические и/или водно-электролитные нарушения, волемическая перегрузка и др.) показаниям у 62 из 174 больных (59,6 %). Чаще ее начинали не в день перевода, а во время последующего наблюдения в ОРИТ, так на 3-и сутки пребывания в ОРИТ ЗПТ проводили у 25 больных. Выжили 12 из 62 больных (19,4 %), которым проводили ЗПТ, в то время как среди тех, кому ЗПТ не проводили, выжили 83 (74,1 %) из 112 больных (p < 0,001).
Больные наблюдались в ОРИТ от 1 до 159 сут. (медиана — 7 сут., МКИ — 3–19 сут.). В ОРИТ умерли 80 из 174 больных (45,9 %) во время первой госпитализации, и еще 24 человека — во время повторных госпитализаций в ОРИТ. Суммарно с учетом повторных госпитализаций в ОРИТ умерли 59,8 % больных. От момента первой госпитализации в ОРИТ 30-дневная летальность составила 37 %, 100-дневная летальность — 45,7 %. Среди реципиентов алло-ГСК, переведенных в ОРИТ по причине сепсиса, ОДН, неврологических нарушений, были выписаны 68 %, 48 % и 58 % соответственно. Из 7 больных с РТПХ с поражением легких из ОРИТ был выписан только 1 больной. Среди 13 госпитализаций в ОРИТ по причине ЖКК вследствие РПТХ с поражением кишечника, выписка из ОРИТ состоялась в 5 случаях. Все случаи ТМА (n = 3), при которых потребовалось проведение интенсивной терапии, являлись отражением общего неблагополучия больных и имели летальный исход. По мере наблюдения больных в ОРИТ, структура критических синдромов менялась, регрессировали одни осложнения, возникали другие. В итоге причиной смерти больных в ОРИТ в 71 % случаев был СШ. Другими причинами смерти были острое нарушение мозгового кровообращения (n = 9), включая инфекционное поражение головного мозга, ЖКК по причине неконтролируемой РТПХ с поражением кишечника (n = 8), прогрессия ОДН (n = 7), кардиогенный шок (n = 3), прогрессия заболевания (n = 2) и 1 случай вторичного гемофагоцитарного синдрома, который развился по причине посттрансплантационного лимфопролиферативного заболевания, ассоциированного с Эпштейна-Барр вирусной инфекцией.
Прогноз в ОРИТ зависел от сроков, на которые возникли критические состояния, и от потребности в применении методов жизнеобеспечения. Развитие критических состояний на сроке после +30 дня (ОР = 3,06; 95% ДИ: 1,38–6,8; p = 0,006) и после +100 дня (ОР = 3,27; 95% ДИ: 1,53–7,01; p = 0,002) в 3 раза увеличивало риск летального исхода в ОРИТ при многофакторном анализе. Отсутствие потребности в проведении ИВЛ (ОР = 0,54; 95% ДИ: 0,29–1,00; p = 0,048) и вазопрессорной терапии (ОР = 0,35; 95% ДИ: 0,2–0,62; p < 0,001) уменьшало летальность в ОРИТ, в то время как ситуации, в которых ЗПТ не проводилась, напротив, ассоциировались с увеличением летальности в ОРИТ (ОР = 2,0; 95% ДИ: 1,22–3,28; p < 0,006). Выполнение алло-ТГСК от неродственных частично совместимых доноров в 1,9 раза увеличивало риск смерти в ОРИТ по сравнению с родственными совместимыми донорами, однако статистически незначимо в данной модели (ОР = 1,89; 95% ДИ: 0,97–3,70; p = 0,062). Демографические характеристики больных и причины перевода в ОРИТ не влияли на летальность в ОРИТ (рис. 4).
Отдаленные результаты лечения реципиентов алло-ГСК в ОРИТ
При лэндмарк-анализе отдаленных результатов интенсивной терапии, в котором точкой отсчета была принята медиана времени от выполнения алло-ТГСК до госпитализации в ОРИТ, составившей +100 дней, ОВ реципиентов алло-ГСК, госпитализированных в ОРИТ, составила 13,8 % при сроке наблюдения 9 лет, в то время как ОВ реципиентов алло-ГСК, которым госпитализация в ОРИТ не требовалась, — 60,2 % (p < 0,0001) (рис. 5). При анализе ОВ в зависимости от развития критических синдромов, которые послужили причиной перевода в ОРИТ, было выявлено, что инфекционные осложнения, такие как сепсис и СШ, прогностически были наиболее благоприятными — отдаленная ОВ составила 28 % (рис. 6).
Причем прогноз при лечении инфекционных осложнений в ОРИТ в случае их развития до +30 дня был значимо лучше (ОВ — 43,8 %), чем при их развитии после +30 дня и после +100 дня (ОВ — менее 22,2 %) (p = 0,046) (рис. 7). В то же время ОВ больных с тяжелой ОДН составила всего 5,4 %, причем среди больных, страдавших РТПХ с поражением легких, в долгосрочной перспективе выжил только 1 больной (период наблюдения после выписки из ОРИТ — 13 месяцев). Все больные, поступившие в ОРИТ с ЖКК в результате неконтролируемой РТПХ с поражением кишечника, умерли в первые месяцы наблюдения (р = 0,015) (рис. 6).
Больные, которые были успешно пролечены и выписаны из ОРИТ, проанализированы отдельно. Их ОВ была хуже в сравнении с ОВ реципиентов алло-ГСК, которые не переводились в ОРИТ (34,6 % против 58,3 %; p = 0,0013), что было связано с «негативной селекцией» больных группы ОРИТ, которая отразилась на отдаленных результатах лечения. Отдаленные результаты выполнения алло-ТГСК в периоды 2012–2017 гг. и 2017–2022 гг. не различались (p = 0,16).
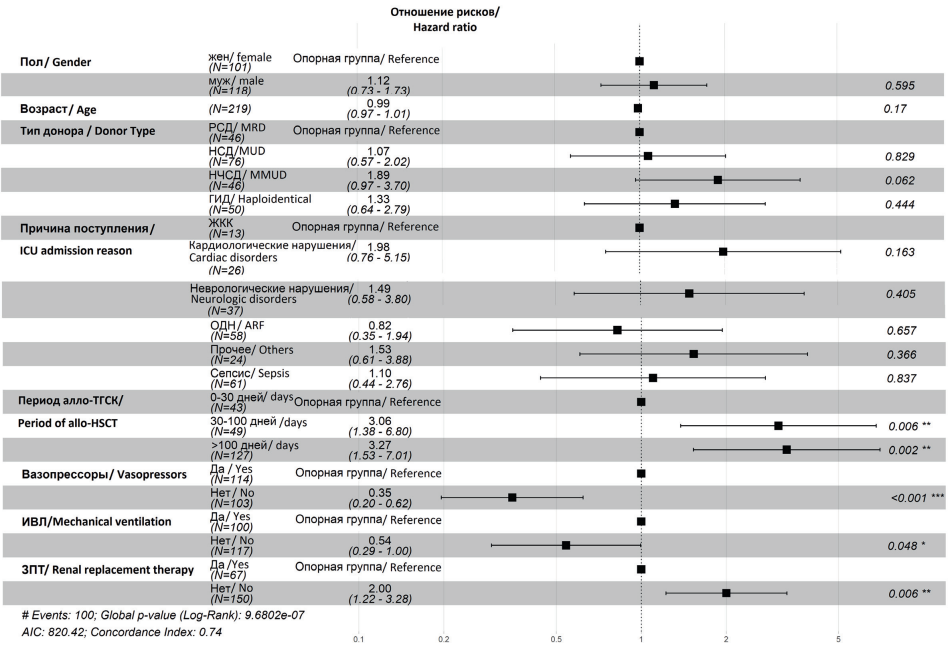
Рисунок 4. Факторы риска летальности реципиентов алло-ГСК в ОРИТ (модель пропорциональных рисков Кокса). ОР — отношение рисков, ДИ — доверительный интервал, НСД — неродственный совместимый донор, НЧСД — неродственный частично совместимый донор, ГИД — гаплоидентичный донор, ОРИТ — отделение реанимации и интенсивной терапии, СШ — септический шок, ОДН — острая дыхательная недостаточность, ИВЛ — искусственная вентиляция легких, ЗПТ — заместительная почечная терапия
Figure 4. Risk factors of ICU mortality after allo-HSCT (Cox proportional hazards model). HR — hazard ratio, CI — confidence interval, MUD — matched unrelated donor, MMUD — mismatched unrelated donor, ICU — intensive care unit, ARF — acute respiratory failure
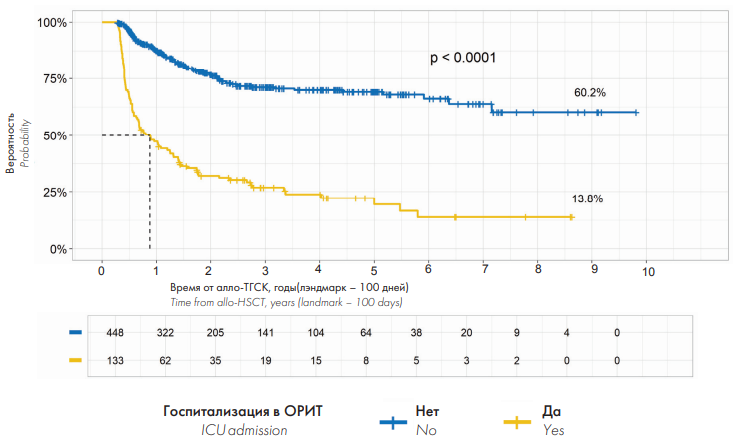
Рисунок 5. Лэндмарк-анализ общей выживаемости реципиентов алло-ГСК, госпитализированных и негоспитализированных в ОРИТ
Figure 5. Landmark analysis of overall survival rate of ICU admitted and ICU non-admitted allo-HSCs recipients

Рисунок 6. Общая выживаемость реципиентов алло-ГСК в зависимости от критических синдромов. ЖКК — желудочно-кишечное кровотечение, ОДН — острая дыхательная недостаточность
Figure 6. Overall survival rate of critical allo-HSCs recipients. GI — gastrointestinal, ARF — acute respiratory failure
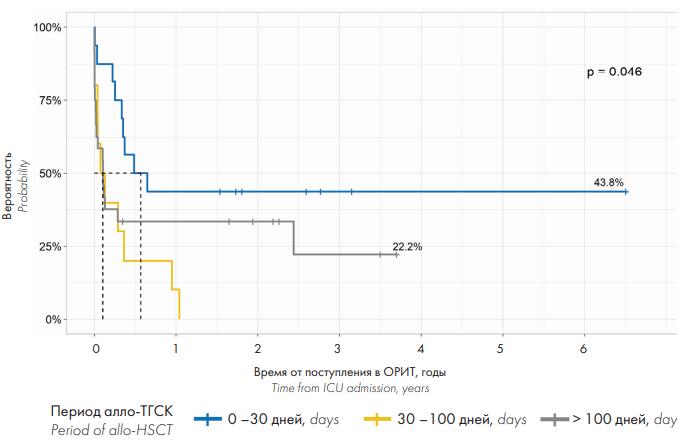
Рисунок 7. Общая выживаемость реципиентов алло-ГСК в зависимости от сроков развития сепсиса и СШ
Figure 7. Overall survival rate by sepsis/septic shock onset time
Обсуждение
Развитие жизнеугрожающих осложнений при выполнении алло-ТГСК — серьезное событие для реципиента алло-ГСК. Прогноз у реципиентов алло-ГСК, переведенных в ОРИТ, остается наиболее неблагоприятным среди больных заболеваниями системы крови [24]. С ростом трансплантационной активности в мире возрастает потребность в подробном анализе осложнений, в том числе жизнеугрожающих, имея под собой идею уменьшения летальности, связанной с трансплантацией, и улучшения результатов выполнения алло-ТГСК [25]. В настоящей работе проведено первое подобное исследование в России, которое оценило потребность в оказании реанимационной помощи в трансплантационном центре, структуру и факторы, способствующие возникновению жизнеугрожающих осложнений, а также результаты их интенсивной терапии у реципиентов алло-ГСК. При анализе осложнений, возникших при алло-ТГСК за 10 лет — с 2012 по 2022 гг., выявлено, что более четверти больных (26,7 %) на разных этапах перитрансплантационного периода нуждались в наблюдении и лечении в условиях ОРИТ, что сопоставимо с данным других исследований, выполненных за аналогичный период, в которых частота переводов в ОРИТ варьировала от 14 до 25 % [3][26].
В настоящем исследовании больные острыми лейкозами, у которых на момент выполнения алло-ТГСК не была достигнута полная ремиссия, больные, которым алло-ТГСК проводилась без предшествующего кондиционирования, от неродственных частично совместимых доноров, а также больные с острой РТПХ и несостоятельностью/гипофункцией трансплантата имели наибольшую вероятность развития жизнеугрожающих осложнений. Ю. С. Осиповым и соавт. [14] было показано, что неблагоприятные исходы сепсиса, возникшего после алло-ТГСК, выполняемой при рефрактерном течении основного заболевания и отсутствии ремиссии, обусловлено предшествующим лечением с большим числом линий противоопухолевой терапии, более длительным периодом нейтропении и селекцией штаммов микроорганизмов с лекарственной устойчивостью. Это подтверждается и другим исследованием [27], по данным которого прогрессия онкогематологического заболевания к моменту выполнения алло-ТГСК в 2 раза увеличивала риск госпитализации в ОРИТ. Выполнение алло-ТГСК у больных, у которых не была достигнута ремиссия онкогематологического заболевания, — это относительно редкое событие: в настоящей работе подобная ситуация наблюдалась лишь у 53 (8,1 %) из 652 больных. Однако другие факторы риска развития жизнеугрожающих осложнений, такие как использование HLA-несовместимых доноров, развитие острой РТПХ, несостоятельность/гипофункция трансплантата, встречались чаще, соответственно в 39,0 %, 33,7 % и 14,4 % (табл. 1) [28]. Вероятно, риск развития опасных для жизни осложнений у этих больных также опосредован тяжелыми инфекционными осложнениями и связан с необходимостью более интенсивной иммуносупрессии. В работе М. И. Ахмедова и соавт. [29] отмечено, что алло-ТГСК от неродственных частично совместимых доноров сопровождалась более высокой частотой первичной несостоятельности трансплантата и более продолжительным периодом нейтропении, что приводило к увеличению частоты инфекций кровотока. В настоящем исследовании в качестве факторов риска анализировали характеристики больных, а не трансплантаций, но можно предположить, что наряду с риском, который несет несостоятельность трансплантата, актуален и риск, связанный с повторными алло-ТГСК, наиболее частыми показаниями к которой являются рецидивы после алло-ТГСК и несостоятельность трансплантата [30]. Развитие РТПХ, в свою очередь, сопровождается прямым повреждением органов, нарушением целостности барьеров слизистых оболочек, необходимостью проведения иммуносупрессии и органной токсичностью препаратов, применяемых для ее контроля [31][32]. Таким образом, выявленные факторы риска развития жизнеугрожающих осложнений у реципиентов алло-ГСК чаще всего реализуются инфекционными осложнениями. Это подтверждается и структурой критических синдромов, послужившими причинами перевода в ОРИТ, среди которых сепсис и ОДН вследствие пневмоний занимали лидирующие позиции, в совокупности превышая 50 %, что согласуется с данными других исследований [6][7][12][32]. Кроме того, нередко такие причины госпитализации в ОРИТ, как неврологические нарушения, аритмии, ОПП, ОПечН, ТМА, также сопровождались или были вызваны инфекционными осложнениями. Причем особенности развития и течения критических состояний были связаны с особенностями и этапами трансплантации. Развитие критических состояний в период кондиционирования и непосредственно перед трансфузией трансплантата может быть неожиданным событием, поскольку обычно кондиционирование начинается в наиболее оптимальном предтрансплантационном статусе, в отсутствии серьезных инфекционных осложнений и при хорошем общесоматическом состоянии, за исключением редких ситуаций, когда алло-ТГСК выполняется в рамках «терапии спасения». Тем не менее около 2 % реципиентов алло-ГСК поступают в ОРИТ именно в этот период [27]. В настоящем исследовании в этот период в ОРИТ поступили 11 человек (1,7 % от всех реципиентов алло-ТГСК), у 8 из них развилась тяжелая инфекция, протекающая с сепсисом и ОДН. Выполнение алло-ТГСК, несмотря на критическое состояние, было единственным шансом для восстановления кроветворения и иммунной системы у этих больных [23].
Инфекционные осложнения посттрансплантационного периода характеризуются фазным течением в зависимости от периодов реконституции иммунной системы [33] и аллоиммунных осложнений. В настоящей работе впервые были проанализированы особенности развития и течения сепсиса и СШ у реципиентов алло-ГСК. Большинство больных, которые были переведены в ОРИТ с сепсисом в ранней фазе до приживления, когда имелось нарушение целостности слизистых барьеров после кондиционирования, перенесли алло-ТГСК от неродственных или гаплоидентичных доноров, включая 5 больных с СШ после αβTCR-деплеции, то есть те виды алло-ТГСК, при которых требуется наиболее интенсивное кондиционирование, влекущее за собой риск наибольшей токсичности и транслокации микрофлоры [34]. Однако, несмотря на столь раннее развитие сепсиса/СШ (медиана — +7 сут.), большинство из этих больных были выписаны из ОРИТ, и у них был сравнительно хороший отдаленный прогноз (ОВ составила 43,8 %), в отличие от больных, у которых сепсис развился после приживления трансплантата (ОВ — менее 22,2 %) (рис. 7). Это объясняется, во-первых, отсутствием необходимости в дополнительной иммуносупрессии для лечения острой РТПХ на этом этапе, во-вторых, меньшей приобретенной лекарственной устойчивостью микроорганизмов [29], и, наконец, несмотря на выраженную аплазию костного мозга после кондиционирования на момент развития инфекции, перспективой достаточно быстрого восстановления кроветворения [35]. После +30 дня посттрансплантационного периода, в силу временного интервала, состоялось большинство госпитализаций в ОРИТ из-за сепсиса. При анализе причин поступления в ОРИТ в этот период не наблюдалось очевидной закономерности между развитием сепсиса и видом алло-ТГСК или режимом профилактики РТПХ по аналогии с ранней фазой. Общепринятыми факторами, влиявшими на развитие инфекции после приживления, были несостоятельность трансплантата и РТПХ, которая приводила к повреждению слизистых барьеров и требовала усиления иммуносупрессивной терапии [29]. Более того, в ряде случаев применение противомикробных и противовирусных препаратов оказывало миелотоксический эффект, что усугубляло выраженность цитопении, приводило к развитию вторичной гипофункции трансплантата, нарушало нормальную микробиоту, способствуя транслокации патогенной флоры из кишечника [13]. Однако, хотя сепсис и СШ у иммунокомпрометированных больных являются хорошо изученными факторами неблагоприятного прогноза [36], в настоящей работе был выявлен парадоксальный феномен: среди всех осложнений перитрансплантационного периода сепсис/СШ, особенно возникшие на ранних сроках после трансплантации, характеризовались наиболее благоприятным прогнозом, чем остальные жизнеугрожающие осложнения (рис. 6). Эти данные отличаются от результатов шведских авторов [6], согласно которым СШ у реципиентов алло-ГСК был столь же прогностически неблагоприятным осложнением, как ОДН и неврологические нарушения.
ОДН — другое частое осложнение, возникающее в перитрансплантационном периоде. Прецизионная диагностика причин возникновения ОДН является краеугольным камнем для лечения онкогематологических больных [37]. У реципиентов алло-ТГСК, помимо инфекционных поражений легких (пневмоний) и гидростатического отека легких, причинами развития ОДН могут быть и другие причины, характерные для алло-ТГСК: диффузный альвеолярный геморраж, интерстициальный пневмонит, синдром приживления, и облитерирующий бронхиолит, являющийся проявлением поражения легких в рамках РТПХ [10, 38]. В условиях полиэтиологичного поражения легких, отсутствия четких критериев диагностики неинфекционных легочных осложнений, частого эмпирического назначения противомикробных препаратов и глюкокортикостероидных гормонов достоверное выявление неинфекционных легочных осложнений затруднено, тем более что большинство из этих неинфекционных легочных осложнений диагностируют методом исключения. Из 54 госпитализаций в ОРИТ в связи с ОДН, обратно в отделение трансплантации реципиенты алло-ГСК были переведены в 48 % случаев, однако отдаленный прогноз даже у выписанных из ОРИТ больных был в целом неблагоприятный: ОВ среди них составила всего 5,4 %. Одной из наиболее прогностически неблагоприятных подгрупп среди больных с ОДН были реципиенты алло-ГСК, у которых поражение легких было вызвано РТПХ. У всех у них наблюдалась декомпенсированная дыхательная недостаточность по гиперкапническому типу и синдром «торакальной утечки воздуха». Из 7 больных из ОРИТ был выписан только один, период наблюдения за ним составил более 1 года от момента выписки из ОРИТ. При интенсивной терапии ОДН, вызванной РТПХ с поражением легких, возможны трудности при проведении ИВЛ, которая сопровождается высоким риском баротравмы, волюмотравмы, плохо поддающейся контролю гиперкапнией [39].
Другой прогностически неблагоприятной группой больных были реципиенты алло-ГСК, переведенные в ОРИТ по причине угрожающего жизни ЖКК вследствие РТПХ с поражением кишечника в позднем периоде после приживления. Такое осложнение возникло у 13 (5,7 %) из 652 реципиентов алло-ГСК. Несмотря на то, что в 5 из 13 случаев больные были выписаны из ОРИТ, все они умерли в течение нескольких последующих месяцев. В условиях неконтролируемой РТПХ с поражением кишечника, несмотря на использование нескольких линий терапии, возможности интенсивной терапии ЖКК ограничены продолжительной гемостатической терапией. Среди экспериментальных опций лечения рассматривается трансплантация фекальной микробиоты [13].
Развитие аритмий в ранней фазе до приживления было обусловлено инфекционными осложнениями или токсичностью препаратов. У 3 из 7 больных нарушения ритма развились после применения циклофосфамида после +3 дня. По данным французского исследования [40], использование ПТ-ЦФ ассоциировалось с трехкратным увеличением частоты кардиальных событий в первые 100 дней посттрансплантационного периода, которые были связаны с уменьшением ОВ. В настоящем исследовании ОВ больных с кардиальными нарушениями составила 17,8 %.
Возникновению таких причин перевода в ОРИТ, как ОПечН, ОПП, ТМА, часто сопутствовали другие осложнения, но степень тяжести именно этих критических синдромов была определяющей в решении о переводе больного в ОРИТ. В представленной работе группа больных с неврологическими нарушениями отличалась выраженной гетерогенностью: больные поступали в ОРИТ с нарушением сознания как по причине обратимых лекарственной нейротоксичности или септической энцефалопатии, так и с тяжелыми грибковыми поражениями головного мозга или фатальными внутримозговыми кровоизлияниями.
В отличие от данных некоторых исследований, в которых показано, что проведение ЗПТ у реципиентов алло-ГСК в ОРИТ ассоциировалось с увеличением летальности [41–43], в настоящей работе наоборот, проведение ЗПТ ассоциировалось с уменьшением летальности. Можно предположить, что применение ЗПТ по расширенным показаниям способствовало лучшей коррекции метаболических нарушений [44].
Полученные в настоящем исследовании результаты интенсивной терапии критических состояний у реципиентов алло-ГСК сопоставимы с данными метаанализа, проведенного C. Saillard и соавт. [41]. В настоящей работе летальность в ОРИТ после первой госпитализации составила 45,9 %, с учетом повторных госпитализаций — 59,8 %, 30-дневная и 100-дневная летальность — 37 и 45,7 % соответственно. Прогностически неблагоприятными факторами риска, влиявшими на летальность в ОРИТ, была потребность в проведении ИВЛ и/или вазопрессорной терапии, которая косвенно отражала тяжесть органной дисфункции. Это согласуется с большинством проведенных исследований [41], в которых было показано, что на краткосрочную летальность после перевода в ОРИТ влияли не характеристики, связанные с трансплантацией, а степень тяжести критических состояний. Однако часто при развитии терминальных состояний, даже зная о неблагоприятном прогнозе, некоторых больных перед смертью все равно переводят на ИВЛ, им начинают вазопрессорную терапию, что может приводить к завышению летальности, связанной с использованием этих методов жизнеобеспечения. По результатам ряда исследований показано, что в последние годы проведение ИВЛ и вазопрессорной терапии у онкогематологических больных больше не означает однозначно неблагоприятного исхода [24][45]. Многие больные преодолевают острый период и успешно отлучаются от аппаратов жизнеобеспечения. Свои преимущества имеет ранняя трахеостомия [46], ранняя реабилитация и активизация [47]. В настоящем исследовании процедуры жизнеобеспечения были успешно прекращены в среднем у 20 % реципиентов алло-ТГСК, что хуже в сравнении с больными острыми лейкозами, которым проводилась ИВЛ (отлучено почти 50 %), и вазопрессорная терапия (успешное прекращение у 30 %) на этапе индукционной химиотерапии [48]. Другим прогностически неблагоприятным фактором, влиявшим на летальность в ОРИТ, было поступление в ОРИТ после +30 дня. Схожие данные показали F. Pene и соавт., согласно которым результаты лечения были лучше у тех, кто поступал в ОРИТ в более ранние сроки до +30 дня, в то время как увеличение частоты РТПХ и оппортунистических инфекций в поздние сроки ухудшало прогноз [49]. По данным других авторов такой связи выявлено не было [50].
В настоящем исследовании кривые вероятности летальности вне рецидива и вероятности госпитализации в ОРИТ (рис. 1) были схожи, что обусловлено тем, что большая часть летальных случаев, не связанных с рецидивом, происходила в ОРИТ. Реципиентам алло-ТГСК до самого последнего момента оказывалась необходимая помощь, поэтому в случае развития жизнеугрожающих состояний их всех переводили в ОРИТ.
Особый интерес представляет отдаленная ОВ больных, переведенных в ОРИТ. В представленной работе ОВ к моменту окончания наблюдения (более 9 лет) составила 13,8 % (рис. 5), что сопоставимо с результатами других авторов, которые сообщали о 18–20 % 5-летней ОВ [7][9]. Но даже при анализе только выписанных из ОРИТ больных их ОВ (34,6 %) была меньше, чем у больных, которые в ОРИТ не поступали (58,3 %) (p = 0,0013), что можно объяснить «негативной селекцией» больных группы в ОРИТ. Похожий анализ был выполнен двумя другими группами исследователей, которые показали, что ОВ больных, выписанных из ОРИТ, была примерно на 10 % меньше, чем ОВ больных, которые не наблюдались в ОРИТ [7][9]. Кроме того, полученные в настоящем исследовании отдаленные результаты лечения критических состояний, которые развились у больных, перенесших алло-ТГСК, были хуже в сравнении с больными, у которых такие осложнения развились на этапе индукционной химиотерапии лейкозов (5-летняя ОВ — 43,2 %) [48], что подтверждает существующее мнение об особой тяжести реципиентов алло-ГСК, у которых развиваются жизнеугрожающие осложнения [24]. В рамках решения этой проблемы некоторыми исследователями предложено два согласительных подхода [51]. Первый из них — неотложное начало интенсивной терапии без отсрочки в случае возникновения острой органной дисфункции с последующей регулярной переоценкой состояния больных [51][52]. Второй — обеспечение соответствующей паллиативной помощи в случаях, при которых не осталось «терапевтических резервов» и неконтролируемой РТПХ [49][51][53].
Таким образом, при проведении алло-ТГСК критические состояния возникают у четверти больных, главным образом, по причине жизнеугрожающих инфекционных осложнений, особенности развития и течения которых определяются этапами трансплантации. Это объясняет невозможность выполнения алло-ТГСК без наличия квалифицированной специализированной реанимационной помощи в структуре трансплантационного центра. На результаты лечения критических состояний в ОРИТ влияют степень тяжести органных дисфункций, отражением которых служит потребность в проведении ИВЛ и вазопрессорной терапии, и сроки посттрансплантационного периода. Реципиенты алло-ГСК, у которых инфекционные осложнения развиваются в ранний период до приживления, имеют наиболее благоприятный прогноз, однако отдаленный прогноз даже у успешно пролеченных и выписанных из ОРИТ больных хуже в сравнении с реципиентами алло-ГСК, которым госпитализация в ОРИТ не требуется.
Список литературы
1. Паровичникова Е.Н., Васильева В.А., Довыденко М.В. и др. Протоколы трансплантации аллогенных гемопоэтических стволовых клеток. Под ред. Савченко В.Г. М.: Практика; 2020: 319 с.
2. Penack O., Peczynski C., Mohty M., et al. How much has allogeneic stem cell transplant-related mortality improved since the 1980s? A retrospective analysis from the EBMT. Blood Adv. 2020; 4(24): 6283. DOI: 10.1182/bloodadvances.2020003418.
3. Michel C.S., Teschner D., Schmidtmann I., et al. Prognostic factors and outcome of adult allogeneic hematopoietic stem cell transplantation patients admitted to intensive care unit during transplant hospitalization. Sci Rep. 2019; 9(1): 19911. DOI: 10.1038/s41598-019-56322-0.
4. Escobar K., Rojas P., Ernst D., et al. Admission of hematopoietic cell transplantation patients to the intensive care unit at the Pontificia Universidad Católica de Chile Hospital. Biol Blood Marrow Transplant. 2015; 21(1): 176–9. DOI: 10.1016/j.bbmt.2014.08.009.
5. Townsend W.M., Holroyd A., Pearce R., et al. Improved intensive care unit survival for critically ill allogeneic haematopoietic stem cell transplant recipients following reduced intensity conditioning. Br J Haematol. 2013; 161(4): 578–86. DOI: 10.1111/bjh.12294.
6. Gilli K., Remberger M., Hjelmqvist H., et al. Sequential Organ Failure Assessment predicts the outcome of SCT recipients admitted to intensive care unit. Bone Marrow Transplant. 2010; 45(4): 682–8. DOI: 10.1038/bmt.2009.220.
7. Lueck C., Stadler M., Koenecke C., et al. Improved shortand long-term outcome of allogeneic stem cell recipients admitted to the intensive care unit: A retrospective longitudinal analysis of 942 patients. Intensive Care Med. 2018; 44(9): 1483–92. DOI: 10.1007/s00134-018-5347-x.
8. Lengliné E., Chevret S., Moreau A.S., et al. Changes in intensive care for allogeneic hematopoietic stem cell transplant recipients. Bone Marrow Transplant. 2015; 50(6): 840–5. DOI: 10.1038/bmt.2015.55.
9. Mayer S., Pastores S.M., Riedel E., et al. Shortand long-term outcomes of adult allogeneic hematopoietic stem cell transplant patients admitted to the intensive care unit in the peritransplant period. Leuk Lymphoma. 2017; 58(2): 382–90. DOI: 10.1080/10428194.2016.1195499.
10. Щекина А.Е., Галстян Г.М., Дроков М.Ю. Роль интенсивной терапии при проведении трансплантации аллогенных гемопоэтических стволовых клеток. Гематология и трансфузиология. 2022; 67(2): 216–39. DOI: 10.35754/0234-5730-2022-67-2-216-239.
11. Turki A.T., Lamm W., Schmitt C., et al. Platelet number and graft function predict intensive care survival in allogeneic stem cell transplantation patients. Ann Hematol. 2019; 98(2): 491–500. DOI: 10.1007/s00277-018-3538-8.
12. Borrega G.J., Heger J.M., Koehler P., et al. Allogeneic stem cell transplant recipients admitted to the intensive care unit during the peri-transplant period have unfavorable outcomes-results of a retrospective analysis from a German university hospital. Ann Hematol. 2022; 101(2): 389–95. DOI: 10.1007/s00277-02104698-3.
13. Голощапов О.В., Чухловин А.Б., Бакин Е.А. и др. Трансплантация фекальной микробиоты при реакции «трансплантат против хозяина» у детей и взрослых: методы, клинические эффекты, безопасность. Терапевтический архив. 2020; 92(7): 43–54. DOI: 10.26442/00403660.2020.07.000773.
14. Осипов Ю.С., Бессмельцев С.С., Салогуб Г.Н. и др. Инфекционные осложнения после гаплоидентичной трансплантации гемопоэтических стволовых клеток у пациентов с опухолями кроветворной и лимфоидной тканей высокого риска: опыт одного центра. Клиническая онкогематология. 2019; 12(4): 406–15. DOI: 10.21320/2500-2139-2019-12-4-406-415.
15. Randolph B.V., Ciurea S.O. What the intensivist needs to know about hematopoietic stem cell transplantation? In: Nates J.L., Price K.J. (eds). Oncologic Critical Care. Springer, Cham; 2020: 1531–46. DOI: 10.1007/978-3-31974588-6.
16. Iacobelli S. Suggestions on the use of statistical methodologies in studies of the European Group for Blood and Marrow Transplantation. Bone Marrow Transplant. 2013; 48(S1): S1–37. DOI: 10.1038/bmt.2012.282.
17. Singer M., Deutschman C.S., Seymour C., et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016; 315(8): 801–10. DOI: 10.1001/jama.2016.0287.
18. Shebl E., Mirabile V.S., Burns B. Respiratory failure. In: StatPearls Publishing; 2022. https://www.ncbi.nlm.nih.gov/books/NBK526127/
19. Wendon J., Cordoba J., Dhawan A., et al. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol. 2017; 66(5): 1047–81. DOI: 10.1016/j.jhep.2016.12.003.
20. Kellum J.A., Aspelin P. KDIGO Clinical Practice Guideline for acute kidney injury. In: Kidney International Supplements; 2012: 1–138. DOI: 10.1038/ kisup.2012.1.
21. Cho B.S., Yahng S.A., Lee S.S.E., et al. Validation of recently proposed consensus criteria for thrombotic microangiopathy after allogeneic hematopoietic stem-cell transplantation. Transplantation. 2010; 90(8): 918–26. DOI: 10.1097/TP.0b013e3181f24e8d.
22. Valcárcel D., Sureda A. Graft failure. In: The EBMT Handbook: Hematopoietic stem cell transplantation and cellular therapies. Springer; 2019: 307–13. DOI: 10.1007/978-3-030-02278-5_41.
23. Галстян Г.М., Макарова П.М., Кузьмина Л.А. и др. Успешная трансплантация аллогенного костного мозга у больных с тяжелым грамотрицательным сепсисом и септическим шоком. Клиническая онкогематология. 2014; 7(2): 122–30.
24. Darmon M., Bourmaud A., Georges Q., et al. Changes in critically ill cancer patients’ short-term outcome over the last decades: Results of systematic review with meta-analysis on individual data. Intensive Care Med. 2019; 45(7): 977–87. DOI: 10.1007/s00134-019-05653-7.
25. Савченко В.Г., Любимова Л.С., Паровичникова Е.Н. и др. Трансплантации аллогенных и аутологичных гемопоэтических стволовых клеток при острых лейкозах (итоги 20-летнего опыта). Терапевтический архив. 2007; 79(7): 30–5.
26. Díaz-Lagares C., Fox L., García-Roche A., et al. Sequential Organ Failure Assessment Score and the need for organ support predict mortality in allogeneic stem cell transplant patients admitted to the intensive care unit. Transplant Cell Ther. 2021; 27(10): 865.e1–7. DOI: 10.1016/j.jtct.2021.06.026.
27. Orvain C., Beloncle F., Hamel J.F., et al. Different impact of the number of organ failures and graft-versus-host disease on the outcome of allogeneic stem cell transplantation recipients requiring intensive care. Transplantation. 2017; 101(2): 437–44. DOI: 10.1097/TP.0000000000001143.
28. Васильева В.А., Кузьмина Л.А., Паровичникова Е.Н. и др. Выполнение трансплантаций аллогенных гемопоэтических стволовых клеток от неродственных доноров из Российского и зарубежного регистров в одном трансплантационном центре. Гематология и трансфузиология. 2020; 65(3): 299–311. DOI: 10.35754/0234-5730-2020-65-3-299-311.
29. Ахмедов М.И., Клясова Г.А., Паровичникова Е.Н. и др. Инфекции кровотока в разные фазы реконституции у больных после первой трансплантации аллогенных гемопоэтических стволовых клеток. Онкогематология. 2022; 17(1): 121–34. DOI: 10.17650/1818-8346-2022-17-1-121-134.
30. Кузьмина Л.А., Конова З.В., Паровичникова Е.Н. и др. Повторная трансплантация аллогенных гемопоэтических стволовых клеток у больных гемобластозами. Гематология и трансфузиология. 2019; 64(1): 35–48. DOI: 10.35754/0234-5730-2019-64-1-35-48.
31. Кузьмина Л.А., Паровичникова Е.Н., Клясова Г.А. и др. Протокол терапии острой реакции «трансплантат против хозяина». В кн.: Савченко В.Г. (ред.). Алгоритмы диагностики и протоколы лечения заболеваний системы крови. М.: Практика; 2018: 1041–66.
32. Pichereau C., Lengliné E., Valade S., et al. Trajectories of acute graft-versushost disease and mortality in critically ill allogeneic-hematopoietic stem cell recipients: The Allo-GRRR-OH score. Bone Marrow Transplant. 2020; 55(10): 1966–74. DOI: 10.1038/s41409-020-0857-x.
33. Tomblyn M., Chiller T., Einsele H., et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: A global perspective. Biol Blood Marrow Transplant. 2009; 15(10): 1143–238. DOI: 10.1016/j.bbmt.2009.06.019.
34. Gea-Banacloche J. Risks and epidemiology of infections after hematopoietic stem cell transplantation. In: Ljungman P., Snydman D., Boeckh M. (eds). Transplant Infections. 4th ed. Cham: Nature Publishing Group; 2016: 81–99. DOI: 10.1007/978-3-319-28797-3_6.
35. van der Heiden P.L.J., Arbous M.S., van Beers E.J., et al. Predictors of shortterm and long-term mortality in critically ill patients admitted to the intensive care unit following allogeneic stem cell transplantation. Bone Marrow Transplant. 2019; 54(3): 418–24. DOI: 10.1038/s41409-018-0277-3.
36. Jamme M., Daviaud F., Charpentier J., et al. Time course of septic shock in immunocompromised and nonimmunocompromised patients. Crit Сare Med. 2017; 45(12): 2031–9. DOI: 10.1097/CCM.0000000000002722.
37. Azoulay E., Mokart D., Kouatchet A., et al. Acute respiratory failure in immunocompromised adults. Lancet Respir Med. 2019; 7(2): 173–86. DOI: 10.1016/S2213-2600(18)30345-X.
38. Haider S., Durairajan N., Soubani A.O. Noninfectious pulmonary complications of haematopoietic stem cell transplantation. Eur Respir Rev. 2020; 29(156): 190119. DOI: 10.1183/16000617.0119-2019.
39. Wohlfarth P., Schellongowski P., Staudinger T., et al. A bi-centric experience of extracorporeal carbon dioxide removal (ECCO 2 R) for acute hypercapnic respiratory failure following allogeneic hematopoietic stem cell transplantation. Artif Organs. 2021; 45(8): 903–10. DOI: 10.1111/aor.13931.
40. Duléry R., Mohty R., Labopin M., et al. Early cardiac toxicity associated with post-transplant cyclophosphamide in allogeneic stem cell transplantation. JACC CardioOncol. 2021; 3(2): 250–9. DOI: 10.1016/j.jaccao.2021.02.011.
41. Saillard C., Darmon M., Bisbal M., et al. Critically ill allogenic HSCT patients in the intensive care unit: A systematic review and meta-analysis of prognostic factors of mortality. Bone Marrow Transplant. 2018; 53(10): 1233–41. DOI: 10.1038/s41409-018-0181-x.
42. Boyaci N., Aygencel G., Turkoglu M., et al. The intensive care management process in patients with hematopoietic stem cell transplantation and factors affecting their prognosis. Hematology. 2014; 19(6): 338–45. DOI: 10.1179/16 07845413Y.0000000130.
43. Gilbert C., Vasu T.S., Baram M. Use of mechanical ventilation and renal replacement therapy in critically ill hematopoietic stem cell transplant recipients. Biol Blood Marrow Transplant. 2013; 19(2): 321–4. DOI: 10.1016/j.bbmt.2012.09.010.
44. Ronco C., Reis T. Continuous renal replacement therapy and extended indications. Semin Dial. 2021; 34(6): 550–60. DOI: 10.1111/sdi.12963.
45. Mokart D., Pastores S.M., Darmon M. Has survival increased in cancer patients admitted to the ICU? Yes. Intensive Care Med. 2014; 40(10): 1570–2. DOI: 10.1007/s00134-014-3433-2.
46. Tanaka A., Uchiyama A., Kitamura T., et al. Association between early tracheostomy and patient outcomes in critically ill patients on mechanical ventilation: A multicenter cohort study. J Intensive Care. 2022; 10(1): 19. DOI: 10.1186/s40560-022-00610-x.
47. Dong Z., Yu B., Sun Y., et al. Effects of early rehabilitation therapy on patients with mechanical ventilation. World J Emerg Med. 2014; 5(1): 48–52. DOI: 10.5847/wjem.j.issn.1920-8642.2014.01.008.
48. Баженов А.В., Галстян Г.М., Паровичникова Е.Н. и др. Роль интенсивной терапии в лечении больных острыми миелоидными лейкозами. Терапевтический архив. 2019; 91(7): 14–24. DOI: 10.26442/00403660.2019.07.000321.
49. Pène F., Aubron C., Azoulay E., et al. Outcome of critically ill allogeneic hematopoietic stem-cell transplantation recipients: A reappraisal of indications for organ failure supports. J Clin Oncol. 2006; 24(4): 643–9. DOI: 10.1200/ JCO.2005.03.9073.
50. Agarwal S., O’Donoghue S., Gowardman J., et al. Intensive care unit experience of haemopoietic stem cell transplant patients. Intern Med J. 2012; 42(7): 748–54. DOI: 10.1111/j.1445-5994.2011.02533.x.
51. Meert A.P., Wittnebel S., Holbrechts S., et al. Critically ill cancer patient’s resuscitation: A Belgian/French societies’ consensus conference. Intensive Care Med. 2021; 47(10): 1063–77. DOI: 10.1007/s00134-021-06508-w.
52. Orvain C., Beloncle F., Hamel J.F., et al. Allogeneic stem cell transplantation recipients requiring intensive care: Time is of the essence. Ann Hematol. 2018; 97(9): 1601–9. DOI: 10.1007/s00277-018-3320-y.
53. Kew A.K., Couban S., Patrick W., et al. Outcome of hematopoietic stem cell transplant recipients admitted to the intensive care unit. Biol Blood Marrow Transplant. 2006; 12(3): 301–5. DOI: 10.1016/J.BBMT.2005.10.020.
Об авторах
А. Е. ЩекинаРоссия
Щекина Антонина Евгеньевна, аспирант, реаниматолог отделения реанимации и интенсивной терапии
125167, Москва
Г. М. Галстян
Россия
Галстян Геннадий Мартинович, доктор медицинских наук, заведующий отделом реанимации и интенсивной терапии
125167, Москва
М. Ю. Дроков
Россия
Дроков Михаил Юрьевич, кандидат медицинских наук, руководитель сектора научных исследований химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга
Л. А. Кузьмина
Россия
Кузьмина Лариса Анатольевна, кандидат медицинских наук, заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга
125167, Москва
Е. Н. Денисова
Россия
Денисова Елена Николаевна, кандидат медицинских наук, руководитель группы диализа с дневным стационаром отдела реанимации и интенсивной терапии
125167, Москва
Н. М. Арапова
Россия
Арапова Наталья Михайловна, врач группы диализа отдела реанимации и интенсивной терапии
125167, Москва
В. В. Троицкая
Россия
Троицкая Вера Витальевна, кандидат медицинских наук, первый заместитель директора по лечебной работе
125167, Москва
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, генеральный директор
125167, Москва
Рецензия
Для цитирования:
Щекина А.Е., Галстян Г.М., Дроков М.Ю., Кузьмина Л.А., Денисова Е.Н., Арапова Н.М., Троицкая В.В., Паровичникова Е.Н. Интенсивная терапия жизнеугрожающих осложнений у реципиентов аллогенных гемопоэтических стволовых клеток. Гематология и трансфузиология. 2022;67(3):308-327. https://doi.org/10.35754/0234-5730-2022-67-3-308-327
For citation:
Shchekina A.E., Galstyan G.M., Drokov M.Y., Kuzmina L.A., Denisova E.N., Arapova N.M., Troitskaya V.V., Parovichnikova E.N. Intensive care of life-threatening complications in allogeneic hematopoietic stem cell recipients. Russian journal of hematology and transfusiology. 2022;67(3):308-327. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-308-327











































