Перейти к:
Возможность наблюдения в ремиссии без лечения больных хроническим миелолейкозом со стабильным глубоким молекулярным ответом по данным российской части международного многоцентрового популяционного исследования EUTOS PBS
https://doi.org/10.35754/0234-5730-2022-67-3-351-366
Аннотация
Введение. Учитывая возможность сохранения молекулярной ремиссии у 40–60 % больных хроническим миелолейкозом (ХМЛ) со стабильным глубоким молекулярным ответом (МО) после отмены терапии ингибиторами тирозинкиназ (ИТК), актуальным является определение числа кандидатов для наблюдения в ремиссии без лечения (РБЛ) и сроков отмены терапии.
Цель — оценить вероятности достижения стабильного глубокого МО и определить долю больных, соответствующих критериям наблюдения в РБЛ, в российской части международного многоцентрового проспективного популяционного исследования EUTOS PBS (European Treatment and Outcome Study — Population-Based Study).
Материалы и методы. Регистрацию всех случаев ХМЛ в исследовании EUTOS PBS проводили с сентября 2009 г. по декабрь 2012 г. в 6 регионах России. Основным критерием включения в исследование являлся диагноз ХМЛ, подтвержденный с помощью цитогенетического или молекулярно-генетического исследования у больных старше 18 лет. Исследуемую группу составили 197 больных ХМЛ: 181 (92 %) больной с хронической фазой (ХФ) ХМЛ, 14 (7 %) — с фазой акселерации (ФА) и 2 (1 %) — с бластным кризом (БК) на момент верификации диагноза. Обновление данных о терапии и ее результатах проводили ежегодно.
Результаты. При медиане срока наблюдения за больными 7 лет (диапазон — от 3 мес. до 10 лет) глубокий МО (как минимум МО4 или уровень BCR::ABL1 менее 0,01 % IS) был достигнут у 104 (54 %) из 192 больных, получавших терапию ИТК. Вероятность достижения глубокого МО через 5 лет составила 48 % (95%-ный доверительный интервал (95% ДИ): 40–55 %) у больных в ХФ. Кумулятивная частота достижения стабильного глубокого МО длительностью более 2 лет у больных в ХФ ХМЛ составила 16 % (95% ДИ: 11–22 %) через 5 лет терапии, 29 % (95% ДИ: 22–37 %) через 7 лет терапии и 50 % (95% ДИ: 38–60 %) через 9 лет терапии ИТК. У больных с глубоким МО через 36 мес. терапии вероятность достичь в последующем статуса стабильного глубокого МО была достоверно выше, чем у больных, у которых был достигнут только большой МО (БМО) к этому сроку наблюдения: 40 % (95% ДИ: 28–53 %) против 3 % (95% ДИ: 0–13 %) через 5 лет терапии; 66 % (95% ДИ: 52–77 %) против 15 % (95% ДИ: 5–30 %) через 7 лет и 89 % (95% ДИ: 64–97 %) против 48 % (95% ДИ: 25–67 %) через 9 лет (p < 0,0001). У больных без БМО к 36 мес. терапии стабильный глубокий МО впоследствии не был получен. Критериям отмены ИТК для перевода в фазу наблюдения в РБЛ, включающим в себя ХФ ХМЛ с типичным транскриптом BCR::ABL1 p210, терапию ИТК более 3 лет и стабильный глубокий МО более 2 лет, соответствовали 54 больных. Доля возможных кандидатов для отмены терапии составила 28 % от всех 192 больных, получавших терапию ИТК в исследовании или 31 % в пересчете на больных только с ХФ ХМЛ. Среди потенциальных кандидатов для отмены ИТК преобладали больные из группы низкого риска по шкале Sokal или ELTS: 26 (48 %) и 33 (61 %) соответственно; больных с длительно существующей резистентностью к терапии не было.
Заключение. В российской части проспективного наблюдательного многоцентрового исследования EUTOS PBS установлено, что при медиане срока терапии ИТК 7 лет около трети больных с ХФ ХМЛ могут являться кандидатами для контролируемой отмены терапии. При сохранении у половины из этих больных молекулярной ремиссии продолжить наблюдение в РБЛ смогут до 15 % от изначального числа больных. Достижение БМО и глубокого МО через 36 мес. терапии ассоциировано с достоверно большей вероятностью соответствия критериям наблюдения в фазе РБЛ в последующем.
Ключевые слова
Для цитирования:
Челышева Е.Ю., Лазарева О.В., Туркина А.Г., Виноградова О.Ю., Гаврилова Л.В., Галайко М.В., Дашеева Д.Б., Лучинин А.С., Мересий С.В., Сендерова О.М., Шутылев А.А., Куликовский А.А., Куликов С.М. Возможность наблюдения в ремиссии без лечения больных хроническим миелолейкозом со стабильным глубоким молекулярным ответом по данным российской части международного многоцентрового популяционного исследования EUTOS PBS. Гематология и трансфузиология. 2022;67(3):351–366. https://doi.org/10.35754/0234-5730-2022-67-3-351-366
For citation:
Chelysheva E.Yu., Lazareva O.V., Turkina A.G., Vinogradova O.Yu., Gavrilova L.V., Galayko M.V., Dasheeva D.B., Luchinin A.S., Meresiy S.V., Senderova O.M., Shutylev A.A., Kulikovskiy A.A., Kulikov S.M. Observation in a treatment-free remission in chronic myeloid leukemia patients with a stable deep molecular response in the Russian portion of the international multicenter population based study EUTOS PBS. Russian journal of hematology and transfusiology. 2022;67(3):351–366. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-351-366
Введение
Применение ингибиторов тирозинкиназ (ИТК) при хроническом миелолейкозе (ХМЛ) изменило прогноз этого заболевания. Продолжительность жизни больных с хронической фазой (ХФ) ХМЛ и оптимальным ответом на терапию стала сопоставима с общепопуляционной [1][2], в связи с чем растет число больных ХМЛ. По мере увеличения сроков терапии ИТК увеличивается доля больных с так называемым глубоким молекулярным ответом (МО), под которым подразумевают уровень BCR::ABL1 < 0,01 % по международной шкале (international scale, IS) [3][4]. Однако вопрос о возможности полного излечения ХМЛ с помощью ИТК остается открытым, с учетом того, что экспрессия BCR::ABL1 определяется в течение многих лет даже при глубоком МО. Персистирование небольшого количества лейкозных стволовых клеток (ЛСК), без способности вызывать клиническую манифестацию заболевания и без формирования резистентных клонов некоторые авторы называют «функциональным излечением» (operational cure) [5]. Данное биологическое явление у больных ХМЛ отмечено как после выполнения трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК), так и при терапии препаратами интерферона (ИФН), а в дальнейшем — при терапии ИТК [5][6].
Одна из гипотез эрадикации минимальной остаточной болезни (МОБ) при ХМЛ предполагает возможность истощения пула покоящихся ЛСК с течением времени, на фоне непрерывного приема ИТК. Согласно теоретическим моделям, эрадикация МОБ возможна приблизительно через 10 лет после достижения глубокого МО [7], однако на практике отсутствуют инструменты определения остаточного количества ЛСК. Оценка МОБ при ХМЛ выполняется с помощью определения экспрессии BCR::ABL1 методом количественной полимеразной цепной реакции (ПЦР) в реальном времени (ПЦР РВ), чувствительность которого ограничена 4,5–5 lg.
Возможность сохранения «функционального излечения» после отмены ИТК является предметом активного изучения. В ряде исследований было установлено, что у 40–60 % больных со стабильным глубоким МО отмена ИТК не приводит к потере достигнутой молекулярной ремиссии, и возможно продолжить наблюдение в ремиссии без лечения (РБЛ) под контролем МОБ [8–14]. Критерием молекулярного рецидива в «стоп» исследованиях и показанием к возобновлению лечения было предложено считать потерю большого молекулярного ответа (БМО), которая соответствует превышению уровня BCR::ABL1 > 0,1 % IS.
В российское проспективное исследование RU-SKI, которое проводилось в рамках клинической апробации Минздрава России в ФГБУ «НМИЦ гематологии» Минздрава России, были включены больные, получавшие терапию ИТК более 3 лет и с глубоким МО (как минимум МО4) сроком более 2 лет. Выживаемость без потери БМО после отмены ИТК составила 57 %, 54 %, 52 % и 50 % через 6, 12, 24 и 36 мес. соответственно. После 28 мес. наблюдения без терапии молекулярных рецидивов не отмечалось [15]. Молекулярные рецидивы были обратимы после возобновления терапии ИТК.
Таким образом, около половины больных ХМЛ, включенных в исследования по отмене ИТК, могут безопасно продолжить длительное наблюдение в РБЛ. Возможность отмены терапии при ХМЛ актуальна для коррекции или предотвращения развития нежелательных явлений длительного лечения, а также для оптимизации финансовой нагрузки при терапии этими дорогостоящими препаратами [16][17].
Критерием возможности отмены лечения является стабильное сохранение глубокого МО в течение определенного периода. В исследованиях по отмене ИТК рассматривался срок стабильного глубокого МО 1–2 года при сроке терапии не менее 3 лет. В рекомендациях European LeukemiaNet (ELN) 2020 г. рекомендуемая длительность терапии ИТК перед отменой лечения составляет не менее 5 лет. Минимальным критерием для рассмотрения отмены ИТК является длительность стабильно глубокого МО более 2 лет, оптимальным критерием — стабильный МО4 (BCR-ABL< 0,01 % IS) сроком более 3 лет или стабильный МО4,5 (BCR-ABL < 0,0032 % IS) сроком более 2 лет [18]. Отмена ИТК признана возможной только при регулярном мониторинге уровня BCR::ABL1 и только у больных с типичным транскриптом BCR::ABL1 p210, выявляемого у 98 % больных ХМЛ, при наличии которого возможна стандартизированная оценка МО.
По данным российского многоцентрового наблюдательного исследования «Регистр больных хроническим миелолейкозом», которое проводилось в 80 регионах России и завершилось в 2016 г., у 41 % из 5690 больных ХМЛ, получавших терапию ИТК более 12 мес., отмечено достижение глубокого МО [19]. Однако сроки достижения стабильного глубокого МО и соответствие критериям наблюдения в РБЛ в указанном исследовании не изучались. Число потенциальных кандидатов для отмены ИТК в российской популяции больных ХМЛ неизвестно.
Учитывая актуальность вопроса наблюдения в РБЛ, запланировано оценить потенциальное число больных ХМЛ, у которых возможна отмена ИТК, в проспективном наблюдательном популяционном исследовании EUTOS PBS (European Treatment and Outcome Study — Population-Based Study).
Целью настоящей работы явилась оценка вероятности достижения стабильного глубокого МО и определение доли больных, соответствующих критериям наблюдения в РБЛ, дополнительно были проанализированы общая выживаемость (ОВ) на поздних сроках терапии ИТК, вероятность достижения глубокого МО и стабильность его сохранения, варианты кинетики лейкемического клона после достижения глубокого МО, а также выполнена клинико-демографическая характеристика выборки больных, соответствующих критериям наблюдения в РБЛ.
Материалы и методы
Протокол исследования и критерии включения больных
Изучаемую группу составили 197 больных ХМЛ из российской части международного многоцентрового проспективного популяционного исследования EUTOS PBS, в котором участвовали 20 европейских стран.
Критерии включения больных и протокол сбора данных подробно описаны в предыдущих публикациях [20][21]. Согласно протоколу исследования, с октября 2009 г. по декабрь 2012 г. в центре-координаторе ФГБУ «НМИЦ гематологии» Минздрава России проводили регистрацию всех случаев впервые диагностированного ХМЛ у взрослых больных из 6 регионов Российской Федерации: Пермский край (2 центра), Иркутская область, Кировская область, Брянская область, г. Чита, Республика Мордовия (г. Саранск).
Основным критерием включения в исследование являлся диагноз ХМЛ, подтвержденный с помощью цитогенетического или молекулярно-генетического исследования у больных старше 18 лет. Первичный сбор данных включал в себя информацию о клинико-демографических характеристиках больных на момент диагностики ХМЛ, методах верификации диагноза и назначенной терапии. При последующем наблюдении проводили ежегодное обновление данных о жизненном статусе больных, смене фаз ХМЛ, смене терапии, а также о результатах цитогенетического и молекулярно-генетического мониторинга в период терапии.
Исследование было строго наблюдательным. При терапии ИТК в клинической практике принимали во внимание актуальные на тот момент времени рекомендации экспертов ELN 2009 г. и рекомендации российской исследовательской группы по диагностике и терапии ХМЛ.
После завершения в 2014 г. европейского исследования наблюдение за указанной российской когортой больных было продолжено в ФГБУ «НМИЦ гематологии» Минздрава России при поддержке Национального гематологического общества. Проводили мониторинг отдаленных событий и обновление данных раз в год при взаимодействии с врачами из региональных центров. Последнее обновление данных выполнено в декабре 2019 г.
Краткая характеристика больных и первой линии терапии
Медиана возраста больных на момент диагностики ХМЛ составила 50 лет (диапазон — от 18 до 82 лет), соотношение мужчины/женщины — 100 (50,7 %) / 97 (49,3 %).
При получении первых клинико-гематологических данных ХФ, фаза акселерации (ФА) и бластный криз (БК) отмечены у 184 (93,4 %), 12 (6 %) и 1 (0,6 %) больного соответственно. В период верификации диагноза (ожидание результатов цитогенетического и молекулярно-генетического исследований) у 2 больных констатирована смена фазы с ХФ до ФА, у 1 — прогрессия от ХФ до БК. По результатам окончательной верификации фаз до начала терапии у 181 (92 %) больного отмечена ХФ, у 14 (7 %) — ФА и у 2 (1 %) — БК (миелоидный вариант).
По уточненным данным, число больных с ХФ ХМЛ из группы низкого, промежуточного и высокого риска по прогностической шкале Sokal [22] составило 61 (34 %), 65 (36 %) и 55 (30 %) соответственно. Число больных из группы низкого, промежуточного и высокого риска по прогностической шкале ELTS [23] составило 91 (50 %), 52 (29 %) и 38 (21 %) соответственно.
После верификации диагноза у 192 (97,5 %) больных назначены ИТК, у 5 (2,5 %) больных с ХФ проводилась только терапия гидроксимочевиной. Медиана срока от установления диагноза ХМЛ до назначения ИТК составила 19 дней (диапазон — от 6 дней до 6,8 мес.). Иматиниб в первой линии терапии применяли у 186 (97 %) больных, ИТК второго поколения (ИТК2) нилотиниб — у 6 (3 %) больных.
Детальные демографические и клинико-гематологические характеристики 197 больных на момент диагностики, а также информация о терапии до назначения ИТК и дозах ИТК представлены в предыдущих публикациях [20, 21].
Критерии МО при терапии ИТК
МО на фоне терапии ИТК оценивали с помощью ПЦР РВ со стандартизацией по IS, соответственно рекомендациям ELN 2013 [4] (табл. 1). Стандартизованную оценку МО проводили только для типичного транскрипта BCR::ABL1 р210 (варианты e13a2 и e14a2).
Таблица 1. Критерии МО у больных ХМЛ при терапии ИТК
Table 1. Criteria of molecular response in CML patients on TKI therapy
|
МО / MR |
Определение / Definition |
|
|
Отсутствие МО2* Absence of MR2* |
BCR::ABL1**/ ABL1 > 1 % |
|
|
МО2 / MR2 |
BCR::ABL1/ABL1 ≤ 1 % и / and > 0,1 % |
|
|
Большой МО (БМО) Major MR (MMR) |
BCR::ABL1/ABL1 ≤ 0,1 % и > 0,01 % BCR::ABL1/ABL1 ≤ 0.1 % and > 0.01 % |
|
|
Глубокий МО Deep MR |
МО4 MR4 |
BCR::ABL1/ABL1 ≤ 0,01 % и > 0,0032 % или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥ 10 000 копий BCR::ABL1/ABL1 ≤ 0.01 % and > 0.0032 % or undetectable level of BCR::ABL1 with ABL1 ≥ 10,000 copy number |
|
МО4,5 MR4,5 |
BCR::ABL1/ABL1 ≤ 0,0032 % и > 0,001 % или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥ 32 000 копий BCR::ABL1/ABL1 ≤ 0.0032 % and > 0.001 % or undetectable level of BCR::ABL1 with ABL1 ≥ 32,000 copy number |
|
|
МО5 MR5 |
BCR::ABL1/ABL1 ≤ 0,001 % или неопределяемый уровень BCR::ABL1 при количестве ABL1 ≥ 100 000 копий BCR::ABL1/ABL1 ≤ 0.001 % or undetectable level of BCR::ABL1 with ABL1 ≥ 100,000 copy number |
|
Примечание: МО — молекулярный ответ; * — отсутствие МО2 констатировали также в случае выявления Ph′-хромосомы при стандартном цитогенетическом исследовании; ** — обозначение BCR::ABL1 представлено в соответствии с обновленными рекомендациями по номенклатуре слитных и химерных онкогенов 2021 г. [24].
Notes: MR — molecular response; * — absence of MR2 was stated in case of Ph′-chromosome detection by standard cytogenetic analysis; ** — the designation of BCR::ABL1 is provided in accordance with the updated guidelines for the nomenclature of fusion and chimeric oncogenes of 2021 [24].
Критерии возможности отмены терапии ИТК и наблюдения в РБЛ
Выбор критериев, при которых возможно рассматривать отмену ИТК и наблюдение в РБЛ, соответствовал применяемым в исследовании RU-SKI: 1) ХФ ХМЛ и отсутствие ФА или БК в анамнезе; 2) типичный транскрипт BCR::ABL1 p210; 3) терапия ИТК более 3 лет; 4) стабильный глубокий МО (как минимум МО4) длительностью как минимум 2 года [15].
Статистический анализ. Для характеристики выборки больных использовали методы описательной статистики и частотного анализа. Для анализа вероятности событий использовали классические методы событийного анализа. Оценку общей выживаемости (ОВ) выполняли по методу Каплана – Майера. Оценку вероятности достижения МО выполняли с помощью метода кумулятивной частоты событий. Событиями являлись достижение глубокого МО и стабильного глубокого МО, а также смерти по любой причине. Длительность времени до события рассчитывали от даты начала терапии ИТК. Вероятность сохранения глубокого МО оценивали после даты его первого достижения. Расчеты выполняли с использованием процедур программы SAS, версия 9.4.
Результаты
Общая выживаемость больных ХМЛ и терапия на момент выполнения анализа
К декабрю 2019 г. медиана срока наблюдения за больными в исследовании EUTOS PBS составила 86 мес. или 7,2 года (диапазон — от 3 мес. до 10 лет). За указанный период на вторую линию терапии ИТК был переведен 31 (17 %) из 192 больных, третью линию терапии ИТК получали 3 (1,6 %) больных. Смена иматиниба на ИТК второго поколения (ИТК2) была выполнена у 27 больных: у 25 (93 %) в связи с неэффективностью; у 2 (7 %) — по решению врача, при оптимальном ответе (БМО).
Смена нилотиниба на иматиниб выполнена у 4 из 6 больных, получавших нилотиниб в первой линии лечения, в связи с невозможностью обеспечения в регионе. На момент смены терапии у 3 больных был оптимальный ответ (БМО — у 2 больных, глубокий МО — у 1 больного), у 1 больного была неудача нилотиниба в первой линии.
Всего за время наблюдения умерли 55 (28 %) из 197 больных: 29 (53 %) — из-за прогрессии ХМЛ, 20 (36 %) — в связи с сопутствующими заболеваниями, 1 (2 %) — в связи с осложнениями после алло-ТГСК, 5 (9 %) — по неизвестной причине.
Все 5 больных с изначальной ХФ, получавшие только терапию гидроксимочевиной, умерли. Из 192 больных, получавших терапию ИТК, умерли 50 (26 %) больных: 43 (24 %) из 176 больных с изначальной ХФ, 5 (36 %) из 14 больных с ФА и оба больных с БК. Соответственно, среди больных, получавших терапию ИТК, на момент выполнения анализа были живы 142 (81 %) из 176 больных с изначальной ХФ и 9 (64 %) из 14 больных с ФА.
ОВ на терапии ИТК у 176 больных с ХФ составила 78 % (95%-ный доверительный интервал (95% ДИ): 72–83 %) через 7 лет (84 мес.) и 69 % (95% ДИ: 58–78 %) через 9 лет (108 мес. %). ОВ на терапии ИТК у 14 больных с ФА составила 63 % (95% ДИ: 34–83 %) через 7 и 9 лет (рис. 1).
Вероятность достижения глубокого МО у больных с ХФ ХМЛ
Оценка достижения глубокого МО на основании данных молекулярного мониторинга была возможной у 172 из 176 больных в ХФ ХМЛ, получавших терапию ИТК. Четверо больных были исключены из анализа: 3 больных с предположительно атипичным транскриптом BCR::ABL1 и 1 — в связи с отсутствием молекулярного мониторинга и смертью по неизвестной причине.
Глубокий МО был получен у 98 (57 %) из 172 больных в ХФ ХМЛ. Вероятность достижения глубокого МО составила 38 % (95% ДИ: 32–47 %) через 3 года (36 мес.), 48 % (95% ДИ: 40–55 %) через 5 лет (60 мес.) и 56 % (95% ДИ: 47–63 %) через 7 лет (84 мес.) (рис. 2А). Отмечены значимые различия достижения глубокого МО в зависимости от группы риска Sokal [22] (p = 0,0179); значимых различий достижения глубокого МО в зависимости от группы риска ELTS [23] не было (p = 0,19).
У больных, имевших БМО через 24 мес. терапии ИТК, вероятность получения глубокого МО в дальнейшем была достоверно выше по сравнению с больными, которые достигли только МО2 к этому сроку лечения, и больными, которые не достигли МО2 (p < 0,0001). Вероятность последующего достижения глубокого МО для больных, достигших БМО через 24 мес. терапии, составила 32 % (95% ДИ: 19–46 %) к 36 мес. терапии, 59 % (95% ДИ: 43–73 %) к 60 мес. и 73 % (95% ДИ: 55–84 %) к 84 мес. (рис. 2Б).
Кинетика МОБ у больных с ХФ ХМЛ и достижение стабильного глубокого МО
Достигнутый глубокий МО не у всех больных сохранялся постоянно на фоне продолжающейся терапии ИТК. Вероятность сохранения глубокого МО после его первого достижения у больных с ХФ ХМЛ составила 69 % (95% ДИ: 62–81 %) через 12 мес., 56 % (95% ДИ: 48–69 %) через 36 мес. и 45 % (95% ДИ: 38–60 %) через 60 мес. (рис. 3).
Однако за время мониторинга на фоне продолжающейся терапии могла отмечаться как потеря глубокого МО (уровни BCR::ABL1 более 0,01 %) и БМО (уровни BCR::ABL1 более 0,1 %), так и последующее восстановление этих видов МО.
На момент подведения итогов (декабрь 2019 г.) были живы 92 (94 %) из 98 больных с ХФ ХМЛ и глубоким МО. У 80 (81 %) больных были данные о динамике МО после получения глубокого МО. При оценке кинетики МОБ на дату последней оценки у этих 80 больных отмечены три основных варианта поведения остаточного лейкемического клона после достижения глубокого МО: 1) постоянное сохранение глубокого МО у 57 (71 %) больных; 2) транзиторная потеря глубокого МО или БМО с последующим восстановлением этих видов МО у 15 (19 %) больных; 3) потеря БМО у 8 (10 %) больных.
Кумулятивная частота достижения стабильного глубокого МО (глубокий МО длительностью 2 года) среди 172 больных с ХФ ХМЛ составила 4 % (95% ДИ: 2–8 %) через 3 года терапии ИТК, 16 % (95% ДИ: 11–22 %) через 5 лет, 29 % (95% ДИ: 22–37 %) через 7 лет и 50 % (95% ДИ: 38–60 %) через 9 лет терапии (рис. 4А).
Вероятность достижения стабильного глубокого МО зависела от уровня BCR::ABL1 и соответствующего МО через 3 года терапии ИТК. К этому сроку наблюдения для анализа были доступны данные 147 больных: у 43 был достигнут МО2, у 38 — БМО, у 36 — глубокий МО.
У больных, которые уже достигли глубокого МО к 3 годам терапии, вероятность последующего достижения стабильного глубокого МО была достоверно выше, чем у больных, которые достигли только БМО или МО2 к этому сроку наблюдения (p < 0,0001). При получении глубокого МО к 3 годам терапии кумулятивная частота достижения стабильного глубокого МО составила 40 % (95% ДИ: 28–53 %) через 5 лет, 66 % (95% ДИ: 52–77 %) — через 7 лет и 89 % (95% ДИ: 64–97 %) — через 9 лет терапии (рис. 4Б).
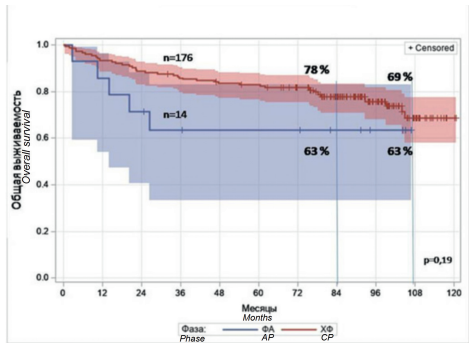
Рисунок 1. Общая выживаемость больных ХМЛ, получавших терапию ИТК в российской части исследования EUTOS PBS в хронической фазе и фазе акселерации
Figure 1. Overall survival of patients with CML on TKI therapy in the Russian part of EUTOS PBS in chronic phase and accelerated phase. AP — accelerated phase, CP — chronic phase
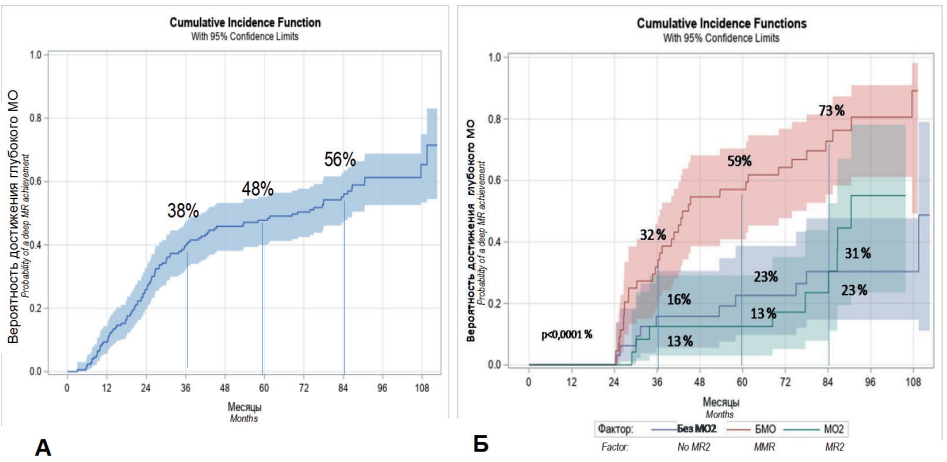
Рисунок 2. Вероятность достижения глубокого МО у 172 больных с ХФ ХМЛ в исследовании EUTOS PBS: А — во всей подгруппе больных с ХФ ХМЛ, Б — в зависимости от достигнутого МО через 24 мес. терапии
Figure 2. Probability of deep MR achievement in 172 patients with CP CML in EUTOS PBS trial: A — in a subgroup of CP CML patients, В — depending on MR at 24 months of therapy

Рисунок 3. Вероятность сохранения глубокого МО у 98 больных с ХФ ХМЛ в исследовании EUTOS PBS
Figure 3. Probability of maintaining deep MR in 98 patients with CP CML in EUTOS PBS trial
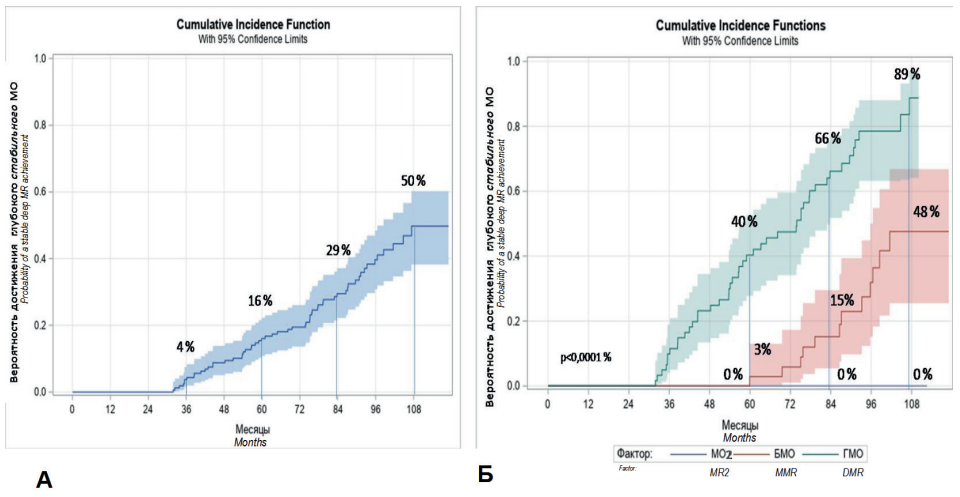
Рисунок 4. Вероятность достижения стабильного глубокого МО у 172 больных с ХФ ХМЛ в исследовании EUTOS PBS: А — во всей подгруппе больных с ХФ ХМЛ, Б — в зависимости от МО через 36 мес. терапии
Figure 4. Probability of a stable deep molecular response in 172 patients with CP CML in EUTOS PBS trial: A — in a subgroup of CP CML patients, B — depending on MR a 36 months of therapy
При наличии только БМО к 3 годам терапии кумулятивная частота последующего достижения стабильного глубокого МО составила 3 % (95% ДИ: 0–13 %) через 5 лет, 15 % (95% ДИ: 5–30 %) — через 7 лет и 48 % (95% ДИ: 25–67 %) — через 9 лет. Ни у одного больного, имевшего только МО2 через 3 года терапии, при дальнейшем наблюдении не был получен стабильный глубокий МО.
Характеристика больных, соответствовавших критериям наблюдения в РБЛ
Этапы оценки соответствия критериям наблюдения в РБЛ у больных ХМЛ в исследовании EUTOS PBS представлены на рисунке 5. Итоговое число потенциальных кандидатов для отмены терапии ИТК со стабильным глубоким МО сроком более 2 лет составило 54 (55 %) из 98 больных с глубоким МО. Доля потенциальных кандидатов для отмены терапии составила 28 % от всех 192 больных, получавших терапию ИТК в исследовании, или 31 % в пересчете на больных только с ХФ ХМЛ.

Рисунок 5. Оценка числа потенциальных кандидатов для отмены ИТК и наблюдения в РБЛ среди 197 больных ХМЛ в исследовании EUTOS PBS
Figure 5. Evaluation of the number of potential candidates for discontinuation of TKI therapy and TFR observation in 197 CML patients in EUTOS PBS trial
Медиана возраста 54 больных, которые соответствовали критериям наблюдения в РБЛ, составила 54 года (диапазон — от 24 до 80 лет). Наибольшее число больных было из группы низкого риска по Sokal [22] и ELTS [23]: 26 (48 %) и 33 (61 %) больных соответственно (табл. 2).
Таблица 2. Характеристика 54 больных ХМЛ, соответствовавших критериям наблюдения в РБЛ, в исследования EUTOS PBS
Table 2. Characteristics of 54 CML patients with corresponding criteria of TFR observation in EUTOS PBS trial
|
Характеристика / Characteristics |
Значения / Value |
|
Соотношение мужчины/женщины / Male/female ratio, n (%) |
24 (44 %) / 30 (56 %) |
|
Возраст, медиана (диапазон), годы / Age, median (range), years |
54 (24–80) |
|
Возраст мужчин, медиана (диапазон), годы / Male age, median (range), years |
50 (24–79) |
|
Возраст женщин, медиана (диапазон), годы / Female age, median (range), years |
57 (31–80) |
|
Группа риска Sokal / Sokal risk score, n (%): |
|
|
низкий риск / low risk |
26 (48 %) |
|
промежуточный риск / intermediate risk |
15 (28 %) |
|
высокий риск / high risk |
13 (24 %) |
|
Группа риска ELTS / ELTS risk score, n (%): |
|
|
низкий риск / low risk |
33 (61 %) |
|
промежуточный риск / intermediate risk |
13 (24 %) |
|
высокий риск / high risk |
8 (15 %) |
|
Длительность терапии ИТК, медиана (диапазон), годы Duration of TKI therapy, median (range), years |
8,4 (3,5–10,1) |
|
Длительность глубокого МО, медиана (диапазон), годы Duration of deep MR, median (range), years |
5,4 (2–9,1) |
|
Терапия ИТК / TKI therapy |
|
|
иматиниб в 1-й линии / imatinib in the first line |
50 (93 %) |
|
иматиниб продолжен / imatinib continued |
45 (83 %) |
|
смена на нилотиниб во 2-й линии / switch to nilotinib in 2nd line |
4 (7 %) |
|
смена на дазатиниб во 2-й линии / switch to dasatinib in 2nd line |
1 (2 %) |
|
ИТК2 нилотиниб в 1-й линии / TKI2 nilotinib in the first line |
4 (7 %) |
|
нилотиниб продолжен / nilotinib continued |
2 (3,5 %) |
|
смена нилотиниба на иматиниб во 2-й линии / switch from nilotinib to imatinib in 2nd line |
2 (3,5 %) |
На момент выполнения анализа медиана длительности терапии ИТК составила 8,4 года (диапазон — от 3,5 до 10,1 года); медиана длительности глубокого МО составила 5,4 года (диапазон — от 2 до 9,1 года). Двое больных уже наблюдались в РБЛ при последней оценке и были цензурированы датой последнего приема ИТК, на момент которой сроки терапии у них составляли 3,5 и 4,3 года соответственно.
Изначально 50 (93 %) больных получали иматиниб, 4 (7 %) получали ИТК2 нилотиниб в первой линии терапии. У 2 из 4 больных, получавших нилотиниб в первой линии лечения, впоследствии был выполнен перевод на иматиниб в связи с невозможностью обеспечения нилотинибом. На момент перевода с нилотиниба на иматиниб оба больных уже достигли глубокого МО, и глубокий МО сохранялся при последующем наблюдении.
У 5 (9 %) из 54 больных в итоговой выборке проводилась терапия ИТК2 во второй линии. У 3 больных смена иматиниба на ИТК2 была выполнена в связи с отсутствием оптимального ответа на иматиниб: у 2 больных на первом году терапии иматинибом, у 1 больного — на 6-м году лечения иматинибом, после потери достигнутого ранее БМО. Еще у 2 больных перевод на ИТК2 был выполнен по решению врача: 1 больная с БМО для индукции глубокого МО и планирования беременности и 1 больная — на ранних этапах терапии иматинибом (2 мес. лечения).
Обсуждение
Оценка числа потенциальных кандидатов для наблюдения в фазе РБЛ у больных ХМЛ с глубоким МО проводились в российской когорте больных впервые, эти результаты на настоящий момент не отражены в литературе.
У 92 % больных в российской части многоцентрового проспективного наблюдательного исследования EUTOS PBS на момент диагноза отмечалась ХФ ХМЛ, при которой ожидаемая эффективность терапии ИТК является наиболее высокой. При этом 7-летняя ОВ у больных с ХФ ХМЛ составила 78 % (95% ДИ: 72–83 %), 9-летняя ОВ — 69 % (95% ДИ: 58–78 %). Эти значения ниже полученных в других исследованиях, в которых 10-летняя ОВ составляла 85–87 % [1, 25, 26]. Предположительно, свой вклад в это могла внести ограниченная доступность ИТК2 в клинической практике и отсутствие своевременного перевода на ИТК2. Как было установлено ранее, большинство смертей в российской когорте больных отмечалось на первом году терапии и было связано с прогрессией ХМЛ [27].
Вероятность достижения глубокого МО у больных с ХФ ХМЛ через 3, 5 и 7 лет терапии ИТК составила 38 % (95% ДИ: 32–47 %), 48 % (95% ДИ: 40–55 %) и 56 % (95% ДИ: 47–63 %) соответственно. Эти результаты сопоставимы с данными многих исследований, в которых оценивалось достижение глубокого МО при проведении терапии иматинибом и ИТК2 [28–30]. Нерегулярный молекулярный мониторинг в клинической практике мог оказать влияние на результаты оценки сроков достижения глубокого МО в настоящем исследовании.
Достижение глубокого МО являлось только первым шагом для оценки последующей возможности отмены ИТК. Установлено, что вероятность сохранения глубокого МО после его первого достижения составила 56 % (95% ДИ: 48–69 %) через 36 мес. и 45 % (95% ДИ: 38–60 %) через 60 мес. Таким образом, возможность последующего рассмотрения больных в качестве кандидатов для отмены терапии отмечалась примерно у половины больных с глубоким МО.
Достижение стабильного глубокого МО длительностью более 2 лет было более поздним событием. Кумулятивная частота достижения стабильного глубокого МО в ХФ ХМЛ составила 16 % (95% ДИ: 11–22 %) через 5 лет терапии ИТК, 29 % (95% ДИ: 22–37 %) — через 7 лет и 50 % (95% ДИ: 38–60 %) — через 9 лет.
Выбранные в качестве критериев наблюдения в РБЛ срок терапии ИТК более 3 лет и длительность стабильного глубокого МО более 2 лет применялись как в ряде зарубежных исследований по изучению РБЛ [8][15][31–38], так и в российском проспективном исследовании RU-SKI. Соответствие указанным критериям, при медиане наблюдения около 7 лет, отмечено у 55 % больных с достигнутым ранее глубоким МО или 31 % в пересчете на всю когорту больных с ХФ ХМЛ. Среди потенциальных кандидатов для отмены ИТК не было больных с длительно существующей резистентностью к терапии.
Как в исследовании RU-SKI, так и в других исследованиях, было установлено, что вероятность сохранения РБЛ после отмены ИТК возрастает с увеличением срока предшествующей терапии и срока стабильного глубокого МО. В рекомендациях ELN 2020 [18] минимальный рекомендуемый срок терапии ИТК перед попыткой отмены лечения составляет 5 лет для иматиниба и 4 года — для ИТК2. Преимущество ИТК2 перед иматинибом в первой линии терапии продемонстрировано только в отдельных исследованиях на основании косвенных данных [34][35][37]. В исследовании RU-SKI было отмечено, что применение ИТК2 в первой линии лечения может сократить общий срок терапии до успешного ведения в РБЛ [39], однако этот вопрос требует дальнейшего изучения в проспективных исследованиях. В российской когорте больных ХМЛ в исследовании EUTOS PBS сроки терапии иматинибом и ИТК2 перед достижением стабильного глубокого МО сложно сравнивать из-за небольшого числа больных, получавших ИТК2 в первой линии лечения, особенно с учетом того факта, что 4 из 6 больных были переведены на лечение иматинибом после применения нилотиниба в первой линии.
Как показал анализ результатов терапии ИТК в исследовании EUTOS PBS, прогнозирование возможности получения стабильного глубокого МО начинается на ранних этапах терапии ИТК. В рекомендациях ELN 2009 г., которые были актуальны в период набора больных в исследование EUTOS PBS, достижение БМО через 18 мес. являлось критерием оптимального ответа на лечение. Оценить достижение БМО именно к этому сроку наблюдения у больных в исследовании EUTOS PBS с привязкой к этому сроку терапии не было возможным из-за относительно нерегулярного молекулярного мониторинга в условиях клинической практики. Однако нами установлено, что достижение БМО на сроке 24 мес. терапии ИТК являлось ключевым условием последующего получения глубокого МО, а отсутствие БМО к 36 мес. терапии ИТК полностью исключало возможность получения стабильного глубокого МО в последующем. Также отмечено, что достижение глубокого МО через 36 мес. терапии значимо повышает вероятность получения стабильного глубокого МО в дальнейшем, и именно эта категория больных ХМЛ может рассматриваться в качестве кандидатов для отмены терапии ИТК.
Практическая ценность выполненного анализа в том, что полученные данные позволяют прогнозировать, в каких группах больных и в какие сроки возможно рассматривать потенциальных кандидатов для отмены ИТК и наблюдения в РБЛ, а также выстроить оптимальную стратегию терапии больных на 1–2-м году лечения с целью увеличения доли больных с наименьшим риском прогрессии заболевания и наибольшей вероятностью отмены ИТК.
Таким образом, перевод в фазу наблюдения в РБЛ при ХМЛ, является одной из новых и перспективных целей лечения, однако эта опция доступна далеко не всем больным. В российской части проспективного наблюдательного многоцентрового исследования EUTOS PBS было установлено, что при медиане срока терапии ИТК 7 лет около трети больных с ХФ ХМЛ могут являться кандидатами для контролируемой отмены терапии. Это означает, что при сохранении у половины из этих больных молекулярной ремиссии, продолжить наблюдение в РБЛ смогут до 15 % от изначального числа больных. Получение оптимального ответа на ранних этапах лечения с помощью своевременной смены ИТК может позволить увеличить число потенциальных кандидатов для отмены терапии. Детальный фармакоэкономический прогноз применения подхода с ранней индукцией глубокого МО для включения большего числа больных в фазу наблюдения в РБЛ является перспективным направлением разработки оптимальной стратегии терапии больных ХМЛ.
Список литературы
1. Hochhaus A., Larson R.A., Guilhot F., et al. Long term outcomes of imatinib treatment for chronic myeloid leukemia. N Engl J Med. 2017; 376(10): 917–27. DOI: 10.1056/NEJMoa1609324.
2. Bower H., Bjorkholm M., Dickman P.W., et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol. 2016; 34(24): 2851–7. DOI: 10.1200/JCO.2015.66.2866.
3. Туркина А.Г., Зарицкий А.Ю., Шуваев В.А. и др. Клинические рекомендации по диагностике и лечению хронического миелолейкоза. Клиническая онкогематология. 2017; 10(3): 294–316. DOI: 10.21320/25002139-2017-10-3-294-316.
4. Baccarani M., Deininger M.W., Rosti G., et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013; 122(6): 872–84. DOI: 10.1182/blood-2013-05-501569.
5. Mughal T., Goldman J. Chronic myeloid leukemia: Current status and controversies. Oncology. 2004; 18(7): 837–44.
6. Goldman J.M. Chronic myeloid leukemia: Molecular targeting as a basis for therapy. Rev Clin Exp Hematol. 2004; 7(1): 64–72.
7. Roeder I., Horn M., Glauche I., et al. Dynamic modeling of imatinib-treated chronic myeloid leukemia: Functional in sights and clinical implications. Nat Med. 2006; 12(10): 1181–4. DOI: 10.1038/nm1487.
8. Mahon F.X., Rea D., Guilhot J., et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: The prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol. 2010; 11(11): 1029–35. DOI: 10.1016/S1470-2045(10)70233-3.
9. Ross D.M., Branford S.M., Seymour J.F., et al. Safety and efficacy of imatinib cessation for CML patients with stable undetectable minimal residual disease: Results from the TWISTER study. Blood. 2013; 122(4): 515–22. DOI: 10.1182/ blood-2013-02-483750.
10. Ross D.M., Pagani I.S., Shanmuganathan N., et al. Long-term treatment-free remission of chronic myeloid leukemia with falling levels of residual leukemic cells. Leukemia. 2018; 32(12): 2572–9. DOI: 10.1038/s41375-018-0264-0.
11. Shah N.P., García-Gutiérrez V., Jiménez-Velasco A., et al. Dasatinib discontinuation in patients with chronic-phase chronic myeloid leukemia and stable deep molecular response: The DASFREE study. Leuk Lymphoma. 2020; 61(3): 650–9. DOI: 10.1080/10428194.2019.1675879.
12. Saussele S., Richter J., Guilhot J., et al. Discontinuation of tyrosine kinase in hibitor therapy in chronic myeloid leukaemia (EURO-SKI): A prespecified in terim analysis of a prospective, multicentre, non-randomised, trial. Lancet Oncol. 2018; 19(6): 747–57. DOI: 10.1016/S1470-2045(18)30192-X.
13. Kumagai T., Nakaseko C., Nishiwaki K., et al. Dasatinib cessation after deep molecular response exceeding 2 years and natural killer cell transition during dasatinib consolidation. Cancer Science. 2018; 109(1): 182–92. DOI: 10.1111/cas.13430.
14. Takahashi N., Nishiwaki K., Nakaseko C., et al. Treatment-free remission after two-year consolidation therapy with nilotinib in patients with chronic myeloid leukemia: STAT2 trial in Japan. 2018; 103(11): 1835–42. DOI: 10.3324/haematol.2018.194894.
15. Туркина А.Г., Петрова А.Н., Челышева Е.Ю. и др. Результаты проспективного исследования по наблюдению больных хроническим миелолейкозом после прекращения терапии ингибиторами тирозинкиназ. Гематология и трансфузиология. 2020; 65(4): 370–85. DOI: 10.35754/0234-5730-2020-65-4-370-385.
16. Lou J., Huang J., Wang Z., et al. Chronic myeloid leukemia patients and treatment-free remission attitudes: A multicenter survey. Patient Prefer Adherence. 2018; 12: 1025–32. DOI: 10.2147/PPA.S163393.
17. Jiang Q., Liu Z.C., Zhang S.X., Gale R.P. Young age and high cost are associated with future preference for stopping tyrosine kinase in hibitor therapy in Chinese with chronic myeloid leukemia. J Cancer Res Clin Oncol. 2016; 142(7): 1539–47. DOI: 10.1007/s00432-016-2159-7.
18. Hochhaus A., Baccarani M., Silver R.T., et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. 2020; 34(4): 966–84. DOI: 10.1038/s41375-020-0776-2.
19. Туркина А.Г., Новицкая Н.В., Голенков А.К. и др. Регистр больных хроническим миелолейкозом в Российской Федерации: от наблюдательного исследования к оценке эффективности терапии в клинической практике. Клиническая онкогематология. 2017; 10(3): 390–401. DOI: 10.21320/25002139-2017-10-3-390-401.
20. Hoffmann V.S., Baccarani M., Hasford J., et al. Treatment and outcome of 2904 CML patients from the EUTOS population-based registry. Leukemia. 2017; 31(3): 593–601. DOI: 10.1038/leu.2016.246.
21. Лазарева О.В., Туркина А.Г., Челышева Е.Ю. и др. Клиническая и гематологическая характеристика больных хроническим миелолейкозом в современных условиях: результаты российской части международного многоцентрового проспективного популяционного исследования EUTOS Population-based CML Study. Клиническая онкогематология. 2017; 10(1): 65–74. DOI: 10.21320/2500-2139-2017-10-1-65-74.
22. Sokal J.E., Cox E.B., Baccarani M., et al. Prognostic discrimination in “goodrisk” chronic granulocytic leukemia. Blood. 1984; 63(4): 789–99.
23. Pfirrmann M., Baccarani M., Saussele S., et al. Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia. Leukemia. 2016; 30(1): 48–56. DOI: 10.1038/leu.2015.261.
24. Bruford E.A., Antonescu C.R., Carroll A.J., et al. HUGO Gene Nomenclature Committee (HGNC) recommendations for the designation of gene fusions. Leukemia. 2021; 35(11): 3040–3. DOI: 10.1038/s41375-021-01436-6.
25. Шухов О.А. Молекулярная и цитогенетическая характеристика Ph-позитивного клона у больных хроническим миелолейкозом при длительном воздействии ингибиторов тирозинкиназ: дисс. канд. мед. наук. М.; 2015.
26. Лазарева О.В., Туркина А.Г., Гусарова Г.А. и др. Итоги 12-летней терапии ингибиторами тирозинкиназ больных в поздней хронической фазе хронического миелолейкоза после неудачи лечения ИФН-α. Сибирский научный медицинский журнал. 2015; 35(1): 90–7.
27. Туркина А.Г., Лазарева О.В., Челышева Е.Ю. и др. Результаты терапии больных хроническим миелолейкозом по данным российской части международного многоцентрового популяционного исследования EUTOS population-based study (EUTOS –PBS). Гематология и трансфузиология. 2019; 64(2): 106–21. DOI: 10.35754/0234-5730-2020-65-4-370-385.
28. Hehlmann R., Muller M.C., Lauseker M., et al. Deep molecular response is reached by the majority of patients treated with imatinib, predicts survival, and is achieved more quickly by optimized high-dose imatinib: Results from the randomized CML-study IV. J Clin Oncol. 2014; 32(5): 415–23. DOI: 10.1200/JCO.2013.49.9020.
29. Hochhaus A., Saglio G., Hughes T.P., et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia. 2016; 30(5): 1044–54. DOI: 10.1038/leu.2016.5.
30. Cortes J.E., Saglio G., Kantarjian H.M., et al. 5-year study results of DASISION: The dasatinib versus imatinib study in treatment-naive chronic myeloid leukemia patients trial. J Clin Oncol. 2016; 34(20): 2333–40. DOI: 10.1200/ JCO.2015.64.8899.
31. Etienne G., Guilhot J., Rea D., et al. Long-term follow-up of the French Stop Imatinib (STIM1) study in patients with chronic myeloid leukemia. J Clin Oncol. 2017; 35(3): 298–305. DOI: 10.1200/JCO.2016.68.2914.
32. Ross D.M., Branford S., Seymour J.F., et al. Safety and efficacy of imatinib cessation for CML patients with stable undetectable minimal residual disease: Results from the TWISTER study. Blood. 2013; 122(4): 515–22. DOI: 10.1182/ blood-2013-02-483750.
33. Rousselot P., Charbonnier A., Cony-Makhoul P., et al. Loss of major molecular response as a trigger for restarting tyrosine kinase in hibitor therapy in patients with chronic-phase chronic myelogenous leukemia who have stopped imatinib after durable undetectable disease. J Clin Oncol. 2014; 32(5): 424–30. DOI: 10.1200/JCO.2012.48.5797.
34. Hochhaus A., Masszi T., Giles F.J., et al. Treatment-free remission following frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: Results from the ENESTfreedom study. Leukemia. 2017; 31(7): 1525–31. DOI: 10.1038/leu.2017.63.
35. Ross D.M., Masszi T., Gómez Casares M.T., et al. Durable treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: 96-week update of the ENESTfreedom study. J Cancer Res Clin Oncol. 2018; 144(5): 945–54. DOI: 10.1007/s00432-018-2604-x.
36. Rea D., Nicolini F.E., Tulliez M., et al. Discontinuation of dasatinib or nilotinib in chronic myeloid leukemia: Interim analysis of the STOP 2G-TKI study. Blood. 2017; 129(7): 846–54. DOI: 10.1182/blood-2016-09-742205.
37. Shah N.P., García-Gutiérrez V., Jiménez-Velasco A., et al. Dasatinib discontinuation in patients with chronic-phase chronic myeloid leukemia and stable deep molecular response: The DASFREE study. Leuk Lymphoma. 2020; 61(3): 650–9. DOI: 10.1080/10428194.2019.1675879.
38. Nagafuji K., Matsumura I., Shimose T., et al. Cessation of nilotinib in patients with chronic myelogenous leukemia who have maintained deep molecular responses for 2 years: A multicenter phase 2 trial, stop nilotinib (NILSt). Int J Hematol. 2019; 110(6): 675–82. DOI: 10.1007/s12185-019-02736-5.
39. Шухов О.А., Петрова А.Н., Челышева Е.Ю. и др. Факторы сохранения молекулярной ремиссии после прекращения терапии ингибиторами тирозинкиназ у пациентов с хроническим миелолейкозом: результаты нерандомизированного проспективного клинического исследования. Клиническая онкогематология. 2021; 14(1): 1–12. DOI: 10.21320/2500-2139-2021-14-1-1-12.
Об авторах
Е. Ю. ЧелышеваРоссия
Челышева Екатерина Юрьевна, доктор медицинских наук, ведущий научный сотрудник отдела диагностики и лечения гематологических заболеваний
125167, Москва
О. В. Лазарева
Россия
Лазарева Ольга Вениаминовна, кандидат медицинских наук, руководитель управления регионального и межведомственного сотрудничества по профилю «гематология»
125167, Москва
А. Г. Туркина
Россия
Туркина Анна Григорьевна, доктор медицинских наук, профессор, руководитель клинико-диагностического отдела гематологии миелопролиферативных заболеваний
125167, Москва
О. Ю. Виноградова
Россия
Виноградова Ольга Юрьевна, доктор медицинских наук, заведующая Московским городским гематологическим центром; профессор кафедры онкологии, гематологии и лучевой терапии; главный научный сотрудник отдела кооперативных исследований в гематологии и онкологии у подростков и взрослых
125284, Москва
117997, Москва
117997, Москва
Л. В. Гаврилова
Россия
Гаврилова Любовь Владимировна, кандидат медицинских наук, гематолог
430032, Саранск
М. В. Галайко
Россия
Галайко Мария Владимировна, гематолог
129128, Москва
Д. Б. Дашеева
Россия
Дашеева Долгоржап Баторовна, гематолог, ГУЗ «Забайкальский краевой онкологический диспансер»
672012, Чита
А. С. Лучинин
Россия
Лучинин Александр Сергеевич, кандидат медицинских наук, гематолог клинико-диагностического отделения
610027, Киров
С. В. Мересий
Россия
Мересий Сергей Васильевич, гематолог, ГБУЗ Пермского края «Клиническая медико-санитарная часть № 1»
Пермь
О. М. Сендерова
Россия
Сендерова Ольга Михайловна, кандидат медицинских наук, гематолог
664003, Иркутск
А. А. Шутылев
Россия
Шутылев Антон Аркадьевич, гематолог
614990, Пермь
А. А. Куликовский
Россия
Куликовский Антон Анатольевич, ведущий специалист информационно-аналитического отдела
125167, Москва
С. М. Куликов
Россия
Куликов Сергей Михайлович, кандидат технических наук, начальник информационно-аналитического отдела
125167, Москва
Рецензия
Для цитирования:
Челышева Е.Ю., Лазарева О.В., Туркина А.Г., Виноградова О.Ю., Гаврилова Л.В., Галайко М.В., Дашеева Д.Б., Лучинин А.С., Мересий С.В., Сендерова О.М., Шутылев А.А., Куликовский А.А., Куликов С.М. Возможность наблюдения в ремиссии без лечения больных хроническим миелолейкозом со стабильным глубоким молекулярным ответом по данным российской части международного многоцентрового популяционного исследования EUTOS PBS. Гематология и трансфузиология. 2022;67(3):351–366. https://doi.org/10.35754/0234-5730-2022-67-3-351-366
For citation:
Chelysheva E.Yu., Lazareva O.V., Turkina A.G., Vinogradova O.Yu., Gavrilova L.V., Galayko M.V., Dasheeva D.B., Luchinin A.S., Meresiy S.V., Senderova O.M., Shutylev A.A., Kulikovskiy A.A., Kulikov S.M. Observation in a treatment-free remission in chronic myeloid leukemia patients with a stable deep molecular response in the Russian portion of the international multicenter population based study EUTOS PBS. Russian journal of hematology and transfusiology. 2022;67(3):351–366. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-351-366











































