Перейти к:
Комбинация ибрутиниба и венетоклакса с последующей терапией Т-клетками с химерным антигенным рецептором в первой линии лечения у пожилого больного лимфомой из клеток мантии с гиперлейкоцитозом и мутацией в гене ТР53
https://doi.org/10.35754/0234-5730-2022-67-3-441-452
Аннотация
Введение. Тактика терапии пожилых коморбидных больных лимфомой из клеток мантии (ЛКМ) с факторами неблагоприятного прогноза (ФНП) (комплексный кариотип, делеция 17р13, мутации в гене ТР53) не разработана. Использование интенсивных схем химиотерапии и трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) часто невозможно из-за коморбидности пожилых больных. Рациональным подходом является применение комбинации ибрутиниба и венетоклакса. В качестве альтернативы алло-ТГСК новой опцией для пожилых больных с ФНП является терапия Т-клетками с химерным антигенным рецептором (Chimeric Antigen Receptor T-cells, CAR-T-клетки).
Цель — представить опыт применения комбинации ибрутиниба и венетоклакса с последующей CAR-T-клеточной терапией в первой линии лечения у пожилого больного ЛКМ, у которого было множество ФНП.
Основные сведения. Больной М., 68 лет, был госпитализирован в октябре 2021 г. При обследовании были выявлены гиперлейкоцитоз (978 × 109/л), анемия (55 г/л), тромбоцитопения (30 × 109/л), спленомегалия (250 × 180 мм). По результатам лабораторных исследований была верифицирована ЛКМ с комплексным кариотипом, делецией 17р13, 13q14 и мутацией p.R248W в 7-м экзоне гена ТР53 (VAF = 26 %). С циторедуктивной целью проведено два сеанса лейкоцитафереза и предфаза циклофосфамидом (200 мг/м2) и дексаметазоном (10 мг/м2). С 3-го дня была начата терапия ибрутинибом в дозе 420 мг/сут. и венетоклаксом в дозе 100 мг/сут. Через 2 сут. количество лейкоцитов крови составило 0,7 × 109/л, уменьшились размеры селезенки, развился синдром лизиса опухоли. В результате интенсивной терапии, включавшей заместительную почечную терапию, состояние было стабилизировано, что позволило возобновить лечение. Через 7 сут. в анализе крови количество лейкоцитов стало 2,5 × 109/л, нейтрофилов — 70 %, тромбоцитов — 90 × 109/л, гемоглобин — 95 г/л. По данным иммунофенотипирования, популяция В-лимфоцитов составила 4 %. По данным секвенирования нового поколения аллельная нагрузка мутации в гене ТР53 — 0,8 %. Больному была проведена анти-CD19 CAR-T-клеточная терапия, достигнута полная ремиссия. Через 3 мес. после терапии сохраняется МОБ (минимальная остаточная болезнь) — негативная ремиссия и определяется персистенция CAR-T-клеток.
Ключевые слова
Для цитирования:
Звонков Е.Е., Королева Д.А., Габеева Н.Г., Щекина А.Е., Теляшов М.А., Алешина О.А., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Гальцева И.В., Двирнык В.Н., Троицкая В.В., Галстян Г.М., Масчан М.А., Паровичникова Е.Н. Комбинация ибрутиниба и венетоклакса с последующей терапией Т-клетками с химерным антигенным рецептором в первой линии лечения у пожилого больного лимфомой из клеток мантии с гиперлейкоцитозом и мутацией в гене ТР53. Гематология и трансфузиология. 2022;67(3):441-452. https://doi.org/10.35754/0234-5730-2022-67-3-441-452
For citation:
Zvonkov E.E., Koroleva D.A., Gabeeva N.G., Shchekina A.E., Telyashov M.A., Aleshina O.A., Biderman B.V., Sudarikov A.B., Obukhova T.N., Galtseva I.V., Dvirnik V.N., Troitskaya V.V., Galstyan G.M., Maschan M.A., Parovichnikova E.N. Combination of ibrutinib and venetoclax followed by Chimeric Antigen Receptor T-cell therapy in the first line of treatment in an elderly patient with mantle cell lymphoma with hyperleukocytosis and mutation in the TP53 gene. Russian journal of hematology and transfusiology. 2022;67(3):441-452. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-441-452
Введение
Лимфома из клеток мантии (ЛКМ) — это СD5-позитивная В-клеточная лимфатическая опухоль, в большинстве случаев с генетически обусловленной гиперэкспрессией белка Cyclin D1, гетерогенным клиническим течением и результатом ответа на противоопухолевую терапию [1]. ЛКМ чаще болеют мужчины, медиана возраста начала заболевания — 65 лет. Клинические проявления и прогноз ЛКМ определяются степенью биологической прогрессии опухоли [2]. Появление мутации в гене ТР53 в ходе неизбежной эволюции ЛКМ проявляется агрессивным клиническим течением, часто высоким лейкоцитозом, комплексным кариотипом и резистентностью к ДНК-токсичным цитостатическим препаратам [3][4]. Тактика лечения ЛКМ с мутацией в гене ТР53 до сих пор не определена [4–6]. Для молодых больных ЛКМ с мутацией в гене ТР53 наиболее оправданной стратегией является проведение максимально интенсивной комбинированной (цитостатические и таргетные препараты) терапии [6]. В случае неэффективности терапии и рецидива заболевания рассматривается вопрос о проведении трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) или терапии T-клетками с химерным антигенным рецептором (Chimeric Antigen Receptor T-cell, CAR-T) [7–9].
Среди больных ЛКМ наиболее сложной терапевтической группой являются пожилые люди с мутацией в гене ТР53, у которых при имеющейся нередко коморбидности невозможно проведение интенсивных курсов химиотерапии (ХТ) и алло-ТГСК [10][11]. Применение «стандартных» режимов ХТ (R-CHOP, R-B и т. д.) для этой группы больных неэффективно и приводит к накоплению тяжелой токсичности и ранней прогрессии заболевания в 100 % случаях [12]. Данные об использовании монотаргетной терапии, а также би- и политаргетной терапии у пожилых больных ЛКМ с мутациями в гене ТР53 в первой линии терапии ограничены единичными описаниями, короткими сроками наблюдения и трудно интерпретируемы [13]. Ранее опубликованные успешные результаты применения комбинации ибрутиниба и венетоклакса в первой линии терапии больных хроническим лимфолейкозом (ХЛЛ) с мутациями в гене ТР53 дают основания для применения этого сочетания и у больных ЛКМ из группы высокого риска [14][15].
Имеющиеся данные об использовании комбинации ритуксимаба и ибрутиниба в первой линии терапии ЛКМ свидетельствуют о ее высокой эффективности, однако при длительном приеме у половины больных потребовалась редукция дозы или полное прекращение лечения, что было обусловлено высокой токсичностью [16]. Еще более сложная ситуация наблюдается в случаях, когда ЛКМ протекает с гиперлейкоцитозом, при котором введение ритуксимаба может приводить к развитию синдрома лизиса опухоли [17][18], а применение ибрутиниба — к дальнейшему нарастанию лейкоцитоза [19]. Единственной возможной опцией лечения пожилых больных ЛКМ с мутациями в гене ТР53 на сегодняшний день является CAR-T-клеточная терапия [20]. Доказана эффективность CAR-T-клеточной терапии у больных с рецидивирующим/рефрактерным (Р/Р) течением ЛКМ, даже при наличии мутаций в гене ТР53, однако в качестве терапии «первой линии» она пока не применялась [8]. Может ли CAR-T-клеточная терапия служить равноценной альтернативой алло-ТГСК у больных ЛКМ с мутацией в гене ТР53, также еще предстоит выяснить.
Цель настоящей работы — представить опыт применения комбинации ибрутиниба и венетоклакса с последующей CAR-T-клеточной терапией в первой линии лечения у пожилого больного ЛКМ, у которого было множество факторов неблагоприятного прогноза.
Клиническое наблюдение
Больной М., 68 лет, в октябре 2021 г. отметил увеличение в объеме живота, тяжесть в левом подреберье, нарастание общей слабости и появление признаков дыхательной недостаточности. Ранее у больного были диагностированы хроническая обструктивная болезнь легких на фоне длительного стажа курения и хроническая сердечная недостаточность. При обследовании были выявлены спленомегалия (размеры селезенки составляли 250 × 180 мм) (рис. 1), гиперлейкоцитоз до 980 × 109/л (за счет лимфоцитоза 100 %) (рис. 2), тромбоцитопения — 32 × 109/л. С направительным диагнозом «острый лейкоз» в октябре 2021 г. больной был госпитализирован в ФГБУ «НМИЦ гематологии» Минздрава России. По данным стандартного цитогенетического исследования, были обнаружены множественные хромосомные аберрации. По данным флуоресцентной гибридизации in situ была выявлена транслокация (11;14)(q13;q32) и делеции 17p13 и 13q14. Был верифицирован диагноз «ЛКМ, бластоидный вариант». По критериям биологического международного прогностического индекса MIPIb [21] больной был отнесен к группе высокого риска (9,8). Анализ генов вариабельных участков иммуноглобулинов (IGVH) показал менее 98 % сходства с герминальным геном, что соответствует мутированному варианту заболевания. При выполнении секвенирования нового поколения 2–11-х экзонов гена ТР53 была обнаружена миссенс-мутация p.R248W в 7-м экзоне с аллельной нагрузкой (variable allele frequency, VAF) 26 %.
В связи с гиперлейкоцитозом с циторедуктивной целью больному были проведены две процедуры лейкоцитафереза, позволившие уменьшить количество лейкоцитов до 500 × 109/л. Учитывая наличие факторов неблагоприятного прогноза (ФНП), а именно мутацию в гене ТР53, комплексный кариотип, гиперлейкоцитоз и возраст больного, в качестве индукции ремиссии была начата битаргетная терапия ибрутинибом в дозе 420 мг/сут. и венетоклаксом в дозе 100 мг/сут. Через 2 сут. комбинированного применения ибрутиниба и венетоклакса количество лейкоцитов у больного составило 0,7 × 109/л, что осложнилось развитием синдрома лизиса опухоли, проявившимся метаболическим ацидозом, гиперкалиемией до 9,8 ммоль/л, нарушениями ритма сердца по типу желудочковой экстрасистолии и прогрессией острой дыхательной недостаточности. Больной был переведен в отделение реанимации и интенсивной терапии, где в течение 5 сут. ему проводили неинвазивную вентиляцию легких, продленную гемодиафильтрацию, антиаритмическую терапию и коррекцию метаболических и электролитных нарушений. После восстановления количества лейкоцитов и тромбоцитов больному была продолжена терапия ибрутинибом и венетоклаксом в прежних дозах. Через 10 дней в клиническом анализе крови количество лейкоцитов составило 5,5 × 109/л, нейтрофилы — 75 % (рис. 3). По данным инструментальных методов обследования (ультразвуковое исследование, компьютерная томография) размеры селезенки составили 85 × 132 мм (рис. 4). При контрольном исследовании аллельная нагрузка мутации в гене ТР53 составила 0,8 %. Методом 6-цветной проточной цитофлуориметрии (ПЦ) определялась минимальная остаточная болезнь (МОБ) 4,5 %. Таким образом, была достигнута только частичная ремиссия (ЧР) заболевания.
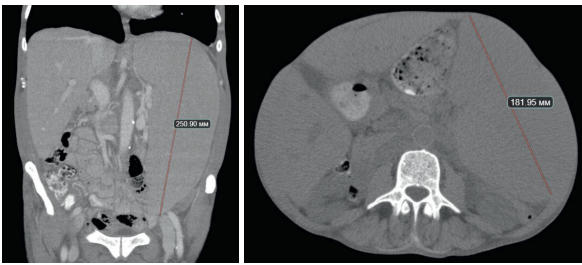
Рисунок 1. Компьютерная томография органов брюшной полости: спленомегалия 250 × 180 мм
Figure 1. Computed tomography of the abdomen: splenomegaly 250 × 180 mm
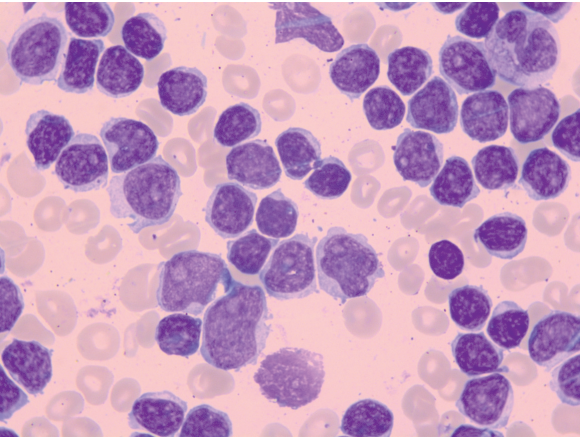
Рисунок 2. Цитологическое исследование мазка периферической крови в дебюте (лимфоциты — 97 %), ув. ×100, окраска азур-эозином
Figure 2. Cytological examination of a peripheral blood smear at the onset (lymphocytes — 97 %), magnification ×100, azure-eosin staining
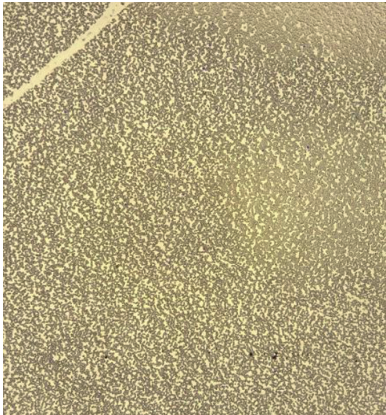
Рисунок 3. Цитологическое исследование мазка периферической крови на фоне терапии ибрутинибом и венетоклаксом (нейтрофилы — 75 %), ув. ×50, окраска азур-эозином
Figure 3. Cytological examination of a peripheral blood smear during therapy with ibrutinib and venetoclax (neutrophils — 75 %), magnification ×50, azure-eosin staining
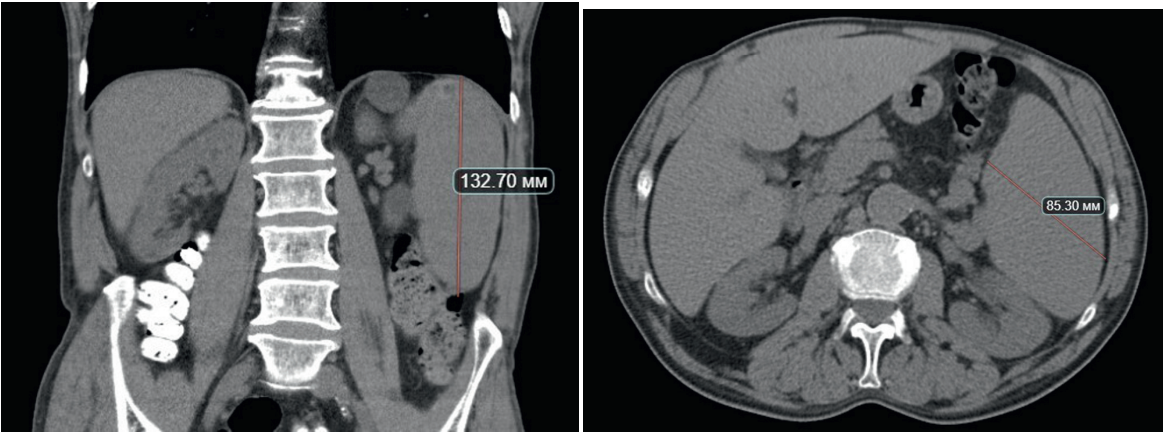
Рисунок 4. Компьютерная томография органов брюшной полости после лечения: размеры селезенки 85 × 132 мм
Figure 4. Computed tomography of the abdomen after treatment: the size of the spleen is 85 × 132 mm
В качестве консолидации больному было выполнено две трансфузии ауто-анти-CD19 CAR-T-клеток 2-го поколения с интервалом в 7 дней, созданных на основе антиген-распознающей части FMC63 и ко-стимулирующего домена 4-1ВВ. С целью лимфодеплеции больному была проведена ХТ по программе флударабин (25 мг/м2) и циклофосфамид (300 мг/м2) в течение 3 дней. Для профилактики синдрома выброса цитокинов (СВЦ) перед каждой трансфузией CAR-T-клеток вводили внутривенно тоцилизумаб в дозе 8 мг/кг. Первая доза CAR-T-клеток составила 0,1 × 106/кг массы тела, последующая — 1,06 × 106/кг массы тела. После трансфузии CAR-T-клеток СВЦ и нейротоксичности отмечено не было. После первой трансфузии количество персистирующих CAR-T-клеток составило 0,08 % от всех Т-клеток, МОБ методом ПЦ составила 0,22 % (табл. 1). Однако уже после второй трансфузии CAR-T-клеток количество персистирующих CAR-T-клеток составило 42,6 %, и была достигнута МОБ-негативность в периферической крови и костном мозге. Через 3 мес. после CAR-T-клеточной терапии у больного сохраняется полная ремиссия (ПР) заболевания, признаки МОБ в периферической крови и костном мозге отсутствуют. Персистенция CAR-T-клеток составляет 0,27 % (табл. 1).
Таблица 1. Мониторинг персистенции CAR-T-клеток
Table 1. Monitoring of CAR-T-cell persistenceѕ
|
Клеточный состав Cellular components |
После первой трансфузии After the first transfusion |
После второй трансфузии After the second transfusion |
Через 1 мес. One month after the transfusion |
Через 3 мес. Three months after the transfusion |
||||
|
% |
106/мл 106/mL |
% |
106/мл 106/mL |
% |
106/мл 106/mL |
% |
106/мл 106/mL |
|
|
Т-клетки T-cells |
37,79 |
0,14 |
67,15 |
0,67 |
19,06 |
0,25 |
15,6 |
0,36 |
|
В-клетки B-cells |
0,28 |
0,001019 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
|
CAR-T-клетки CAR-T-cells |
0,08 |
0,000115 |
42,61 |
0,290046 |
6,07 |
0,15253 |
0,27 |
0,00101 |
Обсуждение
В настоящем клиническом наблюдении ответ на лечение и МОБ-негативная ремиссия были достигнуты у больного с крайне неблагоприятным вариантом течения заболевания, благодаря обследованию и выбранной тактике лечения. От проведения интенсивной циторедуктивной ХТ было решено воздержаться, учитывая возраст больного и коморбидность (длительный стаж курения, хроническая обструктивная болезнь легких, хроническая сердечная недостаточность). Подобная ситуация не редкость у больных ЛКМ, среди которых пожилая когорта составляет примерно 50–60 % от общей популяции, а доля мужчин достигает 75 %, что также негативно сказывается на прогнозе заболевания [22, 23]. Согласно существующим рекомендациям [11][12][24], основным методом лечения пожилых больных ЛКМ является применение неинтенсивных программ ХТ (R-CHOP, R-B, R-BAC). Однако обнаружение мутации в гене ТР53 полностью исключило такую возможность. По данным литературы [3][4][25][26], наличие мутаций в гене ТР53 определяется примерно у 20 % больных ЛКМ в дебюте заболевания и ассоциируется с неблагоприятным прогнозом. В работе C.W. Eskelund и соавт. [4] в 2017 г. было показано, что у больных ЛКМ с мутациями в гене ТР53 даже интенсивная ХТ и ауто-ТГСК позволяют достичь медианы беспрогрессивной выживаемости (БПВ) только от 8 до 12 мес. Сопутствующая коморбидность у данного больного не предоставляла и этой возможности.
В настоящее время как оптимальный и эффективный метод лечения может быть рассмотрена таргетная терапия, применение которой обладает наименьшей токсичностью и позволяет обойти сигнальный путь р53. По аналогии с ХЛЛ, было предположено, что наибольшей эффективностью в терапии ЛКМ с мутациями в гене ТР53 обладают ингибиторы тирозинкиназы Брутона (БТК) и белка bcl2 (B-cell lymphoma 2) [13]. Применение такой терапии уже описано у больных с рецидивом ЛКМ с мутациями гена ТР53, однако медиана ответа на монотерапию ибрутинибом не превышала 4 мес., в сравнении с 12 мес. в группе больных ЛКМ без мутаций [27–29]. Данные по эффективности монотерапии венетоклаксом у больных ЛКМ с мутациями в гене ТР53 не предоставлены. Гораздо более длительной продолжительности ответа удавалось достичь у больных с рецидивом ЛКМ с мутациями в гене ТР53 при комбинации таргетной терапии (ибрутиниб + леналидомид, ибрутиниб + венетоклакс, ибрутиниб + палбоциклиб и т. д.) [30–32]. M. Jerkeman и соавт. [30] при комбинированном применении ритуксимаба, ибрутиниба и леналидомида получили увеличение однолетней беспрогрессивной выживаемости (БПВ) до 56,9 % у больных с рецидивом ЛКМ, даже с мутациями в гене ТР53. Применение ибрутиниба в сочетании с венетоклаксом у больных Р/Р ЛКМ с мутациями в гене ТР53 позволило достичь медианы БПВ до 35 мес. [31][33].
Имеются только единичные нерандомизированные клинические исследования о применении битаргетной терапии (акалабрутиниб + венетоклакс) [34] и тройной терапии (акалабрутиниб + венетоклакс + ритуксимаб [35]; обинутузумаб + венетоклакс + ибрутиниб [36]) без применения ХТ в первой линии лечения ЛКМ. Только в одном случае была применена тройная таргетная комбинация (занубрутиниб + венетоклакс + обинутузумаб [37]) в первой линии терапии ЛКМ с мутациями в гене ТР53. Предварительные результаты обнадеживают, но требуются более длительные сроки наблюдения. Кроме того, лечение во всех этих исследованиях не подразумевало проведения консолидирующей терапии.
Более длительное наблюдение применения ибрутиниба и венетоклакса [15] в первой линии терапии проанализировано у больных ХЛЛ как возможно наиболее близкой с ЛКМ группы лимфатических опухолей. В 2019 г. N. Jain и соавт. опубликовали результаты применения комбинации ибрутиниба и венетоклакса в первой линии терапии у больных ХЛЛ, в том числе с мутациями в гене ТР53 [14]. В исследование были включены 80 больных ХЛЛ с медианой возраста 65 (26–83) лет, причем 30 % из них были в возрасте 70 лет и старше. Кроме того, у 92 % больных определялись ФНП — немутированный вариант генов тяжелых цепей иммуноглобулинов (83 %), делеция 11q (25 %), аберрации гена TP53 (делеции 17р — 18 %, мутации ТР53 — 14 %). После 12 циклов комбинированного лечения у 88 % больных была достигнута ПР, из них у 61 % — МОБ-негативная ремиссия с минимальным влиянием перечисленных ФНП [14].
Учитывая крайне неблагоприятные факторы прогноза и предполагаемую неэффективность ХТ, у данного больного уже в первой линии лечения была применена комбинированная таргетная терапия ибрутинибом и венетоклаксом. С осложнениями, связанными с синдромом лизиса опухоли, удалось справиться в условиях реанимационного отделения. Безусловно, в клинических исследованиях рекомендовано последовательное добавление венетоклакса к ибрутинибу с постепенным еженедельным увеличением дозы с целью профилактики развития синдрома лизиса опухоли [31]. Однако было принято осознанное решение об одновременном назначении ибрутиниба и венетоклакса в дозах ниже, по сравнению с рекомендуемыми. Предполагаемое развитие выраженной гиперкалиемии у больного с гиперлейкоцитозом при использовании венетоклакса свидетельствует о том, что такое лечение должно проводиться в условиях реанимационного отделения и сопровождаться тщательным мониторингом концентрации электролитов в сыворотке крови и своевременным проведением сеансов заместительной почечной терапии [38].
После проведения битаргетной терапии удалось нормализовать показатели периферической крови, размеры селезенки, однако МОБ-негативности на 21-й день терапии достичь не удалось. Несмотря на наличие одной из самых неблагоприятных мутаций гена ТР53 p.R248W в 7-м экзоне, у данного больного уже на 10-е сутки терапии аллельная нагрузка снизилась с 26 до 0,8 %, что свидетельствовало о высокой эффективности данной комбинации. Кроме того, комбинированная таргетная терапия в ряде случаев может быть оправдана у больных с гиперлейкоцитозом, у которых применение только ибрутиниба в монотерапии может приводить к дальнейшему нарастанию количества лейкоцитов [19].
С учетом доступности и стоимости двойной таргетной терапии ее проведение длительное время было невозможно. Возник вопрос о том, как проводить консолидацию у этого больного. По данным собственного исследования «ЛКМ-2016» [6, 26], у молодых больных ЛКМ при наличии мутаций в гене ТР53 выполнение алло-ТГСК в первой линии лечения являлось единственным эффективным методом, позволяющим достичь длительных стойких ремиссий. Аналогичные результаты алло-ТГСК у больных ЛКМ в первой линии терапии, в том числе у больных с мутациями в гене ТР53, были представлены в других исследованиях. R.J. Lin и соавт. [39] показали, что медианы выживаемости больных ЛКМ с мутациями и без мутаций в гене ТР53 были сопоставимы, а 2-летняя БПВ в общей группе составила 61 %. У данного больного, несмотря на эффективность данной стратегии, выполнение алло-ТГСК не предоставлялось возможным.
Альтернативой алло-ТГСК является CAR-T-клеточная терапия. В настоящее время проводится более 900 клинических исследований по изучению эффективности и безопасности использования CAR-T-клеточной терапии у больных лимфомами и лейкозами. По результатам исследования ZUMA-2, применение анти-CD19 CAR-T-клеточной терапии было одобрено для лечения больных Р/Р ЛКМ в 2020 г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США и Европейским агентством лекарственных средств [8]. В исследование было включено 74 больных Р/Р ЛКМ. У 60 больных наблюдалось резистентное к ингибиторам БТК течение заболевания: в 42 случаях — первичная рефрактерность и у 18 больных после первоначального ответа. Однолетняя БПВ и общая выживаемость (ОВ) составили 61 и 83 % соответственно. По данным анализа больных с мутациями и без мутаций в гене ТР53 были установлены аналогичные результаты эффективности — медиана БПВ была не достигнута в обеих группах [8]. Кроме того, в общей группе больных ЛКМ, резистентных к ингибиторам БТК, при применении стандартных схем ХТ медиана БПВ и ОВ составила только 10,1 и 12,5 месяцев соответственно [40], в сравнении с достижением плато на кривых БПВ и ОВ при использовании CAR-T-клеточной терапии [8].
В настоящее время официальных показаний для выполнения алло-ТГСК или CAR-T-клеточной терапии в первой линии для больных ЛКМ нет [41]. Однако в 2021 г. были опубликованы результаты объединенных американских и европейских рекомендаций, в которых экспертами впервые было принято единогласное решение о возможности интеграции алло-ТГСК и CAR-T-клеточной терапии в первой линии консолидации для больных с мутациями в гене ТР53 или биаллельной делеции 17р13. Такой подход казался оптимальным у данного больного [42]. Были использованы CAR-T-клетки второго поколения, которые отличаются наличием ко-стимулирующего (4-1ВВ) домена, что позволяет достичь длительной пролиферации Т-клеток и секреции цитокинов, что приводит к значительно большей эффективности в уничтожении клеток-мишеней in vivo [43]. Выполнение CAR-T-клеточной терапии позволило достичь МОБ-негативной ремиссии. Кроме того, использование данной стратегии консолидации у больного с мутацией в гене ТР53 избавило от необходимости длительного применения таргетных препаратов.
Если при выборе тактики индукционной терапии перед алло-ТГСК основным принципом являлось достижение максимальной редукции опухолевой массы в результате применения различных программ ХТ, то для CAR-Т-клеточной терапии, кроме объема опухоли, одним из обязательных условий являлось сохранение функциональной активности Т-лимфоцитов для дальнейшего производства CAR-T-клеток. В ряде работ было показано негативное влияние на функции Т-лимфоцитов таких цитостатических препаратов, как бендамустин и антрациклины. Сроки восстановления функции Т-лимфоцитов после применения бендамустина составляют до 3 лет [44]. С другой стороны, на модели ХЛЛ было показано сохранение и даже восстановление функциональной активности Т-лимфоцитов после терапии ибрутинибом, перед проведением СAR-T-клеточной терапии [45]. Этот фактор также учитывался в стратегии терапии данного больного. При оценке активности Т-лимфоцитов у наблюдаемого больного перед проведением цитафереза была показана их высокая «годность» для дальнейших генетических манипуляций и терапевтическая перспективность. По аналогии, минимизация линий терапии и максимальное приближение СAR-T-клеточной терапии к первой линии показали преимущества в эффективности и сохранения пула «жизнеспособных Т-клеток» в исследовании ZUMA-12 для агрессивных лимфом [46].
Таким образом, рациональное таргетное воздействие и CAR-T-клеточная терапия, выполненная в первой линии, оказались эффективными. Данных о применении такого подхода в литературе нет. Однако в 2020 г. американскими исследователями было высказано предположение о рациональном сочетании таргетной (4–6 циклов ингибиторов БТК) и СAR-T-клеточной терапии в качестве первой линии у больных ЛКМ из группы высокого риска, но результаты этих исследований до сих пор не опубликованы [47].
Таким образом, несмотря на исходно крайне неблагоприятную ситуацию, применение оригинального терапевтического подхода в условиях мультидисциплинарного взаимодействия гематологов, генетиков, биоинженеров, врачей интенсивной терапии и других специалистов позволило достичь ПР у больного ЛКМ, ранее считавшегося неизлечимым. Несмотря на достигнутый успех, для окончательных выводов требуется увеличение числа больных и более длительные сроки наблюдения. Кроме того, при использовании клеточной терапии следует помнить о риске высокой летальности в случае инфицирования новой коронавирусной инфекцией и целесообразности проведения профилактических мероприятий (вакцинации или применения комбинированных моноклональных антител длительного действия). Тем не менее полученные данные открывают новые перспективы в лечении этой крайне сложной группы больных ЛКМ.
Список литературы
1. Jain P., Wang M.L. Mantle cell lymphoma in 2022 — A comprehensive update on molecular pathogenesis, risk stratification, clinical approach, and current and novel treatments. Am J Hematol. 2022; 97(5): 638–56. DOI: 10.1002/ajh.26523.
2. Sethi S., Epstein-Peterson Z., Kumar A., et al. Current knowledge in genetics, molecular diagnostic tools, and treatments for mantle cell lymphomas. Front Oncol. 2021; 11: 739441. DOI: 10.3389/fonc.2021.739441.
3. Beà S., Valdés-Mas R., Navarro A., et al. Landscape of somatic mutations and clonal evolution in mantle cell lymphoma. Proc Natl Acad Sci USA. 2013; 110(45): 18250–5. DOI: 10.1073/pnas.1314608110.
4. Eskelund C.W., Dahl C., Hansen J.W., et al. TP53 mutations identify younger mantle cell lymphoma patients who do not benefit from intensive chemoimmunotherapy. Blood. 2017; 130(17): 1903–10. DOI: 10.1182/blood-2017-04-779736.
5. Obr A., Klener P., Furst T., et al. A high TP53 mutation burden is a strong predictor of primary refractory mantle cell lymphoma. Br J Haematol. 2020; 191(5): e103–6. DOI: 10.1111/bjh.17063.
6. Королева Д.А., Габеева Н.Г., Кузьмина Л.А. и др. Негативное влияние мутаций в гене ТР53 на эффективность терапии лимфомы из клеток мантии. Промежуточные результаты протокола «ЛКМ-2016». Гематология и трансфузиология. 2019; 64(3): 256–73. DOI: 10.35754/0234-5730-2019-64-3256-273.
7. Kharfan-Dabaja M.A., Reljic T., El-Asmar J., et al. Reduced-intensity or myeloablative allogeneic hematopoietic cell transplantation for mantle cell lymphoma: A systematic review. Futur Oncol. 2016; 12(22): 2631–42. DOI: 10.2217/fon2016-0146.
8. Wang M., Munoz J., Goy A., et al. KTE-X19 CAR-T-cell therapy in relapsed or refractory mantle-cell lymphoma. N Engl J Med. 2020; 382(14): 1331–42. DOI: 10.1056/NEJMoa1914347.
9. Gauthier J., Maloney D.G. Allogeneic transplantation and chimeric antigen receptor-engineered T-cell therapy for relapsed or refractory mantle cell lymphoma. Hematol Oncol Clin North Am. 2020; 34(5): 957–70. DOI: 10.1016/j. hoc.2020.06.010.
10. Kluin-Nelemans H.C., Hoster E., Hermine O., et al. Treatment of older patients with mantle-cell lymphoma. N Engl J Med. 2012; 367(6): 520–31. DOI: 10.1056/nejmoa1200920.
11. Doorduijn J.K., Kluin-Nelemans H.C. Management of mantle cell lymphoma in the elderly patient. Clin Interv Aging. 2013; 8: 1229–36. DOI: 10.2147/CIA. S35082.
12. Rummel M.J., Maschmeyer G., Ganser A., et al. Bendamustine plus rituximab (B-R) versus CHOP plus rituximab (CHOP-R) as first-line treatment in patients with indolent lymphomas: Nine-year updated results from the StiL NHL1 study. J Clin Oncol. 2017; 35(15_suppl): 7501. DOI: 10.1200/jco.2017.35.15_suppl.7501.
13. Zhang J., Lu X., Li J., Miao Y. Combining BTK inhibitors with BCL2 inhibitors for treating chronic lymphocytic leukemia and mantle cell lymphoma. Biomark Res. 2022; 10(1): 17. DOI: 10.1186/s40364-022-00357-5.
14. Jain N., Keating M., Thompson P., et al. Ibrutinib and venetoclax for first-line treatment of CLL. N Engl J Med. 2019; 380(322): 2095–103. DOI: 10.1056/ NEJMoa1900574.
15. Tam C.S., Allan J.N., Siddiqi T., et al. Fixed-duration ibrutinib plus venetoclax for first-line treatment of CLL: Primary analysis of the CAPTIVATE FD cohort. Blood. 2022; 139(22): 3278–89. DOI: 10.1182/blood.2021014488.
16. Jain P., Zhao S., Lee H.J., et al. Ibrutinib with rituximab in first-line treatment of older patients with mantle cell lymphoma. J Clin Oncol. 2022; 40(2): 202–12. DOI: 10.1200/jco.21.01797.
17. Yang H., Rosove M.H., Figlin R.A. Tumor lysis syndrome occurring after the administration of rituximab in lymphoproliferative disorders : High-grade non-Hodgkin’s lymphoma and chronic lymphocytic leukemia. Am J Hematol. 1999; 62(4): 247–50. DOI: 10.1002/(sici)1096-8652(199912)62:4<247::aidajh9>3.0.co;2-t.
18. Jensen M., Winkler U., Manzke O., et al. Rapid tumor lysis in a patient with B-cell chronic lymphocytic leukemia and lymphocytosis treated with an anti-CD20 monoclonal antibody. Ann Hematol. 1998; 77(1-2): 89–91. DOI: 10.1007/s002770050419.
19. Herman S.E.M., Niemann C.U., Farooqui M., et al. Ibrutinib-induced lymphocytosis in patients with chronic lymphocytic leukemia. Leukemia. 2015; 28(11): 2188–96. DOI: 10.1038/leu.2014.122.
20. Wang M. CAR-T-cell therapies in mantle cell lymphoma, hints of cure. CLML. 2002; 21: S189–91. DOI: 10.1016/S2152-2650(21)01262-3.
21. Hoster E., Dreyling M., Klapper W., et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood. 2008; 111(2): 558–65. DOI: 10.1182/blood-2007-06-095331.
22. Kluin-Nelemans H.C., Hoster E., Hermine O., et al. Treatment of older patients with mantle cell lymphoma (MCL): Long-term follow-up of the randomized European MCL Elderly trial. J Clin Oncol. 2020; 38(3): 248–56. DOI: 10.1200/ JCO.19.01294.
23. Romancik J.T., Cohen J.B. Management of older adults with mantle cell lymphoma. Drugs Aging. 2020; 37(7): 469–81. DOI: 10.1007/s40266-02000765-y.
24. Visco C., Chiappella A., Nassi L., et al. Rituximab, bendamustine, and lowdose cytarabine as induction therapy in elderly patients with mantle cell lymphoma: a multicentre, phase 2 trial from Fondazione Italiana Linfomi. Lancet Haematol. 2017; 4(1): e15–23. DOI: 10.1016/S2352-3026(16)30185-5.
25. Ferrero S., Rossi D., Rinaldi A., et al. KMT2D mutations and TP53 disruptions are poor prognostic biomarkers in mantle cell lymphoma receiving high-dose therapy: A FIL study. Haematologica. 2019; 105(6): 1604–12. DOI: 10.3324/ haematol.2018.214056.
26. Королева Д.А., Габеева Н.Г., Дроков М.Ю. и др. Первый опыт трансплантации аллогенных гемопоэтических стволовых клеток у больных лимфомой из клеток мантии с мутациями в гене ТР53. Гематология и трансфузиология. 2020; 65(4): 483–500. DOI: 10.35754/0234-57302020-65-4-483-500.
27. Dreyling M., Jurczak W., Jerkeman M., et al. Ibrutinib versus temsirolimus in patients with relapsed or refractory mantle-cell lymphoma: An international, randomised, open-label, phase 3 study. Lancet. 2016; 387(10020): 770–8. DOI: 10.1016/S0140-6736(15)00667-4.
28. Rule S., Dreyling M., Goy A., et al.. Ibrutinib for the treatment of relapsed/refractory mantle cell lymphoma: Extended 3.5-year follow up from a pooled analysis. Haematologica. 2019; 104(5): e211–4. DOI: 10.3324/haematol.2018.205229.
29. Wang M.L., Lee H., Chuang H., et al. Ibrutinib in combination with rituximab in relapsed or refractory mantle cell lymphoma: A single-centre, openlabel, phase 2 trial. Lancet Oncol. 2016; 17(1): 48–56. DOI: 10.1016/S14702045(15)00438-6.
30. Jerkeman M., Eskelund C.W., Hutchings M., et al. Ibrutinib, lenalidomide, and rituximab in relapsed or refractory mantle cell lymphoma (PHILEMON): A multicentre, open-label, single-arm, phase 2 trial. Lancet Haematol. 2018; 5(3): e109–16. DOI: 10.1016/S2352-3026(18)30018-8.
31. Tam C.S., Anderson M.A., Pott C., et al. Ibrutinib plus venetoclax for the treatment of mantle-cell lymphoma. N Engl J Med. 2018; 378(13): 1211–23. DOI: 10.1056/nejmoa1715519.
32. Lee C., Huang X., Liberto M. Di, et al. Targeting CDK4/6 in mantle cell lymphoma. Ann Lymphoma. 2020; 4: 1. DOI: 10.21037/aol.2019.12.01.
33. Wang M., Ramchandren R., Chen R., et al. Concurrent ibrutinib plus venetoclax in relapsed / refractory mantle cell lymphoma: The safety run-in of the phase 3 SYMPATICO study. J Hematol Oncol. 2021; 14(1): 179. DOI: 10.1186/s13045021-01188-x.
34. https://clinicaltrials.gov/ct2/show/NCT03946878.
35. https://clinicaltrials.gov/ct2/show/NCT02717624.
36. Gouill S. Le, Morschhauser F., Chiron D., et al. Ibrutinib, obinutuzumab, and venetoclax in relapsed and untreated patients with mantle cell lymphoma: A phase 1/2 trial. Blood. 2021; 137(7): 877–87. DOI: 10.1182/blood.2020008727.
37. https://clinicaltrials.gov/ct2/show/NCT03824483.
38. Verma A., Mbughuni M., Mariash E., et al. Hyperleukocytosis increases risk of fatal hyperkalemia with new ibrutinib/venetoclax regimen for refractory mantle cell lymphoma. J Chemother. 2019; 31(7–8): 428–31. DOI: 10.1080/1120009 X.2019.1687995.
39. Lin R.J., Ho C., Hilden P.D., et al. Allogeneic haematopoietic cell transplantation impacts on outcomes of mantle cell lymphoma with TP53 alterations. Br J Haematol. 2019; 184(6): 1006–10. DOI: 10.1111/bjh.15721.
40. Burkart M., Karmali R. Relapsed/refractory mantle cell lymphoma: Beyond BTK inhibitors. J Pers Med. 2022; 12(3): 376. DOI: 10.3390/jpm12030376.
41. Duarte R.F., Labopin M., Bader P., et al. Indications for haematopoietic stem cell transplantation for haematological diseases, solid tumours and immune disorders: Current practice in Europe, 2019. Bone Marrow Transplant. 2019; 54(10): 1525–52. DOI: 10.1038/s41409-019-0516-2.
42. Munshi P.N., Hamadani M., Kumar A., et al. American Society of Transplantation and Cellular Therapy, Center of International Blood and Marrow Transplant Research, and European Society for Blood and Marrow Transplantation clinical practice recommendations for transplantation and cellular therapies in mantle cell lymphoma. Transplant Cell Ther. 2021; 27(9): 720–8. DOI: 10.1016/j. jtct.2021.03.001.
43. Johnson P.C., Abramson J.S. Engineered T cells: CAR-T cell therapy and beyond. Curr Oncol Rep. 2022; 24(1): 23–31. DOI: 10.1007/s11912-021-01161-4.
44. Yutaka T., Ito S., Ohigashi H., et al. Sustained CD4 and CD8 lymphopenia after rituximab maintenance therapy following bendamustine and rituximab combination therapy for lymphoma. Leuk Lymphoma. 2015; 56(11): 3216–8. DOI: 10.3109/ 10428194.2015.1026818.
45. Davis J.E., Handunnetti S.M., Ludford-Menting M., et al. Immune recovery in patients with mantle cell lymphoma receiving long-term ibrutinib and venetoclax combination therapy. Blood Adv. 2020; 4(19): 4849–59. DOI: 10.1182/bloodadvances.2020002810.
46. Neelapu S.S., Dickinson M., Munoz J., et al. Axicabtagene ciloleucel as firstline therapy in high-risk large B-cell lymphoma: The phase 2 ZUMA-12 trial. Nat Med. 2021; 28(4): 735–42. DOI: 10.1038/s41591-022-01731-4.
47. Jain P., Dreyling M., Seymour J.F., Wang M. High-risk mantle cell lymphoma: Definition, current challenges, and management. J Clin Oncol. 2020; 38(36): 4302–16. DOI: 10.1200/JCO.20.02287.
Об авторах
Е. Е. ЗвонковРоссия
Евгений Евгеньевич Звонков, доктор медицинских наук, заведующий от- делением гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Д. А. Королева
Россия
Дарья Александровна Королева, кандидат медицинских наук, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Н. Г. Габеева
Россия
Габеева Нелли Георгиевна, кандидат медицинских наук, старший научный сотрудник, врач-гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
А. Е. Щекина
Россия
Щекина Антонина Евгеньевна, реаниматолог отделения реанимации и интенсивной терапии
125167, Москва
М. А. Теляшов
Россия
Теляшов Максим Александрович, трансфузиолог отделения забора гемопоэтических стволовых клеток, обработки и хранения костного мозга и гемопоэтических стволовых клеток
125167, Москва
О. А. Алешина
Россия
Алешина Ольга Александровна, кандидат медицинских наук, заведующая обсервационным отделением
125167, Москва
Б. В. Бидерман
Россия
Бидерман Белла Вениаминовна, кандидат биологических наук, старший научный сотрудник лаборатории молекулярной гематологии
125167, Москва
А. Б. Судариков
Россия
Судариков Андрей Борисович, доктор биологических наук, заведующий лабораторией молекулярной гематологии
125167, Москва
Т. Н. Обухова
Россия
Обухова Татьяна Никифоровна, кандидат медицинских наук, заведующая лабораторией кариологии
125167, Москва
И. В. Гальцева
Россия
Гальцева Ирина Владимировна, кандидат медицинских наук, заведующая лабораторией иммунофенотипирования клеток крови и костного мозга
125167, Москва
В. Н. Двирнык
Россия
Двирнык Валентина Николаевна, кандидат медицинских наук, заведующая централизованной клинико-диагностической лабораторией
125167, Москва
В. В. Троицкая
Россия
Троицкая Вера Витальевна, кандидат медицинских наук, первый заместитель генерального директора
125167, Москва
Г. М. Галстян
Россия
Галстян Геннадий Мартинович, доктор медицинских наук, заведующий отделом реанимации и интенсивной терапии
125167, Москва
М. А. Масчан
Россия
Масчан Михаил Александрович, доктор медицинских наук, профессор, заместитель генерального директора института молекулярной и экспериментальной медицины
117997, Москва
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, генеральный директор
125167, Москва
Рецензия
Для цитирования:
Звонков Е.Е., Королева Д.А., Габеева Н.Г., Щекина А.Е., Теляшов М.А., Алешина О.А., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Гальцева И.В., Двирнык В.Н., Троицкая В.В., Галстян Г.М., Масчан М.А., Паровичникова Е.Н. Комбинация ибрутиниба и венетоклакса с последующей терапией Т-клетками с химерным антигенным рецептором в первой линии лечения у пожилого больного лимфомой из клеток мантии с гиперлейкоцитозом и мутацией в гене ТР53. Гематология и трансфузиология. 2022;67(3):441-452. https://doi.org/10.35754/0234-5730-2022-67-3-441-452
For citation:
Zvonkov E.E., Koroleva D.A., Gabeeva N.G., Shchekina A.E., Telyashov M.A., Aleshina O.A., Biderman B.V., Sudarikov A.B., Obukhova T.N., Galtseva I.V., Dvirnik V.N., Troitskaya V.V., Galstyan G.M., Maschan M.A., Parovichnikova E.N. Combination of ibrutinib and venetoclax followed by Chimeric Antigen Receptor T-cell therapy in the first line of treatment in an elderly patient with mantle cell lymphoma with hyperleukocytosis and mutation in the TP53 gene. Russian journal of hematology and transfusiology. 2022;67(3):441-452. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-441-452











































