Перейти к:
Внедрение лабораторного исследования на анти-HBcore у доноров крови
https://doi.org/10.35754/0234-5730-2022-67-4-525-534
Аннотация
Введение. Внедрение скринингового тестирования на антитела к ядерному антигену вируса гепатита В (анти-HBcore) призвано предотвратить заготовку донорской крови от лиц, имеющих скрытую форму вирусного гепатита В, при которой не идентифицируется поверхностный HBsAg.
Цель – оценить частоту встречаемости маркеров анти-HBcore у доноров в условиях действующего нормативно-правового поля.
Материалы и методы. Проведено ретроспективное обсервационное исследование среди доноров крови ФГБУЗ «Центра крови ФМБА России» (ЦК) в условиях действующего нормативно-правового поля. Период наблюдения составил один год. Скрининговое исследование на анти-HBcore у доноров крови и ее компонентов носило избирательный характер согласно требованиям к приложению № 4 приказа МЗ РФ № 1166н от 28.10.2020.
Результаты. В период исследования ЦК посетили 17 180 доноров, сдавших 35 840 раз донорскую кровь и ее компоненты. Было проведено 181 исследование на анти-HBcore (0,5 % от всех образцов крови) у 178 уникальных доноров крови и ее компонентов (1,03 % от всех доноров). Получено 14 положительных, 2 сомнительных и 166 отрицательных результатов на анти-HBcore. Вероятность обнаружения положительного результата, в зависимости от условий, составила 9 % (7,3–14,7 %). Не получено значимых различий по обнаружению анти-HBcore у первичных доноров в сравнении с регулярными (отношение шансов (ОШ) = 2,539; 95%-ный доверительный интервал (95% ДИ): 0,7321–8; p = 0,13), так же как и у дон оров мужчин в сравнении с женщинами (ОШ = 2,448; 95% ДИ: 0,7141–11,11; p = 0,17). У 86,7 % доноров с положительным анализом на анти-HBcore ранее не было признаков заболевания вирусным гепатитом В, не выявлялось наличие сомнительного HBsAg, т. е. данные случаи могут быть связаны с оккультной формой. У доноров, не имевших ранее в период донорской карьеры сомнительных результатов по различным гемотрансмиссивным инфекциям, отмечалась незначительно большая вероятность обнаружения положительного результата на анти-HBcore в сравнении с донорами, ранее имевшими сомнительные результаты (OШ = 1,24; 95% ДИ: 0,42–3,69; p = 0,69). За период донорской карьеры донорами с положительным результатом на анти-HBcore было совершено 233 донации крови и ее компонентов, получено 468 единиц донорских компонентов, из которых 365 единиц были выданы в лечебные учреждения.
Заключение. Вероятность получения положительного анализа на анти-HBcore в условиях действующего нормативного поля случайна и не зависит от результатов исследования на другие инфекционные маркеры. Рекомендуется проводить анализ на анти-HBcore при каждой донации крови и ее компонентов.
Для цитирования:
Фаенко А.П., Филиппова А.А., Голосова С.А., Глазов Я.Н., Иванова И.В., Клюева Е.А., Касаткин М.А. Внедрение лабораторного исследования на анти-HBcore у доноров крови. Гематология и трансфузиология. 2022;67(4):525-534. https://doi.org/10.35754/0234-5730-2022-67-4-525-534
For citation:
Faenko A.P., Filippova A.A., Golosova S.A., Glazov Ya.N., Ivanova I.V., Klyueva E.A., Kasatkin M.A. The introduction of Laboratory testing for anti-HBcore in blood donors. Russian journal of hematology and transfusiology. 2022;67(4):525-534. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-525-534
Введение
Вирусный гепатит B — антропонозное инфекционное заболевание, вызываемое вирусом гепатита B (ВГВ), является ведущей причиной развития острых и хронических вирусных заболеваний печени. По данным Всемирной организации здравоохранения (ВОЗ), к 2019 г. около 2 млрд людей переболели острым вирусным гепатитом В, из которых 296 млн являются хроническими носителями ВГВ, т. е. положительными по HBsAg. Количество первично инфицированных ВГВ в2019 г. составило около 1,5 млн человек [1]. Кроме того, по оценкам ВОЗ, количество смертей от цирроза печени и гепатоцеллюлярной карциномы, связанных с ВГВ, составляет около 900 000 в год [2]. С 2011 по 2020 г. в России отмечено снижение заболеваемости острым вирусным гепатитом В почти в 5 раз, в настоящее время она составляет 0,35 случая на 100 000 населения, а заболеваемость хронической формой уменьшилась в 2 раза и составила 4,4 случая на 100 000 населения, что обусловлено программой массовой иммунизации населения Российской Федерации против ВГВ [3].
ВГВ — гепатотропный вирус, относящийся к семейству Hepadnaviridae. Он имеет узкий диапазон хозяев и заражает только людей и несколько видов приматов [4]. Вирус имеет сферическую форму, диаметр которой 42 нм. Его ядро состоит из нуклеокапсида, включающее ДНК, фермент ДНК полимеразу и ряд белков: ядерный (HB-core) антиген, его секретируемая, растворимая часть (HBe-антиген) и неструктурный белок X (HBx), который индуцирует развитие гепатоцеллюлярной карциномы [5]. Наружная оболочка ВГВ представлена поверхностным антигеном (HBsAg). Вирус чрезвычайно устойчив во внешней среде и сохраняется при комнатной температуре в течение 3 мес., при замораживании — до 15–20 лет, автоклавирование при 1200 °C убивает вирус через 45 мин, стерилизация сухим жаром при 1800 °C — через 60 мин. Он не чувствителен к лиофилизации, ультрафиолетовому облучению, раствор 1–2 % хлорамина инактивирует вирус через 2 ч, а1,5%-ный раствор формалина — через 7 сут. [6][7].
Клиническая картина инфицирования ВГВ может протекать по-разному, что обусловлено мутационной изменчивостью самого вируса и состоянием иммунной системы зараженного [7]. Примерно у трети взрослых острый вирусный гепатит В протекает бессимптомно, а прогрессирование до хронического течения наблюдается у 10 % больных. Инкубационный период от заражения ВГВ до выявления клинических симптомов составляет в среднем от 60 до 120 дней, однако для трансфузионной медицины данная фаза имеет решающее значение, когда вирус может размножаться бессимптомно. В течение первого месяца после инфицирования вируса возможно обнаружение ДНК ВГВ, затем несколько недель спустя можно обнаружить HBsAg, спустя еще 3 мес. начинают образовываться антитела к ядерному антигену (анти-HBcore) (рис. 1). При бессимптомном течении инфекции и у реконвалесцентов острого гепатита количество ДНК ВГВ и HBsAg уменьшается вплоть до полной элиминации, тогда как при хронической инфекции ДНК ВГВ и HBsAg часто обнаруживаются в течение нескольких месяцев и даже лет. Анти-HBcore обнаруживаются в организме на протяжении многих лет или в течение всей жизни, даже после полного выздоровления [9].
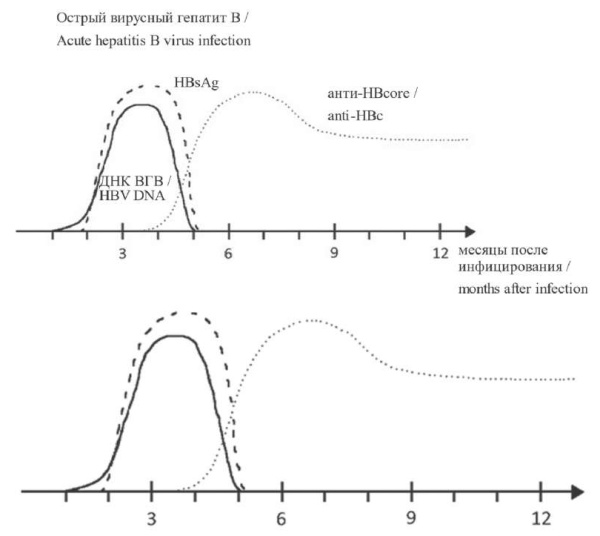
Рисунок 1. Динамика обнаружения лабораторных маркеров ВГВ [8]
Figure 1. The detection dynamics of hepatitis B virus laboratory markers [8]
История тестирования на маркеры ВГВ началась в 1964 г. после открытия Самуэлем Бламбергом поверхностного антигена B при изучении образцов крови австралийского аборигена. Дальнейшая взаимосвязь развития вирусного гепатита В с наличием HBsAg была установлена Альфредом Принсом в 1968 г., в трансфузионной медицине исследование на HBsAg начали применять с 1972 г. в банках крови США [10]. Данные первоначального скрининга на HBsAg демонстрировали более высокие показатели инфицирования среди платных доноров, что привело службу крови к массовому переходу на безвозмездное донорство крови в США и во многих других странах к середине 1970-х годов [11]. Крупные многоцентровые исследования конца 1980-х и начала 1990-х годов выявили эпидемиологические связи между наличием суррогатных маркеров у доноров — повышением концентрации аланинаминотрансферазы (АЛТ) и развитием посттрансфузионных гепатитов у реципиентов [12]. Были представлены данные о том, что переливание анти-HBcore-положительной крови от HBsAg-отрицательных доноров (оккультная форма вирусного гепатита В) коррелировало с посттрансфузионным инфицированием ВГВ [13]. После доклада Национального института здоровья США в 1986 г. в банках крови США ввели дополнительное регулярное тестирование на АЛТ и тест на анти-HBcore [14].
В ряде стран Европы, так же как и России, тестирование доноров на маркеры ВГВ проводили исключительно иммунологическими исследованиями на HBsAg [15], которые в 2008 г. дополнились молекулярно-биологическими методами. Согласно международным клиническим и экспериментальным исследованиям, остаточный риск передачи ВГВ, связанный с оккультной формой вирусного гепатита В, составляет 3–14 % [16]. В связи с этим в службе крови России в 2021 г. вводится новое дополнительное тестирование на анти-HBcore [17].
Цель настоящего исследования — оценить частоту встречаемости маркеров анти-HBcore у доноров в условиях действующего нормативно-правового поля.
Материалы и методы
Проведено ретроспективное обсервационное исследование среди доноров крови ФГБУЗ «Центр крови ФМБА России» (ЦК) в период первого года с момента внедрения скринингового тестирования на анти-HBcore. Все доноры ЦК, которые были допущены до донации, проходили стандартное лабораторное обследование согласно нормативным требованиям РФ [17]. Скрининговое исследование на анти-HBcore у доноров крови и ее компонентов носило избирательный характер согласно требованиям к приложению № 4 приказа № 1166н от 28.10.2020 «Об утверждении порядка прохождения донорами медицинского обследования и перечня медицинских противопоказаний (временных и постоянных) для сдачи крови и (или) ее компонентов и сроков отвода, которому подлежит лицо при наличии временных медицинских показаний, от донорства крови и (или) ее компонентов» МЗ РФ [17]. Среди данных условий выделены три группы. Первая группа включала исследование на анти-HBcore в случае получения сомнительного результата повторного иммунологического исследования на маркеры ВГВ HBsAg. Вторая группа — в случае осуществления сероконтрольных исследований не ранее чем через120 календарных дней, независимо от того, маркеры какого возбудителя были выявлены при первичном исследовании. Третья группа — в случае невыявления положительного образца при индивидуальном исследовании на наличие вирусов иммунодефицита человека, гепатитов B и C образцов крови, ранее входивших в минипул, проводится повторное индивидуальное исследование образцов крови доноров, а также дополнительное исследование образцов крови, ранее входивших в минипул, на наличие анти-HBcore.
Исследования на анти-HBcore проводили на анализаторе «Architect i2000sr» (Abbott, США) с использованием реагентов «Architect Anti-HBc II» (Abbott, США).
Статистический анализ. Для статистического анализа использовали методы описательной статистики, оценка рисков. Рассчитывали отношение шансов (ОШ), 95%-ный доверительный интервал (95% ДИ), медиану (Ме), межквартильный интервал (МКИ). Статистическую обработку результатов проводили в программе Microsoft Office Excel 2019 и SPSS v.23.
Результаты
За период наблюдения ЦК посетили 17 180 доноров, из них 4351 первичный донор, 10 266 мужчин и 6914 женщин, осуществлено 35 840 донаций (цельная кровь — 27 788, аппаратный плазмаферез — 5231 и аппаратный тромбоцитаферез — 2821)и 547 обследований без донации на предмет восстановления в донорстве или выпуска карантинизированной свежезамороженной плазмы.
Было проведено 181 исследование на анти-HBcore (0,5 % от всех образцов крови) у 178 уникальных доноров крови и ее компонентов (1,03 % от всех доноров). Получено 14 положительных, 2 сомнительных и 166 отрицательных результатов. Сомнительные результаты исследования на анти-HBcore были получены от одного донора при осуществлении сероконтрольных исследований через 139 календарных дней между анализами. Дальнейшую обработку данных и продукцию от данного донора проводили аналогично с донорами с положительным анализом на анти-HBcore. Встречаемость результатов исследований на анти-HBcore в зависимости от условий определения представлена в таблице 1.
Таблица 1. Результаты исследований на анти-HBcore в зависимости от условий к определению согласно действующему нормативному документу
Table 1. The results of studies on anti-HBcore, depending on the conditions for determination in accordance with the current regulatory document
Группа (условие) | Положительный результат | Отрицательный результат | Частота обнаружения |
При сомнительном результате исследования на HBsAg | 1 | 9 | 11,1 % |
При сероконтрольном исследовании по ВИЧ, гепатита В и С, сифилиса | 5 | 34 | 14,7 % |
В случае попадания в положительный пул ПЦР | 9 | 123 | 7,3 % |
Всего / Total | 15 | 166 | 9,0 % |
Примечание: ПЦР — полимеразная цепная реакция.
Note: PCR — polymerase chain reaction.
С учетом ограниченных условий определения анти-HBcore, данный показатель составил 3,3 % от всех положительных результатов исследований по выявлению различных маркеров гемотрансмиссивных инфекций (ГТИ), которые проводили при каждой донации (рис. 2).
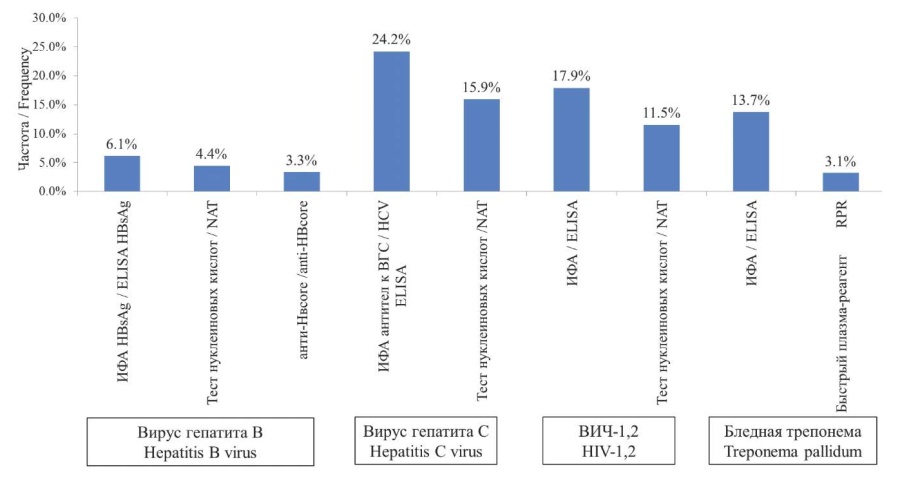
Рисунок 2. Частота выявления маркеров гемотрансмиссивных инфекций в ФГБУЗ «Центр крови ФМБА России»
Примечание: ИФА — иммуноферментный анализ, ПЦР — полимеразная цепная реакция
Figure 2. The frequency of bloodborne infections markers detection in Blood center of the Federal Medical-Biological Agency
Note: NAT — nucleic acid test, ELISA — enzyme-linked immunosorbent assay, RPR — rapid plasma reagent
Были систематизированы данные распределения по полу, возрасту и частоте донаций среди 15 доноров с положительным анализом на анти-HBcore (табл. 2). Из них 5 (33,3 %) работают в промышленном производстве, 4 (26,7 %) являются офисными работниками, 2 (13,3 %) работают в городском транспорте, 1 (6,7 %) — в медицине, 1 (6,7 %) — в спорте и 2 (13,3 %) — временно безработные. Не получено статистически значимых различий при обнаружении анти-HBcore у первичных доноров в сравнении с регулярными (ОШ = 2,539; 95% ДИ: 0,7321–8; p = 0,13), так же как и для доноров мужчин в сравнении с женщинами (ОШ = 2,448; 95% ДИ: 0,7141–11,11; p = 0,17).
Таблица 2. Характеристика доноров с положительным анализом на анти-HBcore
Table 2. Blood donor profile with positive anti-HBcore
Показатель / Parameter | Значения / Value |
Мужчины / Males, n (%) | 12 (80) |
Возраст мужчин, Ме (МКИ), годы / Male age, Me (IQR), years | 41 (37–45,7) |
Женщины / Females, n (%) | 3 (20) |
Возраст женщин, Ме (МКИ), годы / Female age, Me (IQR), years | 33 (31,3–37,8) |
Первичные доноры / Primary donors, n (%) | 5 (33,3) |
Регулярные доноры / Regular donors, n (%) | 10 (66,7) |
В период донорской карьеры два регулярных донора (13,3 %) ранее имели сомнительный результат исследования на HBsAg, еще 4 (26,7 %) донора — сомнительные результаты по другим маркерам ГТИ в прошлом. Трое доноров (20 %) на момент обнаружения положительного анализа на анти-HBcore имели положительные анализы по другим инфекционным маркерам: один — по маркерам сифилиса и гепатита С, второй — по гепатиту С, третий — по ВИЧ. У доноров, не имевших ранее в период донорской карьеры сомнительных результатов по различным ГТИ, вероятность обнаружения положительного анализа на анти-HBcore в сравнении с донорами, ранее имевшими данные сомнительные результаты, незначительно выше (ОШ = 1,24; 95% ДИ: 0,42–3,69; p = 0,69). У двух регулярных доноров (13,3 %) в период донорской карьеры было отмечено однократное повышение концентрации АЛТ в сыворотке крови, у двух доноров (13,3 %) — периодические отклонения белковых фракций крови от нормальных значений, еще у одного (6,7 %) — трехкратное изменение показателей лейкограммы (в двух случаях — лимфоцитоз, в одном — моноцитоз). Подробные данные о количестве совершенных донаций и продуктах, полученных от каждого из доноров с положительным анти-HBcore, представлены в таблице 3.
Таблица 3. Типы донаций и количество произведенных компонентов от доноров с положительным анализом на анти-HBcore
Table 3. Types of donations and number of components produced from anti-HBcore positive donors
№ донора / | Тип донации / Type of donation, n | Произведено (единиц) / Produced (units) | ||||||
Цельная кровь | Плазмаферез | Тромбоцитаферез | Всего /Total | Эритроцитсодержащие компоненты | Плазменные компоненты | Концентраты тромбоцитов | Всего /Total | |
1 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 2 |
2 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 2 |
3 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 2 |
4 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 2 |
5 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 2 |
6 | 2 | 0 | 0 | 2 | 2 | 2 | 0 | 4 |
7 | 4 | 0 | 0 | 4 | 4 | 4 | 0 | 8 |
8 | 8 | 0 | 0 | 8 | 8 | 8 | 0 | 16 |
9 | 9 | 0 | 0 | 9 | 9 | 9 | 0 | 18 |
10 | 4 | 5 | 0 | 9 | 5 | 13 | 1 | 19 |
11 | 16 | 0 | 0 | 16 | 16 | 16 | 0 | 32 |
12 | 4 | 5 | 9 | 18 | 4 | 14 | 18 | 36 |
13 | 29 | 5 | 2 | 36 | 29 | 41 | 2 | 72 |
14 | 51 | 5 | 7 | 63 | 52 | 62 | 14 | 128 |
15 | 1 | 53 | 9 | 63 | 1 | 108 | 16 | 125 |
Итого | 133 | 73 | 27 | 233 | 135 | 282 | 51 | 468 |
В целях обеспечения инфекционной безопасности донорской крови и ее компонентов вся заготовленная продукция, а также продукция, находившаяся на карантине, от доноров с наличием маркера анти-HBcore, была забракована и утилизирована, однако 365 единиц различных донорских компонентов были переданы для клинического использования (табл. 4).
Таблица 4. Данные по реализации компонентов от доноров с положительным анализом на анти-HBcore
Table 4. Information on the use of components from anti-HBcore positive donors
№ донора/ | Выдано для клинического использования (единиц) | Утилизировано (единиц) | ||||||
Эритроцитсодержащие компоненты | Плазменные компоненты | Концентраты тромбоцитов | Всего /Total | Эритроцитсодержащие компоненты | Плазменные компоненты | концентрат тромбоцитов | Всего /Total | |
1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
2 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
3 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
4 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
5 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 2 |
6 | 0 | 1 | 0 | 1 | 1 | 2 | 0 | 3 |
7 | 3 | 2 | 0 | 5 | 1 | 2 | 0 | 3 |
8 | 7 | 5 | 0 | 12 | 1 | 3 | 0 | 4 |
9 | 8 | 4 | 0 | 12 | 1 | 5 | 0 | 6 |
10 | 2 | 0 | 0 | 2 | 3 | 13 | 1 | 17 |
11 | 13 | 13 | 0 | 26 | 2 | 2 | 0 | 4 |
12 | 4 | 8 | 16 | 28 | 0 | 6 | 2 | 8 |
13 | 25 | 26 | 2 | 53 | 4 | 15 | 0 | 19 |
14 | 52 | 56 | 14 | 122 | 1 | 6 | 0 | 7 |
15 | 1 | 87 | 16 | 104 | 0 | 21 | 0 | 21 |
Итого | 115 | 202 | 48 | 365 | 19 | 80 | 3 | 102 |
Обсуждение
Внедрение нового метода тестирования в службу крови является экономически затратным и сложным организационным процессом, сопровождающимся повышением себестоимости заготовленных компонентов, а также неминуемой утратой донорских кадров, но является важным шагом к повышению инфекционной безопасности клинического использования донорских сред.
Настоящее исследование, выполненное в рамках действующих нормативных документов [17], демонстрирует выборочный характер исследования на анти-HBcore, в результате которого было обследовано всего 1,03 % от всех доноров, при этом отводы от донорства по анти-HB составляют 3,3 % от всех отводов по другим рутинным маркерам ГТИ. Можно предположить, что внедрение регулярного обследования на анти-HBcore при каждой донации на начальных этапах может привести к более частой причине отводов от донорства крови только по данному показателю, до момента выхода на некое плато, при котором будут обследованы почти все регулярные доноры крови и ее компонентов. Ожидаемая потеря донорских кадров в данном случае может достичь около 9 %.
У 86,7 % доноров с положительным анализом на анти-HBcore ранее не имелись признаки заболевания вирусным гепатитом В, не выявлялось наличие сомнительного HBsAg, то есть данные случаи могут быть связаны с оккультной формой. У46,6 % доноров с положительными анализами на анти-HBcore имелись признаки сомнительных результатов анализов по другим маркерам ГТИ, в то время как у 40 % доноров был только один положительный анализ на анти-HBcore, т. е. имелся случайный характер выявления — попадание в положительный минипул при выполнении молекулярно-биологического исследования.
В отсутствие информации о других маркерах ВГВ, наличие анти-HBcore позволяет предположить, что человек может быть инфицирован или переносил вирусный гепатит B в прошлом и имеет иммунитет [18]. При получении положительного результата исследования на маркеры ГТИ у донора крови, организация, осуществляющая заготовку, переработку, использование донорских материалов, оперативно проводит анализ предыдущих случаев донаций за период не менее 12 мес., предшествовавших выявлению ГТИ, и выбраковывает донорскую кровь и ее компоненты, полученные от этого донора в указанный период. Отозванные продукты крови изолируются и передаются для исследования в территориальные органы, уполномоченные осуществлять государственный санитарно-эпидемиологический надзор [19]. Экстренное извещение о положительном результате исследования крови на маркеры ГТИ передается в межрегиональное управление № 1 ФМБА России.
В ЦК активно используются технологии снижения содержания патогенов, в частности с 2019 г. подвергаются патогенредукции все дозы концентратов тромбоцитов. Данные технологии рекомендуются к применению в случаях, когда выявление маркера ГТИ затруднено из-за присутствия патогенов в низком титре, в том числе при оккультных формах вирусного гепатита В [20]. В то же время вирусы без оболочки [21], споры бактерий [22] и прионы устойчивы к технологиям патогенинактивации, а потому данные технологии в настоящее время применяются только в качестве дополнительной меры безопасности, и их использование в качестве единственной линии защиты считается недостаточным для достижения полной инфекционной безопасности [23].
В 2019 г. служба крови Великобритании расследовала 139 инцидентов с подозрением на бактериальную инфекцию и 13 инцидентов с подозрением на вирусную инфекцию у реципиентов, из них один подтвержденный случай заражения вирусным гепатитом Е и один вероятный случай — вирусным гепатитом В [24]. В США, где проводят все три метода тестирования ВГВ на регулярной основе (иммунологические исследования образцов крови доноров на HBsAg и анти-HBcore в дополнение с молекулярно-биологическим исследованием на ВГВ), осуществляемые при каждой донации крови и ее компонентов, оценивают остаточный риск инфицирования ВГВ на уровне 1 случая на 1,5 млн трансфузий [25].
Таким образом, вероятность получения положительного анализа на анти-HBcore в условиях действующего нормативного поля случайна и не зависит от результатов исследования на другие инфекционные маркеры. Рекомендуется проводить анализ на анти-HBcore при каждой донации крови и ее компонентов.
Список литературы
1. Гепатит B. Всемирная организация здравоохранения; 2022. https://www.who.int/ru/news-room/fact-sheets/detail/hepatitis-b.
2. Всемирный день борьбы с гепатитом 2020 г. Всемирная организация здравоохранения; 2022. https://www.who.int/ru/campaigns/world-hepatitis-day/2020.
3. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году. Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2021: 256.
4. Chuang Y.C., Tsai K.N., Ou J.J. Pathogenicity and virulence of hepatitis B virus. Virulence. 2022; 13(1): 258–96. DOI: 10.1080/21505594.2022.2028483.
5. Al-Qahtani A.A., Al-Anazi M.R., Nazir N., et al. Hepatitis B virus (HBV) X gene mutations and their association with liver disease progression in HBV-infected patients. Oncotarget. 2017; 8(62): 105115–25. DOI: 10.18632/oncotarget.22428.
6. Burns G.S., Thompson A.J. Viral hepatitis B: Clinical and epidemiological characteristics. Cold Spring Harb Perspect Med. 2014; 4(12): a024935. DOI: 10.1101/cshperspect.a024935.
7. European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017; 67(2): 370–98. DOI: 10.1016/j.jhep.2017.03.021.
8. Mitterreiter J., Scheiblauer H., Fiedler S., Kreß J. Safety of blood and blood products: Test methods for the detection of hepatitis B, C, and E virus. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2022; 65(2): 209–19. DOI: 10.1007/s00103-021-03480-0.
9. Shin E.C., Sung P.S., Park S.H. Immune responses and immunopathology in acute and chronic viral hepatitis. Nat Rev Immunol. 2016; 16(8): 509–23. DOI: 10.1038/nri.2016.69.
10. Busch M.P., Bloch E.M., Kleinman S. Prevention of transfusion-transmitted infections. Blood. 2019; 133(17): 1854–64. DOI: 10.1182/blood-2018-11-833996.
11. Perkins H.A., Busch M.P. Transfusion-associated infections: 50 years of relentless challenges and remarkable progress. Transfusion. 2010; 50(10): 2080–99. DOI: 10.1111/j.1537-2995.2010.02851.x.
12. Alter H.J., Klein H.G. The hazards of blood transfusion in historical perspective. Blood. 2008; 112(7): 2617–26. DOI: 10.1182/blood-2008-07-077370.
13. Hoofnagle J.H., Seeff L.B., Bales Z.B., Zimmerman H.J. Type B hepatitis after transfusion with blood containing antibody to hepatitis B core antigen. N Engl J Med. 1978; 298(25): 1379–83. DOI: 10.1056/NEJM197806222982502.
14. Glynn S.A., Busch M.P., Dodd R.Y., et al. Emerging infectious agents and the nation’s blood supply: Responding to potential threats in the 21st century. Transfusion. 2013; 53(2): 438–54. DOI: 10.1111/j.1537-2995.2012.03742.x.
15. Official Journal of the European Union: Directive 2002/98/EC of the European Parliament and of the Council of 27 January 2003 setting standards of quality and safety for the collection, testing, processing, storage and distribution of human blood and blood components and amending Directive 2001/83/EC. 2003. European Medicines Agency; 2022. https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/directive-2002/98/ec-european-parliament-council-27-january-2003-setting-standards-quality-safety-collection-testing_en.pdf.
16. Candotti D., Boizeau L., Laperche S. Occult hepatitis B infection and transfusion-transmission risk. Transfus Clin Biol. 2017; 24(3): 189–95. DOI: 10.1016/j.tracli.2017.06.014.
17. Приказ № 1166н от 28 октября 2020 «Об утверждении порядка прохождения донорами медицинского обследования и перечня медицинских противопоказаний (временных и постоянных) для сдачи крови и (или) ее компонентов и сроков отвода, которому подлежит лицо при наличии временных медицинских показаний, от донорства крови и (или) ее компонентов» МЗ РФ.
18. Hourfar M.K., Walch L.A., Geusendam G., et al. Sensitivity and specificity of Anti-HBc screening assays — which assay is best for blood donor screening? Int J Lab Hematol. 2009; 31(6): 649–56. DOI: 10.1111/j.1751-553X.2008.01092.x.
19. Постановление Главного государственного санитарного врача РФ № 4 от 28.01.2021 (ред. от 25.05.2022) «Об утверждении санитарных правил и норм СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней»».
20. Allain J.P. Occult hepatitis B virus infection: Implications in transfusion. Vox Sang. 2004; 86(2): 83–91. DOI: 10.1111/j.0042-9007.2004.00406.x.
21. Hauser L., Roque-Afonso A.M., Beylouné A., et al. Hepatitis E transmission by transfusion of Intercept blood system-treated plasma. Blood. 2014; 123(5): 796–7. DOI: 10.1182/blood-2013-09-524348.
22. Störmer M., Vollmer T., Kleesiek K., Dreier J. Spore-forming organisms in platelet concentrates: A challenge in transfusion bacterial safety. Transfus Med. 2008; 18(6): 371–6. DOI: 10.1111/j.1365-3148.2008.00895.x.
23. Domanović D., Ushiro-Lumb I., Compernolle V., et al. Pathogen reduction of blood components during outbreaks of infectious diseases in the European Union: An expert opinion from the European Centre for Disease Prevention and Control consultation meeting. Blood Transfus. 2019; 17(6):433–48. DOI: 10.2450/2019.0288-19.
24. SHOT Annual Report and Summary, 2019. https://www.shotuk.org/wp-content/uploads/myimages/SHOT-REPORT-2019-Final-Bookmarked-v2.pdf.
25. Dodd R.Y., Crowder L.A., Haynes J.M., et al. Screening blood donors for HIV, HCV, and HBV at the American Red Cross: 10-Year trends in prevalence, incidence, and residual risk, 2007 to 2016. Transfus Med Rev. 2020; 34(2): 81–93. DOI: 10.1016/j.tmrv.2020.02.001.
Об авторах
А. П. ФаенкоРоссия
Фаенко Александр Павлович, кандидат медицинских наук, трансфузиолог отделения комплектования донорских кадров
123182, Москва
А. А. Филиппова
Россия
Филиппова Анна Александровна, кандидат медицинских наук, заведующая отделом обеспечения безопасности донорской крови и ее
компонентов, эпидемиолог
123182, Москва
С. А. Голосова
Россия
Голосова София Александровна, директор
123182, Москва
Я. Н. Глазов
Россия
Глазов Ярослав Николаевич, заместитель директора по медицинской части, трансфузиолог
123182, Москва
И. В. Иванова
Россия
Иванова Ирина Викторовна, заведующая отделом лабораторной диагностики
123182, Москва
Е. А. Клюева
Россия
Клюева Елена Александровна, кандидат медицинских наук, заведующая отделом организации оказания медицинской помощи по профилю «Трансфузиология», врач-методист
123182, Москва
М. А. Касаткин
Россия
Касаткин Михаил Анатольевич, заведующий отделом заготовки донорской крови и ее компонентов, трансфузиолог
123182, Москва
Рецензия
Для цитирования:
Фаенко А.П., Филиппова А.А., Голосова С.А., Глазов Я.Н., Иванова И.В., Клюева Е.А., Касаткин М.А. Внедрение лабораторного исследования на анти-HBcore у доноров крови. Гематология и трансфузиология. 2022;67(4):525-534. https://doi.org/10.35754/0234-5730-2022-67-4-525-534
For citation:
Faenko A.P., Filippova A.A., Golosova S.A., Glazov Ya.N., Ivanova I.V., Klyueva E.A., Kasatkin M.A. The introduction of Laboratory testing for anti-HBcore in blood donors. Russian journal of hematology and transfusiology. 2022;67(4):525-534. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-525-534











































