Перейти к:
Внутрисосудистая В-крупноклеточная лимфома с изолированным поражением костного мозга
https://doi.org/10.35754/0234-5730-2022-67-4-579-585
Аннотация
Введение. Внутрисосудистая крупноклеточная В-клеточная лимфома является редким вариантом В-крупноклеточных высокоинвазивных экстранодальных опухолей лимфатической системы. Патогенез заболевания заключается в проникновении опухолевых клеток в мелкие сосуды и капилляры различных органов. Клиническая манифестация нетипична для диффузной В-крупноклеточной лимфомы.
Цель – представить опыт диагностики внутрисосудистой В-клеточной лимфомы.
Основные сведения. Представлено клиническое наблюдение 78-летнего больного, у которого заболевание дебютировало лихорадкой, анемией, тромбоцитопенией, в крови выявили 4 % клеток с морфологией лимфобластов. Гистологическая и иммуногистохимическая картина костного мозга соответствовала поражению внутрисосудистой крупноклеточной В-клеточной лимфомой, при иммунофенотипировании выявили 15,7 % бластных клеток с иммунофенотипом CD19+HLA/DR+CD24+CD37+CD20+CD10+IgM+. Установлен диагноз: диффузная В-крупноклеточная лимфома, IVВ стадия, внутрисосудистый вариант с поражением костного мозга, агрессивное течение. Проведена терапия по схеме «R-CHOР». При контрольном исследовании костного мозга количество лимфоидных элементов составило 3,6 %, лабораторные показатели нормализовались.
Для цитирования:
Фокина Е.С., Дьяконов Д.А., Докшина И.А., Росин В.А. Внутрисосудистая В-крупноклеточная лимфома с изолированным поражением костного мозга. Гематология и трансфузиология. 2022;67(4):579-585. https://doi.org/10.35754/0234-5730-2022-67-4-579-585
For citation:
Fokina E.S., Dyakonov D.A., Dokshina I.A., Rosin V.A. Intravascular large B-cell lymphoma with isolated bone marrow involvement. Russian journal of hematology and transfusiology. 2022;67(4):579-585. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-579-585
Введение
Внутрисосудистая B-крупноклеточная неходжкинская лимфома (ВСВКЛ) является чрезвычайно редким вариантом диффузной B-крупноклеточной лимфомы (ДВВКЛ), на которую приходится всего 1 % от общего числа случаев. Ежегодная заболеваемость составляет менее 0,5 случая на 1 000 000 населения [1]. Обычно данный вид лимфомы выявляют у пожилых людей, средний возраст которых около 70 лет. Гендерных различий не установлено [1].
Согласно четвертому изданию классификации ВОЗ [2], встречаются две основные клинические формы ВСВКЛ — классическая форма и форма, связанная с гемофагоцитарным синдромом. Форма заболевания, ассоциированная сгемофагоцитарным синдромом (азиатский вариант), характеризуется полиорганной недостаточностью, панцитопенией и гепатоспленомегалией [3][4]. У больных классической формой (преобладает в странах Европы) чаще выявляются поражения кожи и центральной нервной системы (ЦНС). Также диагностируют поражения легких, почек, надпочечников и костного мозга [4]. Имеются описания отдельных клинических наблюдений больных ВСВКЛ с вовлечением щитовидной железы ипростаты [4]. Клиническая картина при данном варианте лимфомы неспецифична.
Из-за отсутствия специфических признаков варианты ВСВКЛ трудно диагностировать. Часто отмечается лихорадка (45 %), изменение лабораторных показателей в сыворотке крови: высокая концентрация лактатдегидрогеназы (ЛДГ) и растворимого рецептора интерлейкина-2 (sIL-2R) [6][7]. К моменту обращения в лечебное учреждение у больных часто констатируют запущенную стадию заболевания, а диагноз устанавливают только при аутопсии. Часть больных умирает в течение года, что свидетельствует о высокой степени злокачественности опухоли и неблагоприятном прогнозе. По данным некоторых исследователей, 3-летняя общая выживаемость при использовании схемы «R-CHOP» (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизолон) составляет 60–81 % [5][7].
Морфологическая картина при ВСВКЛ представлена диффузной пролиферацией лимфоидных клеток в просветах мелких и средних сосудов в тканях и органах. Микроскопически опухолевые элементы имеют средний или большой размер, выраженные ядрышки, скудную цитоплазму, часто выявляются фигуры митоза [8]. Они экспрессируют зрелые пан-В-клеточные антигены, около 30 % являются CD5-положительными [9]. Такие маркеры, как CD10 (10 %), BCL-2 (90 %), C-MYC (70 %), IRF4/MUM-1 (75 %) и BCL-6 (25–60 %), также могут выявляться на поверхности клеток опухолевого субстрата. Пролиферативная активность высокая, уровень Ki-67 варьирует от 60 до 100 %. Экспрессия PD-L1 может быть установлена в 44–50 % случаев при любом клиническом варианте [9]. Наиболее значимой для дифференциальной диагностики ВСВКЛ считается иммуногистохимическая экспрессия CD34, CD20 и PAX5.
Цель настоящей работы — представить клиническое наблюдение больного с конституциональными симптомами и лихорадкой неясного генеза, у которого диагностирована ВСВКЛ. Из-за неспецифичности симптомов диагностика заболевания была затруднена, болезнь протекала крайне агрессивно.
Клиническое наблюдение
Больной 78 лет, заболел остро. В дебюте заболевания отметил появление слабости и фебрильной лихорадки в течение 3 недель. При осмотре терапевтом по месту жительства периферические лимфатические узлы не пальпировались, органомегалия отсутствовала, определялась пастозность голеней и стоп. Состояние больного прогрессивно ухудшалось, в связи с чем он был госпитализирован в терапевтическое отделение КОГБУЗ «Кировская клиническая больница № 7 им. В.И. Юрловой». С 06.08.17 по 15.08.2017 больной получал антибактериальную терапию ex juvantibus (азитромицин, цефтриаксон) и симптоматическое лечение без эффекта. Для исключения онкологической патологии выполнены рентгенография легких, выявлен диффузный пневмосклероз. По данным компьютерной томографии органов брюшной полости имелся отек паренхимы печени, лимфатические узлы были не увеличены, селезенка, почки, поджелудочная железа не изменены. Ректороманоскопия патологии также не выявила. Больной был консультирован ревматологом, данных о наличии системного заболевания соединительной ткани не установлено. По данным эхокардиоскопии, имелись лишь возрастные изменения. В общем анализе крови: гемоглобин — 104 г/л, эритроциты — 3,0 × 1012/л, СОЭ — 24 мм/ч, тромбоциты — 112 × 109/л, лейкоциты — 4,9 × 109/л, в лейкоцитарной формуле выявлено 4 % клеток с морфологией лимфобластов. Больной был направлен на консультацию к гематологу в ФГБУН КНИИГиПК ФМБА России. На основании выявленных в общем анализе крови изменений заподозрен лейкоз. 11.09.2017 выполнена стернальная пункция, при цитологическом исследовании костного мозга выявлено 53 % опухолевых клеток без выраженных признаков линейной принадлежности, с явлениями атипии ядер. Выявлены ядра средних и крупных размеров, округлой формы, зернистым хроматином, выраженными нуклеолами, широкой резко базофильной цитоплазмой с зоной перинуклеарного просветления; в части патологических элементов отмечалось эксцентричное расположение ядер, необильная вакуолизация ядер и цитоплазмы. При цитохимическом анализе на липиды, миелопероксидазу и гликоген в бластных клетках — реакции отрицательные; при реакции с α-нафтол AS ацетат-эстеразой отмечена слабая активность без признаков ее ингибирования NaF. Выполнено иммуноцитохимическое исследование, при котором установлено, что опухолевые клетки инфильтрата имели В-клеточную направленность (СD20+). В этих же клетках отмечались реакции с PAX5+, BCL2+, CD44+. Четверть опухолевых элементов имела позитивные реакциис MUM1, CD10. Маркер пролиферативной активности Ki-67 был положительным в 70 % клеток. Реакции с CD5, CD30, CD38, CD138, CD56, Tdt, ALK, BCL6, c-MYC, SOX11 в патологических В-клетках отрицательные. Таким образом, цитологическая картина, с учетом результатов цитохимических и иммуноцитохимических исследований, наиболее соответствовала поражению костного мозга крупноклеточной В-клеточной лимфомой.
Больной был госпитализирован во взрослое отделение гематологии и химиотерапии ФГБУН КНИИГ и ПК ФМБА России (даты госпитализации: 12.09.2017–12.10.2017) для уточнения диагноза, определения дальнейшей тактики лечения и проведения терапии. При объективном обследовании выявлено ослабление дыхания, периферические лимфатические узлы не пальпировались, размеры печени и селезенки при пальпации были в норме, отмечалась пастозность нижней трети голенейи стоп. В анализах сыворотки крови выявили: повышение концентраций мочевой кислоты — до 639 мкмоль/л (норма — 202–417 мкмоль/л), ЛДГ — до 1885 ед./л (норма — 135–225 ед./л), бета-2-микроглобулина — до 8,9 ммоль/л (норма — 0,9–2,0 ммоль/л), С-реактивного белка — до 0,6 г/л (норма — 0–0,005 г/л), уменьшение концентрации общего белка — до 45 г/л (норма — 66–87 г/л), увеличение концентрации аспартатаминотрансферазы — до 48 ед./л (норма — 0–40 ед./л) принормальных концентрациях билирубина и аланинаминотрансферазы.
На основании результатов обследования был установлен предварительный диагноз: неходжкинская лимфома, IVВ стадия, неуточненный вариант с поражением костного мозга, агрессивное течение. Для уточнения диагноза 13.09.2017 выполнено гистологическое исследование костного мозга (трепанобиопсия) (рис. 1).
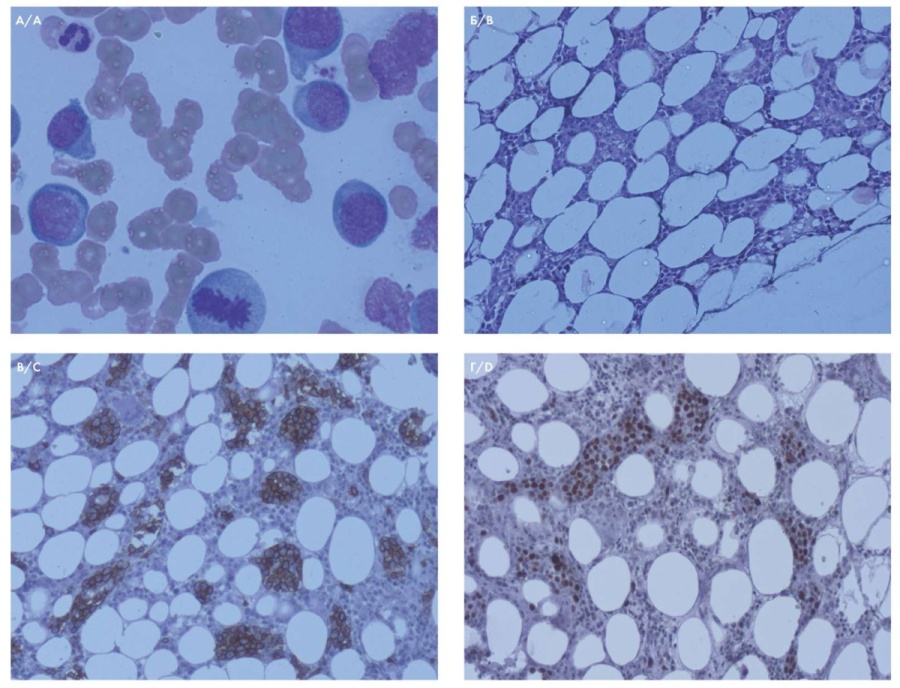
Рисунок 1. А — миелограмма: клетки лимфомы в пунктате костного мозга, фигуры митоза; окраска по Романовскому, ×1000; Б — гистологический препарат костного мозга: группы лимфоидных клеток в просветах сосудистых синусов; окраска гематоксилином и эозином, ×100; В — иммуногистохимическое исследование костного мозга: группы опухолевых клеток в просветах сосудистых синусов экспрессировали CD20, ×100; Г — иммуногистохимическое исследование костного мозга с антителом к Ki-67: высокая пролиферативная активность в опухолевых клетках, ×100
Figure 1. A — myelogram: lymphoma cells in bone marrow punctate, mitotic figures; stain according to Romanovsky, ×1000; B — histological preparation of the bone marrow: groups of lymphoid cells in the lumen of the vascular sinuses; stained with hematoxylin and eosin, ×100; C — immunohistochemical study of the bone marrow: groups of tumor cells in the lumen of the vascular sinuses express CD20, ×100; D — immunohistochemical study of the bone marrow with an antibody to Ki-67: high proliferative activity in tumor cells, ×100
Характеристика трепанобиоптата: около половины из представленных костномозговых лакун были гипоклеточные, часть из них заполнена опустошенной стромой; в остальных полостях клеточность костного мозга была повышена за счет инфильтрации лимфоидными элементами с ядрами средних и крупных размеров, округлой формы, светлым хроматином, отчетливыми ядрышками и увеличенным показателем ядерно-цитоплазматического отношения. Атипичные лимфоидные клетки заполняли кровеносные синусы костного мозга, местами образовывали интерстициальные инфильтраты. При иммуногистохимическом исследовании выявлено, что клетки лимфоидной инфильтрации имели В-клеточный иммунофенотип (CD20+, CD79α+, PAX-5+). В этих же клетках были положительные реакции с MUM.1+, BCL2+, CD44+, FOXP1+, c-MYC±. Положительная экспрессия с Ki-67 визуализировалась в 70 % опухолевых клеток. Реакции с CD3, CD5, CD10, CD30, CD138, BCL6, TdT, ALK, CyclinD1 — отрицательные. По данным исследования трепанобиоптата было сделано заключение: гистологическая и иммуногистохимическая картина наиболее соответствовала поражению костного мозга ВСВКЛ.
При иммунофенотипировании клеток костного мозга с помощью проточной цитофлуориметрии установлено, что 15,7 % бластных клеток с иммунофенотипом CD19+HLA/DR+CD24+CD37+CD20+CD10+IgM+. На основании полученных данных сделано заключение о поражении костного мозга, характерном для В-линейного лейкоза/лимфомы, В-IV варианта. Для исключения поражения ЦНС 14.09.2017 выполнена люмбальная пункция, при исследовании спинномозговой жидкости цитоз составил 3 клетки в 1 мкл, что позволило исключить поражение ЦНС.
При цитогенетических исследованиях нарушений кариотипа не выявлено. Результат флуоресцентной гибридизации in situ локуса IGH (14q32) соответствовал норме. На основании полученных данных 14.09.2017 установлен окончательный клинический диагноз: диффузная В-крупноклеточная лимфома, IVВ стадия, внутрисосудистый вариант с поражением костного мозга, агрессивное течение. Больному была назначена первая линия терапии по схеме «R-CHOР» (ритуксимаб, циклофосфамид, винкристин, преднизолон). Кроме того, проводили лечение инфекционных осложнений, сопроводительную терапию. В процессе лечения была диагностирована левосторонняя нижнедолевая пневмония. Вследствие нарастания дыхательной и сердечно-сосудистой недостаточности больной был переведен на искусственную вентиляцию легких, которую проводили с 28.09.17 по 07.10.17. В результате проведенных лечебных мероприятий осложнения купированы, больной был выписан в удовлетворительном состоянии. При контрольном исследовании костного мозга 09.10.2017 количество лимфоидных элементов составило 3,6 %, лабораторные показатели нормализовались.
Обсуждение
Данные клинического наблюдения демонстрируют наличие у больного в дебюте заболевания сочетания лихорадки неясного генеза, панцитопении и изменения лабораторных показателей. Отсутствие лимфаденопатии, увеличения печени и селезенки затруднило диагностику лимфомы. Повышение температуры тела при лимфомах является следствием опухолевой интоксикации, может быть ранним и длительным симптомом [9][10][13]. Диагностические трудности возникают в случае отсутствия вовлечения в процесс лимфатических узлов, специфических изменений в общем анализе крови. Выявление у больного в миелограмме высокого содержания опухолевых клеток позволило провести целенаправленный диагностический поиск лимфопролиферативного заболевания. Для окончательного подтверждения диагноза выполнена трепанобиопсия костного мозга, при помощи которой установлен диагноз ВСВКЛ, т. к. были выявлены лимфоидные клетки с характерным иммунофенотипом, расположенные внутри сосудов [13–16]. «Путь к диагнозу» у больного был длительным. Клиническое наблюдение демонстрирует трудности, с которыми может столкнуться врач у больного с лихорадкой неясного генеза. Лихорадка всегда сопутствует опухоли на том или ином этапе развития, но с особым постоянством наблюдается при опухолях лимфоидной ткани. Правильная диагностика и своевременная терапия позволяет улучшить прогноз и продлить жизнь больных с ВСВКЛ.
ВСВКЛ следует рассматривать в качестве конкурирующего диагноза у больных с конституциональными симптомами, лихорадкой неясного генеза, особенно с цитопенией и повышенной концентрацией ЛДГ. Клиническая настороженность является ключом к быстрой диагностике данного варианта ДВВКЛ. Проведение своевременных ранних диагностических мероприятий, определение правильной лечебной тактики позволяет увеличить общую и безрецидивную выживаемость.
Список литературы
1. Sukswai N., Lyapichev K., Khoury J.D., Medeiros L.J. Diffuse large B-cell lymphoma variants: An update. Pathology. 2020; 52(1): 53–67. DOI: 10.1016/j.pathol.2019.08.013.
2. Swerdlow S.H., Campo E., Pileri S.A., et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016; 127(20): 2375–90. DOI: 10.1182/blood-2016-01-643569.
3. Orwat D.E., Batalis N.I. Intravascular large B-cell lymphoma. Arch Pathol Lab Med. 2012; 136(3): 333–8. DOI: 10.5858/arpa.2010-0747-RS.
4. Rosenthal A., Rimsza L. Genomics of aggressive B-cell lymphoma. Hematology Am Soc Hematol Educ Program. 2018; 2018(1): 69–74. DOI: 10.1182/asheducation-2018.1.69.
5. Ameli F., Abadi F., Saffar H. Intravascular large B-cell lymphoma: A report of two cases. Iran J Pathol. 2020; 15(4): 346–50. DOI: 10.30699/ijp.2020.119590.2299.
6. Landsburg D.J., Falkiewicz M.K., Petrich A.M., et al. Sole rearrangement but not amplification of MYC is associated with a poor prognosis in patients with diffuse large B cell lymphoma and B cell lymphoma unclassifiable. Br J Haematol. 2016; 175(4): 631–40. DOI: 10.1111/bjh.14282.
7. Arantza O., Santiago-Quispe N., Iglesias-Martinez E., Romero-Abrio C. Molecular update and evolving classification of large B-cell lymphoma. Cancers (Basel). 2021; 13(13): 3352. DOI: 10.3390/cancers13133352.
8. Chapuy B., Roemer M.G., Stewart C., et al. Targetable genetic features of primary testicular and primary central nervous system lymphomas. Blood. 2016; 127(7): 869–81. DOI: 10.1182/blood-2015-10-673236.
9. Ott G. Aggressive B-cell lymphomas in the update of the 4th edition of the World Health Organization classification of haematopoietic and lymphatic tissues: Refinements of the classification, new entities and genetic findings. Br J Haematol. 2017; 178(6): 871–87. DOI: 10.1111/bjh.14744.
10. Fonkem E., Lok E., Robison D., et al. The natural history of intravascular lymphomatosis. Cancer Med. 2014; 3(4): 1010–24. DOI: 10.1002/cam4.269.
11. Mukherjee A., Ibrahim I.F. Intravascular large B-cell lymphoma: An elusive diagnosis with challenging management. J Community Support Oncol. 2018; 16(6): e280–2. DOI: 10.12788/JCSO.0425.
12. Brunet V., Marouan S., Routy J.P., et al. Retrospective study of intravascular large B-cell lymphoma cases diagnosed in Quebec: A retrospective study of 29 case reports. Medicine (Baltimore). 2017; 96(5): e5985. DOI: 10.1097/MD.0000000000005985.
13. Murase T., Yamaguchi M., Suzuki R., et al. Intravascular large B-cell lymphoma (IVLBCL): A clinicopathologic study of 96 cases with special reference to the immunophenotypic heterogeneity of CD5. Blood. 2007; 109(2): 478–85. DOI: 10.1182/blood-2006-01-021253.
14. Ferreri A.J., Campo E., Seymour J.F., et al. Intravascular lymphoma: clinical presentation, natural history, management and prognostic factors in a series of 38 cases, with special emphasis on the ‘cutaneous variant’. Br J Haematol. 2004; 127(2): 173–83. DOI: 10.1111/j.1365-2141.2004.05177.x.
15. Luo B., Chen J.M., Liu J., et al. A case of intravascular large B cell lymphoma presenting as nodular goiter. Diagn Pathol. 2017; 12(1): 64. DOI: 10.1186/s13000-017-0656-x.
16. Tajima S., Waki M., Yamazaki H., et al. Intravascular large B-cell lymphoma manifesting as cholecystitis: Report of an Asian variant showing gain of chromosome 18 with concurrent deletion of chromosome 6q. Int J Clin Exp Pathol. 2014; 7(11): 8181–9.
17. Tahsili-Fahadan P., Rashidi A., Cimino P.J., et al. Neurologic manifestations of intravascular large B-cell lymphoma. Neurol Clin Pract. 2016; 6(1): 55–60. DOI: 10.1212/CPJ.0000000000000185.
18. Ponzoni M., Campo E., Nakamura S. Intravascular large B-cell lymphoma: A chameleon with multiple faces and many masks. Blood. 2018; 132(15): 1561–7. DOI: 10.1182/blood-2017-04-737445.
19. Ferreri A.J., Dognini G.P., Bairey O., et al. The addition of rituximab to anthracycline-based chemotherapy significantly improves outcome in ‘Western’ patients with intravascular large B-cell lymphoma. Br J Haematol. 2008; 143(2): 253–7. DOI: 10.1111/j.1365-2141.2008.07338.x.
20. Kato K., Ohno Y., Kamimura T., et al. Long-term remission after high-dose chemotherapy followed by auto-SCT as consolidation for intravascular large B-cell lymphoma. Bone Marrow Transplant. 2014; 49(12): 1543–4. DOI: 10.1038/bmt.2014.189.
21. Fonkem E., Lok E., Robison D., et al. The natural history of intravascular lymphomatosis. Cancer Med. 2014; 3(4): 1010–24. DOI: 10.1002/cam4.269.
Об авторах
Е. С. ФокинаРоссия
Фокина Елена Сергеевна*, кандидат медицинских наук, гематолог, заместитель начальника отдела организации и сопровождения научных исследований
610027, Киров
Д. А. Дьяконов
Россия
Дьяконов Дмитрий Андреевич, кандидат медицинских наук, заведующий лабораторией патоморфологии
610027, Киров
И. А. Докшина
Россия
Докшина Ирина Анатольевна, кандидат медицинских наук, гематолог взрослого отделения гематологии и химиотерапии
610027, Киров
В. А. Росин
Россия
Росин Виталий Анатольевич, кандидат медицинских наук, старший научный сотрудник лаборатории патоморфологии
610027, Киров
Рецензия
Для цитирования:
Фокина Е.С., Дьяконов Д.А., Докшина И.А., Росин В.А. Внутрисосудистая В-крупноклеточная лимфома с изолированным поражением костного мозга. Гематология и трансфузиология. 2022;67(4):579-585. https://doi.org/10.35754/0234-5730-2022-67-4-579-585
For citation:
Fokina E.S., Dyakonov D.A., Dokshina I.A., Rosin V.A. Intravascular large B-cell lymphoma with isolated bone marrow involvement. Russian journal of hematology and transfusiology. 2022;67(4):579-585. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-579-585











































