Перейти к:
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ВОССТАНОВЛЕНИЯ ФУНКЦИИ ПОЧЕК У БОЛЬНЫХ ВПЕРВЫЕ ДИАГНОСТИРОВАННОЙ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ, ОСЛОЖНЕННОЙ ТЯЖЕЛОЙ И ДИАЛИЗ-ЗАВИСИМОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
https://doi.org/10.35754/0234-5730-2019-64-3-283-296
Аннотация
Введение. Поражение почек в дебюте множественной миеломы (ММ) имеет место у 20–40 % больных, что в 2–4 % случаев требует начала проведения заместительной почечной терапии. Ухудшение функции почек ассоциируется с высоким риском ранней смерти, частыми осложнениями и ухудшением качества жизни.
Цель представленной работы — анализ лечения больных впервые диагностированной ММ, осложненной тяжелой и диализ-зависимой почечной недостаточностью.
Материалы и методы. В ретроспективное исследование (11.2014–11.2017) включено 62 больных ММ со скоростью клубочковой фильтрации <30 мл/мин/1,73 м2. Критерии включения — концентрация свободных легких цепей в сыворотке крови >500 мг/л и селективный характер протеинурии. Критерий исключения — диагностированный AL-амилоидоз. В зависимости от необходимости проведения гемодиализа больные были разделены на две группы: (I) не нуждающиеся в нём (n = 16) и (II) диализ-зависимые больные (n = 46).
Результаты. В индукции использовали бортезомиб-содержащие программы: VCD — 41 (66,1 %), PAD — 2 (3,2 %), VD — 12 (19,4 %) и VMP — 7 (11,3 %). Высокодозная консолидация с трансплантацией аутологичных гемопоэтических стволовых клеток реализована у 10 (16,1 %) больных. Частота общего противомиеломного ответа по группам составила 64,3 и 85,3 % (р = 0,047), включая полные и строгие полные ремиссии в 14,3 и 14,7 % случаев. Почечного ответа достигли 57,2 и 23,5 % (р = 0,032) больных. При медиане наблюдения 32,1 мес. по всей когорте медиана выживаемости без прогрессирования (ВБП) составила 14,5 мес., 3-летняя ВБП — 27,4 ± 6,6 %, медиана общей выживаемости (ОВ) — 33,6 мес. и 3-летняя ОВ — 41,5 ± 7,7 %. Различий между группами сравнения по показателям выживаемости нет. По выборке оцененных больных (n = 48) достижение любого почечного ответа ассоциировалось с улучшением показателей 3-летней ВБП 61,1 ± 11,5 % против 17,7 ± 7,7 % (р = 0,045), ОВ 72,2 ± 10,6 % против 38,1 ± 10,4 % (р = 0,069). Предиктором почечного ответа оказалось время, прошедшее между первой процедурой гемодиализа и стартом противомиеломной химиотерапии. В группе больных, достигших почечного ответа, среднее время составило 8,6 (95 % доверительный интервал 3,5–13,7) дня против 42,5 (12,6–72,5) дня больных без ответа (p = 0,045).
Заключение. Применение схем на основе бортезомиба обеспечивает высокую частоту противоопухолевых ответов с вероятностью прекратить диализ у 23,5 % зависимых больных. К возможным причинам низкой частоты почечного ответа можно отнести позднюю диагностику ММ как причины поражения почек и отсутствие доступа к новым противомиеломным препаратам в случае необходимости смены индукционной терапии.
Ключевые слова
Для цитирования:
Семочкин С.В., Желнова Е.И., Мисюрина Е.Н., Марьин Д.С., Ушакова А.И., Каримова Е.А., Барях Е.А., Толстых Т.Н., Маврина Е.С., Юрова Е.В., Черкасова А.В., Гришина Е.Ю., Гаглоева Д.Э., Яцков К.В., Котенко О.Н., Лысенко М.А. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ВОССТАНОВЛЕНИЯ ФУНКЦИИ ПОЧЕК У БОЛЬНЫХ ВПЕРВЫЕ ДИАГНОСТИРОВАННОЙ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ, ОСЛОЖНЕННОЙ ТЯЖЕЛОЙ И ДИАЛИЗ-ЗАВИСИМОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Гематология и трансфузиология. 2019;64(3):283-296. https://doi.org/10.35754/0234-5730-2019-64-3-283-296
For citation:
Semochkin S.V., Zhelnova E.I., Misyurina E.N., Maryin D.S., Ushakova A.I., Karimova E.A., Baryakh E.A., Tolstykh T.N., Mavrina E.S., Yurova E.V., Cherkasova A.V., Grishina E.Yu., Gagloeva D.E., Yatskov K.V., Kotenko O.N., Lysenko M.A. CLINICAL IMPORTANCE OF RENAL RECOVER ON OUTCOMES OF NEWLY DIAGNOSED MULTIPLE MYELOMA PATIENTS WITH SEVERE AND DIALYSIS-DEPENDENT KIDNEY FAILURE. Russian journal of hematology and transfusiology. 2019;64(3):283-296. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-3-283-296
Введение
Почечная недостаточность (ПН) представляет собой жизнеугрожающее и достаточно частое осложнение симптоматической множественной миеломы (ММ). Ухудшение функции почек имеет место у 20—40 % больных впервые диагностированной ММ, которая в 2—4 % случаев может манифестировать с тяжелого острого повреждения почек (ОПП), требующего проведения заместительной почечной терапии [1]. Кроме того, ПН может развиться еще у четверти больных уже на этапе рецидивирующей и рефрактерной ММ у которых исходно подобной проблемы не было [2]. Поражение почек при ММ ассоциируется с высоким риском ранней смерти, частыми госпитализациями вследствие осложнений, обусловленных центральным венозным катетером, инфекций, белковых и электролитных нарушений, с ухудшением качества жизни и удорожанием лечения [3, 4].
Чаще всего ОПП при ММ является следствием избыточной продукции миеломными клетками свободных легких цепей (СЛЦ) моноклонального иммуноглобулина, превышающей способности клеток канальцев их реабсорбировать и катаболизировать. Усиленный эндоцитоз СЛЦ клетками проксимальных канальцев приводит к активации в них сигнальных каскадов NF-kB и MAPK, секреции провоспалительных цитокинов (IL-6, CCL2, IL-8 и TGFβ) и, в итоге, к развитию интерстициального фиброза и гибели перегруженных белком клеток [5]. Нереабсорбированные СЛЦ соединяются с белком Тамма—Хорсфалла, образуя в просвете канальцев восковидные цилиндры (“cast" нефропатия) [6]. Развитие восходящей обструкции на фоне усиливающегося фиброза и прогрессивной гибели клеток проксимальных канальцев со временем приводит к формированию необратимой хронической болезни почек (ХБП) [5, 6].
Современная химиотерапия позволяет в части случаев восстановить функцию почек, что ассоциируется с улучшением общей выживаемости (ОВ) таких больных. В силу очевидных обстоятельств больных с тяжелым повреждением почек, как правило, исключают из клинических исследований, поэтому данные по эффективности терапии с помощью новых режимов в этой ситуации отсутствуют. Текущие рекомендации фактически основаны на опыте небольших исследований или ретроспективном анализе серии клинических наблюдений. Чаще всего для лечения больных впервые диагностированной ММ, осложненной умеренной и тяжелой ПН, используются триплеты на основе комбинации ингибитора протеасомы бортезомиба и дексаметазона [1]. Данные в отношении диализ-зависимых больных носят ограниченный характер. Эффективность высокоселективных мембран (high cut-off) для гемодиализа, способных задерживать легкие цепи иммуноглобулинов, вызывает сомнения [7, 8]. Таким образом, оптимальная терапия обсуждаемой категории больных очевидным образом нуждается в уточнении.
Целью работы явился анализ лечения больных впервые диагностированной ММ, осложненной тяжелой и диализ-зависимой ПН с помощью бортезомиб-содер- жащих программ.
Больные и методы
В ретроспективное исследование, проведенное в период с ноября 2014 г. по ноябрь 2017 г., было включено 62 больных тяжелой ПН со скоростью клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2. Для расчета СКФ использовали формулу CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [9]. Условием включения больного в представленный анализ была концентрация вовлеченной СЛЦ в сыворотке крови >500 мг/л и селективный характер протеинурии (альбумин <25 %), что при отсутствии других очевидных причин позволяет предполагать “cast" нефропатию. В качестве критерия исключения рассматривался диагностированный на любом этапе ведения AL-амилоидоз любой анатомической локализации. Для целей последующего анализа больные были разделены на две группы: (I) которым не требовалось проведение гемодиализа (п = 16) и (II) которым заместительная почечная терапия была необходима (п = 46).
Больные получали индукционную противомиеломную химиотерапию и заместительную почечную терапию в условиях ГБУЗ ГКБ №52 ДЗМ (г. Москва). Обеспечивалась сходная сопроводительная терапия и проведение индукции с помощью бортезомиб-содержащих программ. В работе использовались стандартные высокопоточные гемодиализаторы c модифицированными полисульфоновыми мембранами площадью 1,5-2,0 м2.
Инициальный сбор данных включал сведения анамнеза, результаты физикального осмотра, определение стандартных лабораторных параметров, включая концентрацию β2-микроглобулина, общего белка и белковых фракций крови, иммунохимическое исследование белков сыворотки крови и мочи, СЛЦ сыворотки крови, кальция и креатинина крови, стандартное рентгенологическое обследование костной системы, а при наличии показаний — компьютерную томографию или магнитно-резонансную томографию костей и мягких тканей и биопсию костного мозга. Молекулярно-генетическое исследование выполнено по костному мозгу с помощью флуоресцентной гибридизации in situ (fluorescence in situ hybridization — FISH) зондов к t(4;14), t(14;16), del(17p) и +1q21 у 18 (29,0 %) больных. Данные по нежелательным явлениям выбраны из первичной медицинской документации и ограничены первыми 4 циклами индукции. События классифицировали в соответствии с общими критериями токсичности NCI (версия 4.0) [10].
Для оценки почечного ответа использовали критерии Международной рабочей группы по множественной миеломе (International Myeloma Working Group, IMWG) 2010 г. [1]. Полный почечный ответ (ППО) диагностировали при значительном увеличении СКФ по сравнению с базовым уровнем до >60 мл/мин/1,73 м 2; частичный почечный ответ (ЧПО) — как увеличение СКФ с <15 до 30-50 мл/мин/1,73 м 2 и минимальный почечный ответ (МПО) в случае улучшения базовой СКФ с <15 до 15-29 мл/мин/1,73 м 2 или, если исходное значение составляло 15-29 мл/мин/1,73 м 2, то улучшение до 30-59 мл/мин/1,73 м 2. Любой почечный ответ предусматривал отсутствие зависимости от гемодиализа. Противоопухолевый ответ оценивали по стандартным критериям IMWG 2006 г. [11].
Статистический анализ. Количественные переменные, если не указано специально, представлены в статье как среднее с 95 % доверительным интервалом (ДИ) среднего. Оценку значимости различий между качественными характеристиками выборки выполняли с помощью непараметрического теста хи-квадрат Пирсона. Общую выживаемость (ОВ) оценивали от даты начала терапии до даты смерти или последнего контакта с больным. Выживаемость без прогрессирования (ВБ) рассчитывали от момента начала про- тивомиеломной терапии до прогрессирования ММ или смерти от любой причины. Сравнение показателей выживаемости между группами проводили с помощью теста log rank. Показатели выживаемости рассчитаны с помощью метода Каплана—Мейера по состоянию на 01.07.2019. Поиск потенциальных прогностических факторов в отношении вероятности достижения почечного ответа проводили с помощью дисперсионного анализа (Analysis of Variance, ANOVA). Равенство дисперсий между группами оценивали с помощью Е-критерия Ливиня. Для проверки нулевой гипотезы, отсутствия значимости отдельных предикторов ответа использовали непараметрический критерий согласия Колмогорова — Смирнова. Для статистического анализа использовано программное обеспечение IBM SPSS v23.
Результаты
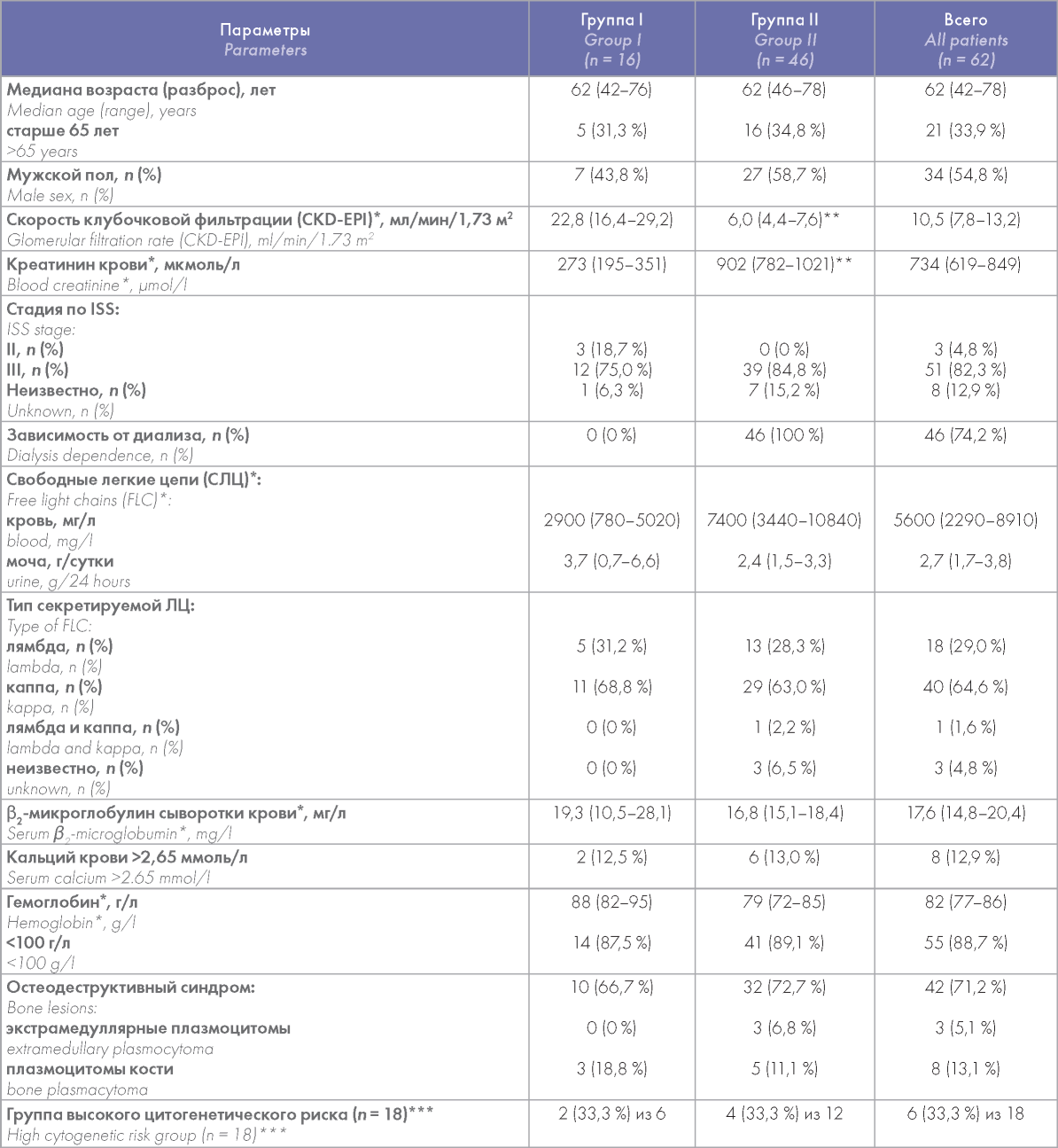
Инициальные характеристики больных представлены в таблице 1.
Таблица 1. Инициальные характеристики больных впервые диагностированной ММ
Table 1. Baseline characteristics of the patients with newly diagnosed multiple myeloma
Параметры Parameters | Группа I Group I (n = 16) | Группа II Group II (n = 46) | Всего All patients (n = 62) |
|---|---|---|---|
Сопутствующая кардиопатология, n (%): Concomitant cardiopathology, n (%): ишемическая болезнь сердца, n (%) coronary artery disease (CAD), n (%) хроническая сердечная недостаточность (>2 NY), n (%) congestive heart failure (>2 NY), n (%) нарушения ритма, n (%) arrhythmia, n (%) артериальная гипертензия, n (%) arterial hypertension, n (%) | 10 (62,5 %) 3 (18,8 %) 2 (12,5 %) 1 (6,3 %) 9 (56,3 %) | 28 (60,9 %) 19 (41,3 %) 9 (19,6 %) 7 (15,2 %) 19 (41,3 %) | 38 (61,3 %) 22 (35,5 %) 11 (177 %) 8 (12,9 %) 28 (45,2 %) |
Примечание. * — данные представлены как среднее (95 % доверительный интервал для среднего значения); ** — p < 0,001; ***t(4;14], t(14;16], del(17p] и/или +1 q21.
Note. *data are presented as mean (95 % Confidence interval); **p < 0.001; ***t(4;14), t(14;16), del(17p) and/or + 1q21; CKD-EPI — Chronic Kidney Disease Epidemiology Collaboration.
Медиана возраста больных составила 62 года (разброс 42-78 лет). Старше 65 лет был 21 (33,9 %) больной. Тридцать четыре больных (54,8 %) были лицами мужского пола. Группы сравнения по демографическим показателям не различались.
В когорте диализ-зависимых больных (группа II) средняя СКФ была значимо ниже — 6,0 (95 % доверительный интервал (ДИ) 4,4-7,6) мл/мин/1,73 м2, чем у независимых (группа I) — 22,2 (95 % ДИ 16,4-29,2) мл/мин/1,73 м2 (р < 0,001), а секреция СЛЦ в сыворотке крови выше — 7400 (95 % ДИ 3440-10840) против 2900 (95 % ДИ 780-5020) мг/л (р < 0,001). Средняя величина экскреции белка с мочой составила 2,7 (95 % ДИ 1,7-3,8) г/сутки без различия между группами. Секреция каппа СЛЦ имела место в 40 (64,6 %) случаях, лямбда — 18 (29,0 %). Средняя концентрация β2-микроглобулина в сыворотке крови составила 17,6 (95 % ДИ 14,8-20,4) мг/л также без отличий по группам.
Гиперкальциемия имела место в 8 случаях (12,9 %). Остеодеструктивный синдром подтвержден у 42 больных (71,2 %). Почти у всех больных наблюдалась анемия — 55 (88,7 %) со средним значением концентрации гемоглобина 82 (95 % ДИ 77-86) г/л. Миелома высокого цитогенетического риска верифицирована при исследовании трети исследованных аспиратов костного мозга. Большинство больных имели клинически значимую кардиологическую патологию — 38 (61,3 %), включая ишемическую болезнь сердца — 22 (35,5 %) и артериальную гипертензию — 28 (45,2 %). Существенных различий между группами сравнения по вышеперечисленным параметрам не было.
Сведения по особенностям проведения первой линии терапии ММ представлены в таблице 2. Среднее время от момента диагностики повреждения почек до начала противомиеломной терапии в группе I составило 45,7 (95 % ДИ 2,7-88,7) дня против 93,4 (95 % ДИ 41,7-145,1) дня в группе II (р = 0,004). В качестве индукции программу VD (бортезомиб, дексаметазон) получили 12 (19,4 %), VCD (VD плюс циклофосфа- мид) — 41 (66,1 %), PAD (VD плюс доксорубицин) — 2 (3,2 %) и VMP (бортезомиб, мелфалан, преднизолон) — 7 (11,3 %) больных.
Таблица 2. Сведения по индукционной терапии множественной миеломы
Table 2. Information on induction therapy of multiple myeloma
Параметры Parameters | Группа I Group I (n =16) | Группа II Group II (n = 46) | Всего All patients (n = 62) |
|---|---|---|---|
Период набора больных Patient recruitment period | 11.2014-10.2017 | 12.2014-11.2017 | 11.2014-11.2017 |
Медиана времени от диагностики ПН до начала химиотерапии ММ (разброс), дней Median time from the diagnosis of renal failure to the beginning of MM chemotherapy (range), days | 21 (1-287) | 39 (1-940) | 25 (1-940) |
Медиана времени от 1-й процедуры гемодиализа до начала химиотерапии ММ (разброс), дней Median time from the first hemodialysis procedure to the start of MM chemotherapy (range), days | - | 12 (1-318) | 12 (1-318) |
Индукционная терапия: Induction therapy: VCD, n (%) PAD, n (%) VD, n (%) VMP, n (%) | 12 (75,0 %) 0 (0 %) 2 (12,5 %) 2 (12,5 %) | 29 (63,0 %) 2 (4,3 %) 10 (21,7 %) 5 (10,9 %) | 41 (66,1 %) 2 (3,2 %) 12 (19,4 %) 7 (11,3 %) |
Смена индукционного режима в случае недостаточного ответа, n (%): Change of induction therapy in case of insufficient response, n (%): VRD, n (%) BBD, n (%) | 3 (18,8 %) 0 (0 %) | 5 (10,9 %) 1 (2,2 %) | 8 (12,9 %) 1 (1,6 %) |
Медиана количества циклов индукционной терапии (разброс) Median number of cycles of induction therapy (range) | 4 (1-6) | 5 (1-8) | 5 (1-8) |
Высокодозная химиотерапия и ауто-ТГСК, n (%) High dose chemotherapy and auto-HSCT, n (%) | 2 (12,5 %) | 8 (17,4 %) | 10 (16,1 %) |
Поддерживающая терапия: Maintenance: бортезомиб (монотерапия), n (%) bortezomib (monotherapy), n (%) леналидомид (монотерапия), n (%) lenalidomide (monotherapy), n (%) схема МР, n (%) protocol МР, n (%) | 5 (31,3 %) 2 (12,5 %) 3 (18,8 %) | 19 (41,3 %) 5 (10,9 %) 8 (17,4 %) | 24 (38,7 %) 7 (11,3 %) 11 (17,7 %) |
Индукционная летальность (первые 60 дней), n (%) Induction mortality (first 60 days), n (%) | 0 (0 %) | 6 (13,0 %) | 6 (9,7 %) |
Выбыли из исследования в пределах первых 6 мес. (не оценен ответ на терапию), n (%) Excluded from the study within the first 6 mon. (response not evaluated), n (%) | 2 (12,5 %) | 12 (26,1 %) | 14 (22,6 %) |
Смена индукционной терапии на программу VRD (VD плюс леналидомид) и BBD (VD плюс бендамустин) ввиду неэффективности стартовой комбинации потребовалась в 8 (12,9 %) и 1 (1,6 %) случаях соответственно. Высокодозную терапию с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) удалось реализовать у 10 (16,1 %) больных, включая 3 случая тандемных трансплантаций. Индукционная летальность за первые 60 дней терапии составила 9,7 %. Выбыли из исследования за первые 6 мес. вследствие смерти либо по причине чрезмерной токсичности (ранний перевод на низкоинтенсивное поддерживающее лечение) — 2 (12,5 %) и 12 (26,1 %) больных I и II групп. В результате их исключения ответ на терапию оценен у 14 (87,5 %) и 34 (73,9 %) больных в соответствующих группах сравнения.
Данные по ответу на противомиеломную терапию представлены на рисунке 1. Частота общего ответа (>ЧР, частичная ремиссия) была ниже в группе больных, независимых от гемодиализа — 64,3 %, по сравнению с зависимыми — 85,3 % (р = 0,047). Полной ремиссии (ПР) и строгой ПР (сПР) достигли 14,3 и 14,7 % больных, как минимум очень хорошей частичной ремиссии (>ОХЧР) — 42,9 и 58,8 % соответственно.
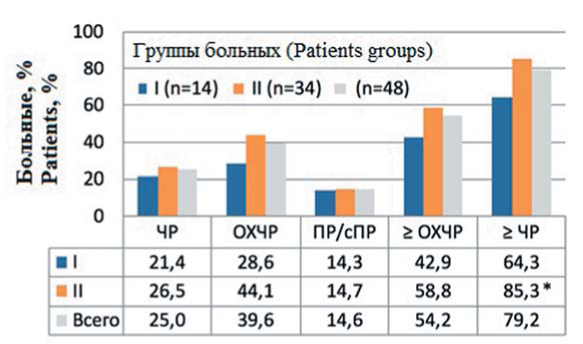
Рисунок 1. Лучший противомиеломный ответ на первую линию терапии Примечание. * — p = 0,047; ЧР — частичная ремиссия, ОХЧР — очень хорошая частичная ремиссия, ПР — полная ремиссия и сПР — строгая полная ремиссия.
Figure 1. Best confirmed myeloma response on the first line therapy Note. * — p = 0.047; PR — partial response, VGPR — very good partial response, CR — complete response and sCR — strong complete response.
В общей сложности почечного ответа в процессе индукционной терапии достигли 16 (33,3 %) человек (табл. 3). Среди субъектов, исходно независимых от гемодиализа (группа I), почечный ответ был получен у 8 (57,1 %) больных, включая 28,6 % ППО, 7,1 % ЧПО и 21,4 % МПО. В результате проведения индукционной химиотерапии стали независимыми от гемодиализа 8 (23,5 %) больных группы II, достигнув ППО — 2,9 %, ЧПО — 8,8 % и МПО — 11,8 %. В целом частота ответов в группе больных, нуждавшихся в гемодиализе, была ниже, чем в группе не нуждавшихся в заместительной почечной терапии (23,5 % против 57,1 %; р = 0,032). В более поздние сроки наблюдения МПО достигли еще 2 больных из группы II. У первого ответ был зарегистрирован после реализации высокодозной химиотерапии и ауто-ТГСК, а у второго — в процессе проведения второй линии терапии с помощью комбинации леналидомида и дек- саметазона через 16 мес. от старта первой линии. Таким образом, в общей сложности независимыми от гемодиализа стали 10 (29,4 %) из 34 оцененных больных группы II.
Таблица 3. Лучший почечный ответ на индукционную противомиеломную терапию
Table 3. Best confirmed renal response on induction therapy of multiple myeloma
Параметры Parameters | Группа I Group I (n = 16) | Группа II Group II (n = 46) | Всего All patients (n = 62) |
|---|---|---|---|
Оценено больных, n (%) Patients evaluated, n (%) | 14 (100 %) | 34 (100 %) | 48 (100 %) |
ППО, n (%) CRrenal, n (%) | 4 (28,6 %) | 1 (2,9 %) | 5 (10,4 %) |
ЧПО, n (%) PRrenal, n (%) | 1 (71 %) | 3 (8,8 %) | 4 (8,3 %) |
МПО, n (%) MRrenal, n (%) | 3 (21,4 %) | 4 (11,8 %) | 7 (14,6 %) |
Общий почечный ответ (>МПО), n (%) Overall renal response (>MRrenal), n (%) | 8 (571 %) | 8 (23,5 %)* | 16 (33,3 %)** |
Примечание. * — p < 0,05; ППО — полный, ЧПО — частичный и МПО — минимальный почечный ответ; ** — дополнительно 2 (4,2 %) больных достигли МПО в поздние сроки.
Note. * — p < 0.05; CRrenal — complete, PR — partial, and MPR — minimal renal response; ** — additionally, 2 (4.2 %) patients achieved a late MPrenal.
Анализ клинически значимых нежелательных явлений, развившихся на протяжении первых 4 циклов химиотерапии, представлен в таблице 4. Гематологическая токсичность, включая нейтропению и тромбоцитопению 4 ст., имела место в 11,3 и 17,7 % случаев соответственно, без различий между группами. Частота инфекционных осложнений была выше в группе диализ-зависимых больных, включая случаи фебрильной нейтропении (4,3 % против 0 %), пневмонии (28,3 % против 6,3 %), сепсиса (13,0 % против 0 %) и клостридиального энтероколита (13,0 % против 0 %). Тромботические осложнения имели место исключительно у диализ-зависимых больных, включая тромбозы артериовенозной фистулы (7,1 % против 0 %) и подключичной вены (4,3 % против 0 %). Острые психические нарушения возникли у двух больных каждой группы, что не позволило в дальнейшем проводить исходно назначенную терапию. Вторая первичная злокачественная опухоль (аденокарцинома толстого кишечника) была диагностирована у одного больного группы II при сроке наблюдения 1,5 мес.
Таблица 4. Клинически значимая гематологическая и негематологическая токсичность индукционной терапии ММ (циклы 1-4)
Table 4. Clinical significantly hematological and non-hematological toxicities following induction therapy of multiple myeloma (cycles 1-4)
Параметры Parameters | Группа I Group I (n = 16) | Группа II Group II (n = 46) | Всего All patients (n = 62) |
|---|---|---|---|
Нейтропения (4 ст.), n (%) Neutropenia (Gr. 4), n (%) | 2 (12,5 %) | 5 (10,9 %) | 7 (11,3 %) |
Тромбоцитопения (4 ст.), n (%) Thrombocytopenia (Gr. 4), n (%) | 3 (18,8 %) | 8 (174 %) | 11 (17,7 %) |
Фебрильная нейтропения, n (%) Febrile neutropenia, n (%) | 0 (0 %) | 2 (4,3 %) | 2 (3,2 %) |
Пневмония, n (%) Pneumonia, n (%) | 1 (6,3 %) | 13 (28,3 %) | 14 (22,6 %) |
Сепсис, n (%) Sepsis, n (%) | 0 (0 %) | 6 (13,0 %) | 6 (9,7 %) |
Инфекция Clostridium difficile, n (%) Clostridium difficile infection, n (%) | 0 (0 %) | 6 (13,0 %) | 6 (9,7 %) |
Энтеропатия, ассоциированная с применением бортезомиба, n (%) | 3 (18,8 %) | 3 (6,5 %) | 6 (9,7 %) |
Herpes zoster, n (%) | 2 (12,5 %) | 3 (6,5 %) | 3 (4,8 %) |
Тромбоз артериовенозной фистулы, n (%) Thrombosis of arteriovenous fistulas, n (%) | - | 5 (71 %) | 5 (8,1 %) |
Тромбоз подключичной вены, n (%) Subclavian vein thrombosis, n (%) | 0 (0 %) | 2 (4,3 %) | 2 (3,2 %) |
Нарушения ритма, n (%) Arrhythmia, n (%) | 0 (0 %) | 2 (4,3 %) | 2 (3,2 %) |
Декомпенсация хронической сердечной недостаточности, n (%) Decompensated heart failure, n (%) | 2 (12,5 %) | 2 (4,3 %) | 4 (6,5 %) |
Периферическая нейропатия (2-3 ст.), n (%) Peripheral neuropathy (Gr. 2-3), n (%) | 4 (25,0 %) | 4 (8,7 %) | 8 (12,9 %) |
Острые психические нарушения, n (%) Acute mental disorders, n (%) | 2 (12,5 %) | 2 (6,5 %) | 4 (6,5 %) |
При медиане наблюдения за выжившими больными 32,1 мес. по всей группе медиана ВБП составила 14,5 мес., 3-летняя ВБП — 27,4 ± 6,6 %. Статистически значимых различий по показателям ВБП между группами сравнения не получено (рис. 2). Медиана ВБП составила 11,9 и 15,0 мес. для I и II группы соответственно, а 3-летняя ВБП — 26,7 ± 11,4 и 30,5 ± 7,5% (р = 0,568). Наилучшие показатели 3-летней ВБП получены для больных, достигших ПР или лучшего ответа, — 57,1 ± 15,7 % и ОХЧР — 52,6 ± 11,5 %.
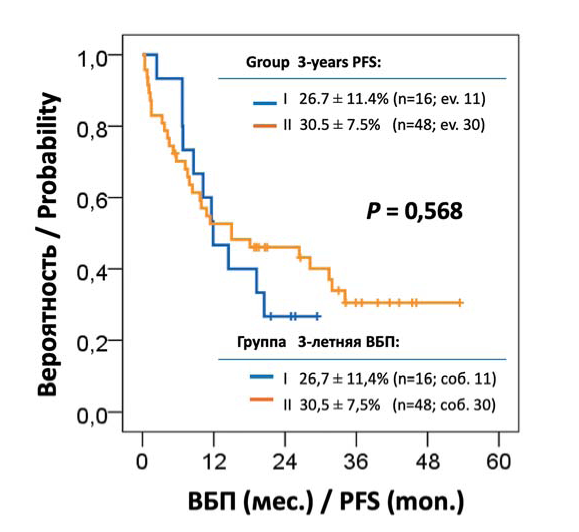
Рисунок 2. Выживаемость без прогрессирования (ВБП) больных с впервые диагностированной ММ, осложненной тяжелой ПН
Figure 2. Progression free survival (PFS) for patients with newly diagnosed multiple myeloma complicated by severe kidney failure
Медиана ОВ по всем больным составила 33,6 мес., 3-летняя ОВ — 41,5 ± 7,7 %. Различий между группами сравнения также не выявлено (рис. 3). Медиана ОВ в обеих группах составила 33,6 мес., показатели 30 мес. ОВ — 52,5 ± 13,5 и 42,3 ± 8,3 % соответственно. По состоянию на момент проведения настоящего анализа умерло в общей сложности 7 (43,8 %) и 22 (47,8 %) больных из двух групп. Причинами смерти в группе I была непосредственно прогрессия ММ — 5 (31,3 %) и инфекционные осложнения, связанные с противоопухолевой терапией — 2 (12,5 %). В группе II вследствие прогрессии ММ умерло 11 (23,9 %), инфекций — 8 (17,4 %), сердечно-сосудистых и тромботических осложнений — соответственно 1 (2,2 %) и 2 (4,3 %) больных.
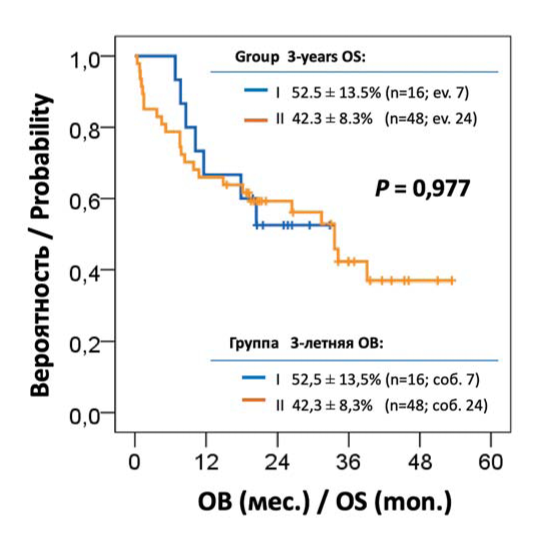
Рисунок 3. Общая выживаемость (ОВ) с впервые диагностированной ММ, осложненной тяжелой ПП
Figure 3. Overall survival (OS) for patients with newly diagnosed multiple myeloma complicated by severe kidney failure
По всей выборке оцененных больных (п = 48) достижение любого почечного ответа ассоциировалось с существенным улучшением показателей 3-летней ВБП 61,1 ± 11,5 % против 17,7 ± 7,7 % (р= 0,045), медиана ВБП при текущем сроке наблюдения в когорте больных с почечным ответом не была достигнута против 11,4 мес. для больных без такового (рис. 4). Для диализ-зависи- мых больных (п = 34) достижение независимости от гемодиализа также улучшало показатели выживаемости: 3-летняя ВБП 57,2 ± 10,1 % против 14,3 ± 13,2 % (р = 0,028) и медиана ВБП 31,6 против 6,2 мес. В отношении ОВ достоверных различий не выявлено, но прослеживалась сходно направленная тенденция: 3-летняя ОВ 72,2 ± 10,6 % против 38,1 ± 10,4 % (р = 0,069).
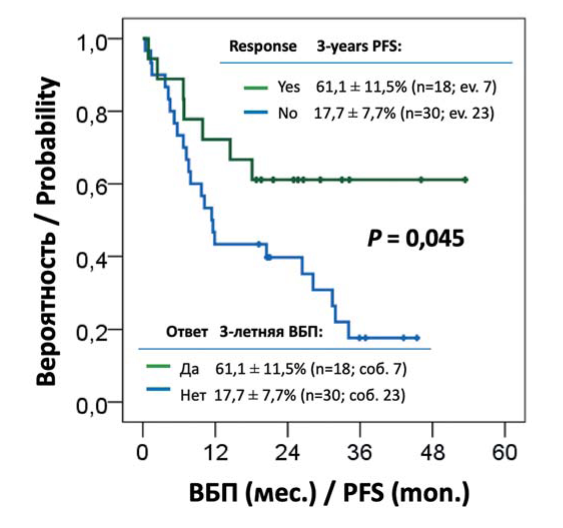
Рисунок 4. Выживаемость без прогрессирования (ВБП) в соответствии с почечным ответом
Figure 4. Progression free survival (PFS) according to renal response
Единственным предиктором почечного ответа, идентифицированным в настоящем исследовании, оказалось время, прошедшее между первой процедурой гемодиализа и стартом противомиеломной химиотерапии. В группе больных, достигших почечного ответа, в условиях однофакторного дисперсионного анализа среднее время составило 8,6 (95 % ДИ 3,5—13,7) дня против 42,5 (95 % ДИ 12,6—72,5) дня (р = 0,038 для К-критерия Ливеня; р = 0,045 для критерия Колмогорова — Смирнова). Ни один из других исследованных параметров, включая время от появления первых признаков ПН до начала химиотерапии, демографические показатели, СКФ, концентрацию СЛЦ и β -микроглобулина в сыворотке крови, вариант конкретной бортезомиб-содержащей схемы, отдельные симптомы ММ (анемия, остеодеструкция), стадию по ISS и глубину противомиеломного ответа (ЧР или >ОХЧР), не влияли на вероятность восстановления функции почек.
Обсуждение
Миеломная нефропатия потенциально обратима, что определяет важность ранней диагностики и незамедлительного начала системной противоопухолевой терапии [1]. На протяжении индукционной химиотерапии важны все компоненты сопроводительной терапии, включая коррекцию гиперкальциемии, адекватную гидратацию, заместительную терапию препаратами крови и фармакологический контроль системы гемостаза [12].
Цель противоопухолевой терапии в случае миеломной “cast" нефропатии заключается в том, чтобы максимально быстро прервать секрецию СЛЦ [1, 12]. Отсрочки в инициации терапии резко снижают вероятность восстановления функции почек. Высокие дозы дексаметазона очень быстро подавляют секрецию СЛЦ, что особенно важно в неотложных ситуациях [13]. Наиболее изученным у больных ММ, осложненной тяжелой ПН, является ингибитор протеасомы первого поколения бортезомиб [14]. В одном из ранних исследований [15] было показано, что схема PAD (бортезомиб, доксорубицин, дексаметазон) позволяет получить у больных (п = 68) впервые диагностированной ММ, осложненной ОПП, противомиеломный ответ в 72 % и почечный ответ в 62 % случаев. Сравнение индукционных режимов PAD и VAD (винкристин, доксорубицин, дексаметазон) с последующей высокодозной терапией и ауто-ТГСК было целью рандомизированного исследования III фазы HOVON-65/GMMG-HD4 (п = 746). Подгрупповой анализ показал очевидное преимущество схемы PAD по сравнению с VAD как в отношении 3-летней ВБП (48 % против 16 %; р = 0,004), так и ОВ (74 % против 34 %; р < 0,001) у больных с почечной недостаточностью (креатинин > 2 мг/дл) [16]. Процитированные работы подтверждают, что миеломную “cast" нефропатию оптимально лечить «триплетами», содержащими бортезомиб и дексаметазон, а в качестве третьего агента в указанных исследованиях использовать доксорубицин, преимущество которого заключается в отсутствии необходимости коррекции доз при любой степени тяжести ПН [15, 16].
Менее токсичной альтернативой доксорубицину является циклофосфамид (схема VCD). В немецком рандомизированном исследовании ММ5 (п = 504) было показано, что VCD эффективнее PAD как в отношении большей частоты >ОХЧР (37,0 % против 34,3 %; р = 0,001), так и меньшего риска прогрессии ММ (0,4 % против 4,8 %; р = 0,003) и более благоприятного профиля нежелательных явлений [17]. В исследовании Греческой миеломной группы [18] 83 больных с впервые диагностированной ММ, осложненной тяжелой ПН (СКФ < 30 мл/мин/1,73 м2), включая 31 (37 %) с диализ-зависимой формой заболевания, получали различные бортезомиб-содержащие комбинации, в том числе VCD в 45 % случаев. В соответствии с критериями IMWG почечного ответа в целом достигли 65 % больных, включая 48 % в диализ-зависимой группе [18]. В нашем исследовании в сходной по характеристикам когорте больных на бортезомиб- содержащей терапии (VCD — 66 %) почечного ответа достигли 33,3 % больных по всей группе и 23,5 % среди диализ-зависимых больных. По данным НМИЦ гематологии Минздрава России, из 40 больных впервые диагностированной ММ, осложненной диализ- зависимой ПН, на бортезомиб-основанной индукции (VCD — 38 %) достигли почечного ответа 26 % больных [19]. В работе исследователей из МОНИКИ им. М.Ф. Владимирского на терапии RVP (леналидомид, бортезомиб, преднизолон) независимости от гемодиализа достигли 2 (22 %) из 9 больных de novo ММ [20]. Назначение леналидомида требует редукции дозы препарата в соответствии с текущей СКФ [21]. Помалидомид представляет собой противоопухолевый иммуномодулятор третьего поколения в несколько раз превышающий по биологической активности леналидомид [22]. В исследовании ММ-013 у больных с рецидивирующей и рефрактерной ММ было показано, что фармакокинетика помалидомида в дозе 4 мг/день в комбинации с дексаметазоном не различалась у больных при любой степени тяжести ПН, включая ситуацию с заместительной почечной терапией [23]. Комбинация PVd (помалидомид, бор- тезомиб, дексаметазон) может быть прекрасной альтернативой у больных ПН [24]. Тяжелая ПН не является препятствием для выполнения ауто-ТГСК, а её выполнение несет очевидную пользу в отношении показателей выживаемости [25].
По данным Греческой группы [18], предиктором неудачи достижения почечного ответа была инициальная концентрация СЛЦ в сыворотке крови >11550 мг/л, а достижение противомиеломного ответа (>ЧР) в пределах первого месяца терапии, наоборот, было благоприятным прогностическим фактором В работе авторов из НМИЦ гематологии [19] благоприятными предикторами почечного ответа были минимальная выраженность тубулоинтерстициального фиброза в нефробиоптате и противоопухолевый ответ в пределах первых 2 мес. терапии. Вероятность почечного ответа в настоящем исследовании была существенно выше в случае быстрого начала противоопухолевой терапии (8,6 против 42,5 дня; р = 0,045). Большинство больных в силу исходной симптоматики на первичном этапе обращаются к терапевтам или нефрологам, и закономерным образом диагностика и лечение ММ начинались с определенной задержкой, что снижало конечную эффективность лечения.
Достижение почечного ответа, по всей видимости, коррелирует с лучшей выживаемостью. В настоящем исследовании для диализ-зависимых больных с почечным ответом медиана ВБП составила 31,6 против 6,2 мес. (р = 0,028) для сохранивших зависимость от гемодиализа. По нашим ранее опубликованным данным [26], факторами неблагоприятного прогноза у больных ММ, осложненной диализ-зависимой ПН, были уровень NT-proBNP в сыворотке крови >7000 пг/мл (2-летняя ВБП 0 ± 0 % против 60,0 ± 18,2 %; р = 0,001) и суточный диурез на момент начала химиотерапии <925 мл/сут. (11,4 ± 10,7 % против 37,5 ± 16,1 %). В одном из сообщений Греческой миеломной группы [27] достижение почечного ответа у больных с диализ-зависимой ПН ассоциировалось с лучшей медианой ОВ (63 против 22 мес.; р = 0,002). Для больных с противоопухолевым ответом, но без почечного ответа, медиана ОВ составила 47 мес. против 62 мес. (р = 0,047) для больных с одновременным противоопухолевым и почечным ответами. Влияние почечного ответа на ОВ в нашем исследовании не выявлено, возможно, в связи с ограниченностью и гетерогенностью представленной выборки.
Таким образом, применение «триплетов» на основе бортезомиба позволяет получить высокую частоту противоопухолевых ответов (79,2 %) с вероятностью прекратить диализ приблизительно у четверти зависимых от данной процедуры больных ММ. К возможным причинам низкой частоты почечного ответа (23,5 %) у диализ-зависимых больных можно отнести позднюю диагностику ММ (медиана 39 дней от дебюта ОПП), обусловленную ограниченными возможностями определения СЛЦ на уровне амбулаторных нефрологов и гематологов городской сети и отсутствие адекватного доступа к противоопухолевым иммуномодуляторам (леналидомид, помалидомид), что требуется для ранней модификации терапии в случае неудовлетворительного ответа уже после первых 1—2 циклов индукционного лечения.
Список литературы
1. Dimopoulos M.A., Terpos E., Chanan-Khan A. et al. Renal impairment in patients with multiple myeloma: A consensus statement on behalf of the International Myeloma Working Group. J Clin Oncol. 2010; 28(33): 4976–84. DOI: 10.1200/JCO.2010.30.8791.
2. Gavriatopoulou M., Terpos E., Kastritis E., Dimopoulos M.A. Current treatments for renal failure due to multiple myeloma. Expert Opin Pharmacother. 2016; 17(16): 2165–77. DOI: 10.1080/14656566.2016.1236915.
3. Haynes R.J., Read S., Collins, G.P. et al. Presentation and survival of patients with severe acute kidney injury and multiple myeloma: a 20-year experience from a single centre. Nephrol Dial Transplant. 2010; 25(2): 419–26. DOI: 10.1093/ndt/gfp488.
4. Горошинская И.А., Франциянц Е.М., Зудерман Н.Е. и др. Показатели повреждения почек у больных множественной миеломой в процессе химиотерапевтического лечения. Клиническая лабораторная диагностика. 2018; 63(12): 741–9. DOI: 10.18821/0869-2084-2018-63-12-741-749.
5. Walk J.C., Ayati B.P., Holstein S.A. Modeling the Effects of Multiple Myeloma on Kidney Function. Sci Rep. 2019; 9(1): 1726. DOI: 10.1038/s41598-018-38129-7
6. Рехтина И.Г., Менделеева Л.П., Бидерман Б.В. и др. Полиморфизмы гена уромодулина у больных каст-нефропатией при множественной миеломе. Терапевтический архив. 2017; 89(8): 68–71. DOI: 10.17116/terarkh201789868-71.
7. Krieter D.H., Devine E., Wanner C. et al. Clearance of drugs for multiple myeloma therapy during in vitro high-cutoff hemodialysis. Artif Organs. 2014; 38(10): 888–93. DOI: 10.1111/aor.12248.
8. Hutchison C.A., Cockwell P., Moroz V. et al. High cutoff versus high-fl ux haemodialysis for myeloma cast nephropathy in patients receiving bortezomibbased chemotherapy (EuLITE): a phase 2 randomised controlled trial. Lancet Haematol. 2019; 6(4): 217–28. DOI: 10.1016/S2352-3026(19)30014-6.
9. Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular fi ltration rate. Ann Intern Med. 2009; 150(9): 604–12. DOI: 10.7326/0003-4819-150-9-200905050-00006.
10. . https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
11. Durie B.G., Harousseau J.L., Miguel J.S. et al. International uniform response criteria for multiple myeloma. Leukemia. 2006; 20(9): 1467–73. DOI: 10.1038/sj.leu.2404284.
12. Салогуб Г.Н., Степанова Н.В., Подгаецкая О.Ю. Поражение почек при множественной миеломе. Гематология и трансфузиология. 2010; 55(3): 25–33.
13. Sanders P.W., Booker B.B. Pathobiology of cast nephropathy from human Bence Jones proteins. J Clin Invest. 1992; 89(2): 630–9. DOI: 10.1172/JCI115629.
14. Chanan-Khan A.A., Kaufman J.L., Mehta J. et al. Activity and safety of bortezomib in multiple myeloma patients with advanced renal failure: A multicenter retrospective study. Blood. 2007; 109(6): 2604–6. DOI: 10.1182/ blood-2006-09-046409.
15. Ludwig H., Adam Z., Hajek R. et al. Light chain-induced acute renal failure can be reversed by bortezomib-doxorubicin-dexamethasone in multiple myeloma: Results of a phase II study. J Clin Oncol. 2010; 28(3): 4635–41. DOI: 10.1200/JCO.2010.28.1238.
16. Scheid C., Sonneveld P., Schmidt-Wolf I.G. et al. Bortezomib before and after autologous stem cell transplantation overcomes the negative prognostic impact of renal impairment in newly diagnosed multiple myeloma: a subgroup analysis from the HOVON-65/GMMG-HD4 trial. Haematologica. 2014; 99(1): 148–54. DOI: 10.3324/haematol.2013.087585.
17. Mai E.K., Bertsch U., Durig J. et al. Phase III trial of bortezomib, cyclophosphamide and dexamethasone (VCD) versus bortezomib, doxorubicin and dexamethasone (PAd) in newly diagnosed myeloma. Leukemia. 2015;29(8):1721–9. DOI: 10.1038/leu.2015.80.
18. Dimopoulos M.A., Roussou M., Gavriatopoulou M. et al. Bortezomib-based triplets are associated with a high probability of dialysis independence and rapid renal recovery in newly diagnosed myeloma patients with severe renal failure or those requiring dialysis. Am J Hematol. 2016; 91(5): 499–502. DOI: 10.1002/ajh.24335.
19. Рехтина И.Г., Менделеева Л.П., Бирюкова Л.С. Диализзависимая почечная недостаточность у больных множественной миеломой: факторы обратимости. Терапевтический архив. 2015; 87(7): 72–6. DOI: 10.17116/terarkh201587772-76.
20. Белоусов К.A., Митина Т.A., Чуксина Ю.Ю. и др. Эффективность леналидомида, бортезомиба и преднизолона (RVP) при лечении пациентов с впервые выявленной множественной миеломой. Онкогематология. 2019; 14(1): 14–9. DOI: 10.17650/1818-8346-2019-14-1-14-19.
21. Mikhael J., Manola J., Dueck A.C. et al. Lenalidomide and dexamethasone in patients with relapsed multiple myeloma and impaired renal function: PrE1003, a PrECOG study. Blood Cancer J. 2018; 8(9): 86. DOI: 10.1038/s41408-018-0110-7
22. Семочкин С.В. Биологические основы применения иммуномодулирующих препаратов в лечении множественной миеломы. Онкогематология. 2010; 5(1): 21–31.
23. Dimopoulos M., Weisel K., van de Donk N.W.C.J. et al. Pomalidomide Plus Low-Dose Dexamethasone in Patients With Relapsed/Refractory Multiple Myeloma and Renal Impairment: Results From a Phase II Trial. J Clin Oncol. 2018; 36(20): 2035–43. DOI: 10.1200/JCO.2017.76.174.
24. Richardson P.G., Oriol A., Beksac M. et al. Pomalidomide, bortezomib, and dexamethasone for patients with relapsed or refractory multiple myeloma previously treated with lenalidomide (OPTIMISMM): a randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20(6): 781–94. DOI: 10.1016/S1470-2045(19)30152-4.
25. Antlanger M., Dust T., Reiter T. et al. Impact of renal impairment on outcomes after autologous stem cell transplantation in multiple myeloma: a multi-center, retrospective cohort study. BMC Cancer. 2018; 18(1): 1008. DOI: 10.1186/s12885-018-4926-0.
26. Semochkin S.V., Misyurina E.N., Zhelnova E.I. et al. N-Terminal Fragment of Brain-Type Natriuretic Peptide (NT-proBNP) as a Prognostic Marker in Patients with Newly Diagnosed Multiple Myeloma Complicated by Dialysis-Dependent Renal Failure. Bull Exp Biol Med. 2019; 167(2): 267–71. DOI: 10.1007/s10517- 019-04506-z.
27. Dimopoulos M.A., Roussou M., Gavriatopoulou M. et al. Outcomes of newly diagnosed myeloma patients requiring dialysis: renal recovery, importance of rapid response and survival benefi t. Blood Cancer J. 2017; 7(6): 571. DOI: 10.1038/bcj.2017.49.
Об авторах
С. В. СемочкинРоссия
доктор медицинских наук, профессор кафедры онкологии, гематологии и лучевой терапии,
123182, г. Москва, Пехотная ул., д. 3, корп. 16, комната 648,
117997, Москва
Е. И. Желнова
Россия
кандидат медицинских наук, заведующий отделением гематологии и высокодозной химиотерапии,
123182, Москва
Е. Н. Мисюрина
Россия
кандидат медицинских наук, руководитель гематологической службы,
123182, Москва
Д. С. Марьин
Россия
заведующий дневным стационаром по гематологии,
123182, Москва
А. И. Ушакова
Россия
заведующая нефрологическим отделением,
123182, Москва
Е. А. Каримова
Россия
врач-гематолог,
123182, Москва
Е. А. Барях
Россия
кандидат медицинских наук, доцент, заведующая отделением гематологии и химиотерапии,
123182, Москва
Т. Н. Толстых
Россия
кандидат медицинских наук, врач-гематолог,
123182, Москва
Е. С. Маврина
Россия
врач-гематолог,
123182, Москва
Е. В. Юрова
Россия
аспирант,
117997, Москва
А. В. Черкасова
Россия
врач-гематолог,
123182, Москва
Е. Ю. Гришина
Россия
врач-гематолог,
123182, Москва
Д. Э. Гаглоева
Россия
врач-гематолог,
123182, Москва
К. В. Яцков
Россия
заведующий отделением реанимации и интенсивной терапии,
123182, Москва
О. Н. Котенко
Россия
кандидат медицинских наук, доцент, главный внештатный специалист, нефролог Департамента здравоохранения города Москвы,
123182, Москва
М. А. Лысенко
Россия
доктор медицинских наук, главный врач,
123182, Москва
Рецензия
Для цитирования:
Семочкин С.В., Желнова Е.И., Мисюрина Е.Н., Марьин Д.С., Ушакова А.И., Каримова Е.А., Барях Е.А., Толстых Т.Н., Маврина Е.С., Юрова Е.В., Черкасова А.В., Гришина Е.Ю., Гаглоева Д.Э., Яцков К.В., Котенко О.Н., Лысенко М.А. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ВОССТАНОВЛЕНИЯ ФУНКЦИИ ПОЧЕК У БОЛЬНЫХ ВПЕРВЫЕ ДИАГНОСТИРОВАННОЙ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ, ОСЛОЖНЕННОЙ ТЯЖЕЛОЙ И ДИАЛИЗ-ЗАВИСИМОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Гематология и трансфузиология. 2019;64(3):283-296. https://doi.org/10.35754/0234-5730-2019-64-3-283-296
For citation:
Semochkin S.V., Zhelnova E.I., Misyurina E.N., Maryin D.S., Ushakova A.I., Karimova E.A., Baryakh E.A., Tolstykh T.N., Mavrina E.S., Yurova E.V., Cherkasova A.V., Grishina E.Yu., Gagloeva D.E., Yatskov K.V., Kotenko O.N., Lysenko M.A. CLINICAL IMPORTANCE OF RENAL RECOVER ON OUTCOMES OF NEWLY DIAGNOSED MULTIPLE MYELOMA PATIENTS WITH SEVERE AND DIALYSIS-DEPENDENT KIDNEY FAILURE. Russian journal of hematology and transfusiology. 2019;64(3):283-296. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-3-283-296











































