Перейти к:
ПРИМЕНЕНИЕ РОТАЦИОННОЙ ТРОМБОЭЛАСТОМЕТРИИ ДЛЯ ДИАГНОСТИКИ ДЕФИЦИТА ФАКТОРОВ СВЕРТЫВАНИЯ И КОНТРОЛЯ ГЕМОСТАТИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ НАСЛЕДСТВЕННЫМИ КОАГУЛОПАТИЯМИ
https://doi.org/10.35754/0234-5730-2019-64-3-297-316
Аннотация
Введение. Ротационная тромбоэластометрия (РОТЭМ) является методом исследования гемостаза, который выполняется по месту лечения и позволяет выявлять нарушения по внешнему и/или внутреннему пути свертывания крови.
Цель работы — изучить возможность использования РОТЭМ для диагностики дефицита отдельных факторов свертывания крови и мониторинга эффективности и безопасности гемостатической терапии, проводимой при этих коагулопатиях.
Материалы и методы. В исследование было включено 9 больных с врожденным дефицитом различных факторов свертывания крови. Проводили коагулогические тесты (определение активированного частичного тромбопластинового времени, протромбина по Квику, фибриногена, плазменной активности факторов свертывания FV, FVII, FVIII, FIX, FXI и FXII) и РОТЭМ. Для исключения влияния гепарина или гипофибриногенемии выполняли HEPTEM и/или FIBTEM. Для выявления дефицита отдельных факторов свертывания крови использовали образцы стандартной плазмы и плазмы, дефицитной по одному из факторов свертывания крови. Исследуемую цитратную кровь смешивали в соотношении 2:1 со стандартной плазмой и с дефицитной по одному из исследуемых факторов плазмой, повторно выполняли тесты EXTEM и/или INTEM. Дефицит фактора свертывания крови подтверждали по изменению параметра CT.
Результаты. Изолированное удлинение CT в тесте EXTEM выявлялось при дефиците FVII, удлинение CT только в INTEM возникало при дефиците FVIII, FIX, FXI, FXII, одновременное удлинение EXTEM и INTEM определялось при дефиците FV. При выполнении пробы со смесью цитратной крови и стандартной плазмы параметр CT укорачивался в тесте EXTEM при дефиците FVII, в тесте INTEM — при дефиците FVIII, FIX, FXI, FXII, в обоих тестах — при дефиците FV. В пробе со смесью цельной крови и дефицитной по исследуемому фактору плазмой интервал CT сохранялся удлиненным либо увеличивался. Приведены клинические примеры диагностики дефицита факторов свертывания с помощью РОТЭМ.
Заключение. Нормализация показателей РОТЭМ в пробе со стандартной плазмой и сохранение гипокоагуляции в пробе с дефицитной по фактору плазмой позволяет подтвердить дефицит фактора свертывания крови. С помощью РОТЭМ возможно проведение мониторинга эффективности гемостатической терапии при врожденных дефицитах отдельных факторов свертывания крови.
Ключевые слова
Для цитирования:
Галстян Г.М., Полеводова О.А., Яковлева Е.В., Щекина А.Е. ПРИМЕНЕНИЕ РОТАЦИОННОЙ ТРОМБОЭЛАСТОМЕТРИИ ДЛЯ ДИАГНОСТИКИ ДЕФИЦИТА ФАКТОРОВ СВЕРТЫВАНИЯ И КОНТРОЛЯ ГЕМОСТАТИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ НАСЛЕДСТВЕННЫМИ КОАГУЛОПАТИЯМИ. Гематология и трансфузиология. 2019;64(3):297-316. https://doi.org/10.35754/0234-5730-2019-64-3-297-316
For citation:
Galstyan G.M., Polevodova O.A., Yakovleva E.V., Shchekina A.E. ROTATION THROMBOELASTOMETRY FOR THE DIAGNOSIS OF FACTOR DEFICIENCY AND MANAGEMENT OF THE HEMOSTATIC THERAPY IN PATIENTS WITH INHERITED COAGULATION DISORDERS. Russian journal of hematology and transfusiology. 2019;64(3):297-316. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-3-297-316
Введение
Ротационная тромбоэластометрия (РОТЭМ) позволяет оценить нарушения гемостаза у больных в критических состояниях, выбрать тот или иной метод лечения, мониторировать его эффективность [1]. РОТЭМ является point-of-care тестированием, т.е. исследованием, которое проводится по месту лечения, медицинским персоналом, не имеющим лабораторного образования [2]. Для его выполнения не требуется центрифугировать кровь, а результаты могут быть получены в течение короткого промежутка времени. В отличие от традиционных коагулогических тестов, с помощью РОТЭМ оценивают не активность отдельных факторов свертывающей или противосвертывающей систем, а систему гемостаза в целом как результат взаимодействия этих факторов [3]. Метод позволяет графически представить процесс образования и лизиса сгустка и с помощью соответствующих активаторов дифференцированно оценивать внешний и внутренний пути свертывания крови. В тесте INTEM после предварительной рекальцификации с помощью реагента star-tem добавляется реактив in-TEM, содержащий фосфолипиды, выделенные из мозга кроликов, и эллаговую кислоту. То есть, по сути, это реагент активированного частичного тромбопластинового времени (АЧТВ), инициирующий внутренний путь свертывания. Таким образом, в тесте INTEM свертывание по внутреннему пути запускается эллаговой кислотой на фосфолипидах, введенных в образец крови. В тесте EXTEM после реагента startem добавляется реактив ex-TEM, содержащий фосфолипиды, тканевой фактор, запускающий свертывание по внешнему пути, и гепариназу, которая нивелирует возможное действие присутствующего гепарина. Таким образом, тесты EXTEM и INTEM можно использовать как скрининг для выявления нарушений свертывания крови по внешнему и/или внутреннему путям свертывания. При выявлении гипокоагуляции в тесте INTEM можно с помощью теста HEPTEM исключить или подтвердить действие гепарина. При наличии в крови гепарина гипокоагуляция будет устранена добавлением гепариназы, при дефиците факторов свертывания крови она сохранится. Дефицит фактора, который привел к гипокоагуляции, выясняется обычно с помощью коагулогических тестов, при которых количественно оценивается активность факторов в плазме крови. Однако далеко не во всех стационарах есть лаборатории, которые могут определять дефицит отдельных факторов свертывания, прежде всего при врожденных коагулопатиях. Подобные больные, поступая в стационар для планового или экстренного хирургического вмешательства или в связи с геморрагическим синдромом, часто либо не получают адекватной помощи и перенаправляются в другие специализированные стационары, либо их лечат трансфузиями плазмы, которые не всегда эффективны.
Простота, удобство и информативность вискоэластичных методов оценки гемостаза способствовали их широкому распространению в клинической практике. Они востребованы для выявления нарушений гемостаза и мониторинга проводимой гемостатической терапии в акушерстве и гинекологии [4—6], интенсивной терапии и анестезиологии [7—10], сердечно-сосудистой хирургии [11—14], травматологии [15—18], при трансплантации печени [1, 19, 20]. Учитывая их большое значение, приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 919 н регламентировано обязательное наличие тромбоэластографа или тромбоэластометра в отделениях анестезиологии-реаниматологии [21].
В этой связи представляется актуальным адаптировать метод РОТЭМ, доступный в большинстве стационаров, для определения дефицита отдельных факторов свертывания крови и мониторинга проводимой целенаправленной гемостатической терапии.
Цель настоящей работы — изучить возможность использования ротационной тромбоэластометрии для диагностики врожденного дефицита отдельных факторов свертывания крови и мониторинга эффективности и безопасности проводимой при этих коагулопатиях гемостатической терапии.
Материалы и методы
Работа состояла из двух этапов. Задачей первого этапа была разработка алгоритма определения дефицита отдельных факторов свертывания крови с помощью РОТЭМ. Задача второго этапа — показать на клинических примерах, как с помощью РОТЭМ можно диагностировать дефицит отдельных факторов свертывания крови и мониторировать эффективность и безопасность гемостатической терапии при этих коагулопатиях.
В исследование было включено 9 больных (4 мужчин и 5 женщин) в возрасте от 15 до 54 лет с врожденным дефицитом различных факторов свертывания крови (FV, FVII, FVIII, FIX, FXI и FXII). У 8 больных плазменная активность дефицитного фактора не превышала 1 %, у 1 больной плазменная активность FV составила 1,7 %.
Для исследований гемостаза кровь у больных получали путем венепункции одной из периферических вен и собирали в пробирки S-Monovette с 3,2 % раствором цитрата натрия в соотношении 1 часть раствора цитрата натрия, 9 частей крови. Для выполнения тестов на РОТЭМ использовали цельную цитратную кровь. Для выполнения коагуляционных тестов получали бедную тромбоцитами плазму. Бедную тромбоцитами плазму приготовляли путем центрифугирования цитратной крови со скоростью 1200 g (3000 об./мин) в течение 15 мин при температуре 15—25 °C. АЧТВ определяли в условиях стандартной активации каолином и фосфолипидами. Исследование выполняли на автоматическом коагулометре Sysmex CA-600 фирмы Sysmex Corporation (Япония) с использованием Pathromtin* SL фирмы Siemens Healthcare (Германия) [22].
Протромбиновое время (ПВ) определяли с тромбопластином, стандартизованным по международному индексу чувствительности (МИЧ 1,1) с расчетным показателем, выраженным в %, рассчитывали международное нормализованное отношение (МНО). Исследование выполняли на автоматическом коагулометре Sysmex CA-600 фирмы Sysmex Corporation (Япония) с использованием реагента ThromoborelR S фирмы Siemens Healthcare (Германия).
Концентрацию фибриногена в плазме определяли по Клауссу. Исследование выполняли на автоматическом коагулометре Sysmex CA-600 фирмы Sysmex Corporation (Япония) с использованием реагента DadeR Thrombin Reagent фирмы Siemens Healthcare (Германия).
Определение активности факторов свертывания крови выполняли на автоматическом коагулометре Sysmex CA-600 фирмы Sysmex Corporation (Япония) одностадийным клоттинговым методом с использованием субстратных (дефицитных) образцов плазмы, лишенных одного из факторов свертывания крови. Исследование выполняли c использованием реагентов Coagulation Factors Deficient Plasma фирмы Siemens Healthcare (Германия).
Тромбоэластометрию выполняли на 4-канальном анализаторе ROTEM delta фирмы Pentapharm GmbH (Германия). В исследовании были использованы пять основных тестов: EXTEM (внешний путь свертывания), INTEM (внутренний путь свертывания), FIBTEM (контроль полимеризации фибрина), HEPTEM (мониторинг гепарина). Тесты выполняли согласно рекомендациям производителя. При проведении анализа использовали автоматическое пипетирование цельной цитратной крови в комбинации с различными специфическими реагентами. При постановке тестов для исследования использовали образцы стандартной плазмы (Standard human plasma, FII 100 %, FV 90 %, FVII 90 %, FVIII 85-93 %, FIX 94 %, FX 101 %, FXI 90 %, FXII 97 %, FXIII 121 %, Siemens Healthcare Diagnostic Products GmbH, Германия) и дефицитной по одному из факторов свертывания плазмы (Coagulation Factor Deficient Plasma, Siemens Healthcare Diagnostic Products GmbH, Германия).
Результаты
Поскольку РОТЭМ позволяет выявить нарушения как внутреннего, так и внешнего пути свертывания с помощью соответствующих тестов INTEM и EXTEM, они были использованы как скрининговые тесты для выявления коагулопатии (рис. 1).

Рисунок 1. Алгоритм диагностики дефицитов факторов свертывания крови на основе РОТЭМ
Figure 1. Diagnostic algorithm of coagulation factor deficiencies based on ROTEM
В зависимости от выявленной гипокоагуляции в INTEM или EXTEM выполнялись тесты HEPTEM и/или FIBTEM для исключения таких причин гипокоагуляции, как гипофибриногенемия и/или наличие гепарина в образце крови. Значения теста FIBTEMMCF >9 мм и отсутствие укорочения HEPTEMct по сравнению INTEMct позволяли исключить гипофибриногенемию и действие гепарина как причины гипокоагуляции. Дальнейшие исследования были направлены на выявление дефицита отдельных факторов свертывания крови (рис. 1).
Принцип выявления дефицита отдельных факторов свертывания с помощью РОТЭМ был одинаков для каждого фактора. При выявлении удлинения в тестах внешнего пути (EXTEM) и/или внутреннего пути свертывания (INTEM), исследуемую цитратную кровь смешивали в соотношении 2:1 со стандартной плазмой, в которой активность всех факторов свертывания была в норме, и с дефицитной по одному из исследуемых факторов плазмой (рис. 2).
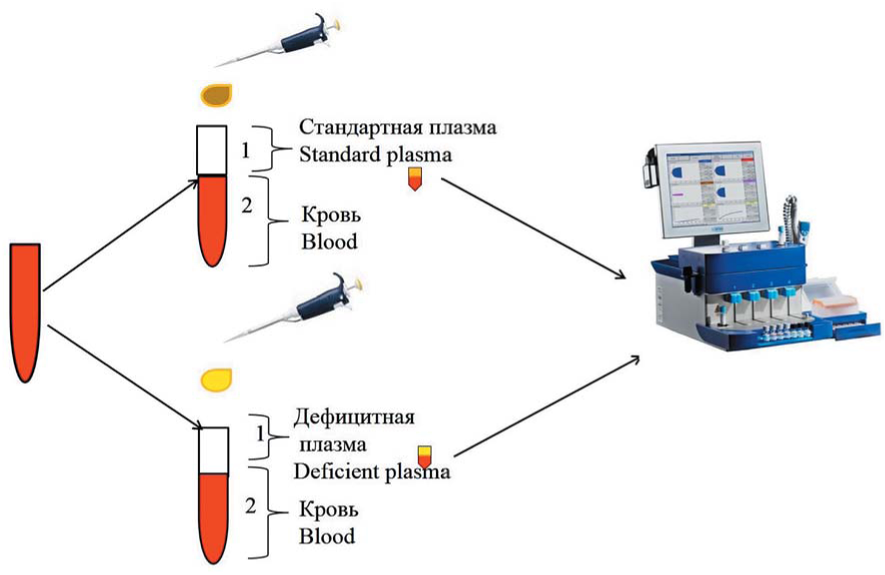
Рисунок 2. Схема выполнения исследования
Figure 2. Scheme of the blood dilution
После чего повторяли тесты EXTEM и/или INTEM в зависимости от участия исследуемого фактора в каскаде свертывания. При наличии дефицита одного из факторов свертывания в тесте, выполненном со смесью цельной крови и стандартной плазмой, параметр CT укорачивался в тесте EXTEM и/или INTEM, а в пробе со смесью цельной крови и плазмой, дефицитной по исследуемому фактору, интервал СТ сохранялся удлиненным либо даже увеличивался еще больше вследствие дилюции.
Удлинение только EXTEMct выявляется при дефиците FVII
Для подтверждения дефицита FVII на одном канале тромбоэластометра выполняли тест EXTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части стандартной плазмы, а на другом канале выполняли тест EXTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FVII. При дефиците FVII в тесте, выполненном со смесью крови с дефицитной плазмой, сохранялось удлинение EXTEM , а в тесте со смесью крови со стандартной плазмой происходила нормализация EXTEMct.
Одновременное удлинение EXTEMct и INTEMct выявляется при тяжелом дефиците FV
Для определения дефицита FV на двух каналах РОТЭМ выполняли тесты EXTEM и INTEM из пробирки, содержавшей смесь двух частей цельной ци- тратной исследуемой крови и одной части стандартной плазмы, а на других двух каналах — тесты EXTEM и INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FV. При дефиците FV в тестах EXTEM и INTEM, выполненных со смесью крови с дефицитной плазмой, сохранялось удлинение EXTEMct и INTEMct, а в тестах EXTEM и INTEM, выполненных со смесью исследуемой крови со стандартной плазмой, происходила нормализация EXTEMct и INTEMct
Удлинение только INTEMct возникает при дефиците FVIII, FIX, FXI и FXII
Для выявления дефицита FVIII на одном канале РОТЭМ выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части стандартной плазмы, а на другом канале выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FVIII. При дефиците FVIII в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранялось удлинение INTEMct, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, происходила нормализация INTEMct.
Для выявления дефицита FIX на одном канале РОТЭМ выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части стандартной плазмы, а на другом канале выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FIX. При дефиците FIX в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранялось удлинение INTEMct, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, происходила нормализация INTEMct
Для выявления дефицита FXI на одном канале РОТЭМ выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части стандартной плазмы, а на другом канале выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FXI. При дефиците FXI в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранялось удлинение INTEMct, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, происходила нормализация INTEMct
Для выявления дефицита FXII выполняли на одном канале РОТЭМ выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части стандартной плазмы, а на другом канале выполняли тест INTEM из пробирки, содержавшей смесь двух частей цельной цитратной исследуемой крови и одной части плазмы, дефицитной по FXII. В тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранялось удлинение INTEMct, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, происходила нормализация INTEMct
Ниже приведены примеры диагностики дефицита факторов у больных врожденными коагулопатиями.
Диагностика дефицита FVII
Больной О., 28 лет, страдает гипопроконвертинеми- ей. Заболевание протекает с геморрагическим синдромом в виде желудочно-кишечных и носовых кровотечений. Основные показатели системы гемостаза: АЧТВ 31 с, протромбин по Квику 14,5 %, МНО 4,6, фибриноген 2,3 г/л, плазменная активность FVII 1,7 %. В тесте INTEM не выявлено отклонений от нормы, в тесте EXTEM выявлено удлинение EXTEMct до 809 с (норма до 79 с), в тесте FIBTEM показатель MCF был в пределах нормы (12 мм), что исключило гипофибриногенемию как причину гипокоагуляции (рис. 3).

Рисунок 3. Показатели РОТЭМ больного гипопроконвертинемией: удлинение EXTEMct, нормальные INTEMct FIBTEMmcf
Figure 3. ROTEM patterns of patient with hypoproconverfinemia, prolonged EXTEMcr, normal INTEMcr and EIBTEMmcf
В тесте EXTEM, выполненном со смесью цельной цитратной крови со стандартной плазмой, EXTEMct сократился до 75 с, а в тесте EXTEM, выполненном со смесью цельной цитратной крови с плазмой, дефицитной по FVII, EXTEMct остался удлиненным до 490 с, что свидетельствует об изолированном дефиците FVII. На рисунке 4 представлен тест EXTEM при постановке со смесью цельной крови больного с дефицитом FVII со стандартной плазмой и смесью цельной крови больного с дефицитом FVII и плазмой, дефицитной по FVII. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой (рис. 4).
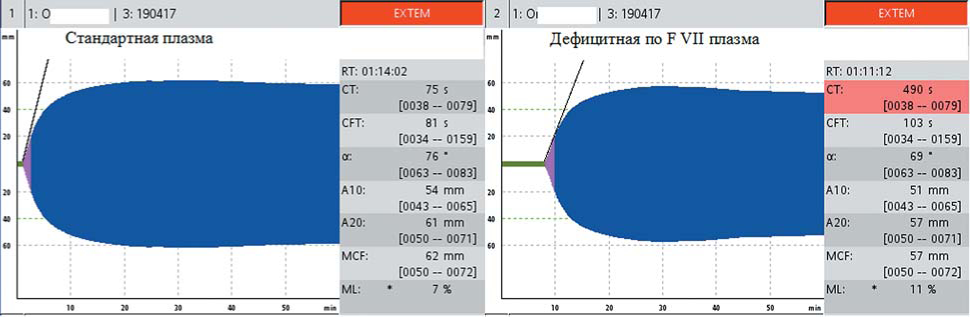
Рисунок 4. Изменения СТ в EXTEM в смеси крови больного гипопроконвертинемией со стандартной плазмой (нормализация СТ) и плазмой, дефицитной по FVI (сохраняется удлинение СТ)
Figure 4. Changes of EXTEMct in the mixture of patient's blood with standard plasma (CT normalization) and with coagulation factor deficient plasma in hypoproconvertinemia
Оценка эффективности гемостатической терапии у больной гипопроконвертинемией
Больной З., 27 лет, страдающей гипопроконвертинемией, выполнено лапароскопическое удаление кисты яичника. До и после оперативного вмешательства выполнялись коагулогические исследования, измерялась плазменная активность FVII, выполнялась тромбоэла- стометрия. Как видно из таблицы 1, до введения рекомбинантного активированного фактора свертывания VII (rFVIIa) отмечалось выраженное удлинение EXTEMct до 405 с. После введения rFVIIa у больной уменьшился EXTEMct с 405 до 71 с, т.е. до нормы, и лишь через 12 ч возникли показания к повторному введению rFVIIa (удлинение EXTEMct до 116 с), хотя активность FVII в плазме была при этом 39 %, а МНО 1,23.
Таблица 1. Мониторинг гемостатической терапии rFVIIa у больной с гипопроконвертинемией
Table 1. Monitoring of rFVIIa hemostatic treatment of patient with hypoproconvertinemia

Таким образом, использование РОТЭМ позволило контролировать гемостаз во время операции и в послеоперационном периоде и принять решение о повторном введении rFVIIa.
Диагностика дефицита FV
Больная Д., 18 лет, врожденный дефицит FV у нее был выявлен в возрасте 7 лет. Геморрагический синдром проявляется маточными кровотечениями, гематомами различной локализации (плазменная активность FV 0,5 %, АЧТВ 200 с, протромбин по Квику 10,7 %). В тесте ЕХТЕЖ выявлено удлинение СТ до 1953 с (норма до 79 с), в тесте INTEM — удлинение СТ до 1415 с (норма до 240 с). Показатель FIBTEMmcf 17 мм позволил исключить дефицит фибриногена. Сохраняющееся удлинение СТ до 1069 с в тесте НЕРТЕМ позволило исключить действие гепарина как причины гипокоагуляции (рис. 5).

Рисунок 5. РОТЭМ у больной с дефицитом FV: удлинение EXTEMcr и INTEMcr, нормальный FIBTEMmcf, отсутствует нормализация СТ в тесте HEPTEM
Figure 5. ROTEM patterns of patient with factor V deficiency: prolonged EXTEMcj and INTEMct, normal FIBTEMmcf, the lack of CT normalization in HEPTEM test
При выполнении тестов со смесью цельной цитрат - ной крови со стандартной плазмой интервал EXTEMct укоротился до 79 с, INTEMct — до 202 c, т.е. нормализовались. При выполнении тестов со смесью цельной цитратной крови с плазмой, дефицитной по FV, сохранилось патологическое удлинение EXTEMct до 475 с и INTEMct до 1060 с, что подтвердило дефицит FV (рис. 6).

Рисунок 6. EXTEm и INTEM при постановке тестов смеси цельной крови больной с врожденным дефицитом FV со стандартной плазмой и смеси цельной крови больной с врожденным дефицитом FV с плазмой, дефицитной по FV: нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой
Figure 6. EXTEM and INTEM data for a mixture of whole blood collected from a patient with congenital FV deficiency and standard plasma, as well as for a mixture of whole blood collected from a patient with congenital FVand plasma deficient in FV: CT normalization in the mixture with standard plasma and persisting hypocoagulation in the mixture with deficient plasma
Оценка эффективности гемостатической терапии у больной с дефицитом FV
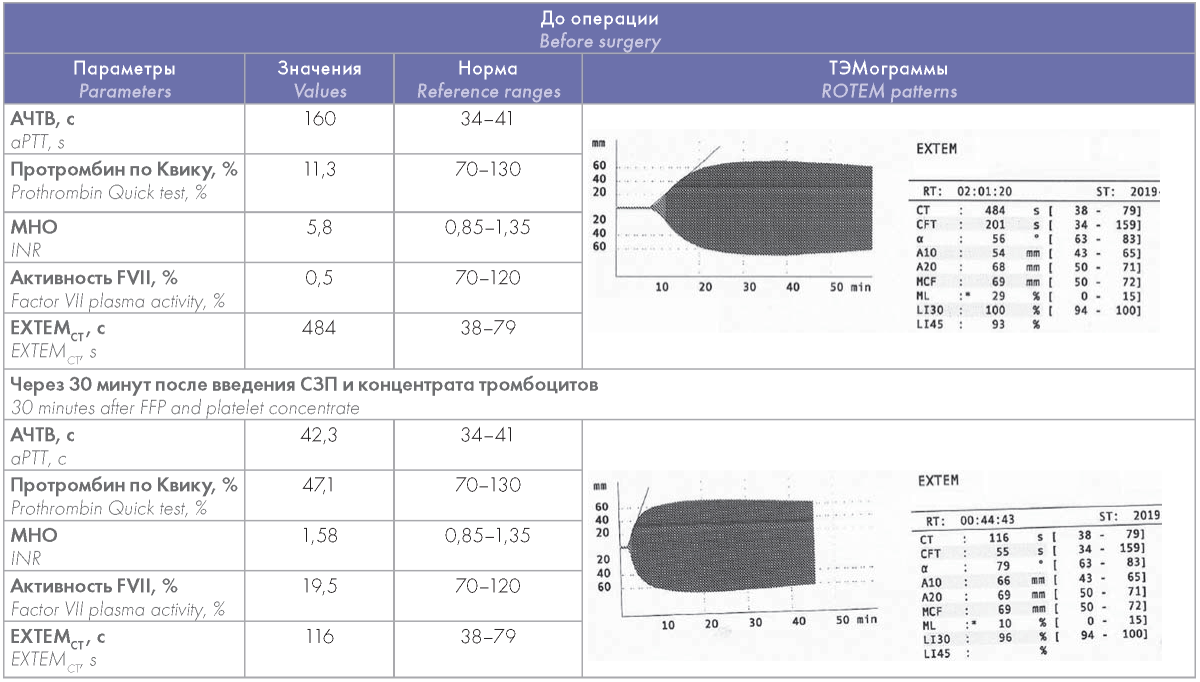
Больной И., 21 года, с врожденным дефицитом FV (плазменная активность FV 0,5 %) была выполнена имплантация венозной порт-системы. Коррекция гипокоагуляции проводилась трансфузией свежезамороженной плазмы (СЗП) и концентратом тромбоцитов. В таблице 2 представлены основные коагулогические показатели и результаты тромбоэластометрии до и после заместительных трансфузий. Особенностью данного клинического примера являлось то, что у больной в анамнезе были эпизоды венозных тромбозов после лечения СЗП. Поэтому основной задачей лечения было компенсировать гипокоагуляцию таким образом, чтобы избежать гиперкоагуляции. До операции отмечалось выраженное удлинение EXTEMct до 484 с (норма до 79 с). После трансфузии СЗП и концентрата тромбоцитов у больной уменьшился EXTEMct до 116 с, активность FV в плазме стала 19,5 %, МНО — 1,58 (табл. 2). Установлена порт-система без осложнений.
Таблица 2. Изменения показателей после гемостатической терапии СЗП и концентратом тромбоцитов у больной с дефицитом FV
Table 2. Chang es of coagulation parameters of patient with factor V deficiency after hemostatic treatment with fresh frozen plasma and platelet concentrate
Пример 5. Диагностика дефицита FVIII
Больному А., 32 лет, диагноз гемофилия А был установлен в детском возрасте. В анамнезе отмечались рецидивирующие гемартрозы, кровотечения после экстракции зубов. Плазменная активность FVIII составляла 0,7-1,5 %. При настоящем обследовании в результате профилактической гемостатической терапии концентратом FVIII: АЧТВ 57 с, протромбин по Квику 110 %, фибриноген 2,4 г/л, активность FVIII 11 %. При обследовании в соответствии с алгоритмом диагностики дефицита факторов свертывания с помощью РОТЭМ (рис. 1) в тесте EXTEM не выявлено отклонений от нормы, в тесте INTEM выявлено удлинение СТ до 872 с (норма до 240 с) (рис. 7).
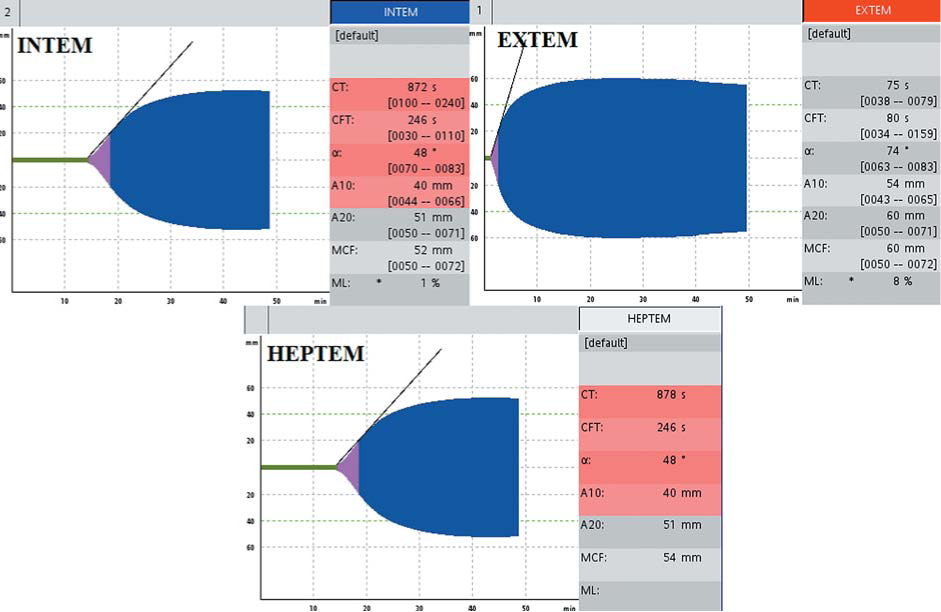
Рисунок 7. Показатели РОТЭМ больного гемофилией А: удлинение INTEMct, нормальный EXTEMct отсутствует нормализация СТ в тесте HEPTEM
Figure 7. ROTEM in patient with hemophilia A: prolonged INTEMcj, normal EXJEMcj, the lack of CT normalization in HEPTEM test
Сохранение гипокоагуляции в тесте НЕРТЕМ исключило влияние гепарина (рис. 7). При выполнении теста INTEM со стандартной плазмой и плазмой, дефицитной по FVIII, выявлено укорочение INTEMct до 232 с в пробе со стандартной плазмой и сохранение удлинения INTEMct до 1929 с в пробе с плазмой, дефицитной по FVIII (рис. 8), что подтвердило дефицит FVIII. Дальнейшее увеличение INTEMct в пробе с дефицитной плазмой можно объяснить дилюцией и уменьшением концентрации FVIII.
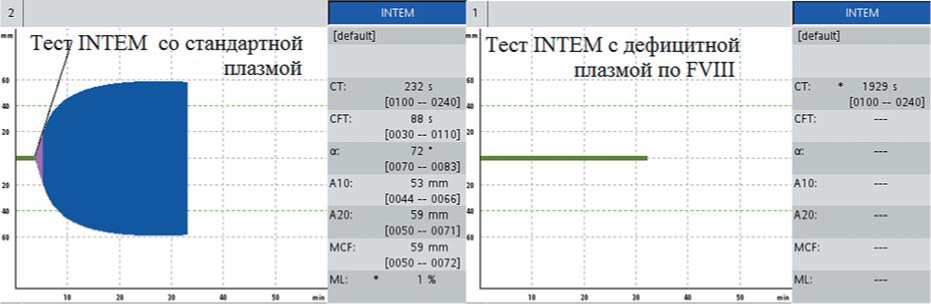
Рисунок 8. Тесты INTEM при постановке со смесью цельной крови больного гемофилией А со стандартной плазмой и смесью цельной крови больного гемофилией А и плазмой, дефицитной по FVIII: нормализация СТ в смеси со стандартной плазмой и гипокоагуляция в смеси с дефицитной плазмой
Figure 8. INTEM of patient with hemophilia A in the mixture of patient's blood with standard plasma and in the mixture of patient's blood with coagulation factor VIII deficient plasma: CT normalization in the mixture with standard plasma and hypocoagulation in the mixture with coagulation factor deficient plasma
Диагностика дефицита FIX
Больной И., 15 лет, с рождения возникали спонтанные внутримышечные гематомы, носовые кровотечения, гемартрозы обоих коленных суставов. Диагностирована гемофилия В, тяжелая форма (FIX <1 %). При настоящем обследовании АЧТВ 151 с, протромбин по Квику 71 %, фибриноген 2,9 г/л, плазменная активность FIX 0,5 %. При обследовании в соответствии с алгоритмом диагностики дефицита факторов свертывания (рис. 1) в тесте EXTEM не выявлено отклонений от нормы, выявлено удлинение INTEMCT до 505 с (норма до 240 с) (рис. 9).
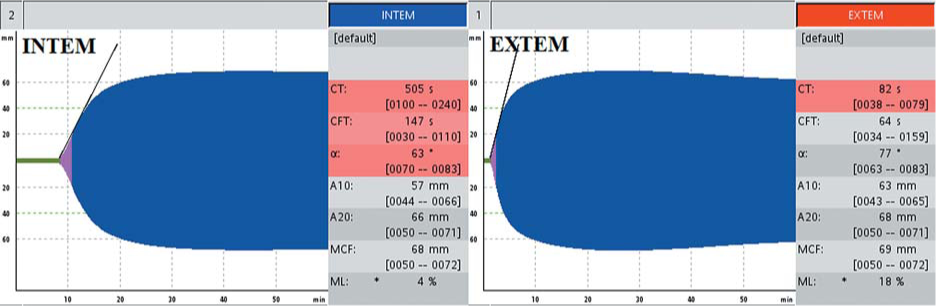
Рисунок 9. Показатели РОТЭМ у больного гемофилией В: удлинение INTEMct, нормальный EXTEMct
Figure 9. ROTEM in patient with hemophilia B: prolonged INTEMa., normal EXTEMa
С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови со стандартной плазмой INTEM — 185 с, в тесте с дефицитной плазмой INTEMct — 485 с (рис. 10), что подтвердило диагноз гемофилии В.
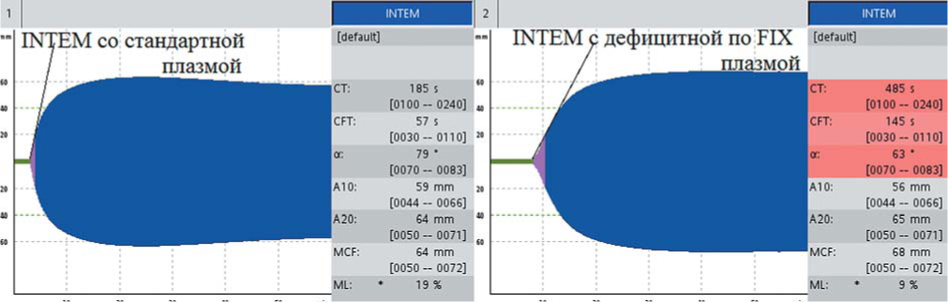
Рисунок 10. Тесты INTEM при постановке со смесью цельной крови больного гемофилией В со стандартной плазмой и смесью цельной крови больного и плазмой, дефицитной по FIX: нормализация СТ в смеси со стандартной плазмой и гипокоагуляция в смеси с дефицитной плазмой
Figure 10. INTEM of patient with hemophilia B in the mixture of patient's blood with standard plasma and in the mixture of patient's blood with coagulation FIX deficient plasma: CT normalization in the mixture with standard plasma and hypocoagulation in the mixture with coagulation factor deficient plasma
Диагностика дефицита фактора свертывания XI
Больная К., 44 лет, страдает гемофилией С (дефицит XI). Жалоб на спонтанную кровоточивость не предъявляла, считала себя здоровой. Диагноз был установлен при обследовании перед хирургическим вмешательством: АЧТВ удлинено до 90 с, протромбин по Квику 92 %, фибриноген 3,3 г/л, активность FXI составила 0,7 %. При обследовании в соответствии с алгоритмом диагностики дефицита факторов свертывания (рис. 1) в тесте EXTEM не выявлено отклонений от нормы, выявлено удлинение INTEMCT до 472 с (норма до 240 с).
С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови больной со стандартной плазмой INTEMCT составил 203 с, в то время как в тесте с дефицитной плазмой INTEMct — 637 с (рис. 12), что подтвердило наличие дефицита FXI как причины гипокоагуляции.
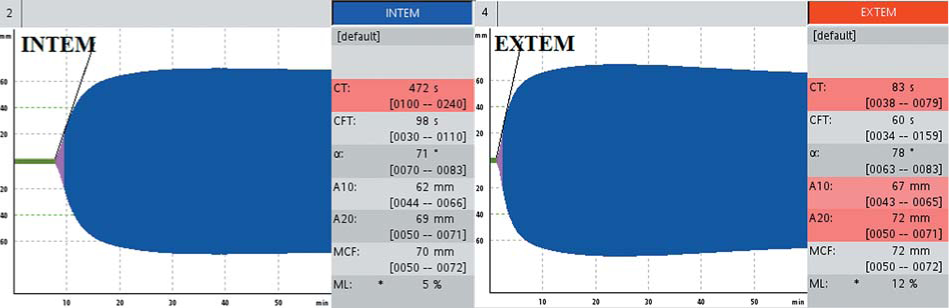
Рисунок 11. Показатели РОТЭМ у больной гемофилией С: удлинение INTEMct, нормальный EXTEMc
Figure 11. ROTEM in patient with hemophilia C: prolonged lNTEMa, normal EXJEMa
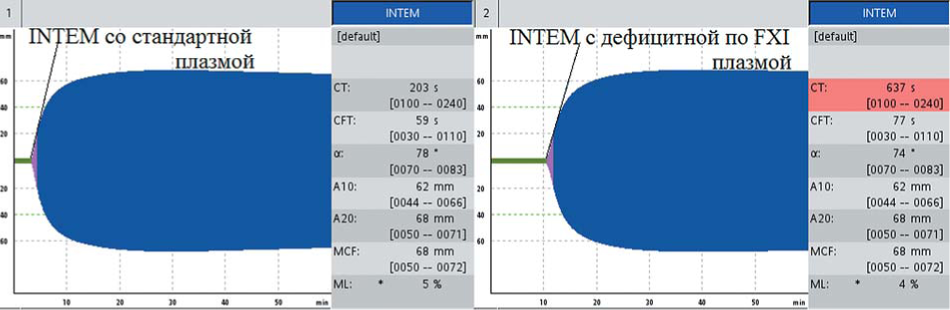
Рисунок 12. INTEM при постановке тестов со смесью цельной крови больной гемофилией С со стандартной плазмой и смеси цельной крови больной гемофилией C и плазмой, дефицитной по FXI: нормализация СТ в смеси со стандартной плазмой и гипокоагуляция в смеси с дефицитной плазмой
Figure 12. INTEM of patient with hemophilia C in the mixture of patient's blood with standard plasma and in the mixture of patient's blood with coagulation FXl deficient plasma: CT normalization in the mixture with standard plasma and hypocoagulation in the mixture with coagulation factor deficient plasma
Диагностика дефицита FXII
Больная Д., 47 лет, страдает болезнью Хагемана (дефицит FXII). Заболевание впервые диагностировано в возрасте 37 лет, когда накануне оперативного вмешательства было выявлено удлинение АЧТВ до 86 с, активность FXII составляла менее 1 %. В соответствии с алгоритмом диагностики дефицита факторов свертывания (рис. 1) в тесте ЕХТЕМ не выявлено отклонений от нормы, выявлено удлинение INTEMct до 1681 с (норма до 240 с) (рис. 13).
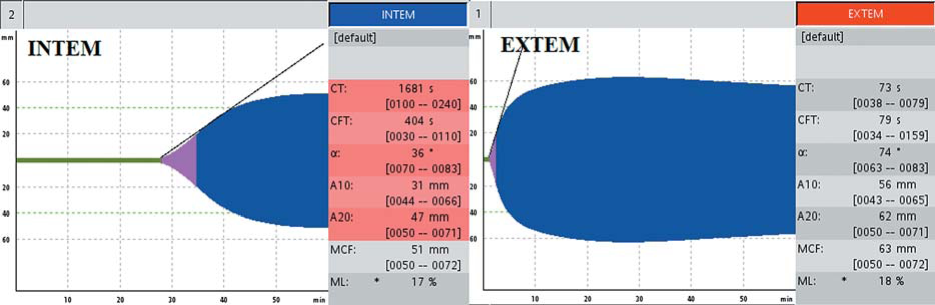
Рисунок 13. Показатели РОТЭМ у больной болезнью Хагемана (дефицит FXII) с: удлинение INTEMct, нормальный EXTEMct
Figure 13. ROTEM in patient with Hegemon's disease (factor Xll deficiency): prolonged INTEMСТ, normal EXTEMСТ
С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови больной со стандартной плазмой INTEMct нормализовался — 243 с, в то время как в тесте с плазмой, дефицитной по FXII, INTE^Pt остался удлиненным — 694 с (рис. 14), что подтвердило дефицит FXII.
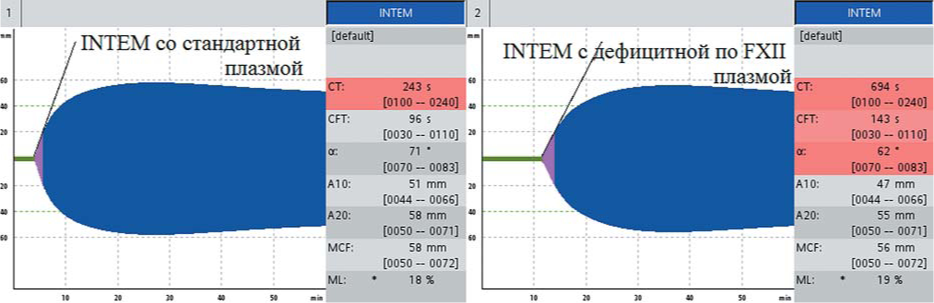
Рисунок 14. INTEM при постановке тестов со смесью цельной крови больной с дефицитом FXII со стандартной плазмой и смесью цельной крови плазмой, дефицитной по FXII: нормализация СТ в смеси со стандартной плазмой и гипокоагуляция в смеси с дефицитной плазмой
Figure 14. INTEM of patient with factor XII deficiency in the mixture of patient's blood with standard plasma and in the mixture of patient's blood with coagulation FXII deficient plasma: CT normalization in the mixture with standard plasma and hypocoagulation in the mixture with coagulation factor deficient plasma
Оценка эффективности гемостатической терапии у больного с врожденным дефицитом FXII
Больному В., 54 лет, с диагнозом болезнь Хагемана, выполнено эндопротезирование коленного сустава.
До операции в коагулограмме: АЧТВ 164 с, концентрация фибриногена 3,8 г/л; протромбин по Квику 90 %, МНО 1,06; плазменная активность FXII 1 %. При исследовании методом РОТЭМ цельной крови удлинение INTEM 933 с (рис. 15).
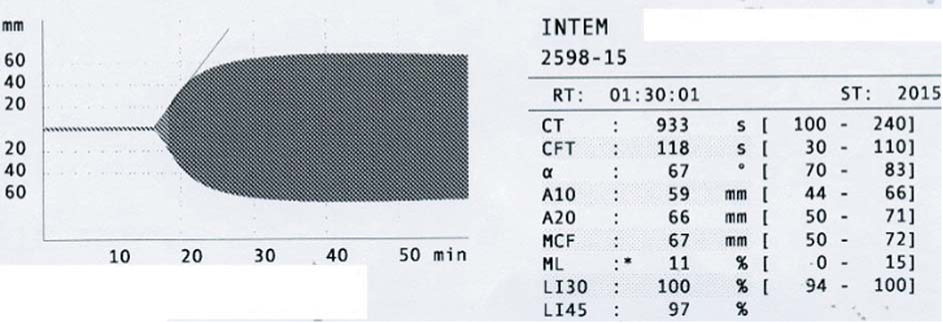
Рисунок 15. INTEMcr у больного болезнью Хагемана до начала гемостатической терапии
Figure 15. INTEMcr in patient with Hageman's disease before hemostatic treatment
После трансфузии СЗП в коагулограмме АЧТВ сократилось до 45 с. При исследовании методом РОТЭМ после терапии СЗП уменьшился до нормальных значений INTEMct 193 с (рис. 16). В послеоперационном периоде каких-либо геморрагических и тромботических осложнений не наблюдалось.
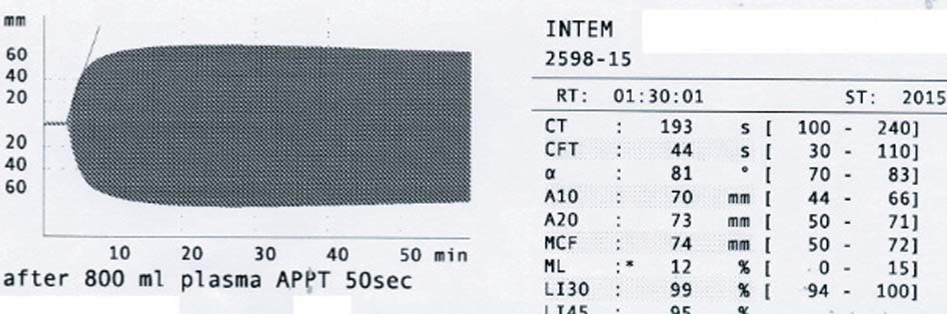
Рисунок 16. Нормализация INTEMct у больного болезнью Хагемана после трансфузии СЗГ
Figure 16. INTEMcrnormalization in patient with Hageman's disease after FFP transfusion
Обсуждение
К наследственным (врожденным) коагулопатиям относятся моногенные коагулопатии, которые вызваны дефицитом плазменных белков, участвующих в гемостазе [23]. Наиболее распространенным заболеванием в этой группе является гемофилия, редкие наследственные коагулопатии включают дефицит FI, FII, FV, FVII, FX, FXI, FXII. Причиной их развития является, как правило, рецессивное наследование уникального или редких нуклеотидных изменений в генах, кодирующих коагуляционные факторы, или в белках, необходимых для посттрансляционных модификаций данных факторов. Эти заболевания наиболее распространены в этнических группах, в которых приняты близкородственные браки, вследствие вероятности гомозиготного носительства дефекта гена [23]. До недавнего времени описания редких когулопатий состояли из исследований случай-контроль или малочисленных когортных исследований. Однако в последние годы появилось несколько специфических регистров. К ним можно отнести регистр Европейской сети редких геморрагических заболеваний (European Network of the Rare Bleeding Disorders) [24], североамериканский регистр [25], английский (UKHDCO, www.ukhdco.org), итальянский (http://www.aiceonline.it), швейцарский (www.aekreg.ch), бразильский и международный (htttp://www.factorxi.org) регистры [26, 27]. Инцидентность этих редких врожденных коагулопатий колеблется от 1 : 500 000 до 1 : 2 000 000 населения [26]. Даже среди остальных врожденных коагулопа- тий редкие нарушения свертывания крови встречаются нечасто. По данным итальянского регистра [28], в который в 2016 г. было включено 10 300 больных орфанными нарушениями свертывания крови, а именно гемофилией, болезнью Виллебранда и дефицитом отдельных факторов свертывания, больные с дефицитом отдельных факторов составляли всего 2093 человека, или 20,2 %.
В настоящей работе разработан алгоритм диагностики дефицита FV, FVII, FXI, FXII.
При тяжелой форме дефицита FV (болезнь Оврена) у больных обнаруживают удлинение ПВ и АЧТВ. Удлинение времени в обоих тестах связано с тем, что FV входит в состав протромбиназного комплекса общего пути свертывания, который катализирует превращение тромбина из протромбина. Диапазон нормальных значений плазменной активности FVII составляет 70120 % [22, 29, 30].
При дефиците FVII, или гипопроконвертинемии, спонтанные кровотечения встречаются редко. Заболевание у мужчин часто протекает бессимптомно, у женщин проявляется обильными менометроррагиями, геморрагический синдром может проявиться при травме или хирургических вмешательствах [29]. Диагностика основана на результатах определения плазменной активности FVII, диапазон нормальных значений которой составляет 70-120 %. При гипопроконвертинемии выраженность клинических проявлений слабо коррелирует с выраженностью дефицита FVII [31], а при проведении заместительной терапии rFVIIa лабораторные тесты (АЧТВ, ПВ, плазменная активность FVII) не коррелируют с его гемостатическим эффектом [32].
При дефиците FVIII (гемофилии А) отмечается снижение плазменной активности FVIII и удлинение АЧТВ при сохранении других показателей в пределах нормальных значений. Для тяжелой формы гемофилии А характерно снижение активности FVIII менее 1 %, для средней степени тяжести 1—5 %, для легкой степени тяжести >5 % [23].
При дефиците FIХ (гемофилии В) отмечается снижение плазменной активности FIX и удлинение АЧТВ. Диапазон нормальных значений плазменной активности FK составляет 50—120 %. Для тяжелой формы гемофилии В характерно снижение активности FIX менее 1 %, для средней степени тяжести 1—5 %, для легкой степени тяжести >5 % [23].
При дефиците FXI (гемофилия С) геморрагический синдром редко возникает спонтанно, как правило, после хирургических манипуляций, травм. Диапазон нормальных значений плазменной активности FXI составляет 70—120 %. Диагноз устанавливается на основании удлинения АЧТВ и сниженной плазменной активности FXI [29].
FXII (фактор Хагемана) активирует FXI, который затем триггирует фактор IX и приводит к тромбин-опосредованному образованиюю фибрина [33]. Однако ведущая физиологическая роль FXII — участие в процессах фибринолиза. Поэтому дефицит FXII рассматривается как протромботическое состояние. В то время как геморрагические проявления случаются редко, обычно при инвазивных вмешательствах или операциях, нарушения гемостаза часто обнаруживают случайно при предоперационном скрининге. Диапазон нормальных значений плазменной активности FXI составляет 70—120 % [29]. Удлинение АЧТВ регистрируется при снижении активности FXII в плазме крови ниже 42,5 % [34].
В основу методов определения активности факторов свертывания крови положено проведение тестов (FII, FV, FVII, FX) и/или АЧТВ (FVIII, FIX, FXI, FXII)
в разбавленном исследуемом образце. При этом снижение активности факторов свертывания компенсируют внесением в инкубационную среду субстратной плазмы, не содержащей соответствующего фактора, но имеющей полноценную активность других факторов свертывания. Таким образом, активность анализируемых факторов в исследуемом образце оказывается единственной неизвестной величиной, определяющей скорость процесса свертывания. Количественное определение активности факторов проводят по калибровочному графику разведений плазмы-калибратора с аттестованной активностью соответствующего фактора [35].
Распространенным способом определения дефицита факторов свертывания является одностадийный клоттинговый метод исследования с использованием субстратных (дефицитных) образцов плазмы, лишенных одного из факторов свертывания крови [36]. Принцип метода заключается в определении промежутка времени после добавления стартового реактива, запускающего каскад свертывания плазмы по внутреннему или внешнему пути, в смесь субстратной (дефицитной) плазмы, в которой отсутствует исследуемый фактор, и исследуемой плазмы больного. Степень коррекции зависит от активности исследуемого фактора свертывания, поскольку активность других факторов свертывания в этой системе в норме. Активность дефицитного фактора в исследуемой плазме определяют по кривой разведения.
Двухстадийный клоттинговый метод определения активности факторов свертывания крови не требует использования субстратной дефицитной плазмы и не зависит от наличия активированного фактора свертывания в исследуемом образце [37]
Хромогенный метод определения активности факторов свертывания крови рекомендуется использовать только как ориентировочный и предпочтительно для оценки концентратов факторов свертывания, а не с диагностическими целями [35].
Концентрация факторов может также определяться иммуноферментным методом.
С помощью линейной регрессии показано [24], что имеется сильная ассоциация между выраженностью геморрагического синдрома и сниженной активностью FI и слабая ассоциация между выраженностью дефицита FV и FVII и клиническими проявлениями кровоточивости. Минимальная концентрация факторов, ниже которой у больных возникал геморрагический синдром, составила для фибриногена 1 г/л, для FV — 12 ед/дл, FVII — 25 ед/дл, FXI — 26 ед/дл, FXII — 31 ед/дл, а концентрация факторов в плазме крови, которая соответствует выраженному геморрагическому синдрому, составляет <10 ед/дл для FVII, <25 ед/дл для FХI, а для факторов свертывания FI, FV и FXII выраженный геморрагический синдром возникает, когда их концентрация в крови не определяется вообще [24].
Более того, ни один из вышеперечисленных методов нельзя отнести к методам point-of-care. Во многих стационарах нет условий, оборудования и специалистов для исследования активности факторов свертывания. В результате при выявлении нарушений в системе гемостаза, особенно если до обследования не известен диагноз, отменяются или откладываются инвазивные вмешательства либо лечение проводится без установленного диагноза и может оказаться неэффективным [38]. В то же время согласно приказу Министерства здравоохранения РФ от 15 ноября 2012 г. № 919н «Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю “анестезиология и реаниматология”» в стандарт оснащения отделения анестезиологии-реанимации с палатами реанимации и интенсивной терапии входит тромбоэластограф или тромбоэластометр. В литературе описаны попытки использовать глобальные тесты исследования гемостаза для диагностики дефицита отдельных факторов свертывания [30]. Но большинство из них относится к применению теста генерации тромбина [39—41] и лишь единичные — к применению тромбоэластометрии [42].
Белорусские исследователи [43] изучили параметры тромбоэластометрии во время операции трансплантации печени, при которых отмечались изменения в крови содержания факторов свертывания (фибриногена, FII, FV, FVII, FVIII, FIX, FX, FXI, FXII). Авторы [43] отметили, что наибольшей диагностической эффективностью обладали следующие параметры: ЕХТЕМСТ >80 с и КТЕМст >240 с. Чувствительность изменения ЕХТЕМст составила всего 19 %, т.е. по данным тром- боэластометрии восполнение дефицита факторов будет проводиться лишь в каждом пятом случае, когда имеются показания согласно общепринятым рекомендациям (МНО >2,0). Чувствительность изменения КТЕМст >составила 51 %. Однако авторы [43] не пытались по параметрам РОТЭМ дифференцировать дефицит отдельных факторов крови, а лишь оценивали их изменения в совокупности. Кроме того, в этом исследовании дефицит факторов был невыраженный, минимально факторы снижались через 15 минут после реперфузии (медианы FII 44 %, FV 17 %, FVII 29 %, FIX 59 %, FX 39 %, FXI 56 %, FXII 66 %), т.е. их содержание было значительно больше, чем у больных с врожденным дефицитом, чем можно объяснить низкую чувствительность тестов.
Оценить возможность использования РОТЭМ для диагностики дефицита FV попытались Т. Haas и соавт. [44]. Авторы смешивали плазму, дефицитную по FV, с нормальной человеческой плазмой (активность FV 96 %) в разных пропорциях, чтобы получить плазму с активностью фактора 0, 10, 16, 25, 50 и 100 %. Затем исследовали каждое из разведений плазмы на Rotem, чтобы оценить влияние разного количества фактора на СТ. Низкая активность FV ассоциировалась с удлинением СТ. Уменьшение активности FV со 100 до 25 % сопровождалось удлинением СТ лишь с 50 до 65 с, но при уменьшении активности FV менее 10 % период СТ удлинялся до 140 с и более.
Эти данные согласуются с результатами, полученными нами в настоящем исследовании: при смешивании цельной крови больного с дефицитом FV с дефицитной по FV плазмой сохранялось удлинение СТ, а при смешивании с нормальной плазмой происходила нормализация СТ.
L. Spiezia и соавт. [42] исследовали возможность использования РОТЭМ для выявления нарушений гемостаза у 9 больных с дефицитом FV, используя для этого их цельную кровь и бедную тромбоцитами плазму. При постановке тестов с цельной кровью они выявили значимое удлинение СТ в трех стандартных тестах (INTEM, EXT EM, FIBTEM), в то время как показатель CFT был удлинен только в тесте INTEM и был неизмеряемым в тесте FIBTEM. При исследованиях in vitro с плазмой больных с дефицитом FV, бедной тромбоцитами, авторы выявили удлинение СТ и укорочение MCF в тестах INTEM, EXTEM и FIBTEM по сравнению с аналогичными показателями, выполненными с бедной тромбоцитами плазмой здоровых людей. Добавление при пробоподготовке к обоим образцам бедной тромбоцитами плазмы тромбоцитов больных либо тромбоцитов здоровых людей приводило к укорочению СТ, которое было более выражено при использовании тромбоцитов здоровых людей, причем СТ больше сокращался в EXTEM, чем в INTEM. Полученный эффект связан с тем, что 20 % всего пула FV хранится в α-гранулах тромбоцитов в частично активированной форме [45]. Аналогичные изменения на РОТЭМ зафиксировано было и в настоящей работе после трансфузии СЗП и концентрата тромбоцитов у больной с дефицитом фактора V при установке порт-системы.
Однако в работах по изучению влияния дефицита FV на показатели РОТЭМ исследователи не предлагали непосредственно методику диагностики дефицита фактора на основе РОТЭМ и не использовали ее для оценки эффективности и безопасности терапии. Особенностью представленного в настоящей работе клинического примера лечения больной дефицитом FV являлось то, что у больной в анамнезе были эпизоды венозных тромбозов после трансфузии свежезамороженной плазмы. Поэтому основной задачей лечения было компенсировать гипокоагуляцию таким образом, чтобы избежать гиперкоагуляции, сохраняя умеренную гипокоагуляцию, которая позволила бы выполнить оперативное вмешательство.
В нашем исследовании РОТЭМ использовали для диагностики и контроля за гемостатической терапией rFVIIa во время оперативного вмешательства у больной гипопроконвертинемией. В литературе мало сообщений об использовании вискоэластичных методов у больных гипопроконвертинемией. H.T.T. Tran и соавт. [46] обследовали с помощью модифицированных тестов РОТЭМ 12 больных с плазменной активностью FVII <1 %. Как и в нашем исследовании, они выявили двукратное удлинение СТ в тесте с тканевым фактором (аналог теста EXTEM) по сравнению со здоровым контролем, при этом параметр MCF между группами не различался.
Описаны изменения РОТЭМ у больных гемофилией А и В [47], причем изменения параметров INTEM коррелируют с тяжестью гемофилии и выраженностью дефицита FVIII. Более того, отмечается, что использование вискоэластичных методов позволяет подобрать индивидуально дозы дефицитных факторов [47].
Данные по влиянию дефицита FXI фактора на INTEM были получены D. Dirkmann и соавт. [48]. Авторы использовали ROTEM для оценки влияния дефицита FXI на коагуляцию у пятилетней девочки с врожденным тяжелым дефицитом FXI, у которой отмечалось удлинение АЧТВ до 65-99 с, МНО составило 0,98, концентрация фибриногена плазмы — 3,5 г/л, плазменная активность FXI — 2 %. При обследовании с помощью РОТЭМ у нее были нормальные значения EXTEMct и более чем в три раза увеличен показатель INTEM (776 c). При добавлении in vitro rFVIIa к пробе крови в концентрациях от 0,25 до 1 мкг/мл, что соответствует концентрации препарата в крови при внутривенном введении в дозе 15-70 мкг/кг массы тела. Было показано, что доза концентрации в крови 0,5 мкг/мл (что соответствует внутривенному введению rFVIIa в дозе 30 мкг/кг массы тела) столь же эффективно нормализовала параметр INTEMct, как и концентрация 1 мкг/мл [49]. Имеется сообщение об использовании ROTEM для мониторинга терапии малыми дозами rFVIIa у больных с тяжелым дефицитом FXI при хирургических вмешательствах [49]. В нашем исследовании дефицит FXI проявлялся удлинением INTEM , которое компенсировалось при добавлении стандартной плазмы в пробирку.
В литературе имеются лишь единичные сообщения о применении тромбоэластографии для диагностики изолированного дефицита FXII и мониторинга проводимой терапии у людей [50, 51]и животных [52]. Помимо того что при этом заболевании выявляется гипокоагуляция, дефицит FXII рассматривается как протромботическое состояние, ввиду того что FXII участвует в процессах фибринолиза. Преимущество использования РОТЭМ заключается в том, что, не измеряя непосредственно активности факторов, метод позволяет не только диагностировать нарушения гемостаза, но и контролировать эффективность и безопасность гемостатической терапии. Он позволяет дозировать гемостатическую терапию таким образом, чтобы удерживаться в «терапевтическом окне», в котором достигается приемлемый гемостаз, и в то же время не возникает гиперкоагуляция. Переход из состояния гипокоагуляции в гиперкогуляцию не всегда соответствует концентрации фактора в плазме, и лучше оценивать его функционально, с помощью РОТЭМ.
Ограничения исследования. Одним из ограничений исследования является небольшая выборка больных, поскольку это редко встречающиеся нарушения свертывания крови.
Другим ограничением метода может явиться сочетанный дефицит нескольких факторов, и хотя он также встречается крайне редко, для его диагностики будет необходимо усложнить алгоритм обследования.
Наконец, третьим ограничением может явиться наличие ингибиторов к факторам свертывания, когда представленный алгоритм не будет работать, поскольку в этих условиях добавление стандартной плазмы не приведет к нормализации активности факторов свертывания.
Таким образом, с помощью РОТЭМ возможно определение дефицита отдельных факторов свертывания крови. После выявления удлинения СТ в EXTEM и/или INTEM, исключения действия гепарина и гипофибриногенемии, необходимо выполнить смешивание исследуемой свежей цитратной крови в соотношении 2:1 со стандартной плазмой и с дефицитной по одному из исследуемых факторов плазмой. Нормализация показателей РОТЭМ в пробе со стандартной плазмой и сохранение гипокоагуляции в пробе с дефицитной по фактору плазмой позволяет подтвердить дефицит фактора свертывания крови.
Список литературы
1. Saner F.H., Kirchner C. Monitoring and Treatment of Coagulation Disorders in End-Stage Liver Disease. Visc Med. 2016; 32(4): 241–8.
2. Дементьева И.И., Морозов Ю.А., Чарная М.А., Гончарова А.В. Технологии point of care в клинике неотложных состояний. Клиническая лабораторная диагностика. 2013; (7): 5–10.
3. Lang T., Bauters A., Braun S.L. et al. Multi-centre investigation on reference ranges for ROTEM thromboelastometry. Blood coagulation & fi brinolysis: Int. J Haemost Thromb. 2005; 16(4): 301–10.
4. Butwick A.J., Goodnough L.T. Transfusion and coagulation management in major obstetric hemorrhage. Curr Opin Anaesthesiol. 2015; 28(3): 275–84.
5. Allard S., Green L., Hunt B.J. How we manage the haematological aspects of major obstetric haemorrhage. Br J Haematol. 2014; 164(2): 177–88.
6. Guasch E., Gilsanz F. Massive obstetric hemorrhage: Current approach to management. Med Intensiva. 2016; 40(5): 298–310.
7. Kander T., Larsson A., Taune V. et al. Assessment of Haemostasis in Disseminated Intravascular Coagulation by Use of Point-of-Care Assays and Routine Coagulation Tests, in Critically Ill Patients; A Prospective Observational Study. PloS One. 2016; 11(3): e0151202.
8. Wikkelsø A., Wetterslev J., Møller A.M., Afshari A. Thromboelastography (TEG) or rotational thromboelastometry (ROTEM) to monitor haemostatic treatment in bleeding patients: a systematic review with meta-analysis and trial sequential analysis. Anaesthesia. 2017; 72(4): 519–31. DOI: 10.1111/anae.13765
9. Meybohm P., Zacharowski K., Weber C.F. Point-of-care coagulation management in intensive care medicine. Crit care. 2013; 17(2): 218.
10. Curry N.S., Davenport R., Pavord S. et al. The use of viscoelastic haemostatic assays in the management of major bleeding. Br J Haematol. 2018; 182(6): 789–806.
11. Korpallova B., Samos M., Bolek T. et al. Role of Thromboelastography and Rotational Thromboelastometry in the Management of Cardiovascular Diseases. Clin Appl Thromb Hemos. 2018; 24(8): 1199–207.
12. Zaky A. Thromboelastometry Versus Rotational Thromboelastography in Cardiac Surgery. Semin Cardiothorac Vasc Anesth. 2017; 21(3): 206–11.
13. Weber C.F., Görlinger K., Meininger D. et al. Point-of-Care Testing. Anesthesiology. 2012; 117(3): 531–47.
14. Görlinger K., Jambor C., Hanke A.A. et al. Perioperative Coagulation Management and Control of Platelet Transfusion by Point-of-Care Platelet Function Analysis. Transfus Med Hemother. 2007; 34(6): 396–411. DOI: 10.1159/000109642
15. Rugeri L., Levrat A., David J.S. et al. Diagnosis of early coagulation abnormalities in trauma patients by rotation thrombelastography. J Thromb Haemost. 2007; 5(2): 289–95.
16. Rizoli S., Min A., Perez Sanchez A. et al. In Trauma, Conventional ROTEM and TEG Results Are Not Interchangeable But Are Similar in Clinical Applicability. Mil Med. 2016; 181(5S): 117–26.
17. da Luz L.T., Nascimento B., Rizoli S. Thrombelastography (TEG®): practical considerations on its clinical use in trauma resuscitation. Scand J Trauma, Resusc Emerg Med. 2013; 21(1): 29.
18. Gonzalez E., Moore E.E., Moore H.B. Management of Trauma-Induced Coagulopathy with Thrombelastography. Crit Care Clin. 2017; 33(1): 119–34.
19. Abuelkasem E., Lu S., Tanaka K. et al. Comparison between thrombelastography and thromboelastometry in hyperfi brinolysis detection during adult liver transplantation. Br J Anaesth. 2016; 116(4): 507–12.
20. Roullet S., Labrouche S., Mouton C. et al. Lysis Timer: a new sensitive tool to diagnose hyperfi brinolysis in liver transplantation. J Clin Pathol. 2019; 72(1): 58–65.
21. Приказ Министерства здравоохранения и социального развития РФ от 13 апреля 2011 г. № 315н «Об утверждении Порядка оказания анестезиолого-реанимационной помощи взрослому населению».
22. Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. 3-е изд. М.: Ньюдиамед, 2008; 292.
23. Зозуля Н.И., Свирин П.В. Клинические рекомендации по диагностике и лечению редких коагулопатий: Наследственный дефицит факторов свертывания крови II, VII, X. НГО. 2014; 35: 19.
24. Peyvandi F., Palla R., Menegatti M. et al. Coagulation factor activity and clinical bleeding severity in rare bleeding disorders: Results from the European Network of Rare Bleeding Disorders. J Thromb Haemost. 2012; 10(4): 615–21.
25. Acharya S.S., Coughlin A., Dimichele D.M., North American Rare Bleeding Disorder Stud Group. Rare Bleeding Disorder Registry: defi ciencies of factors II, V, VII, X, XIII, fi brinogen and dysfi brinogenemias. J Thromb Haemost. 2004; 2: 248–56.
26. Peyvandi F., Spreafi co M. National and international registries of rare bleeding disorders. Blood Transfus. 2008; 6(Suppl. 2): 45–8.
27. Rezende S.M., Rodrigues S.H.L., Brito K.N.P. et al. Evaluation of a webbased registry of inherited bleeding disorders: A descriptive study of the Brazilian experience with HEMOVIDAweb Coagulopatias. Orphanet J Rare Dis. 2017; 12(1): 1–7.
28. Abbonizio F., Hassan H.J., Riccioni R. et al. New data from the Italian National Register of Congenital Coagulopathies, 2016 Annual Survey. Blood Transfus. 2019; 1–8.
29. Мамаев А.Н. Коагулопатии. М.: ГЭОТАР-Медиа, 2012; 260.
30. Palla R., Peyvandi F., Shapiro A.D. Rare bleeding disorders: Diagnosis and treatment. Blood. 2015; 125(13): 2052–61.
31. Herrmann F.H., Wulff K., Auberger K. et al. Molecular biology and clinical manifestation of hereditary factor VII defi ciency. Semin Thromb Hemost. 2000; 26(4): 393–400.
32. Martinowitz U., Michaelson M. Guidelines for the use of recombinant activated factor VII (rFVIIa) in uncontrolled bleeding: a report by the Israeli multidisciplinary rFVIIa task force. J Thromb Haemost. 2005; 3(4): 640–8.
33. Simão F., Feener E.P. The effects of the contact activation system on hemorrhage. Front Med. 2017; 4: 1–10.
34. Bachler M., Niederwanger C., Hell T. et al. Infl uence of factor XII defi ciency on activated partial thromboplastin time (aPTT) in critically ill patients. J Thromb Thrombolysis. 2019. DOI: 10.1007/s11239-019-01879-w
35. Долгов В., Свирин ПВ. Лабораторная диагностика нарушений гемостаза. М.–Тверь: Триада; 2005: 227.
36. Langdell R., Wagner R., Brinkhous K. Effect of antihemophilic factor on onestage clotting tests; a presumptive test for hemophilia and a simple one-stage antihemophilic factor assy procedure. J Lab Clin Med. 1953; 41(4): 637–47.
37. Biggs R., Eveling J., Richards G. The Assay of Antihaemophilic-Globulin Activity. Br J Haematol. 1955; 1(1): 20–34.
38. Лубнин А.Ю., Коновалов А.Н., Ласунин Н.В. и др. Тяжелые послеоперационные интракраниальные геморрагические осложнения у нейрохирургического больного с не диагностированной до операции болезнью Виллебранда (клиническое наблюдение и обзор литературы). Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018; 82(3): 56–65. DOI: 10.17116/neiro201882356
39. Rugeri L., Quélin F., Chatard B. et al. Thrombin generation in patients with factor XI defi ciency and clinical bleeding risk. Haemophilia. 2010; 16(5): 771–7.
40. Hemker H., Giansily M., Peyvandi F. et al. The Thrombogram in Rare Inherited Coagulation Disorders: Its Relation to Clinical Bleeding. Thromb Haemost. 2018; 88(10): 576–82.
41. Van Geffen M., Menegatti M., Loof A. et al. Retrospective evaluation of bleeding tendency and simultaneous thrombin and plasmin generation in patients with rare bleeding disorders. Haemophilia. 2012; 18(4): 630–8.
42. Spiezia L., Radu C., Campello E. et al. Whole blood rotation thromboelastometry (ROTEM®) in nine severe factor V defi cient patients and evaluation of the role of intraplatelets factor V. Haemophilia. 2012; 18(3): 463–8.
43. Минов А.Ф., Дзядзько А.М., Руммо О.О. Тромбоэластометрические критерии коррекции нарушений гемостаза при трансплантации печени. Анестезиология и реаниматология. 2012; 57(2): 35–41.
44. Haas T., Cushing M.M., Asmis L.M. Infl uence of Factor V Defi ciency on ROTEM® Clotting Time. Blood. 2014; 124(21): 5039.
45. Chakri G., Yates S.G., Rambally S., Sarode R. Transfusion management of factor V defi ciency: three case reports and review of the literature. Transfusion. 2016; 56(7): 1745–9.
46. Tran H.T.T., Tjønnfjord G.E., Holme P.A. Use of thromboelastography and thrombin generation assay to predict clinical phenotype in patients with severe FVII defi ciency. Haemophilia. 2013; 20(1): 141–6.
47. Nogami K. The utility of thromboelastography in inherited and acquired bleeding disorders. Br J Haematol. 2016; 174(4): 503–14.
48. Dirkmann D., Hanke A.A., Görlinger K., Peters J. Perioperative use of modifi ed thrombelastography in factor XI defi ciency: A helpful method to assess drug effects. Acta Anaesthesiol Scand. 2007; 51(5): 640–3. DOI: 10.1111/j.1399-6576.2007.01284.x
49. Riddell A., Abdul-Kadir R., Pollard D. et al. Monitoring low dose recombinant factor VIIa therapy in patients with severe factor XI defi ciency undergoing surgery. Thromb Haemost. 2011; 106(9): 521–7.
50. Pivalizza E.G. Perioperative use of the Thrombelastograph® in patients with inherited bleeding disorders. J Clin Anesth. 2003; 15(5): 366–70.
51. Pluthero F.G., Ryan C., Williams S. et al. Decreased in vitro thrombin generation and clot stability in human FXII-null blood and plasma. Br J Haematol. 2011; 152(1): 111–2.
52. Blois S.L., Holowaychuk M.K., Wood R.D. Evaluation of thromboelastography in two factor XII-defi cient cats. JFMS Open Rep. 2015; 1(1): 205511691558502. DOI: 10.1177/2055116915585025
Об авторах
Г. М. ГалстянРоссия
доктор медицинских наук, заведующий отделением реанимации и интенсивной терапии,
125167, Москва
О. А. Полеводова
Россия
врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии,
125167, Москва
Е. В. Яковлева
Россия
кандидат медицинских наук, врач-гематолог отдела коагулопатий,
125167, Москва
А. Е. Щекина
Россия
аспирант отделения реанимации и интенсивной терапии,
125167, Москва
Рецензия
Для цитирования:
Галстян Г.М., Полеводова О.А., Яковлева Е.В., Щекина А.Е. ПРИМЕНЕНИЕ РОТАЦИОННОЙ ТРОМБОЭЛАСТОМЕТРИИ ДЛЯ ДИАГНОСТИКИ ДЕФИЦИТА ФАКТОРОВ СВЕРТЫВАНИЯ И КОНТРОЛЯ ГЕМОСТАТИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ НАСЛЕДСТВЕННЫМИ КОАГУЛОПАТИЯМИ. Гематология и трансфузиология. 2019;64(3):297-316. https://doi.org/10.35754/0234-5730-2019-64-3-297-316
For citation:
Galstyan G.M., Polevodova O.A., Yakovleva E.V., Shchekina A.E. ROTATION THROMBOELASTOMETRY FOR THE DIAGNOSIS OF FACTOR DEFICIENCY AND MANAGEMENT OF THE HEMOSTATIC THERAPY IN PATIENTS WITH INHERITED COAGULATION DISORDERS. Russian journal of hematology and transfusiology. 2019;64(3):297-316. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-3-297-316











































