Перейти к:
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ТОЛЩИНЫ СТЕНКИ КИШЕЧНИКА У БОЛЬНЫХ ОСТРОЙ РЕАКЦИЕЙ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА» С ПОРАЖЕНИЕМ КИШЕЧНИКА
https://doi.org/10.35754/0234-5730-2019-64-4-412-423
Аннотация
Введение. Трансплантация гемопоэтических стволовых клеток является терапией выбора многих больных злокачественными заболеваниями системы крови. Одним из наиболее тяжелых осложнений у них является острая реакция «трансплантат против хозяина» (РТПХ) с поражением кишечника. Однако принятый в настоящее время в качестве диагностического критерия объем стула за сутки не всегда позволяет вовремя установить диагноз.
Цель — исследовать возможность применения ультразвукового исследования кишечника для диагностики острой РТПХ с поражением кишечника.
Материалы и методы. В исследование было включено 50 больных, перенесших трансплантацию аллогенных гемопоэтических стволовых клеток. У 40 имелись клинические признаки РТПХ с поражением кишечника (диарея >500 мл/сут). Контрольная группа включала 10 больных после трансплантации аллогенных гемопоэтических стволовых клеток, у которых отсутствовали признаки поражения желудочно-кишечного тракта. Всем больным проводили ультразвуковое измерение толщины стенки кишечника.
Результаты. Было сформировано 3 группы больных: больные с острой РТПХ, диареей вирусного или инфекционного генеза, диареей вследствие токсического воздействия химиопрепаратов. По результатам исследования у больных с острой РТПХ стенки всех отделов кишечника были значимо толще, по сравнению с контрольной группой и с больными с диареей вследствие других причин.
Заключение. Утолщение стенки слепой кишки более 3,25 мм, выявленное ультразвуковым методом, может использоваться в качестве диагностического признака РТПХ с поражением кишечника.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Финансирование: исследование не имело спонсорской поддержки.
Ключевые слова
Для цитирования:
Дроков М.Ю., Дубняк Д.С., Яцык Г.А., Киреева А.В., Пырикова О.В., Кузьмина Л.А., Попова Н.Н., Васильева В.А., Масликова У.В., Паровичникова Е.Н. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ТОЛЩИНЫ СТЕНКИ КИШЕЧНИКА У БОЛЬНЫХ ОСТРОЙ РЕАКЦИЕЙ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА» С ПОРАЖЕНИЕМ КИШЕЧНИКА. Гематология и трансфузиология. 2019;64(4):412–423. https://doi.org/10.35754/0234-5730-2019-64-4-412-423
For citation:
Drokov M.Yu., Dubnyak D.S., Yatsyk G.A., Kireeva A.A., Pyrikova O.V., Kuzmina L.A., Popova N.N., Vasilyeva V.A., Maslikova U.V., Parovichnikova E.N. ULTRASOUND EXAMINATION OF BOWEL WALL THICKNESS IN PATIENTS WITH ACUTE INTESTINAL GRAFT-VERSUS-HOST DISEASE. Russian journal of hematology and transfusiology. 2019;64(4):412–423. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-412-423
Введение
Трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК) является «золотым стандартом» лечения многих злокачественных заболеваниях системы крови. Согласно данным Европейской организации по трансплантации стволовых клеток и костного мозга (European Blood and Marrow Transplantation — EBMT) за 2014 г., в 656 трансплантационных центрах в 47 странах выполнено 15 765 (43 %) алло-ТГСК и 20 704 (57 %) трансплантаций аутологичных стволовых клеток [1].
Наиболее частым и серьезным осложнением аллоТГСК, которое снижает показатели общей выживаемости, является острая реакция «трансплантат против хозяина» (РТПХ). Летальность при развитии этого осложнения варьирует от 28 %, в случае острой РТПХ средней степени тяжести, до 92 % — при тяжелой форме острой РТПХ [2, 3].
По данным H.J. Khoury и соавт. [4], частота выявления тяжелой формы РТПХ (III–IV степени) постепенно снижается с 56 % в период с 1999 по 2001 г., 47 % в 2002—2005 гг. и 37 % — в 2006—2012 гг. Несмотря на это, число случаев РТПХ с поражением кишечника значимо выросло с 11 % в 1999—2001 гг. до 24 % в 2006—2012 гг. Острая РТПХ с поражением кишечника является наиболее тяжелой формой аллоиммунных осложнений после алло-ТГСК. По данным С. Castilla-Llorente и соавт. [5], лишь 25 % больных с тяжелой степенью острой РТПХ с поражением кишечника остаются в живых в течение двух лет после установления этого диагноза.
Вопросы терапии этого осложнения также до конца не определены, в частности при тяжелых формах РТПХ с поражением кишечника, рефрактерных к терапии глюкокортикоидными гормонами. Во многом успех терапии определяется ранним началом лечения, что, в свою очередь, зависит от своевременной диагностики этого осложнения. Диагностические критерии не всегда позволяют быстро и точно установить диагноз острой РТПХ с поражением кишечника и начать терапию глюкортикортикоидными гормонами. В диагностические критерии острой РТПХ с поражением кишечника входит лишь объем стула, что для больных после алло-ТГСК не является высокоспецифичным критерием [6—8]. Часто вместе с клинической картиной дебюта острой РТПХ с поражением кишечника наблюдаются проявления различных инфекционных осложнений, в первую очередь вирусного генеза, а также проявления токсичности недавно проведенного предтрансплан- тационного кондиционирования. Отсутствие специфических критериев увеличивает время, затрачиваемое на установку окончательного диагноза, что приводит к позднему началу иммуносупрессив- ной терапии.
Имеются множество работ [9—12] по применению ультразвукового исследования (УЗИ) для диагностики таких воспалительных заболеваний кишечника, как болезнь Крона, неспецифический язвенный колит. В то же время количество публикаций, посвященных ультразвуковой диагностике острой РТПХ с поражением кишечника, крайне ограниченно, и чаще всего они представляют собой описание единичных случаев [13].
Цель работы — исследовать возможность применения ультразвукового исследования кишечника для диагностики острой РТПХ с поражением кишечника.
Больные и методы
Больные
В проспективное исследование, проведенное с 2014 по 2017 г., было включено 50 больных заболеваниями системы крови, перенесших алло-ТГСК. У 40 больных, включенных в исследование, были клинические признаки острой РТПХ с поражением кишечника (диарея более 500 мл/сут, развившаяся после алло-ТГСК в период ожидаемого приживления трансплантата). Всем больным было выполнено УЗИ кишечника, вирусологическое исследование образцов кала и крови, а также определение наличия клостридиального токсина в образцах стула.
Группа контроля включала 10 больных, перенесших алло-ТГСК, у которых на момент исследования отсутствовали признаки диареи, а также не было проявлений поражения кишечника инфекционного или опухолевого генеза. УЗИ кишечника больным из этой группы было выполнено после алло-ТГСК в сроки до +100 дня. Характеристика больных приведена в таблице 1.
Таблица 1. Характеристика больных, включенных в исследование
Table 1. Characteristics of patients included in the study
Характеристики Characteristics | Больные, перенесшие алло-ТГСК Patients after allo-HSCT (n = 40) | Контрольная | |
|---|---|---|---|
больные с диареей из-за острой РТПХ (n = 29) Patients with diarrhoea caused by acute GvHD (n = 29) | больные с диареей, не связанной с острой РТПХ (n = 11) Patients with diarrhoea not related to GvHD (n = 11) | группа Control group (n=10) | |
Возраст, медиана (разброс), лет Age, median (range), years | 37 (19-64) | 32 (21-58) | 40 (18-55) |
Мужчины/женщины, n Males / Females, n | 16/13 | 6/5 | 3/7 |
Диагноз Diagnosis |
|
|
|
ОМЛ, n (%) AML, n (%) | 13 (44,9) | 4 (36,4) | 6 (60) |
ОЛЛ, n (%) ALL, n (%) | 6 (20,7) | 3 (273) | 2 (20) |
ХМЛ, n (%) CML, n (%) | 3 (10,3) | - | - |
МДС, n (%) MDS, n (%) | 6 (20,7) | 1 (9) | - |
ЛПЗ, n (%) LPD, n %%) | 1 | 3 (2/,3) | 2 (20) |
Вид трансплантации Transplantation type |
|
|
|
Родственный совместимый, n (%) Match related, n (%) | 12 (41,3) | 2 (18,1) | 3 (30) |
Неродственный совместимый, n (%) Match unrelated, n (%) | 9 (31) | 3 (27,4) | 4 (40) |
Неродственный частично совместимый, n (%) Mismatch unrelated, n (%) | 7 (24,2) | 4 (36,4) | 3 (30) |
Гаплоидентичный, n (%) ldaploidentical, n (%) | 1 (3,5) | 2 (18,1) |
|
Режим кондиционирования Conditioning regimen |
|
|
|
Миелоаблативный, n (%) Myeloablative, n (%) | 5 (172) | 3 (273) | 4 (40) |
Пониженной интенсивности, n (%) Reduced-intensity, n (%) | 24 (82,8) | 8 (72,7) | 6 (60) |
Источник трансплантата Transplant source |
|
|
|
Костный мозг, n (%) Bone marrow, n (%) | 14 (48,2) | 8 (72,7) | 7 (70) |
Гемопоэтические стволовые клетки крови, n (%) IHaematopoietic stem cells, n (%) | 15 (51,8) | 3 (277) | 3 (30) |
Объем диареи, медиана (разброс), мл Diarrhoea volume, median (range), ml | 700 (500-3500) | 900 (500-2500) | - |
Время от даты трансплантации до даты проведения исследования, медиана (разброс), дней Interval between the transplant date and the ultrasound examination, median (range), days | 76 (15-272) | 12 (5-62) | 20 (13-61) |
Примечание. ОМЛ — острый миелоидный лейкоз, ОЛЛ — острый лимфобластный лейкоз, ХМЛ — хронический миелоидный лейкоз, МДС — миелодиспластический синдром, ЛПЗ — лимфопролиферативные заболевания.
Note. AML — acute myeloid leukaemia, ALL — acute lymphoid leukaemia, CML — chronic myeloid leukaemia, MDS — myelodysplastic syndrome, LPD — lymphoproliferative diseases.
Диагностика острой РТПХ
Для диагностики, оценки стадии и степени острой РТПХ использовали критерии H. Glucksberg и соавт. [6], основанные на клинических признаках острой РТПХ. В настоящем исследовании диагноз острой РТПХ с поражением кишечника также устанавливался согласно этим критериям, т.е. только на основании клинической картины (объем стула за сутки >500 мл), после исключения других причин диареи (герпесвирусной инфекции; колит, ассоциированный с Clostridium difficile; токсический энтероколит). Определение токсина Clostridium difficile в кале проводилось иммуноферментным методом (R Biopharm, Германия). Для определения ДНК гер- песвирусов в кале и крови методом полимеразной цепной реакции (ПЦР) использовался набор реагентов «АмплиСенс EBV/CMV/HHV6-cкрин-FL» («Интерлаб сервис», Россия). Все исследования выполнялись одновременно.
Диагноз цитомегаловирусного (ЦМВ) колита устанавливали на основании выявления ДНК ЦМВ методом ПЦР, проведенной с образцами стула и/или крови. При отрицательных результатах указанных выше исследований и при регрессе диареи без проведения дополнительной иммуносупрессивной терапии считали, что диарея вызвана токсичностью.
Согласно современным рекомендациям, результаты биопсии и эндоскопического исследования пораженного органа не входят в диагностические критерии РТПХ [6, 14], более того, рекомендуется не учитывать результаты биопсии для диагностики РТПХ [15]. Несмотря на это, у 28 больных была выполнена биопсия кожи (при сочетанном поражении кожи и кишечника) или слизистой одного из участков желудочно-кишечного тракта (двенадцатиперстной кишки, толстой кишки, прямой кишки). Однако, учитывая, что гистологическая диагностика РТПХ с поражением кишечника сложна и не являлась целью данной работы, результаты биопсии пораженных органов в работе не представлены и не обсуждаются.
УЗИ
УЗИ было выполнено в течение 72 ч от момента возникновения диареи объемом более 500 мл/сут. Все больные на момент исследования не употребляли пищу или воду в течение нескольких дней. УЗИ с целью оценки толщины стенок кишечника было выполнено с использованием конвексного датчика с частотой 2,5—5 МГц на аппарате Aloka, Alfa 10 (Япония) в положении больного лежа на спине. Толщину стенок различных участков гастроинтестинального тракта (тонкой, слепой, восходящего, поперечного и нисходящего отделов толстой кишки) оценивали по методу, описанному Н.Р. Haber и соавт. [12]. Ультразвуковые изображения тонкой кишки и восходящего отдела толстой кишки у больного из контрольной группы и у больного с диареей вследствие острой РТПХ представлены на рисунках 1 и 2. Поскольку была поставлена задача разработки универсального диагностического маркера РТПХ с поражением кишечника, который может быть выражен количественно, не учитывались такие параметры, как толщина отдельных слоев, четкость/ нечеткость границ между ними, цветное доплеровское сканирование, ввиду их низкой специфичности.
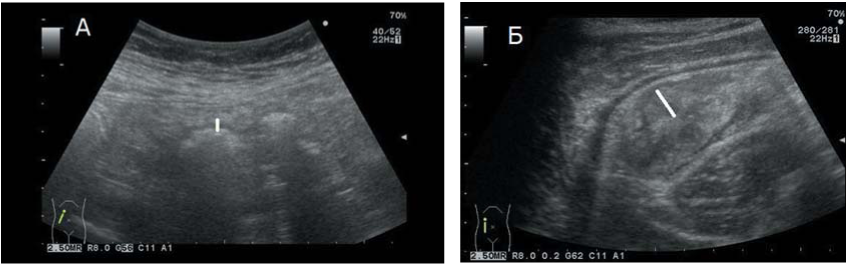
Рисунок 1. Восходящий отдел ободочной кишки: А — нормальная толщина стенок; Б — больной с диареей, обусловленной РТПХ
Figure 1. Ascending colon: А — normal wall thickness; Б — patients with diarrhoea caused by acute GvHD

Рисунок 2. Тонкая кишка: А — нормальная толщина стенок; Б — больной с диареей, не связанной с РТПХ
Figure 2. Small intestine: А — normal wall thickness; Б — patients with diarrhoea not related to GvHD
Статистический анализ. Анализ данных проводили с использованием R версии 3.5.2 (Core Team, 2018). Для проверки нормальности распределения исследуемых выборок был использован критерий Шапиро—Уилка. Учитывая распределение, отличное от нормального (тест Шапиро—Уилка, р = 0.0001), в дальнейшем для оценки различий между двумя независимыми выборками был использован Н-критерий Манна—Уитни, для оценки трех и более — критерий Краскела—Уоллиса. Для анализа таблиц сопряженности использовали критерий хи-квадрат. При анализе таблиц 2x2 был использован точный тест Фишера. Диагностическую значимость метода оценивали по ROC-кривой. ROC-анализ также использовали для оценки чувствительности и специфичности УЗИ. Использованы также методы описательной статистики. Порог статистической значимости р принят равным 0,05.
Результаты
Группы больных были сбалансированы по таким исследованным признакам, как пол, возраст, диагноз, характеристика донора, режим кондиционирования, источник трансплантата и объем диареи.
С целью исключения влияния на толщину стенки кишки таких факторов, как режим кондиционирования и источник трансплантата, было оценено влияние этих факторов в контрольной группе. Связи между толщиной стенки кишечника, определяемой методом УЗИ, и этими факторами не найдено (р > 0,05).
Все больные после верификации причины диареи были разделены на три группы. В первую группу были включены больные, у которых причиной диареи была острая РТПХ с поражением кишечника (п = 29). Медиана времени диагностики острой РТПХ от момента трансплантации составила 74 (15—272) дня. Распределение по стадиям острой РТПХ было следующим: стадия 1 (500—1000 мл/сут) — 58,6 % (n = 17), стадия 2 (1000—1500 мл/сут) — 17,2 % (п = 5), стадия 3 (1500—2000 мл/сут) — 10,3 % (п = 3) и стадия 4 (2000 мл/сут и более) — 13,8 % (п = 4). Помимо развития у больных клинической картины острой РТПХ с поражением кишечника, у 8 (27,6 %) из них была вовлечена также кожа, у 17,2 % (п = 5) — печень. У 16 (55,2 %) из 29 больных из группы острой РТПХ с поражением кишечника был поражен только кишечник, у 7 больных РТПХ с поражением кишечника дебютировала после трансфузии лимфоцитов доноров, которая была выполнена в связи со смешанным химеризмом, что объясняет поздние сроки диагностики острой РТПХ.
Во вторую группу были включены 11 больных с диареей, не связанной с РТПХ. В этой группе у 2 больных диарея возникла вследствие ЦМВ колита, что было верифицировано с помощью обнаружения ДНК ЦМВ методом ПЦР, проведенной с образцами кала и/или крови; у 8 больных диарея была обусловлена предшествующими режимами кондиционирования. У них ПЦР исследование не выявило ДНК вирусов группы герпеса. Токсин Clostridium difficile выявлен также не был. Диарея у этих больных регрессировала без проведения дополнительной иммуносупрессив- ной терапии.
Для определения зависимости между объемом диареи и толщиной стенки различных участков кишечника в различных анализируемых группах была построена диаграмма рассеяния. Диаграммы рассеяния между толщиной различных участков кишечника и объемом стула в различных анализируемых группах представлены на рисунке 3.
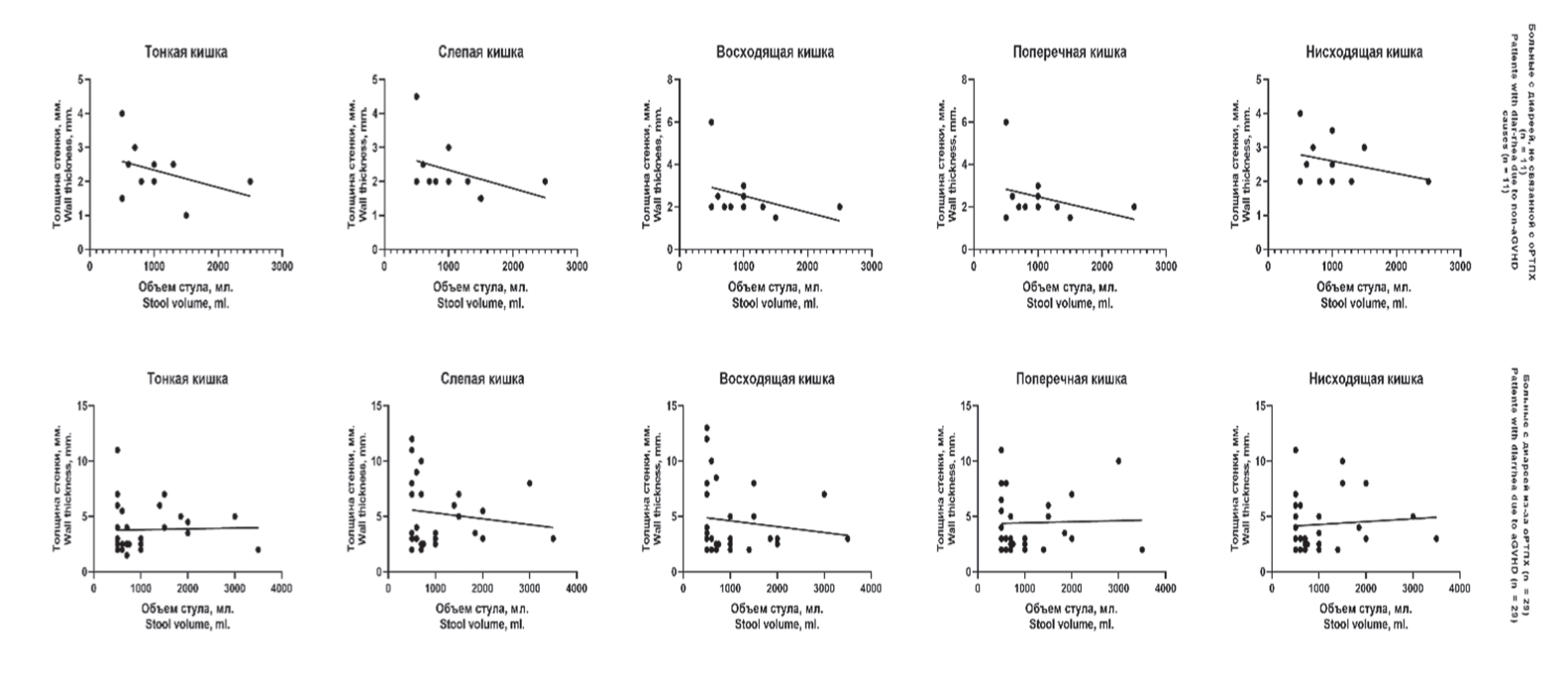
Рисунок 3. Зависимость между объемом диареи и толщиной стенки различных участков кишечника в различных группах больных
Figure 3. Correlation between the volume of diarrhoea and the wall thickness of different intestinal sections in different patient groups
Для анализа зависимости между объемом стула и толщиной стенки кишечника в различных отделах был выполнен корреляционный анализ. Результаты для больных с диареей объемом >500 мл/сут в зависимости от причины представлены на рисунке 4.
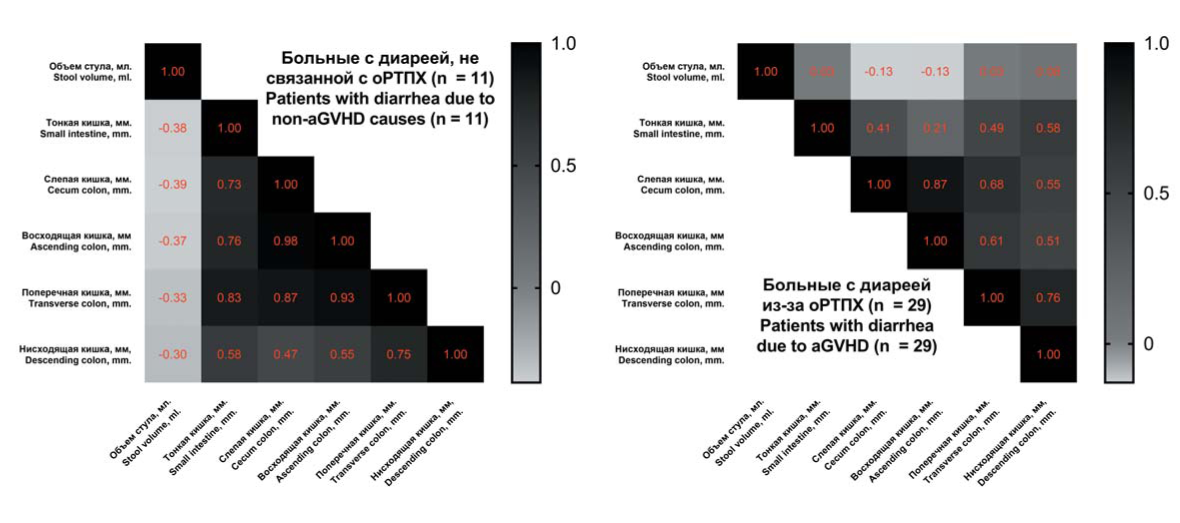
Рисунок 4. Коэффициенты корреляции между объемом стула и толщиной стенки кишечника у больных с диареей после алло-ТГСК. Цифрами отображены коэффициенты корреляции
Figure 4. Correlation coefficients between stool volume and intestinal wall thickness for patients after allo-HSCT with diarrhoea. The numbers show the correlation coefficients
Не найдено корреляции между толщиной стенки различных участков кишечника и объемом диареи (р > 0,05). Выявлено, что утолщение стенок кишечника при возникновении диареи после алло-ТГСК не зависело от ее причины и носило распространенный характер, т.е. имелась прямая корреляция между толщиной стенок различных участков кишечника (с увеличением толщины стенки одного отдела кишки происходило увеличение толщины стенки и в остальных).
Влияние острой РТПХ на толщину стенки кишечника
Толщина стенки всех отделов кишечника у больных с острой РТПХ была значимо больше по сравнению с таковой у больных из контрольной группы, у которых были нормальные значения показателей толщины стенки различных участков гастроинтестинального тракта, а также у больных с диареей другого неиммунного генеза (табл. 2).
Таблица 2. Результаты измерения толщины стенки различных участков кишечника у больных с диареей и без нее. Данные представлены в виде медианы, минимального и максимального значения
Table 2. Results of measuring wall thickness in different parts of the intestine in patients with and without diarrhoea. The data is presented as a median (range). Significant differences are marked by an asterisk
Толщина стенки Wall thickness | Больные с диареей вследствие острой РТПХ (п = 29) Patients with diarrhoea caused by acute GvHD (n = 29) | Больные с диареей, не связанной с острой РТПХ (п = 11) Patients with diarrhoea not related to acute GvHD (п=11) | Контрольная группа (п = 10) Control group (п = 10) | р |
|---|---|---|---|---|
Тонкая кишка, мм Small intestine, mm | 3 (1,5-11) | 2,5 (1-4) | 2 (2-3) | 0,008* |
Слепая кишка, мм Caecum, mm | 3,5 (2-12) | 2 (1,5-4,5) | 2 (2-3) | 0,001* |
Восходящая кишка, мм Ascending colon, mm | 3 (2-13) | 2 (1,5-6) | 2 (2-3) | 0,002* |
Поперечная кишка, мм Transverse colon, mm | 3(2-11) | 2 (1,5-6) | 2 (2-3) | 0,001* |
Нисходящая кишка, мм Descending colon, mm | 3 (2-11) | 2,5 (2-4) | 2 (2-3) | 0,002* |
Примечание. * — р < 0,05.
Note. * — р < 0.05.
ROC-анализ
Был выполнен ROC-анализ для оценки возможности использования УЗИ толщины стенки кишечника как метода верификации причины диареи у больных после ал- ло-ТГСК (п = 40). Площадь под кривой (AUC) с 95 % доверительным интервалом для тонкой, слепой, восходящей, поперечной и нисходящих отделов кишечника составила: 0,74 (0,59-0,9); 0,87 (0,76-0,99); 0,77 (0,61-0,93); 0,8 (0,640,95); 0,72 (0,56-0,88) соответственно. Изображение ROC-кривой представлено на рисунке 5.
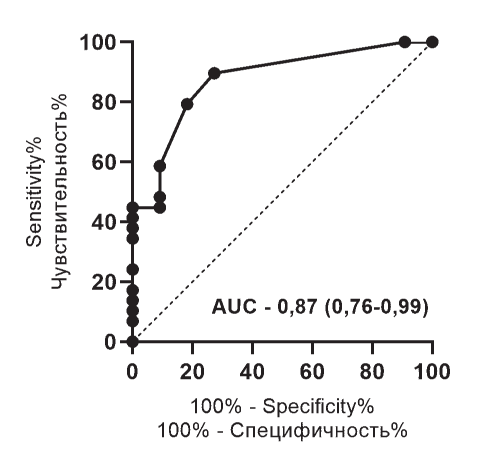
Рисунок 5. ROC-кривая для предсказания острой РТПХ с поражением кишечника на основании толщины стенки слепой кишки
Figure 5. ROC curve for predicting acute intestinal GvHD on the basis of the wall thickness of the caecum
Результаты ROC-анализа показали, что при ультразвуковом измерении толщины стенки слепой кишки показатель 3,25 мм (чувствительность — 79,31 %; специфичность — 81,82 %) может быть использован для проведения дифференциальной диагностики диареи у больных после алло-ТГСК, а именно диареи вследствие острой РТПХ с поражением кишечника от диареи другой этиологии.
Обсуждение
В патогенезе острой РТПХ выделяют несколько этапов: активация Т-клеток, их пролиферация, миграция в органы-мишени и реализация своего цитотоксического потенциала. Один из них — миграция Т-клеток в органы-мишени, что вызывает локальное повреждение и отек тканей [16]. Миграция Т-клеток в кишечник и повреждение тканей приводит к развитию массивного отека стенки кишки, который может быть визуализирован с помощью инструментальных методов диагностики. В начале 2000-х годов велись исследования по использованию компьютерной томографии (КТ) для диагностики острой РТПХ с поражением кишечника [17, 18]. По данным I.D.C. Kirkpatrick и соавт. [18], при проведении КТ исследования у больных с острой РТПХ с поражением кишечника в 89 % случаев отмечено контрастное усиление стенки кишечника. Сообщалось, что для острой РТПХ характерно утолщение стенок кишечника в среднем до 5 мм. Однако исследователи не выявили значимых различий между результатами КТ кишечника при его поражении РТПХ и неиммунными причинами [18]. Одним из недостатков метода КТ по сравнению с предлагаемым в настоящей работе является ограниченность его воспроизводимости и трудности проведения перорального контрастирования у больных с диареей. По этим причинам метод КТ так и не нашел широкого применения в диагностике острой РТПХ с поражением кишечника.
Другой попыткой неинвазивной диагностики острой РТПХ с поражением кишечника стало использование позитронно-эмиссионной томографии (ПЭТ) с фтор- дезоксиглюкозой. M. Stelljes и соавт. [16] показали сначала на мышах, а потом и в исследованиях на больных, что при проведении ПЭТ у больных с острой РТПХ фтордезоксиглюкоза активно включается в ткани кишечника. Это аномальное включение фтордезоксиглюкозы было отмечено в 82 % случаев острой РТПХ с поражением кишечника, в то время как у больных без РТПХ такого не наблюдалось. С. Bodet-Milin и соавт. [19] использовали этот феномен в качестве предиктора развития РТПХ с поражением кишечника, при этом чувствительность метода составила 81 %, специфичность — 90 %. Однако этот способ не может рассматриваться как общедоступный метод диагностики поражения кишечника в рамках РТПХ у больных, перенесших алло-ТГСК.
В настоящее время УЗИ является недорогим и широко используемым методом диагностики различных воспалительных заболеваний кишечника [9, 10]. Отсутствие лучевой нагрузки, что важно у больных гемобластозами, особенно детей, низкая себестоимость и повсеместная доступность являются несомненными преимуществами УЗИ и делают его крайне привлекательным для применения в трансплантационных центрах.
В настоящем исследовании показано, что УЗИ желудочно-кишечного тракта может быть одним из основных методов диагностики острой РТПХ с поражением кишечника. Важным является тот факт, что пол и возраст не влияли на толщину стенки кишечника [20]. Выявлены достоверные различия в толщине стенки кишечника у больных после алло-ТГСК без РТПХ с поражением кишечника и у больных с острой РТПХ кишечника (р < 0,05). Схожие результаты, но на меньшей выборке больных и без указания границы отсечки (cut-off) были получены работе Е. Calabrese и соавт. [13]. В работе C. Gorg и соавт. [21] была выявлена корреляция между стадиями острой РТПХ, оцененной по объему диареи, и толщиной стенки кишечника. В настоящем исследовании такой взаимосвязи не было выявлено, что можно объяснить лишь низкой статистической мощностью исследования немецких авторов [21].
Высокая чувствительность и специфичность оценки толщины стенки слепой кишки с помощью УЗИ как маркера острой РТПХ с поражением кишечника, которые были установлены в настоящей работе, описаны в работе S.A. Klein и соавт. [22]. Другие параметры, а именно результаты цветного доплеровского сканирования, по данным тех же авторов, являются малоспецифичными и не могут быть использованы как основа для разработки диагностического маркера [22]. Эти же авторы впервые обратили внимание на илеоцекальный регион как «зону интереса» у больных с острой РТПХ с порождением кишечника. По данным настоящего исследования, толщина стенки кишки более 3,25 мм в этой области может быть использована для дифференциальной диагностики между диареей при острой РТПХ с поражением кишечника и диареей другого генеза. По данным D. Weber и соавт. [23], толщина более 3 мм также рассматривалась как критерий острой РТПХ с поражением кишечника, однако с целью повышения чувствительности и специфичности методики были дополнительно использованы эластография, УЗИ с контрастированием, а также различные сывороточные биомаркеры. Это позволило достичь 100 % чувствительности и 100 % специфичности. Однако комбинация многочисленных методик и исследуемых параметров лишает УЗИ главного преимущества — простоты и доступности.
Исследование различных аспектов острой РТПХ с поражением кишечника всегда затрудняется тем, что, несмотря на высокую частоту развития диареи у больных после алло-ТГСК, сложно найти группу сравнения для больных с острой РТПХ с поражением кишечника. Включение в анализ больных с диареей менее 500 мл/сут и тех, у кого диарея развилась сразу после алло-ТГСК, неоправданно, так как в этих клинических ситуациях сложно заподозрить РТПХ. Такие же сложности возникают при включении в группу сравнения больных с клостридиальными колитами, так как у них в воспалительный процесс вовлекается только толстая кишка. При острой РТПХ с поражением кишечника, как правило, процесс носит генерализованный характер. Именно это, по всей видимости, и объясняет крайне малые группы сравнения практически во всех работах по изучению острой РТПХ кишечника.
Таким образом, дифференциальный диагноз острой РТПХ с поражением кишечника часто является непростой задачей для каждого трансплантационного центра. В предлагаемом методе УЗИ кишечника у больных с острой РТПХ с подозрением на поражение кишечника толщина стенки слепой кишки может рассматриваться как диагностический маркер. Метод, несмотря на простоту и доступность, обладает достаточной чувствительностью и специфичностью, что позволяет его использовать в клинической практике.
Список литературы
1. Passweg J.R., Baldomero H., Bader P. et al. Hematopoietic stem cell transplantation in Europe 2014: more than 40 000 transplants annually. Bone Marrow Transplant. 2016; 51(6): 786–92. DOI: 10.1038/bmt.2016.20
2. Gratwohl A., Hermans J., Apperley J. et al. Acute graft-versus-host disease: grade and outcome in patients with chronic myelogenous leukemia. Working Party Chronic Leukemia of the European Group for Blood and Marrow Transplantation. Blood. 1995; 86(2): 813–8.
3. Shokouhi S., Bray S., Bakhtiyari S. et al. Effects of aGVHD and cGVHD on Survival Rate in Patients with Acute Myeloid Leukemia after Allogeneic Stem Cell Transplantation. Int. J. Hematol Stem Cell Res. 2015; 9(3): 112–21.
4. Khoury H.J., Wang T., Hemmer M.T. et al. Improved survival after acute graftversus-host disease diagnosis in the modern era. Haematologica. 2017; 102(5): 958–66. DOI: 10.3324/haematol.2016.156356
5. Castilla-Llorente C., Martin P.J., McDonald G.B. et al. Prognostic factors and outcomes of severe gastrointestinal GVHD after allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2014; 49(7): 966–71. DOI: 10.1038/bmt.2014.69
6. Glucksberg H., Storb R., Fefer A. et al. Clinical manifestations of graft-versushost disease in human recipients of marrow from HL-A-matched sibling donors. Transplantation. 1974; 18(4): 295–304.
7. Martino R., Romero P., Subirá M. et al. Comparison of the classic Glucksberg criteria and the IBMTR Severity Index for grading acute graft-versus-host disease following HLA-identical sibling stem cell transplantation. Bone Marrow Transplant. 1999; 24(3): 283–7. DOI: 10.1038/sj.bmt.1701899
8. Rowlings P., Przepiorka D., Klein J.P. et al. IBMTR Severity Index for grading acute graft-versus-host disease: retrospective comparison with Glucksberg grade. Br. J. Haematol. 1997; 97: 855–64.
9. Самсонова Т.В. Орлова ЛП. Ультразвуковая семиотика болезни крона тонкой кишки. Колопроктология. 2014; 1(47): 60–8.
10. Пыков М.И., Галкина Я.А, Дёмина А.М. Ультразвуковые критерии дифференциальной диагностики воспалительных заболеваний кишечника у детей. Колопроктология. 2017; 0(2S): 37–48.
11. Calabrese E. Bowel ultrasound for the assessment of Crohn’s disease. Gastroenterol. Hepatol. (N Y). 2011; 7(2): 107–9.
12. Haber H.P., Benda N., Fitzke G. et al. Colonic wall thickness measured by ultrasound: striking differences in patients with cystic fi brosis versus healthy controls. Gut. 1997; 40(3): 406–11.
13. Calabrese E., Zorzi F., Visconti E. et al. Bowel ultrasonography as an aid for diagnosis of intestinal acute graft-versus-host-disease after allogeneic haematopoietic stem cell transplantation. Dig. Liver Dis. 2013; 45(11): 899–904. DOI: 10.1016/j.dld.2013.04.004
14. Przepiorka D., Weisdorf D., Martin P. et al. 1994 Consensus Conference on Acute GVHD Grading. Bone Marrow Transplant. 1995; 15(6): 825–8.
15. Dignan F.L., Clark A., Amrolia P. et al. Diagnosis and management of acute graft-versus-host disease. Br. J. Haematol. 2012; 158(1): 30–45. DOI: 10.1111/j.1365-2141.2012.09129.x
16. Stelljes M., Hermann S., Albring J. et al. Clinical molecular imaging in intestinal graft-versus-host disease: mapping of disease activity, prediction, and monitoring of treatment effi ciency by positron emission tomography. Blood. 2008; 111(5): 2909–18. DOI: 10.1182/blood-2007-10-119164
17. Jones B., Fishman E., Kramer S. et al. Computed tomography of gastrointestinal infl ammation after bone marrow transplantation. Am. J. Roentgenol. 1986; 146(4): 691–5. DOI: 10.2214/ajr.146.4.691
18. Kirkpatrick I.D.C., Greenberg H.M. Gastrointestinal Complications in the Neutropenic Patient: Characterization and Differentiation with Abdominal CT. Radiology. 2003; 226(3): 668–74. DOI: 10.1148/radiol.2263011932
19. Bodet-Milin C., Lacombe M., Malard F. et al. 18F-FDG PET/CT for the assessment of gastrointestinal GVHD: results of a pilot study. Bone Marrow Transplant. 2014; 49(1): 131–7. DOI: 10.1038/bmt.2013.144
20. Haber H.P., Stern M. Intestinal ultrasonography in children and young adults: bowel wall thickness is age dependent. J. Ultrasound Med. 2000; 19(5): 315–21. DOI: 10.7863/jum.2000.19.5.315
21. Gorg C., Wollenberg B., Beyer J. et al. High-resolution ultrasonography in gastrointestinal graft-versus-host disease. Ann. Hematol. 2005; 84(1): 33–9. DOI: 10.1007/s00277-004-0893-4
22. Klein S.A., Martin H., Schreiber-Dietrich D. et al. A new approach to evaluating intestinal acute graft-versus-host disease by transabdominal sonography and colour Doppler imaging. Br. J. Haematol. 2001; 115(4): 929–34. DOI: 10.1046/j.1365-2141.2001.03221.x
23. Weber D., Weber M., Hippe K. et al. Non-invasive diagnosis of acute intestinal graft-versus-host disease by a new scoring system using ultrasound morphology, compound elastography, and contrast-enhanced ultrasound. Bone Marrow Transplant. 2019; 54(7): 1038–48. DOI: 10.1038/s41409-018-0381-4
Об авторах
М. Ю. ДроковРоссия
Дроков Михаил Юрьевич, кандидат медицинских наук, научный сотрудник отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным и дневным стационарами в составе отдела химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга
Д. С. Дубняк
Россия
Дубняк Дарья Станиславовна, врач-гематолог отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным и дневным стационарами
Г. А. Яцык
Россия
Яцык Галина Александровна, кандидат медицинских наук, врач-рентгенолог, заведующий отделением магнитно-резонансной томографии и ультразвуковой диагностики
А. В. Киреева
Россия
Киреева Анна Аркадьевна, врач ультразвуковой диагностики отделения магнитно-резонансной томографии и ультразвуковой диагностики
О. В. Пырикова
Россия
Пырикова Ольга Викторовна, врач ультразвуковой диагностики отделения магнитно-резонансной томографии и ультразвуковой диагностики
Л. А. Кузьмина
Россия
Кузьмина Лариса Анатольевна, кандидат медицинских наук, заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным и дневным стационарами
Н. Н. Попова
Россия
Попова Наталья Николаевна, врач-гематолог отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным и дневным стационарами
В. А. Васильева
Россия
Васильева Вера Алексеевна, кандидат медицинских наук, научный сотрудник сектора по изучению иммунных воздействий и осложнений после ТКМ
У. В. Масликова
Россия
Масликова Ульяна Владиславовна, клинический ординатор
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, руководитель отдела химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга
Рецензия
Для цитирования:
Дроков М.Ю., Дубняк Д.С., Яцык Г.А., Киреева А.В., Пырикова О.В., Кузьмина Л.А., Попова Н.Н., Васильева В.А., Масликова У.В., Паровичникова Е.Н. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ТОЛЩИНЫ СТЕНКИ КИШЕЧНИКА У БОЛЬНЫХ ОСТРОЙ РЕАКЦИЕЙ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА» С ПОРАЖЕНИЕМ КИШЕЧНИКА. Гематология и трансфузиология. 2019;64(4):412–423. https://doi.org/10.35754/0234-5730-2019-64-4-412-423
For citation:
Drokov M.Yu., Dubnyak D.S., Yatsyk G.A., Kireeva A.A., Pyrikova O.V., Kuzmina L.A., Popova N.N., Vasilyeva V.A., Maslikova U.V., Parovichnikova E.N. ULTRASOUND EXAMINATION OF BOWEL WALL THICKNESS IN PATIENTS WITH ACUTE INTESTINAL GRAFT-VERSUS-HOST DISEASE. Russian journal of hematology and transfusiology. 2019;64(4):412–423. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-412-423











































