Перейти к:
ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ ПЕРВИЧНОЙ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ПРОМЕЖУТОЧНЫЕ РЕЗУЛЬТАТЫ ПРОТОКОЛА CNS-2015
https://doi.org/10.35754/0234-5730-2019-64-4-447-461
Аннотация
Введение. Основой индукционной химиотерапии (ХТ) первичной диффузной В-крупноклеточной лимфомы центральной нервной системы (ПДВККЛ ЦНС) является применение метотрексата в высоких дозах. Оптимальной стратегией консолидации является высокодозная ХТ с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (ауто-ТГСК). Наиболее эффективным режимом кондиционирования являются комбинации химиопрепаратов с включением тиотепы.
Цель: предоставить собственный опыт применения ауто-ТГСК/TBC у больных ПДВККЛ ЦНС.
Методы. С 2015 по 2019 г. в проспективное исследование CNS-2015 было включено 20 больных в возрасте от 20 до 52 лет (медиана 42 года). Соотношение мужчины/женщины = 13/7. Соматический статус у 17 (85 %) больных соответствовал 0–1 баллу по шкале ECOG и только у 3 (15 %) — 4 баллам. Согласно критериям прогностической системы MSKCC, 18 (90 %) больных были отнесены к группе низкого риска и 2 (10 %) больных — к группе среднего риска.
Результаты. Всем больным, включенным в исследование, было проведено 3–5 циклов ХТ с метотрексатом в высоких дозах, винкристином, прокарбазином и ритуксимабом (R-MPV) и выполнена ауто-ТГСК с режимом кондиционирования TBC (тиотепа, бусульфан, циклофосфамид). Перед началом ауто-ТГСК у 15 их 20 больных, у которых полностью завершили индукционную ХТ, была достигнута полная ремиссия, а у 5 — частичная ремиссия. У 5 больных с исходным частичным ответом после ауто-ТГСК удалось достичь полной ремиссии. Всем больным проводилась поддерживающая терапия темозоломидом в течение 2 лет. При медиане наблюдения 17 (1–46) месяцев 18 больных живы и находятся в ремиссии заболевания. Двое больных, у которых развился рецидив заболевания (+4 и +5 месяцы после ауто-ТГСК) и не было ответа на вторую линию ХТ и лучевую терапию, умерли через 24 и 26 месяцев после ауто-ТГСК.
Заключение. Режим R-MPV является эффективным методом лечения больных ПДВККЛ ЦНС, не сопровождающийся тяжелой токсичностью. Применение высокодозной ХТ по программе TBC позволяет достичь высокой частоты ремиссий, при этом смертность, связанная с лечением, в группе больных, включенных в протокол, была равна 0 %.
Ключевые слова
Для цитирования:
Звонков Е.Е., Королева Д.А., Габеева Н.Г., Гаврилина О.А., Федорова С.Ю., Губкин А.В., Ковригина А.М., Яцык Г.А., Клясова Г.А., Савенко Т.А., Савченко В.Г. ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ ПЕРВИЧНОЙ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ПРОМЕЖУТОЧНЫЕ РЕЗУЛЬТАТЫ ПРОТОКОЛА CNS-2015. Гематология и трансфузиология. 2019;64(4):447–461. https://doi.org/10.35754/0234-5730-2019-64-4-447-461
For citation:
Zvonkov E.E., Koroleva D.A., Gabeeva N.G., Gavrilina O.A., Fedorova S.Yu., Gubkin A.V., Kovrigina A.M., Yatsyk G.A., Klyasova G.A., Savenko T.A., Savchenko V.G. HIGH-DOSE CHEMOTHERAPY FOR PRIMARY DIFFUSE LARGE B-CELL LYMPHOMA OF THE CENTRAL NERVOUS SYSTEM. INTERIM RESULTS OF THE CNS-2015 PROTOCOL. Russian journal of hematology and transfusiology. 2019;64(4):447–461. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-447-461
Введение
Первичная диффузная В-крупноклеточная лимфома центральной нервной системы (ПДВККЛ ЦНС) составляет от 1 до 3 % всех лимфом и не более 3 % всех опухолей головного мозга [1—5]. Медиана возраста больных на момент установления диагноза составляет 65 лет. Редкая встречаемость, особенности первичной локализации, агрессивное клиническое течение ПДВККЛ ЦНС создают объективные сложности диагностики и лечения. Длительное время считалось, что в основе химиорезистентности этой опухоли лежит ее уникальная локализация, а все химиотерапевтические подходы были связаны с преодолением гематоэнцефалического барьера (ГЭБ). Многочисленные попытки применения химиотерапии (ХТ) с максимальным набором цитостатических препаратов, способных преодолеть ГЭБ, не привели к существенному успеху [1, 2, 4—10]. Рецидивы заболевания, возникающие как в ранние сроки после ХТ, так и через несколько лет после ее окончания, выделяли ПДВККЛ ЦНС среди других форм диффузной В-крупноклеточной лимфомы (ДВККЛ). На протяжении последних лет, благодаря морфологическим, иммуногистохимическим, кариологическим и молекулярно-генетическим исследованиям, были выявлены уникальные биологические особенности ПДВККЛ ЦНС, радикально отличающие ее от других нодальных и экстранодальных форм ДВККЛ [11—22]. Факты, полученные при изучении нейроиммунологических свойств опухоли, также изменили стереотипное понимание «иммунопривилегированности» ПДВККЛ ЦНС. Стало понятным, что ГЭБ в условиях опухолевого поражения не является существенной «преградой» не только для большинства цитостатических препаратов, но и моноклональных антител [23], «малых молекул» [24] Т-клеток с химерным антигенным рецептором (CAR-T клетки) [25], что существенно изменило тактику лечения ПДВККЛ ЦНС.
Улучшить показатели безрецидивной (БРВ) и общей выживаемости (ОВ) ПДВККЛ ЦНС удалось после введения в протоколы лечения миелоаблативных режимов кондиционирования, включающего в себя высокие дозы тиофосфамида, бусульфана и циклофосфамида (ТВС режим) с последующей трансплантацией аутологичных гемопоэтических стволовых клеток крови (ауто-ТГСК) [26—33].
Изменилась тактика индукционной терапии ПДВККЛ ЦНС, целью которой стало не достижение длительной ремиссии за счет интенсификации химиотерапевтического воздействия, а максимально быстрая кинетическая редукция опухоли, восстановление неврологического статуса и возможность заготовить достаточное количество стволовых клеток крови (СКК) [26].
А. Omuro и соавт. [26] из Memorial Sloan Kettering Cancer Center удалось объединить эти новые терапевтические подходы в одном протоколе и достигнуть показателей БРВ и ОВ ПДВККЛ ЦНС, сопоставимых с таковыми при других экстранодальных диффузных В-крупноклеточных лимфомах (ДВККЛ). Авторами [26] было показано, что достижение 97 % общего ответа и 66 % полных ремиссий (ПР) у 32 больных ПДВККЛ ЦНС возможно на относительно нетоксичной четырехкомпонентной терапии (схема R-MPV — ритуксимаб, высокие дозы метотрексата, прокарбазин, винкристин). Эффективность терапии зависела не от способности этих препаратов, прежде всего ритуксимаба и винкристина, преодолевать ГЭБ, а скорее от кинетической противоопухолевой активности данной схемы. Применение высоких доз тиофосфамида, бусульфана, циклофосфамида (режим ТВС) позволило добиться 81 % пятилетней БРВ в общей группе и 100 % БРВ у 11 больных моложе 50 лет. Однако даже такая двухэтапная тактика не исключает развития рецидива примерно у 20 % больных. Многими авторами [34—36] обсуждается рациональность проведения поддерживающей терапии ПДВККЛ ЦНС (темозоломид, леналидомид, ниволумаб, ибрутиниб), однако утвержденных протоколов пока не разработано. J. Glass и соавт. [36] показали преимущества поддерживающей терапии темозоломидом у больных ПДВККЛ ЦНС после индукционного этапа, однако эффективность такого подхода после высокодозной ХТ не изучена.
Целью данной работы была проспективная оценка эффективности и токсичности высокодозной ХТ (R-MPV + ауто-ТГСК/ТВС) с последующей двухлетней поддерживающей терапией темозоломидом у больных ПДВККЛ ЦНС моложе 60 лет (протокол CNS- 2015) [4].
Материалы и методы
В период с июля 2015 г. по май 2019 г. в ФГБУ «НМИЦ гематологии» Минздрава России в проспективное исследование CNS-2015 было включено 20 больных с впервые установленным диагнозом ПДВККЛ ЦНС: 7 (35 %) женщин и 13 (65 %) мужчин. Медиана возраста на момент установления диагноза составила 42 года (20—62 года). Соматический статус у 17 (85 %) больных соответствовал 0—1 баллу по шкале ECOG и только у 3 (15 %) — 4 баллам [37]. Согласно критериям прогностической системы MSKCC [26], 18 (90 %) больных были отнесены к группе низкого риска и 2 (10 %) больных — к группе среднего риска. Характеристики больных представлены в таблице 1.
Таблица 1. Характеристики больных (n = 20)
Table 1. Patient characteristics (n = 20)

Для установления диагноза больным выполнялись стереотаксическая биопсия (п = 10) и хирургическое удаление опухоли (п = 10).
Протокол CNS-2015 был утвержден локальным этическим комитетом ФГБУ «НМИЦ гематологии» Минздрава России. Больные включались в протокол при наличии впервые установленного диагноза ПДВККЛ ЦНС, подтвержденного результатами гистологического и иммуногистохимического исследований биоптата опухоли. К другим критериям включения были отнесены возраст от 18 до 60 лет, фракция сердечного выброса >50 %, клиренс эндогенного креатинина >50 мл/мин, концентрация общего билирубина <20 мкмоль/л, негативные тесты на ВИЧ, отсутствие очагов поражения вне ЦНС, тяжелых инфекционных осложнений, психических расстройств, второго активного опухолевого процесса и предшествующей длительной терапии глюкокортикостероидными препаратами [4]. Двое из 20 больных, включенных в исследование, не соответствовали критериям включения: один больной в возрасте 62 лет был включен в протокол с учетом отсутствия коморбидности и одна больная — после предшествующей ХТ: ей было проведено два курса R-CHOP.
Всеми больными было подписано добровольное информированное согласие на включение в исследовательский протокол лечения.
При гистологическом и иммуногистохимическом исследованиях биоптатов опухолей все случаи были отнесены к non-GCB — иммуногистохимическому варианту ДВККЛ с высокой пролиферативной активностью по экспрессии Ki-67.
С целью исключения вторичного характера поражения ЦНС всем больным было проведено обследование, включавшее трепанобиопсию костного мозга, иммуно- химическое исследование сыворотки крови и мочи, компьютерную томографию (КТ) органов грудной клетки, брюшной полости и малого таза, магнитнорезонансную томографию (МРТ) головного мозга, ультразвуковое исследование органов мошонки (для мужчин), фиброгастродуоденоскопию. В результате проведенного обследования признаков опухолевой инфильтрации оболочек мозга, поражения спинного мозга выявлено не было. Офтальмологическое исследование было проведено у 16 больных, признаков специфической инфильтрации задних камер глаза не выявлено ни в одном случае. По данным МРТ головного мозга перед выполнением оперативного вмешательства у 10 (50 %) из 20 больных было выявлено более двух опухолевых очагов (рис. 1). У 2 из 10 больных с единичным опухолевым очагом выявлено поражение ствола головного мозга (рис. 2). Одному больному в связи с развитием внутричерепной гипертензии вследствие прорастания опухолью правого бокового желудочка и нарушения ликвородинамики выполнено вентрикулоцистернальное шунтирование по Торкильдсену.

Рисунок 1. Больная М. 52 г. МРТ головного мозга с в/в контрастным усилением (мультифокальное поражение ЦНС)
Figure 1. Patient M., 52 years old. Brain MRI with intravenous contrast enhancement (multiple foci of lymphomaj
Примечание. а) срез на уровне боковых желудочков; б) срез на уровне четверохолмия; в) срез на уровне мозжечка.
Note. a) slice at the level of the lateral ventricles; 6) slice at the level of the quadrigeminal bodies; в) slice at the level of the cerebellum.

Рисунок 2. Больная К. 41 г. Лимфома ЦНС, поражение стволовых структур мозга, МРТ головного мозга ИП Т2 FLAIR; с в/в контрастным усилением
Figure 2. Patient K., 41 years old. CNS lymphoma, lesion of brain stem structures, brain MRI, T2-FLAIR PS; with intravenous contrast enhancement
Примечание. а) ИП Т2FLAIR, очаг в продолговатом мозге справа; б) слабоинтенсивное постконтрастное усиление. ИП — импульсная последовательность. МРТ — магнитно-резонансная томография.
Note. a) T2-FLAIR PS, lesion in the medulla oblongata, on the right; 6) low-intensity post-contrast enhancement. PS — pulse sequence. MRI — magnetic resonance imaging.
Исследование ликвора было возможным провести только у 12 из 20 больных. Лишь у 1 больной в ликворе при нормальном цитозе методом проточной флуориметрии было обнаружено 10 % В-лимфоцитов с опухолевым иммунофенотипом. Всем 12 больным с профилактической целью было выполнено интратекальное введение трех цитостатических препаратов (дексаметазон 4 мг, метотрексат 15 мг, цитарабин 30 мг) [4]. Остальным 8 больным в связи с высоким риском осложнений спинномозговые пункции не выполнялись.
Перед началом терапии всем больным была выполнена электроэнцефалография, и на всех этапах терапии проводилась противосудорожная терапия.
Оценку токсичности проводили по шкале NCIC- CTC (National Cancer Institute — Common Toxicity Criteria, National Cancer Institute) [38].
Оценка МРТ-ответа проводилась с применением критериев RANO [39].
Статистический анализ данных проводили с использованием анализа выживаемости. Для расчетов использованы статистические программы StatView и 4 SAS 9.4. Для бессобытийной выживаемости событием являлась прогрессия заболевания, рецидив или смерть от любой причины, время отсчитывалось от начала ХТ. Для общей выживаемости событием являлась смерть от любой причины, время отсчитывалось от начала ХТ.
Результаты
Лечение по протоколу CNS-2015 проведено у 20 больных (16 больным проводится поддерживающая терапия темозоломидом). Характеристики гематологической и негематологической токсичности приведены в таблицах 2 и 3.
Таблица 2. Гематологическая токсичность (критерии токсичности по шкале NCIC-CTC) [37], %
Table 2. Hematological toxicity (NCIC-CTCj [37], %
Параметры Parameters | R-MPV | ГСК/TBC Auto-HSCT/TBC |
|---|---|---|
Нейтропения III-IV степени, % | 0 | 100 |
Neutropenia grade III-IV, % | ||
Тромбоцитопения III-IV степени, % Thrombocytopenia grade III-IV, % | 0 | 100 |
Анемия II-III степени, % Anemia grade III-IV, % | 0 | 100 |
Таблица 3. Негематологическая токсичность (критерии токсичности по шкале NCIC-CTC) [37] %
Table 3. Non-hematological toxicity (NCIC-CTCj [37], %
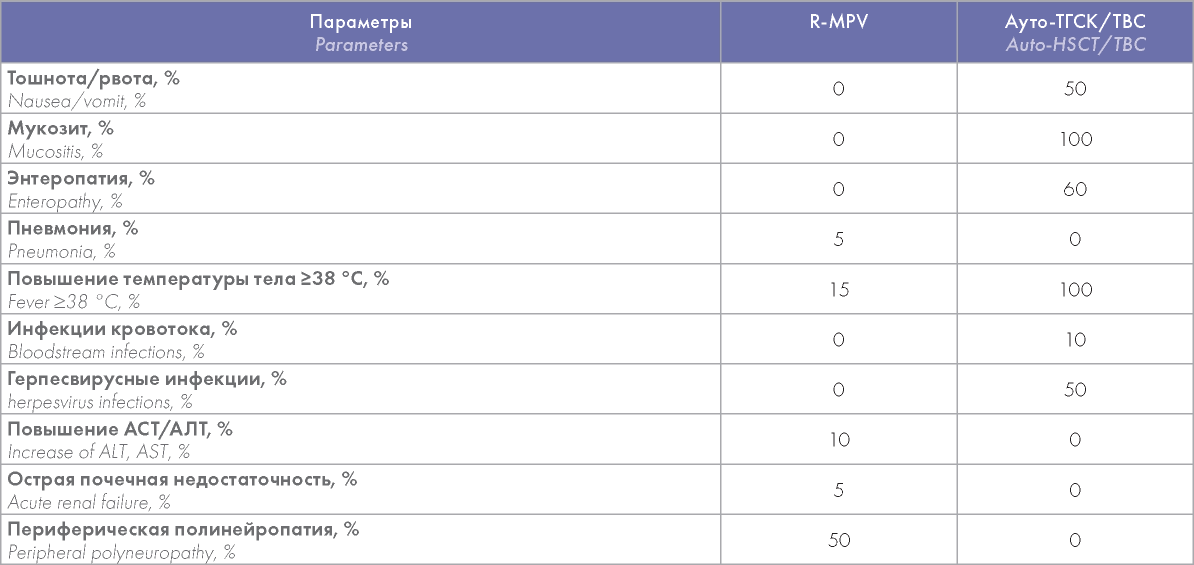
Примечание. АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза.
Notes. AST — aspartate aminotransferase, ALT — alanine aminotransferase.
Индукция ремиссии
В качестве индукции ремиссии больным было проведено от 3 до 5 курсов по программе R-MPV (ритук- симаб 375 мг/м2 в/в — 1-й день, метотрексат 3500 мг/м2 в/в — 2-й день, винкристин 2 мг в/в — 2-й день, про- карбазин 100 мг/м2 — 2—8-й дни перорально в нечетных курсах). В качестве сопроводительной терапии всем больным проводили противосудорожную (леве- тирацетам), противоотечную (маннитол) и антикоагулянтную терапию [4]. Тяжелой гематологической токсичности выявлено не было. Ни у одного больного на индукционном этапе не было миелотоксического агранулоцитоза, выраженной анемии, тромбоцитопении и зависимости от заместительной трансфузионной терапии.
У 18 из 20 больных было проведено четыре индукционных курса ХТ. У 1 больного после третьего курса ХТ при использовании высоких доз метотрексата отмечалось развитие острой почечной недостаточности (ОПН). Несмотря на комплекс проводимых мероприятий, включавших форсированный диурез, терапию фолинатом кальция, у больного в течение трех недель сохранялась гиперазотемия, отечный синдром и тенденция к олигурии. Учитывая высокий риск развития повторного эпизода ОПН и достижение максимальной редукции опухоли, четвертый курс R-MPV проведен не был.
Одному больному, у которого в связи с сохраняющимися признаками внутричерепной гидроцефалии был установлен вентрикулоцистернальный шунт, было выполнено повторное вентрикулоперитонеальное шунтирование. В связи с необходимостью решунтирования, требующего перерыва в лечении, больному перед операцией был проведен пятый курс индукционной ХТ.
Из наиболее частых негематологических осложнений было отмечено развитие периферической полинейропатии легкой степени у 50 % больных, вероятно, обусловленное токсическим действием винкристина. Вторым по частоте (10 %) осложнением являлось изолированное транзиторное повышение активности аминотрансфераз, максимально у одной больной до 40 норм после первого курса ХТ. В результате гепатопротекторной терапии удалось достичь полного регресса печеночной дисфункции, что позволило полностью выполнить программу лечения. У 1 больного после четырех курсов ХТ развилась двусторонняя нижнедолевая пневмония. По результатам исследования бронхоальвеолярного лаважа этиологию пневмонии установить не удалось. В результате противомикробной и противовирусной терапии удалось достичь полного обратного развития воспалительных изменений в легких. У 2 больных развилась фебрильная лихорадка без установленного очага инфекции. Наиболее вероятной причиной предполагалось побочное действие приема прокарбазина, при отмене которого у обоих больных температура тела нормализовалась.
Всем больным удалось эффективно выполнить мобилизацию и сбор СКК. Стимуляция гемопоэза гранулоцитарным колониестимулирующим фактором (Г-КСФ в дозе 10 мг/кг/сут) проводилась с 5-го дня межкурсового перерыва после 2-го цикла R-MPV. Среднее количество заготовленных СКК составило 7,8 х 106/кг С034+-клеток (3,4—12,4 х 106/кг).
После каждого цикла R-MPV всем больным выполняли МРТ головного мозга с внутривенным контрастированием. На этапе индукции ни у одного больного не наблюдалось прогрессии заболевания. У 15 больных была достигнута ПР и у 5 — частичная ремиссия (ЧР). Размеры резидуальных очагов составили от 6 до 17 мм.
Высокодозная ХТ и ауто-ТГСК
Всем 20 больным была выполнена ауто-ТГСК с режимом кондиционирования TBC (тиофосфамид 250 мг/м2 в/в с —8 по -6-й дни, бусульфан 4 мг/кг с —5 по -4-й дни перорально, циклофосфамид 60 мг/кг в/в с —3 по -2-й дни) [4]. У 2 больных при проведении кондиционирования отмечались тошнота и рвота на фоне приема бусульфана. Признаков развития веноокклюзионной болезни и тяжелых токсических осложнений не было. Гематологическая токсичность III-IV степени развивалась в 100 % случаев после ауто-ТГСК. Среднее время восстановления количества нейтрофилов составило 9 дней (от 8 до 14 дней). Всем больным с +1 дня после ауто-ТГСК проводилась стимуляция лейкопоэза Г-КСФ в дозе 5 мг/кг/сут [4]. У всех 20 больных после ауто-ТГСК на фоне миелотоксического агрануло- цитоза отмечалось развитие инфекционных осложнений. В 100 % случаев наблюдалось развитие мукозита III-IV степени, в 2 случаях болевой синдром вследствие мукозита потребовал применения наркотических анальгетиков. У половины больных отмечалось развитие герпесвирусных инфекций с различными клиническими проявлениями: мукозиты (5), цистит (1), поражение кожи (3) и ЦМВ-виремия (3). Случаи некротической энтеропатии наблюдались у 11 больных, и у 1 больного была доказана диарея, ассоциированная с Clostridium difficile. У 2 больных развились инфекции кровотока, в обоих случаях грамотрицательной этиологии (Klebsiella pneumoniae — 2), которые были купированы на фоне терапии противомикробными препаратами.
Среднее время восстановления количества тромбоцитов составило 13 дней (от 9 до 23 дней). В результате трансфузий концентратов тромбоцитов ни у одного больного не было тяжелых геморрагических осложнений.
У всех больных по данным МРТ головного мозга, выполненной после ауто-ТГСК, была констатирована ПР заболевания. У 2 из 20 больных был выявлен ранний рецидив заболевания (+4 и +5 месяцы) после ауто-ТГСК. В обоих случаях проведение противоре- цидивной таргетной терапии (леналидомид, ибрутиниб, ниволумаб) и лучевой терапии оказали только временный эффект. Спустя 24 и 26 месяцев после ауто-ТГСК больные умерли от прогрессии заболевания. Остальные 18 больных находятся в ПР заболевания. Средний срок наблюдения — 17 месяцев (от 1 до 46 месяцев) (рис. 3).
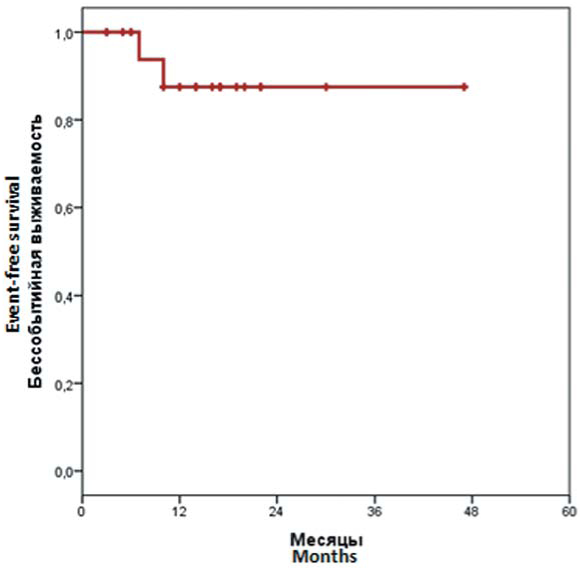
Рисунок 3. Бессобытийная выживаемость
Figure 3. Event-free survival
Поддерживающая терапия и контрольное обследование
Поддерживающая терапия включала в себя пе- роральный прием темозоломида в дозе 150 мг/м2 в течение 5 дней, каждые 3 месяца, в течение 2 лет. Переносимость была удовлетворительной. Закончили поддерживающую терапию 2 больных. Контрольная МРТ головного мозга проводилась каждые три месяца в течение 1-го года наблюдения, каждые шесть месяцев в течение 2-го года и далее 1 раз в год.
Обсуждение
Основным критерием диагноза первичной лимфомы центральной нервной системы является изолированное поражение головного или спинного мозга, задней камеры глаза или мозговых оболочек. Спектр лимфатических опухолей, локализующихся в ЦНС, невелик. Почти в 100 % случаев при поражении вещества головного и спинного мозга, а также задних камер глаза устанавливается диагноз ДВККЛ. Поражение мозговых оболочек и передней камеры глаза в большей степени характерно для лимфомы из клеток маргинальной зоны (MALT-лимфомы) [1—10]. Изучением лимфом ЦНС занимаются с начала прошлого века, однако остается множество нерешенных вопросов в их диагностике и лечении [40].
Предрасполагающими факторами развития первичной лимфомы центральной нервной системы являются иммунодефицитные состояния и аутоиммунные заболевания (синдром приобретенного иммунодефицита; проведение иммуносупрессивной терапии после органной трансплантации, рассеянный склероз и т. д.), однако причина развития опухоли у иммунокомпетентных больных до сих пор не установлена [1—8]. Почти все лимфатические опухоли ЦНС В-клеточной природы, однако в норме В-лимфоцит не способен преодолеть ГЭБ. Этот феномен также пока не объяснен [41].
Сложности диагностики и получения достаточного объема биопсийного материала, длительное время ограничивали изучение биологии ПДВККЛ ЦНС. Морфологическая диагностика не давала возможности выделить черты, отличающие ПДВККЛ ЦНС от других форм ДВККЛ, хотя ответ на терапию этих опухолей сильно отличался. Развитие методов молекулярной генетики и изучение профиля экспрессии генов позволили установить, что почти 100 % ПДВККЛ ЦНС относится к постгерминальному типу ДВККЛ (ABC-тип), который по сравнению с герминальным вариантом (GCB) ассоциируется с плохим прогнозом [8, 22]. В 2017 г. S. Mareschal и соавт. [12], применив метод секвенирования нового поколения (next generation sequencing — NGS), показали, что при ПДВККЛ ЦНС мутации в генах MYD88, CD79b и CARD11 обнаружены в 80, 32 и 8 % случаев соответственно. Для сравнения, при системной ДВККЛ АВС типа аналогичные мутации выявлены только в 28, 25 и 2 % случаев соответственно. Почти в 70 % случаев ПДВККЛ ЦНС была выявлена высокая сочетанная экспрессия белков с- Myc, B cl-6 и Bcl-2 (трипл-экспрессия), что обычно нехарактерно для других форм ДВККЛ [14, 20]. Почти в 100 % случаев ПДВККЛ ЦНС отмечалась выраженная экспрессия белка IRF/MUM1, что дает основание для эффективного применения иммуномодулирующих агентов [22]. Японскими авторами [11] выявлен уникальный профиль метилирования ДНК ПДВККЛ ЦНС, отличный от других форм ДВККЛ. Кроме того, для ПДВККЛ ЦНС характерно выраженное реактивное микроокружение с большим количеством PD-1+ Т-клеток, а также редуцированная экспрессия белков комплекса гистосовместимости [21]. Все это представляет, с одной стороны, трудности для иммунологического надзора за опухолью, с другой — определяет эффективность применения ингибиторов контрольных точек в терапии ПДВККЛ ЦНС. Современные данные нейроиммунологических исследований дают основания предполагать возможность проникновения через ГЭБ практически всех клеток крови, кроме В-лимфоцитов, что позволяет иначе взглянуть на возможности Т-клеточной терапии ПДВККЛ ЦНС [25]. Следовательно, ПДВККЛ ЦНС представляет собой биологически уникальную группу ДВККЛ, что необходимо учитывать при разработке новых программ лечения помимо тактики цитостатического проникновения через ГЭБ. Редкая встречаемость затрудняет проведение проспективных рандомизированных исследований, а большая часть работ по ПДВККЛ ЦНС построена на ретроспективных пилотных наблюдениях сравнительно небольшого числа больных [8].
Несмотря на объективные трудности, удалось доказать, что хирургическая резекция опухоли, лучевая терапия, стандартные режимы ХТ, применяемые для других форм ДВККЛ (схемы R-CHOP, NHL- BFM-90 и т.д.), неэффективны в терапии ПДВБКЛ ЦНС, поскольку пятилетняя БРВ не превышала 5 % [1—10]. Попытки увеличения концентрации цитоста- тических препаратов в ткани мозга путем интраартериального «разрыва» ГЭБ также оказались не только неэффективными, но и часто сопровождались тяжелыми, иногда смертельными, осложнениями [42].
До сих пор не существует утвержденного протокола лечения ПДВККЛ ЦНС. В ведущих онкогематологических руководствах в качестве терапии первой линии рекомендуется применение высоких доз метотрексата (>3 г/м2) в виде монотерапии или в комбинации с другими цитостатическими препаратами, способными преодолеть ГЭБ (цитарабин, кармустин, этопозид, ифосфамид, винкристин, прокарбазин, темозо- ломид, пеметрексед, тиофосфамид и т.д.) [1, 2, 4—10]. Доказанная дополнительная эффективность сочетания ХТ с ритуксимабом у больных ПДВККЛ ЦНС ставит под сомнение нормальную работу ГЭБ в условиях опухолевого поражения мозга с учетом большой молекулярной массы моноклонального антитела [23]. Большинство индукционных комбинаций ХТ оказываются эффективными в достижении первичного общего ответа (ОО), однако, почти у 40 % больных развивается рецидив заболевания в первые два года наблюдения, а пятилетняя БРВ и ОВ не превышают 40 %. Поиск оптимального индукционного курса привел к разработке схемы R-MPV, которая отвечала всем условиям необходимым для терапии этой категории больных [43]. Быстрый МРТ и неврологический ОО у 97 % больных (при достижении 66 % ПР), минимальная негематологическая и костномозговая токсичность, а также возможность заготовить адекватное количество СКК делают эту схему терапией выбора для большинства больных ПДВККЛ ЦНС [26]. У 20 больных в исследовании CNS-2015 также отмечена удовлетворительная переносимость схемы R-MPV. Костномозговая токсичность минимальна, всем больным заготовлено достаточное количество СКК. Повышение уровня креати- нина отмечено только у 1 больного. Полная ремиссия, определяемая по результатам МРТ головного мозга, была достигнута у 15 (80 %) из 20 больных. В дальнейшем у 5 больных, находившихся в ЧР, произошла конверсия в ПР после проведения ауто-ТГСК с режимом кондиционирования TBC, что не противоречит данным литературы [44].
Проведение консолидирующей высокодозной ХТ является сегодня необходимым условием достижения длительной БРВ и ОВ больных ПДВККЛ ЦНС [6-10, 26-33, 45-49]. По данным сравнительных исследований [1-10, 31], применение лучевой терапии в консолидации ремиссии менее эффективно, сопряжено с тяжелой ранней нейротоксичностью и значительно снижает качество и продолжительность жизни больных. Среди схем высокодозной ХТ, используемых в консолидации ремиссии, преимущества имеет терапия с включением высоких доз тиофосфамида и бу- сульфана [26-33]. Помимо нециклоспецифичной противоопухолевой активности эти препараты обладают высокой способностью проникать через ГЭБ (более 80 %). Рациональность добавления высоких доз цикло- фосфамида (схема ТВС) обсуждается. Эффективность схемы ТВС сначала была доказана у больных с рецидивами ПДВККЛ ЦНС (трехлетняя БРВ составила 37-53 %) [48], а затем и у больных, которым была проведена первая линия терапии (двухлетняя БРВ достигала 92 %) [26-33]. Были отмечены явные преимущества применения схемы ТВС у больных ПДВККЛ ЦНС в сравнении со схемой BEAM [47-49]. Однако при сравнительной оценке режимов ТВС и ВЕАМ у больных нодальной ДВККЛ значимых отличий в эффективности выявлено не было [49]. Рецидивы и резистентное течение после проведения схемы ТВС наблюдались у 10-20 % больных. По результатам проведенных 7 исследований (4 проспективных, 2 ретроспективных и 1 сравнительное) применения схемы ТВС у больных ПДВККЛ ЦНС [26-32], большинство рецидивов ПДВККЛ ЦНС развились в первые 2 года после ауто-ТГСК (в протоколе CNS-2015 констатировано 2 рецидива через 4 и 5 месяцев после ауто-ТГСК). Кроме того, высокая токсичность терапии и связанная с ней смертность, достигающая 12-14 %, затрудняют применение схемы ТВС у пожилых больных с высокой коморбидностью, больных с тяжелыми неврологическими дефектами, сопутствующими инфекционными осложнениями на фоне длительной терапии кортикостероидами. Есть только единичные сообщения в литературе о применении высокодозной ХТ у больных ПДВККЛ ЦНС старше 70 лет. В 2017 г. были опубликованы результаты исследования, включающего 52 больных, медиана возраста которых была 68,5 года. В качестве консолидации первой ремиссии высоко- дозная ХТ с ауто-ТГСК была проведена 15 больным и во второй или последующей линиях — 37 больным. При среднем сроке наблюдения 22 месяца медиана БПВ и ОВ составили 51,1 и 122,3 месяца соответственно. Смертность, связанная с лечением, составила всего 3,8 % [43]. Таким образом, у больных пожилого возраста протокол с применением высокодозной ХТ с последующей ауто-ТГСК эффективен и осуществим, но с учетом соматического статуса больного.
Большинство больных в протоколе CNS-2015 были из группы низкого риска, без тяжелых неврологических нарушений, без длительной терапии кортикостероидами и в возрасте до 60 лет. Смертей, связанных с токсичностью терапии, не было, что, вероятно, связано с селекцией больных и строгим выполнением протокола сопроводительной терапии [4].
Данные о поддерживающей терапии ПДВККЛ ЦНС ограниченны. Онкологической группой RTOG 0227 было проведено исследование, в котором после индукции ритуксимабом, метотрексатом, темозоломидом и лучевой терапии была проведена ежемесячная поддерживающая терапия темозоломидом в течение 1 года. Вследствие этого было получено существенное улучшение показателей БРВ и ОВ в сравнении с историческим контролем [36]. Данные об эффективности темозоломида у больных с впервые выявленной опухолью, а также у больных с рецидивом ПДВККЛ ЦНС дали основание применить его в виде «предфазы» и поддерживающей терапии в протоколе CNS- 2015 [50].
Перспективными представляются работы по применению таргетной терапии ПДВККЛ ЦНС. В протоколе CNS-2015 у 2 больных с рецидивом заболевания был достигнут ответ на терапии леналидомидом в течение 5 и 15 месяцев приема. В результате терапии ибрутинибом и ниволумабом длительность полного ответа была меньше — 1 и 2,5 месяца соответственно. По данным литературы [35, 36, 51—56], применение леналидомида, ибрутиниба и ниволумаба у больных с рецидивами ПДВККЛ ЦНС также показало высокую эффективность. Перспективным кажется применение таргетной терапии у больных с впервые выявленной опухолью, в комбинации с существующими протоколами ХТ, а также в виде поддерживающей терапии под контролем оценки минимальной резидуальной болезни (МРБ).
Появление сверхчувствительных методов оценки МРБ в крови и ликворе в перспективе дает возможность проводить ориентированную на наличие остаточного опухолевого клона ХТ и таргетную терапию у больных ПДВККЛ ЦНС. По данным De Mattos- Arruda L. и соавт. [19], концентрация свободной опухолевой ДНК в ликворе значительно выше, чем в крови больных ПДВККЛ ЦНС. Кроме того, при использовании метода NGS отмечена почти 100 %-ная корреляция выявленных драйверных мутаций в ликворе и первичном биоптате опухоли [13, 15]. Применение метода NGS при ПДВККЛ ЦНС имеет и другие преимущества. Даже небольшое количество биопсийного материала, обычно полученное после стереотаксиче- ской биопсии, дает возможность получить полноценную молекулярно-генетическую характеристику опухоли, недоступную другими методами. По данным H.D. Munch-Peterson и соавт. [16] и N. Galanina и соавт. [15], у 30—100 % больных ПДВККЛ ЦНС в биоптатах опухоли выявляется мутация в гене ТР53 [15, 16]. Однако негативное прогностическое значение имели только мутации, расположенные в локусах, связанных с ДНК-контактированием (до 30 % больных) [15]. Возможно, это объясняет резистентное к химиотерапевтическому воздействию течение заболевания у 20—30 % больных ПДВККЛ ЦНС даже после высокодозной ХТ. В качестве преодоления первичной резистентности только небольшое число авторов рассматривает проведение трансплантации аллогенных гемопоэтических стволовых клеток у больных ПДВККЛ ЦНС [57, 58]. Позитивный опыт даже единичных сообщений дает основания продолжить работу в этом направлении. Собственное наблюдение эффективной CAR-терапии у больной с первичной крупноклеточной В-клеточной медиастинальной лимфомой с поражением головного мозга в рецидиве заболевания дает основания предполагать о возможности трансплантированных донорских или модифицированных Т-клеток не только преодолевать ГЭБ, но и проявлять противоопухолевую активность.
Таким образом, по результатам проспективного исследования можно констатировать наличие в химиотерапевтическом арсенале высокоэффективного протокола высокодозной ХТ ПДВККЛ ЦНС. Достигнутые результаты значительно выше, чем в ранее применяемых протоколах лечения ПДВККЛ ЦНС. Эффективность и переносимость терапии зависит от адекватных диагностических и лечебных мероприятий после появления первых признаков заболевания. Осложненные «радикальные хирургические вмешательства», длительный прием кортикостероидов и сопутствующие инфекционные осложнения делают невозможным проведение высокодозной ХТ ПДВККЛ ЦНС. Выполнение высокодоз- ной ХТ у больных старше 60 лет может рассматриваться с учетом их соматического статуса. Выполнение высокодозной ХТ ПДВККЛ ЦНС возможно в любых специализированных гематологических стационарах, проводящих ауто-ТГСК, при строгом соблюдении схем ХТ и сопроводительного лечения [4]. При ПДВККЛ ЦНС перспективным является применение высокочувствительных методов оценки МРБ (свободно циркулирующая опухолевая ДНК) в ликворе и плазме, с обязательной детекцией мутаций в гене ТР53. С целью повышения эффективности и снижения токсичности рациональна разработка новых МРБ-ориентированных протоколов лечения ПДВККЛ ЦНС, с использованием таргетной терапии (леналидомид, ибрутиниб, ниволумаб). Также возможна разработка протоколов терапии с применением CAR-Т-клеток и трансплантации аллогенных гемопоэтических стволовых клеток для резистентных случаев ПДВККЛ ЦНС.
Список литературы
1. Губкин А.В., Звонков Е.Е., Кременецкая А.М. и др. Первичные лимфопролиферативные заболевания центральной нервной системы. Клиническая онкогематология. М., 2008; 1(4): 323–32.
2. Губкин A.В., Звонков Е.Е., Кременецкая А.М. и др. Первичные лимфопролиферативные заболевания центральной нервной системы. Терапевтический архив. 2009; 81(7): 85–91.
3. Воробьев А.И., Кременецкая А.М. Атлас опухолей лимфатической системы. М.: Ньюамед, 2007. — 292 с.
4. Звонков Е.Е., Королева Д.А., Габеева Н.Г. и др. Исследовательский протокол лечения больных первичной диффузной В-крупноклеточной лимфомой центральной нервной системы (протокол CNS-2015). Алгоритмы диагностики и протоколы лечения заболеваний системы крови, под редакцией академика РАН В.Г. Савченко. М., 2018; 2: 609–22.
5. Grommes C., DeAngelis L. M. Primary CNS Lymphoma. J. Clin. Oncol. 2017; 35(21): 2410–18. DOI: 10.1200/JCO.2017.72.7602
6. Fox C.P., Phillips E.H., Smith J. et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br. J. Haematol. 2019; 184(3): 348–63. DOI: 10.1111/bjh.15661
7. Paydas S. Primary central nervous system lymphoma: essential points in diagnosis and management. Med. Oncol. 2017; 34(61). DOI: 10.1007/s12032-017- 0920-7
8. Löw S., Han C.H., Batchelor T.T. Primary central nervous system lymphoma. Therapeutic Advances in Neurological Disorders. 2018; 11: 1–16. DOI: 10.1177/1756286418793562
9. Sethi T.K., Reddy N.M. Treatment of newly diagnosed primary central nervous system lymphoma: current and emerging therapies. Leuk. Lymphoma. 2019; 60(1): 6–18. DOI: 10.1080/10428194.2018.1466296
10. Grommes C., Rubenstein J.L., DeAngelis L.M. et al. Comprehensive approach to diagnosis and treatment of newly diagnosed primary CNS lymphoma. Neuro Oncol. 2019; 21(3): 296–305. DOI: 10.1093/neuonc/noy192
11. Nakamura T., Yamashita S., Fukumura K. et al. Genomewide DNA methylation profi ling identifi es primary central nervous system lymphoma as a distinct entity different from systemic diffuse large B-cell lymphoma. Acta Neuropathol. 2017; 133(2): 321–4. DOI: 10.1007/s00401-016-1664-8
12. Mareschal S., Pham-Ledard A., Viailly P.J. et al. Identifi cation of somatic mutations in primary cutaneous diffuse large B-cell lymphoma, leg type by massive parallel sequencing. J Invest. Dermatol. 2017; 137: 1984–94. DOI: 10.1016/j. jid.2017.04.010
13. Fontanilles M., Marguet F., Bohers É. et al. Non-invasive detection of somatic mutations using next-generation sequencing in primary central nervous system lymphoma. Oncotarget. 2017; 8(29): 48157–68. DOI: 10.18632/oncotarget.18325
14. Brunn A., Nagel I., Montesinos-Rongen M. et al. Frequent triple-hit expression of MYC, BCL2, and BCL6 in primary lymphoma of the central nervous system and absence of a favorable MYClowBCL2low subgroup may underlie the inferior prognosis as compared to systemic diffuse large B cell lymphomas. Acta Neuropathol. 2013; 126: 603–5. DOI: 10.1007/s00401-013-1169-7
15. Galanina N., Bejar R., Choi M. et al. Comprehensive genomic profi ling reveals diverse but actionable molecular portfolios across hematologic malignancies: implications for next generation clinical trials. Cancers. 2018; 11(1). DOI: 10.3390/cancers11010011
16. Munch-Petersen H. D., Asmar F., Dimopoulos K. et al. TP53 hotspot mutations are predictive of survival in primary central nervous system lymphoma patients treated with combination chemotherapy. Acta Neuropathol. Commun. 2016; 4: 40. DOI: 10.1186/s40478-016-0307-6
17. Hickmann A.K., Frick M., Hadaschik D. et al. Molecular tumor analysis and liquid biopsy: a feasibility investigation analyzing circulating tumor DNA in patients with central nervous system lymphomas. BMC Cancer. 2019; 19: 192. DOI: 10.1186/s12885-019-5394-x
18. Nayyar N., White M. D., Gill C.M. et al. MYD88 L265P mutation and CDKN2A loss are early mutational events in primary central nervous system diffuse large B-cell lymphomas. Blood. 2019; 3: 3. DOI: 10.1182/bloodadvances.2018027672
19. De Mattos-Arruda L., Mayor R. et al. Cerebrospinal fl uid-derived circulating tumour DNA better represents the genomic alterations of brain tumors than plasma. Nat. Commun. 2015; 6: 8839. DOI: 10.1038/ncomms9839
20. Nosrati A., Monabati A., Sadeghipour A. et al. MYC, BCL2, and BCL6 rearrangements in primary central nervous system lymphoma of large B cell type. Ann. Hematol. 2019; 98(1):169–73. DOI: 10.1007/s00277-018-3498-z
21. Chapuy B., Roemer G.M., Stewart C. et al. Targetable genetic features of primary testicular and primary central nervous system lymphomas. Blood. 2016; 127(7): 869–81. DOI: 10.1182/blood-2015-10-673236
22. Cai Q., Fang Yu, Young K.H. Primary central nervous system lymphoma: molecular pathogenesis and advances in Treatment. Transl. Oncol. 2019; 12: 523– 38. DOI: 10.1016/j.tranon.2018.11.011
23. Holdhoff M., Ambady P., Abdelaziz A. et al. High-dose methotrexate with or without rituximab in newly diagnosed primary CNS lymphoma. Neurology. 2014; 83: 235–39. DOI: 10.1212/WNL.0000000000000593
24. Mendez J. S., Grommes C. Treatment of primary central nervous system lymphoma: from chemotherapy to small molecules. Am. Soc. Clin. Oncol. Educ Book. 2018; 23(38): 604–15. DOI: 10.1200/EDBK_200829
25. Abramson J.S., McGree B., Noyes S. et al. Anti-CD19 CAR T cells in CNS diffuse large-B-cell lymphoma. N. Engl. J. Med. 2017; 377(8): 783–4. DOI: 10.1056/NEJMc1704610
26. Omuro A., Correa D.D., DeAngelis L.M. et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015; 125: 1403–10. DOI: 10.1182/ blood-2014-10-604561
27. Scordo M., Bhatt V., Hsu M. et al. A comprehensive assessment of toxicities in patients with CNS lymphoma undergoing autologous stem cell transplantation using Thiotepa, Busulfan and Cyclophosphamide conditioning. Biol Blood Marrow Transplant. 2017; 23(1): 38–43. DOI: 10.1016/j.bbmt.2016.09.024
28. DeFilipp Z., Li S., El-Jawahri A. et al. High-Dose chemotherapy with Thiotepa, Busulfan, and Cyclophosphamide and autologous stem cell transplantation for patients with primary central nervous system lymphoma in fi rst complete remission. Cancer. 2017; 123(16): 3073–9. DOI: 10.1002/cncr.30695
29. Cheng T., Forsyth P., Chaudhry A. et al. High-dose thiotepa, busulfan, cyclophosphamide and ASCT without whole-brain radiotherapy for poor prognosis primary CNS lymphoma. Bone Marrow Transplant. 2003; 31: 679–85. DOI:10.1038/sj.bmt.1703917
30. Chen Yi-Bin, Batchelor T., Li S. et al. Phase 2 Trial of High-Dose Rituximab with high-dose cytarabine mobilization therapy and high-dose thiotepa, busulfan, and cyclophosphamide autologous stem cell transplantation in patients with central nervous system involvement by Non-Hodgkin lymphoma. Cancer. 2015; 121(2): 226–33. DOI: 10.1002/cncr.29023
31. Houillier C., Taillandier L., Dureau S. et al. Radiotherapy or autologous stemcell transplantation for primary CNS lymphoma in patients 60 years of age and younger: results of the intergroup ANOCEF-GOELAMS randomized phase II PRECIS study. J. Clin. Oncol. 2019; 37: 823–33. DOI: 10.1200/JCO.18.00306
32. Alimohamed N., Daly A., Owen C. et al. Upfront thiotepa, busulfan, cyclophosphamide, and autologous stem cell transplantation for primary CNS lymphoma: a single centre experience. Leuk. Lymphoma. 2012; 53(5): 862–67. DOI: 10.3109/10428194.2011.633250
33. Hu B. A Tale of two eras: The story of autologous stem cell transplantation with and without thiotepa for primary central nervous system lymphoma. Biol. Blood Marrow Transplantat. 2019; 25(5): 141–2. DOI: 10.1016/j.bbmt.2019.03.014
34. Terziev D., Hutter B., Klink B., et al. Nivolumab maintenance after salvage autologous stem cell transplantation results in long-term remission in multiple relapsed primary CNS lymphoma. Eur. J. Haematol. 2018; 101(1): 115–8. DOI: 10.1111/ ejh.13072
35. Rubenstein J.L., Geng H., Vu K. et al. Maintenance Lenalidomide in Primary CNS Lymphoma. Ann Oncol. 2019; 30(8):1397–8. DOI: 10.1093/annonc/mdz142
36. Glass J., Won M., Schultz C.J. et al. Phase I and II study of induction chemotherapy with methotrexate, rituximab, and temozolomide, followed by wholebrain radiotherapy and postirradiation temozolomide for primary CNS lymphoma: NRG Oncology RTOG 0227. J. Clin. Oncol. 2016; 34(14): 1620–5. DOI: 10.1200/JCO.2015.64.8634
37. Oken M., Creech R., Tormey D. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5: 649–55.
38. ht tps://w w w.eor tc .be/ser vices/doc/c tc/CTC AE _v5 _Q uick _ Reference_5x7.pd
39. Wen P.Y., Chang S. M., Van den Bent M.J. et al. Response Assessment in Neuro-Oncology Clinical Trials. J. Clin. Oncol. 2017; 35(21): 2439–49. DOI: 10.1200/JCO.2017.72.7511
40. Russell S. and Rubinstei L. J. Pathology of Tumours of the Nervous System. J. Pathol. 1989; 158: 359–60. DOI: 10.1002/path.1711580413
41. Qian L., Tomuleasa C., Florian I. et al. Advances in the treatment of newly diagnosed primary central nervous system lymphomas. Blood 2017; 52: 159–66. DOI: 10.5045/br.2017.52.3.159
42. Angelov L., Doolittle N.D., Kraemer D.F. et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary CNS lymphoma: a multi-institutional experience. J. Clin. Oncol. 2009; 27(21): 3503–9. DOI: 10.1200/JCO.2008.19.3789
43. Gavrilovic I.T., Hormigo A, Yahalom J. et al. Long-Term Follow-Up of HighDose Methotrexate-Based Therapy With and Without Whole Brain Irradiation for Newly Diagnosed Primary CNS Lymphoma. J. Clin. Oncol. 2006; 24(28): 4570–4. DOI: 10.1200/JCO.2006.06.6910
44. Schorb E., Fox C.P., Fritsch K. et al. High-dose thiotepa-based chemotherapy with autologous stem cell support in elderly patients with primary central nervous system lymphoma: a European retrospective study. Bone Marrow Transplant. 2017; 52(8): 1113–9. DOI: 10.1038/bmt.2017.23
45. Gaut D., Schiller G.J. Hematopoietic stem cell transplantation in primary central nervous system lymphoma: a review of the literature. International J. Hematol. 2019; 109(3): 260–77. DOI: 10.1007/s12185-019-02594-1
46. Alnahhas I., Jawish M., Alsawas M. et al. Autologous stem cell transplant for primary central nervous system lymphoma: A systematic review and metaanalysis. Clin. Lymphoma Myeloma Leuk. 2019; 19(3): 129–41. DOI: 10.1016/j. clml.2018.11.018
47. Dholaria B.R., Kumar A., Azzuqua A. et al. Autologous stem cell transplantation in central nervous system lymphoma: A multicenter retrospective series and a review of the literature. Clin. Lymphoma Myeloma Leuk. 2019; 19(6): 273–80. DOI: 10.1016/j.clml.2019.02.013
48. Soussain C., Suzan F., Hoang-Xuan K. et al. Results of intensive chemotherapy followed by hematopoietic stem-cell rescue in 22 patients with refractory or recurrent primary CNS lymphoma or intraocular lymphoma. J. Clin. Oncol. 2001; 19: 742–9. DOI: 10.1200/JCO.2001.19.3.742
49. Sellner L., Boumendil A., Finel H. et al. Thiotepa-based high-dose therapy for autologous stem cell transplantation in lymphoma: a retrospective study from the EBMT. Bone Marrow Transplant. 2016; 51: 212–8. DOI: 10.1038/bmt.2015.273
50. Osmani A.H., Masood N. Temozolomide for relapsed primary CNS lymphoma. J Coll Physicians Surg. Pak. 2012; 22(9): 594–5. DOI: 09.2012/JCPSP.594595
51. Kassa C., Reményi P., Sinkó J. et al. Successful nivolumab therapy in an allogeneic stem cell transplant child with post‐transplant lymphoproliferative disorder. Pediatr. Transplant. 2018; 22(8): 13302. DOI: 10.1111/petr.13302
52. Graham M.S., DeAngelis L. M. Improving outcomes in primary CNS lymphoma. Best Pract Res. Clin. Haematol. 2018; 31: 262–9. DOI: 10.1016/j. beha.2018.07.006
53. Nayak L., Iwamoto F. M, LaCasce A. et al. PD-1 blockade with nivolumab in relapsed/refractory primary central nervous system and testicular lymphoma. Blood. 2017; 129(23): 3071–3. DOI: 10.1182/blood-2017-01-764209
54. Grommes C., Nayak L., Tun H.W., Batchelor T.T. Introduction of novel agents in the treatment of Primary CNS Lymphoma. Neuro-Oncol. 2018; 21(3): 306–13. DOI: 10.1093/neuonc/noy193
55. Chamoun K., Choquet S., Boyle E. et al. Ibrutinib monotherapy in relapsed/ refractory CNS lymphoma: A retrospective case series. Neurology. 2017; 88(1): 101–2. DOI: 10.1212/WNL.0000000000003420
56. Houillier C., Choquet S., Touitou V. et al. Lenalidomide monotherapy as salvage treatment for recurrent primary CNS lymphoma. Neurology. 2015; 84(3): 325–6. DOI: 10.1212/WNL.0000000000001158
57. Atilla E., Sahin U., Atilla P.A. et al. Allogeneic stem cell transplantation for relapsed primary central nervous system lymphoma: Is it feasible? Hematol. Oncol. Stem. Cell Ther. 2018; 1658–3876(18): 30025–6. DOI: 10.1016/j.hemonc.2018.02.001
58. Varadi G., Or R., Kapelushnik J. et al. Graft-Versus-Lymphoma effect after allogeneic peripheral blood stem cell transplantation for primary central nervous system lymphoma. Leuk. Lymph. 1999; 34(1–2): 185–90. DOI: 10.3109/10428199909083396
Об авторах
Е. Е. ЗвонковРоссия
Звонков Евгений Евгеньевич, доктор медицинских наук, заведующий отделением интенсивной высокодозной химиотерапии лимфом с круглосуточным и дневным стационарами
тел.: +7 (495) 612-44-72; 125167
Д. А. Королева
Россия
Королева Дарья Александровна, врач-гематолог отделения интенсивной высокодозной химиотерапии лимфом с круглосуточным и дневным стационарами
Н. Г. Габеева
Россия
Габеева Нэлли Георгиевна, кандидат медицинских наук, врачгематолог отделения интенсивной высокодозной химиотерапии лимфом с круглосуточным и дневным стационарами
тел.: +7 (495) 612-4382, доб. 16-97
О. А. Гаврилина
Россия
Гаврилина Ольга Александровна, кандидат медицинских наук, врач-гематолог отделения интенсивной высокодозной химиотерапии гемобластозов и депрессий кроветворения с круглосуточным стационаром
ORCID: https//orcid.org/0000-0002-9669-8482
С. Ю. Федорова
Россия
Федорова Светлана Юрьевна, врач-невролог лаборатории по изучению психических и неврологических расстройств при заболеваниях системы крови
А. В. Губкин
Россия
Губкин Андрей Владимирович, кандидат медицинских наук, главный гематолог Центральной дирекции здравоохранения — филиала ОАО «РЖД», заведующий отделением, врач-гематолог высшей квалификационной категории
А. М. Ковригина
Россия
Ковригина Алла Михайловна, доктор биологических наук, заведующая патологоанатомическим отделением
Г. А. Яцык
Россия
Яцык Галина Александровна, кандидат медицинских наук, заведующая отделением магнитно-резонансной томографии и ультразвуковой диагностики
Г. А. Клясова
Россия
Клясова Галина Александровна, доктор медицинских наук, профессор, заведующая лабораторией клинической бактериологии, микологии и антибиотической терапии
Т. А. Савенко
Россия
Савенко Татьяна Александровна, кандидат медицинских наук, заместитель директора по лечебной работе
В. Г. Савченко
Россия
Савченко Валерий Григорьевич, доктор медицинских наук, академик РАН, профессор, генеральный директор
Рецензия
Для цитирования:
Звонков Е.Е., Королева Д.А., Габеева Н.Г., Гаврилина О.А., Федорова С.Ю., Губкин А.В., Ковригина А.М., Яцык Г.А., Клясова Г.А., Савенко Т.А., Савченко В.Г. ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ ПЕРВИЧНОЙ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ПРОМЕЖУТОЧНЫЕ РЕЗУЛЬТАТЫ ПРОТОКОЛА CNS-2015. Гематология и трансфузиология. 2019;64(4):447–461. https://doi.org/10.35754/0234-5730-2019-64-4-447-461
For citation:
Zvonkov E.E., Koroleva D.A., Gabeeva N.G., Gavrilina O.A., Fedorova S.Yu., Gubkin A.V., Kovrigina A.M., Yatsyk G.A., Klyasova G.A., Savenko T.A., Savchenko V.G. HIGH-DOSE CHEMOTHERAPY FOR PRIMARY DIFFUSE LARGE B-CELL LYMPHOMA OF THE CENTRAL NERVOUS SYSTEM. INTERIM RESULTS OF THE CNS-2015 PROTOCOL. Russian journal of hematology and transfusiology. 2019;64(4):447–461. (In Russ.) https://doi.org/10.35754/0234-5730-2019-64-4-447-461











































