Перейти к:
Оценка эффективности и безопасности биоаналогичного препарата Глуразим (имиглюцераза) у больных болезнью Гоше I типа
https://doi.org/10.35754/0234-5730-2020-65-1-8-23
Аннотация
Введение. Болезнь Гоше (БГ) — редкое наследственное заболевание, являющееся самой распространенной формой лизосомных болезней накопления. Для лечения БГ I и III типов применяется заместительная ферментная терапия (ЗФТ) рекомбинантной глюкоцереброзидазой. Имиглюцераза (рекомбинантная глюкоцереброзидаза) является первым биотехнологическим лекарственным препаратом ЗФТ с доказанной клинической эффективностью и безопасностью.
Цель — сравнение эффективности и безопасности биоаналогичного препарата Глуразим и референтного препарата Церезим при проведении ЗФТ у больных БГ 1-го типа.
Материалы и методы. В исследование были включены 30 больных в возрасте от 19 до 63 лет (33 ± 9,7 года) со стабильным течением БГ 1-го типа, которых рандомизировали в одну из двух групп лечения исследуемым препаратом Глуразим или референтным препаратом Церезим в соотношении 1:1. В обеих группах лекарственные препараты использовались в дозах 15–40 ЕД/кг внутривенно капельно один раз в 14 дней в течение 52 недель.
Результаты. В конце исследования на 52-й неделе в обеих группах отмечалось схожее повышение концентраций гемоглобина (первичная конечная точка эффективности) по сравнению с исходными данными. В популяции всех больных, включенных в исследование, среднее увеличение концентрации гемоглобина на 52-й неделе составило 4,8 г/л, а разность изменения концентрации гемоглобина между группами была равна 0,1 г/л. Нижняя граница рассчитанного 95 %-го доверительного интервала для разности изменения концентрации гемоглобина на 52-й неделе не пересекала границу не меньшей эффективности препарата, заданную на уровне 18 г/л, что позволило сделать вывод о том, что исследуемый препарат Глуразим не уступает по эффективности референтному препарату Церезим.
При сравнении групп лечения по вторичным конечным точкам эффективности не выявлено снижения концентрации гемоглобина более чем на 20 % в обеих группах, отсутствовали отличия между группами по числу больных с изменением концентрации тромбоцитов относительно исходных значений, не отмечено увеличение объема селезенки более 20 % и печени более 10 % у больных в обеих группах. Дозы исследуемого и референтного препаратов были неизменными и не повышались в исследовании. Концентрация хемокина CCL-18 незначительно снижалась в группе Глуразима у 10 больных (64,3 %) и в группе Церезима у 6 больных (40 %). Доли больных с улучшением физического и психического компонентов здоровья составили 57,1 и 57,1 % соответственно в группе Глуразима, а также 73,3 и 60 % соответственно в группе Церезима. Изменения состояния костной ткани и запасов накопленных метаболитов в костном мозге свидетельствовали о схожем снижении степени выраженности инфильтрации костного мозга в обеих группах.
Заключение. Препараты Глуразим и Церезим при проведении долгосрочной заместительной ферментной терапии больных БГ 1-го типа были сопоставимы по изучаемым параметрам эффективности и безопасности.
Для цитирования:
Сысоева Е.П., Пономарев Р.В., Лукина К.А., Чавынчак Р.Б., Короткова С.Б., Жиляева М.В., Никитина Е.Г., Маркова О.А., Гапченко Е.В., Шустер А.М., Кудлай Д.А., Лукина Е.А. Оценка эффективности и безопасности биоаналогичного препарата Глуразим (имиглюцераза) у больных болезнью Гоше I типа. Гематология и трансфузиология. 2020;65(1):8-23. https://doi.org/10.35754/0234-5730-2020-65-1-8-23
For citation:
Sysoeva E.P., Ponomarev R.V., Lukina K.A., Chavynchak R.B., Korotkova S.B., Zhilyaeva M.V., Nikitina E.G., Markova O.A., Gapchenko E.V., Shuster A.M., Kudlay D.A., Lukina E.A. Evaluation of the efficacy and safety of the biosimilar drug Glurazyme (imiglucerase) in patients with Gaucher disease type 1. Russian journal of hematology and transfusiology. 2020;65(1):8-23. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-1-8-23
Введение
Применение в клинической практике биопрепаратов — лекарственных средств, произведенных путем биотехнологических процессов, — повышает эффективность терапии и качество жизни больных редкими (орфанными) заболеваниями. Разработка и производство биоаналогичных лекарственных препаратов способствуют снижению производственных затрат и, таким образом, расширяют возможности применения современной патогенетической терапии у больных редкими заболеваниями.
Болезнь Гоше (БГ) — редкое заболевание из группы лизосомных болезней накопления, которое является наиболее частой формой наследственных ферментопатий и встречается в общей популяции с частотой от 1: 40 000 до 1: 60 000 [1, 2]. БГ наследуется по аутосомно-рецессивному механизму. В основе заболевания лежат мутации гена глюкоцереброзидазы, локализующегося в регионе q21 на 1-й хромосоме. Присутствие 2 мутантных аллелей гена (гомозиготное наследование) ассоциируется со снижением (или отсутствием) каталитической активности глюкоцереброзидазы, что приводит к накоплению неутилизированных липидов в цитоплазме макрофагов, аутокринной стимуляции моноцитопоэза и увеличению абсолютного числа макрофагов с нарушением их физиологических функций [3, 4]. В зависимости от наличия или отсутствия поражения центральной нервной системы (ЦНС) выделяют три типа БГ. Самым частым является тип 1 (ненейронопатический), при котором нет признаков вовлечения ЦНС [5—8]. Основные клинические проявления БГ 1-го типа включают спленомегалию, гепатомегалию, цитопению и поражение костей.
Для лечения БГ 1-го типа с 1994 г. применяется заместительная ферментная терапия (ЗФТ) рекомбинантной глюкоцереброзидазой (имиглюцеразой или велаглюцеразой) в виде внутривенных инфузий в стандартном режиме 1 раз в 2 недели. ЗФТ приводит к регрессу цитопении, уменьшению размеров селезенки и печени и предотвращает развитие необратимого поражения костно-суставной системы. Лечение носит пожизненный характер, режим поддерживающей терапии находится в стадии разработки [2, 3, 5, 9—12].
Сложность производства биотехнологических лекарственных препаратов для лечения редких заболеваний обусловливает их высокую стоимость и, соответственно, ограниченную доступность для больных. В связи с этим создание новых лекарственных препаратов, в том числе биоаналогов рекомбинантной глюкоцереброзидазы для лечения БГ, является актуальной задачей. Развитие фармацевтического производства биоаналогов оригинальных лекарственных препаратов для лечения редких заболеваний является одним из ведущих направлений фармацевтической промышленности Российской Федерации в соответствии со стратегией «Фарма-2020». Выводу на рынок и началу применения биоаналогов в клинической практике предшествует сложный многоэтапный процесс, связанный с необходимостью доказать сходство биоаналога с оригинальным препаратом на основе результатов сравнительных исследований [13—19]. Разработка биоаналогов регламентирована документами Евразийского экономического союза (ЕАЭС), Всемирной организации здравоохранения (ВОЗ), Европейского агентства по лекарственным средствам и Федерального агентства по контролю за лекарственными препаратами и продуктами питания США [7, 8, 13]. Согласно регуляторным требованиям ЕАЭС, утвержденным Советом Евразийской экономической комиссии 03.11.2016, разработка биоаналога на всех этапах требует проведения сравнительных с оригинальным (референтным) препаратом исследований, в ходе которых изучаются доказательства эквивалентности препаратов по физико-химическим параметрам, доклиническим данным, фармакокинетике (ФК), фармакодинамике (ФД), эффективности, безопасности и иммуногенности. Такой подход позволяет внедрять в клиническую практику эффективный и безопасный продукт с доказанным сходством с оригинальным препаратом. После получения надежных доказательств сходства биоподобного и оригинального препаратов по физико-химическим показателям, доклиническим данным, параметрам ФК и ФД клинические исследования могут быть проведены в сокращенном объеме. При этом дизайн, конечные точки и целевая популяция исследования должны обеспечивать достаточную чувствительность. Особенностью разработки и длительного применения биопрепаратов, включая биоподобные, является обязательная оценка иммуногенности в связи с возможностью нежелательного иммунного ответа на введение белкового препарата. Возможность развития клинических последствий выработки антител, нейтрализующих действие биопрепарата, требует долговременного контроля за безопасностью, так как временные рамки клинических исследований не позволяют полностью выявить побочные явления и иммуногенность препарата.
Разработанный АО «ГЕНЕРИУМ» препарат Глуразим является первым биоаналогом препарата Церезим («Джензайм Корпорейшн», США). В 2019 г. биоаналогичный препарат Глуразим был зарегистрирован в РФ после проведения полного цикла изучения его сопоставимости референтному препарату. Проведенные на этапе разработки препарата сравнительные доклинические исследования продемонстрировали сопоставимость препаратов Глуразим и Церезим по показателям качества, физико-химическим и биофармацевтическим свойствам, включая нетоксичность и хорошую переносимость препарата Глуразим [20, 21]. В рамках клинического исследования I фазы была изучена переносимость, безопасность и фармакокинетика препарата у здоровых добровольцев. Полученные доказательства фармакокинетической эквивалентности препаратов Глуразим и Церезим, а также хорошей переносимости и благоприятного профиля безопасности препарата Глуразим явились основанием для проведения сравнительного клинического исследования II-III фазы [22].
Цель исследования — сравнить эффективность и безопасность препаратов Глуразим и Церезим при проведении ЗФТ у больных БГ 1-го типа.
Материалы и методы
Клиническое исследование GLZ-GHD-II/III было одобрено Минздравом России 29.02.2016 (разрешение № 145) и проведено в ФГБУ «НМИЦ гематологии» Минздрава России. В исследование были включены больные БГ 1-го типа в возрасте 18 лет и старше, подписавшие информированное согласие на участие в исследовании, получавшие регулярную терапию имиглюцеразой в дозе 15-60 ЕД/кг и давшие согласие на использование методов контрацепции в период исследования. У всех больных было стабильное течение
БГ, подтвержденное перед включением в исследование следующими критериями:
- предшествующее лечение имиглюцеразой в течение как минимум одного года;
- отсутствие изменений дозы имиглюцеразы как минимум в течение 3-х последних месяцев;
- отклонение концентрации гемоглобина крови не более чем на 15 % по сравнению со средним значением концентрации гемоглобина крови по результатам двукратного общего анализа крови в течение предшествующего года;
- отклонение количества тромбоцитов не более чем на 20 % (для среднего количества тромбоцитов ≤120 х 10 9/л) и не более, чем на 40 % (для среднего количества тромбоцитов >120 х 10 9/л), по сравнению со средним значением количества тромбоцитов по результатам двукратного общего анализа в течение предшествующего года;
- отсутствие клинически значимого увеличения печени или селезенки по данным ультразвукового исследования (УЗИ) перед включением в исследование в сравнении с результатами УЗИ, полученными в течение предшествующего года.
В исследование не включались больные с анемией или цитопенией, не связанными с БГ, а также больные с неконтролируемыми или значимыми сопутствующими заболеваниями и состояниями (включая ВИЧ, активные вирусные гепатиты B или С, психические заболевания и др.).
После проведения процедур скрининга 30 больных, включенных в исследование, были рандомизированы в одну из двух групп лечения в соотношении 1:1 — группу исследуемого препарата Глуразим (15 больных), и группу референтного препарата Церезим (15 больных).
Препараты Глуразим или Церезим вводили в дозе 15-40 ЕД/кг в виде внутривенных инфузий один раз в 14 дней в течение 52 недель. Начальная доза препарата соответствовала дозе имиглюцеразы, которую больной получал до включения в исследование. В исследовании было предусмотрено увеличения дозы имиглю- церазы в случае значительного снижение количества тромбоцитов (>20 % — для исходного количества ≤120 х 10 9/л и >40 %-го снижения для исходного количества >120 х 10 9/л) по сравнению с исходным средним значением трех измерений количества тромбоцитов (одним измерением непосредственно перед включением в исследование и двумя более ранними измерениями). Увеличение дозы препарата было возможно также при значительном снижение (>20 %) концентрации гемоглобина по сравнению с исходным средним значением трех измерений концентрации гемоглобина (одним измерением непосредственно перед включением в исследование и двумя более ранними измерениями).
Для оценки исходного состояния больным выполняли клинический и биохимический анализы крови, коагулограмму, определение сывороточных показателей метаболизма железа, активности хемокина CCL-18 (С-С motif chemokine ligand-18) [23], исследование иммуногенности, анализ крови на хорионический гонадотропин человека для исключения беременности. исследование антитела к ВИЧ, вирусам гепатитов В и С, общий анализ мочи. У больных измеряли массу тела и рост, производили физикальное обследование, измерение показателей жизненно важных функций, электрокардиографию (ЭКГ), УЗИ печени и селезенки, магнитнорезонансную томографию (МРТ) печени и селезенки для оценки их размеров (объема), наличия или отсутствия клинически значимых отклонений, а также МРТ бедренных костей для контроля состояния костной ткани и запасов накопленных метаболитов в костном мозге [24]. Были собраны данные по сопутствующей терапии и проведена оценка качества жизни по краткому опроснику SF-36, версия 2 (SF-36v2®, OptumInsight Life Sciences, Incorporated, USA) [25]. При выполнении МРТ печени и селезенки оценку объемов органов проводили с использованием рабочей станции GE и мультимодальной рабочей станции «Гамма Мультивокс Д2», версия: 5.5.4975 («Лаборатория медицинских компьютерных систем», Россия).
Нежелательные явления при проведении ЗФТ в обеих группах оценивали в ходе всего исследования по результатам лабораторных анализов, показателям жизненно важных функций, титру иммуноглобулинов, а также по данным физикального осмотра, ЭКГ и МРТ бедренных костей. Оценки эффективности и безопасности терапии имиглюцеразой по показателям клинического и биохимического анализов крови, коагулограммы и опросника качества жизни SF-36 (версия 2) проводили на 4, 16, 28, 40 и 52-й неделях лечения. Сывороточные показатели метаболизма железа, активность CCL-18, МРТ печени, селезенки и бедренных костей оценивали исходно перед включением в исследование и через 52 недели лечения.
Первичной конечной точкой эффективности в исследовании являлось изменение концентрации гемоглобина на 52-й неделе наблюдения относительно исходного среднего значения трех измерений концентрации гемоглобина непосредственно перед включением в исследование и двух предшествующих измерений. Исследование планировалось при мощности 80 % с целью детектировать разницу не менее 10,2 г/л при двустороннем уровне значимости 0,05 [26].
Вторичные конечные точки эффективности включали: число больных без снижения концентрации гемоглобина более чем на 20 % и количества тромбоцитов более чем на 20 % (при исходном их значении ≤120 х 10 9/л) и более 40 % (при исходном их значении >120 х 10 9/л), число больных с отсутствием увеличения селезенки более чем на 20 % и увеличения печени более чем на 10 %, частоту увеличения дозы препарата, число больных с отсутствием увеличения концентрации хемокина CCL-18 и ухудшения показателей краткого опросника для оценки качества жизни SF-36, частоту изменений состояния костной ткани и запасов накопленных метаболитов в костном мозге [26].
Анализ эффективности проводился по оценке первичных и вторичных конечных точек эффективности в популяции всех больных, включенных в исследование (full analyses set, FAS). Дополнительно анализ эффективности проводился в популяции больных, завершивших исследование без значительных отклонений от протокола (per protocol, PP). Все больные, получившие по крайней мере одну дозу препарата Глуразим или Церезим, были включены в анализ параметров безопасности. Из популяции больных, завершивших исследование без значительных отклонений от протокола, при проведении анализа эффективности были исключены 2 больных БГ в группе Глуразима. В первом случае причиной послужило развитие беременности после начала лечения, во втором случае была затруднена оценка результатов из-за несоблюдения больным режима введения препарата.
Для исследования иммуногенности использовались методы выявления антител против имиглюцеразы (титр антиимиглюцераза IgG и антиимиглюцераза IgE, их нейтрализующая активность) в сыворотке больных, разработанные и валидированные в ООО «МБЦ «Генериум»:
- метод иммуноферментного анализа (ИФА) с мостиковым конъюгированием с кислотной диссоциацией для выявления и подтверждения специфичности антител против имиглюцеразы;
- метод «сэндвич»-ИФА — для определения класса (IgG, IgE) и титра антител;
- ферментативный метод с использованием флуоресцентно меченого субстрата для определения нейтрализующей активности антител к имиглюцеразе.
Количественное определение хемокина CCL-18 в сыворотке больных проводили методом «сэндвич»-ИФА с использованием коммерческого набора реагентов RayBio® Human PARC ELISA Kit. Нижний предел количественного определения метода составил 10 нг/мл.
Статистический анализ. Для характеристики больных, включенных в исследование, использовали описательную статистику. Для каждого количественного показателя (возраст, масса тела, данные лабораторных анализов, жизненно важные показатели) были вычислены число непропущенных значений (а), минимальное и максимальное значение (min, max), арифметическое среднее (mean), стандартное отклонение (СО), 95 % доверительный интервал (ДИ) для среднего, медиана (Me), межквартильный интервал (МКИ). Качественные и категориальные показатели (пол, частота наличия отклонений по данным физикального осмотра и др.) были представлены абсолютными значениями, а также долями (%).
При анализе данных проводилось предварительное тестирование количественных переменных на нормальность распределения с помощью теста Шапиро — Уилка, а также теста на асимметрию и эксцесс с указанием значения р при тестировании нулевой гипотезы о нормальном распределении переменной. В случае нормального распределения для статистического анализа применялись параметрические тесты: t-тест, парный t-тест. При значительном отклонении от нормальности (р < 0,05) использовались непараметрические тесты: тест Манна — Уитни, тест Уилкоксона. Для оценки динамики показателей между визитами был использован тест Фридмана. Для сравнения частотных показателей между группами использовался Х2-критерий и, в случае необходимости, точный тест Фишера (если ожидаемая частота в какой-либо из ячеек была менее 5). Представление данных проводилось с использование общепринятых рекомендаций [27].
Результаты
Анализ групп лечения
В исследование было рандомизировано 30 больных БГ 1-го типа. Группы лечения были сопоставимы по демографическим показателям, антропометрическим данным, анамнезу заболевания и исходным характеристикам больных, включая концентрацию гемоглобина, хемокина CCL-18 и титр антилекарственных антител. Количество тромбоцитов в группе Глуразима было ниже, чем в группе Церезима, на 26,05 % (табл. 1 и 2). Учитывая, что изменение количества тромбоцитов рассчитывалось относительно их исходного значения, это несоответствие между группами было учтено при статистической обработке данных.
Таблица 1. Демографическая и антропометрическая характеристика больных БГ 1-го типа
Table 1. Demographic and anthropometric characteristics of type I GD patients
|
Параметры Parameters |
Глуразим Glurazyme (n = 15) |
Церезим Cerezyme (n = 15) |
|---|---|---|
|
Возраст (лет), среднее ± CO (разброс) Age (years), mean ± SD (range) |
32,1 ± 79 (19-53) |
33,8 ± 11,5 (23-63) |
|
Индекс массы тела (ИМТ) (кг/м2), среднее ± CO (разброс), Body mass index (BMI) (kg/m2), mean ± SD (range) |
22,51 ± 4,51 (15,8-31,1) |
21,73 ± 3,27 (16,7-275) |
|
Мужчины, n (%) Men, n (%) |
4/15 (26,7) |
7/15 (46,7) |
|
Женщины, n (%) Women, n (%) |
11/15 (73,3) |
8/15 (53,3) |
|
Европеоидная раса, n (%) Caucasians, n (%) |
15/15 (100,0) |
15/15 (100,0) |
Таблица 2. Исходные характеристики больных с болезнью Гоше 1 -го типа
Table 2. Baseline characteristics of patients with type I Gaucher disease
|
Параметры Parameters |
Глуразим Glurazyme (n =15) |
Церезим Cerezyme (n = 15) |
|---|---|---|
|
Активность в-глюкоцереброзидазы в лейкоцитах ниже нормы, число n (%) The activity of в-glucocerebrosidase in white blood cells below normal, n (%) |
13/13 (100,0)' |
12/12 (100,0)1 |
|
Мутация гена, кодирующего в-глюкоцереброзидазу, число (%) Mutation of the gene encoding в-glucocerebrosidase, n (%) |
2/8 (25,0)2 |
1/5 (20,0)2 |
|
Концентрация хемокина CCL-18 (нг/мл), среднее ± CO Concentration of chemokine CCL-18 (ng/ml), mean ± SD |
233,7 ± 90,3 |
335,2 ± 1978 |
|
Концентрация гемоглобина крови (г/л), среднее ± CO (разброс) Blood hemoglobin concentration (g/l), mean ± SD (range) |
128,1 ± 14,0 (105,0-159,7) |
129,5 ± 11,9 (109,3-148,7) |
|
Количество тромбоцитов крови (109/л), среднее ± CO (разброс) Number of blood platelets (109/L), mean ± SD (range) |
123,5 ± 62,7 (43,3-252,3) |
167,0 ± 105,8 (45,3-392,3) |
|
Объем селезенки (см3), среднее ± CO (разброс) Spleen volume (cm3), mean ± SD (range)3 |
1181,1 ± 727,0 (435-2561) |
9770 ± 681,7 (454-2503) |
|
Объем печени (см3), среднее ± CO (разброс) Liver volume, mean ± SD (range) |
1810,1 ± 399,7 (1225-2460) |
1790,2 ± 1017,3 (1126-5378) |
Примечание. 1,2— диагноз болезни Гоше был подтвержден по данным анамнеза низкой активностью β-глюкоцереброзидазы в лейкоцитах у 25 больных и/или наличием мутации гена, кодирующего β-глюкоцереброзидазу у 3 из 8 больных, по остальным больным данные отсутствовали; 3 — данные по объему селезенки отсутствовали у 4 больных группы Глуразима и у 6 больных группы Церезима в связи с проведенной ранее спленэктомией.
Note. 12 — the diagnosis of Gaucher disease was confirmed by medical history data: the low activity of β-glucocerebrosidase in leukocytes in 25 patients and / or the presence of the gene mutation encoding β-glucocerebrosidase in 3 of 8 patients; for the rest of the patients data were not available;3 — data on the spleen volume were not available for 4 patients in the Glurazyme group and for 6 patients in the Cerezyme group due to the previously conducted splenectomy.
Завершили исследование без значимых отклонений от протокола 28 больных. Из данной популяции при проведении анализа эффективности были исключены 2 больных БГ в группе Глуразима. В первом случае причиной послужило развитие беременности после начала лечения, во втором случае была затруднена оценка результатов из-за несоблюдения больным режима введения препарата.
Первичная конечная точка эффективности
В обеих группах больных наблюдалось схожее повышение концентрации гемоглобина на 52-й неделе по сравнению с исходными данными. В популяции всех больных, включенных в исследование, среднее увеличение концентрации гемоглобина на 52-й неделе составило 4,8 г/л. Различие в изменении концентраций гемоглобина в группах Глуразима и Церезима составило 0,1 г/л (95 % ДИ [-6,3; 6,4] г/л). В популяции больных, завершивших исследование без отклонений от протокола, среднее значение изменения концентрации гемоглобина в группе Глуразима, составило 4,6 г/л, в группе Церезима — 4,8 г/л; разность изменения концентрации гемоглобина составила 0,2 г/л (95 % ДИ [-6,8; 6,5] г/л). Среднее значение изменения концентрации гемоглобина на 52-й неделе у всех включенных больных было схожим в обеих группах и составило в группе Глуразима 4,0 % (95 % ДИ [0,0; 8,0]), а в группе Церезима — 3,8 % (95 % ДИ [0,1; 7,6]). При этом средние значения концентрации гемоглобина к концу исследования увеличились и составили в группе Глуразима 132,6 г/л (95 % ДИ [124,1; 141,1] и в группе Церезима — 134,3 г/л (95 % ДИ [126,7; 141,9]) (рис. 1).

Рисунок 1. Динамика концентрации гемоглобина в группах Глуразима и Церезима за время исследования (n = 30). Данные представлены в виде среднего значения и стандартной ошибки
Figure 1. Dynamics of the hemoglobin concentration in the Glurazyme and Cerezyme groups during the study (n = 30). The information is presented as an average value and a standard error
При анализе первичной конечной точки было проведено построение 95 % ДИ для разности в изменении концентрации гемоглобина на 52-й неделе наблюдения относительно исходного значения в обеих группах лечения. Нижняя граница рассчитанного 95 % ДИ для разности изменения концентрации гемоглобина на 52-й неделе в обеих популяциях не пересекала границу не меньшей эффективности исследуемого препарата, заданную на уровне 18 г/л относительно исходного значения, что подтвердило не меньшую эффективность Глуразима по сравнению с Церезимом (рис. 2).

Рисунок 2. Результаты анализа данных по первичной конечной точке эффективности (разница в изменении концентрации гемоглобина на 52-й неделе относительно исходного значения). Показаны точечная оценка и границы 95 % ДИ
Figure 2. Data analysis for the primary efficacy endpoint (the difference in the change of hemoglobin at 52 weeks relative to the initial value). Point estimation and 95 % CI boundaries are shown
Вторичные конечные точки эффективности
Обследование больных на 52-й неделе лечения не выявило ни одного больного со снижением концентрации гемоглобина крови более чем на 20 % от исходных значений. Выраженность изменения концентрации гемоглобина в обеих группах лечения была схожей как в популяции всех включенных в исследование больных (р = 0,826), так и среди больных, завершивших исследование (р = 0,718).
Уменьшение количества тромбоцитов более чем на 20 % (40 % при исходном их количестве >120 х 10 9/л) было отмечено только у одного больного из всех включенных в исследование (7,1 %) в группе Глуразима. Выраженность изменений количества тромбоцитов между группами статистически значимо не различалась как в популяции всех включенных в исследование больных (р = 0,072), так и среди больных, завершивших исследование (р = 0,125). Не обнаружено также существенных различий по числу больных с повышением или снижением количества тромбоцитов между группами. Среднее значение изменения количества тромбоцитов всех включенных больных на 52-й неделе в группе Глуразима было выше, чем в группе Церезима, и составило 15,7 % (95 % ДИ [—7,0; 38,3]) и 0,5 % (95 % ДИ [—7,1; 8,1]) соответственно. Это различие объяснялось исходно более низким значением показателя в группе Глуразима в сравнении с группой Церезима. При этом средние значения показателей количества тромбоцитов незначительно изменялись в ходе лечения и в конце исследования составили в основной группе 123,7 х 10 9/л (95 % ДИ [94,2; 153,3] и в группе сравнения — 159,9 х 10 9/л (95 % ДИ [108,8; 211,1]) (рис. 3). Статистически значимых отличий в изменении количества тромбоцитов между группами в ходе исследования не выявлено (р = 0,207).

Рисунок 3. Динамика количества тромбоцитов обеих группах за время исследования (п = 30). Планка погрешности показывает стандартную ошибку среднего
Figure 3. Dynamics of the number of platelets in both groups during the study (n =30). The error bar shows the standard error of the mean
Оценка объема селезенки проводилась у 11 больных в группе Глуразима и 9 больных в группе Церезима. У 4 больных в группе Глуразима и 6 больных в группе Церезима до включения в исследование была выполнена спленэктомия. Среднее уменьшение объема селезенки на 52-й неделе относительно исходного объема в обеих группах лечения у всех включенных в исследование больных было сопоставимым и составило в группе Глуразима 12,1 % (95 % ДИ [—20,7; —3,4]), в группе сравнения — 8,6 % (95 % ДИ [—16,2; —1,0]). Медиана значения объема селезенки уменьшалась в обеих группах в ходе лечения и на последнем визите составила в группе Глуразима 759 см 3 (МКИ 467—1820 см 3) и в группе Церезима — 637 см 3 (МКИ 489—986 см 3) (рис. 4). Статистически значимых отличий между средним изменением объема селезенки в обеих группах больных выявлено не было (р > 0,05). Ни у одного из больных, включенных в исследование, не наблюдалось увеличения объема селезенки на 52-й неделе лечения более чем на 20 %. Число больных с увеличением или уменьшением объема селезенки относительного исходного значения не различалось значимо между группами. У большинства больных обеих групп наблюдалось уменьшение объема селезенки в диапазоне от 0 до 35 % от исходного значения, число таких больных составило 9 (81,8 %) в группе Глуразима и 6 (66,7 %) — в группе Церезима.

Рисунок 4. Изменение объема селезенки (см3) по данным МРТ в двух группах лечения (п = 30)
Figure 4. Change in the spleen volume (cm3) according to MRI data in two treatment groups (n = 30)
Среди всех включенных в исследование больных в обеих группах отмечалось схожее уменьшение объема печени, которое составило 4,1 % (95 % ДИ [—8,8; 0,6]) в группе Глуразима и 3,3 % (95 % ДИ [—7,2; 0,7]) — в группе Церезима. Медиана значения объема печени уменьшилась в обеих группах к концу исследования и составила при лечении Глуразимом 1611 см 3 (МКИ 1497—2048 см 3) и при лечении Церезимом — 1497 см 3 (МКИ 1217-1671 см 3) (рис. 5).

Рисунок 5. Изменение объема печени (см3) по данным МРТ в двух группах лечения (n = 30)
Figure 5. Change in the liver volume (cm3) according to MRI data in two treatment groups (n = 30)
Анализ динамики объема печени на 52-й неделе относительно исходного объема выявил отсутствие больных с увеличением объема печени более 10 % в обеих группах. При межгрупповом сравнении число больных с различной степенью изменения объема печени статистически значимых различий не имели как в популяции всех включенных в исследование больных (p = 0,537), так и среди больных, завершивших исследование без существенных отклонений от протокола (р = 0,670).
Средняя концентрация хемокина ССЬ-18 в популяции всех больных, включенных в исследование, в группе Глуразима уменьшилась и составила 1,74 % (95 % ДИ [-26,58; 23,09]); в группе Церезима увеличилась и составила 5,92 % (95 % ДИ [-11,36; 23,19]). По данному показателю не было отмечено статистически значимых различий между группами (р > 0,05) как среди всех больных, включенных в исследование, так и среди больных, завершивших исследование (рис. 6).

Рисунок 6. Изменение концентрации хемокина CCL-18 в двух группах лечения (n = 30)
Figure 6. Changes in the concentration of CCL-18 chemokine in two treatment groups (n = 30)
Огабилизация или уменьшение концентрации хемокина ССЬ-18 были незначительно более выражены в группе Глуразима и наблюдались у 9 (64,3 %) больных в сравнении с группой Церезима — 6 (40 %) больных. Повышение концентрации хемокина ССС-18 отмечалось у 5 (35,7 %) больных в группе Глуразима и у 9 (60 %) больных в группе Церезима.
Стабилизация или улучшение физического компонента здоровья, по данным краткого опросника для оценки качества жизни SF-36 (версии 2), отмечались у 8 (57,1 %) больных в группе Глуразима и у 11 (73,3 %) — в группе Церезима. При этом ухудшение физического компонента здоровья было зарегистрировано у 6 (42,9 %) больных в группе Глуразима и у 4 (26,7 %) — в группе Церезима. Статистически значимых различий данного показателя между группами не отмечено (р > 0,05). Изменение среднего показателя физического компонента здоровья краткого опросника для оценки качества жизни SF-36 (версия 2) в обеих группах было незначительным и характеризовалось статистически недостоверным повышением или снижением показателя в пределах 1,3 балла от исходных значений (рис. 7).
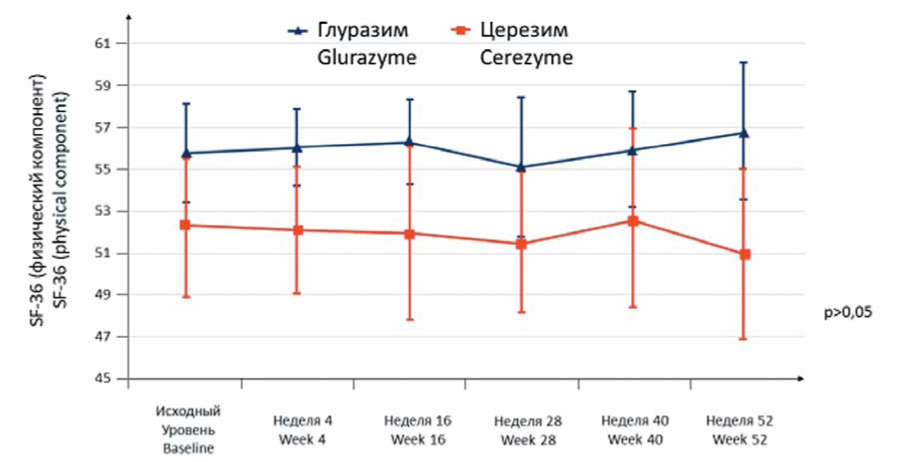
Рисунок 7. Динамика изменений физического компонента здоровья краткого опросника для оценки качества жизни SF-36 (версия 2) в обеих группах (n = 30)
Figure 7. Dynamics of changes in the physical health component in both groups (n = 30) according to the SF-36 (version 2) questionnaire for assessing the quality of life
Стабилизация или улучшение психического компонента здоровья по данным краткого опросника для оценки качества жизни SF-36 (версии 2) отмечались у 8 (57,1 %) больных в группе Глуразима и у 9 (60 %) — в группе Церезима. При этом ухудшение психического компонента здоровья отмечалось у 6 (42,9 %) больных в группе Глуразима и у 6 (40,0 %) больных — в группе Церезима (рис. 10). Статистически значимых различий данного показателя между группами среди всех больных, включенных в исследование, и больных, завершивших исследование, не установлено (р > 0,05). Изменение среднего показателя психического компонента здоровья краткого опросника для оценки качества жизни SF-36 (версия 2) в обеих группах было волнообразным и характеризовалось статистически недостоверным повышением и снижением показателя в диапазоне от 0,1 до 3,8 балла относительно предшествующих значений. В конце исследования показатель был аналогичен исходным значениям в обеих группах (рис. 8).

Рисунок 8. Динамика изменений психического компонента здоровья краткого опросника для оценки качества жизни SF-36 (версия 2) в обеих группах (n = 30)
Figure 8. Dynamics of changes in the mental health component in both groups (n = 30) according to the SF-36 (version 2) questionnaire for assessing the quality of life
Изменения в состоянии костной ткани по данным МРТ на 52-й неделе были отмечены у 3 больных (21,4 %) в группе Глуразима и 2 больных (13,3 %) в группе Церезима. Все изменения были благоприятными и сопровождались уменьшением инфильтрации костного мозга. Неблагоприятные изменения костной ткани отсутствовали у больных в обеих группах. Межгрупповой анализ по частоте изменения состояний костной ткани не выявил статистически значимых различий в обеих группах лечения (р = 0,459) (табл. 3).
Таблица 3. Результаты оценки состояния костной ткани по данным МРТ в двух группах лечения
Table 3. Assessment results of the bone tissue according to MRI data in two treatment groups
|
Результат оценки Assessment result |
Глуразим (η = 15) Glurazyme (n = 15) |
Церезим (η =15) Cerezyme (n = 15) |
p (тест Фишера) p (Fisher's test) |
|---|---|---|---|
|
Неблагоприятные изменения костной ткани, n Adverse changes in the bone tissue, n |
0 |
0 |
- |
|
Благоприятные изменения костной ткани, n (%) Favourable changes in the bone tissue, n (%) |
3/14 (21,4 %) |
2/15 (13,3 %) |
0,459 |
|
Отсутствие изменений костной ткани у больных без патологии, n (%) Lack of changes in the bone tissue in patients without pathology, n (%) |
3/14 (21,4 %) |
1/15 (6,7 %) |
|
|
Отсутствие изменений костной ткани у больных с патологией (инфильтрация/остеонекрозы), n (%) Lack of changes in the bone tissue in patients with pathology (infiltration/osteonecrosis), n (%) |
8/14 (571 %) |
12/15 (80,0 %) |
|
В ходе проведенного исследования за 52 недели лечения ни одному из больных не потребовалось увеличения дозы имиглюцеразы.
Таким образом, эффективность препаратов Глуразим и Церезим при проведении ЗФТ у взрослых больных БГ 1-го типа по всем изученным показателям была сходной как в популяции всех включенных в исследование больных, так и среди больных, завершивших исследование без значительных отклонений от протокола.
Безопасность
На протяжении всего исследования не было зарегистрировано ни одной нежелательной реакции, что указывало на безопасность применения препарата в лечении больных БГ 1-го типа. Были отмечены нежелательные явления максимальной степени тяжести 1 или 2, которые у большинства больных были связаны с нарушениями со стороны желудочно-кишечного тракта или относились к транзиторным изменениям лабораторных или инструментальных данным. Доля больных с нежелательными явлениями была сходной в обеих группах лечения. Было зарегистрировано одно серьезное нежелательное явление (синдром «раздраженного кишечника»), которое не имело связи с исследуемым препаратом, потребовало госпитализации больного и разрешилось без последствий.
Беременность больной, получившей одно введение Глуразима и исключенной из исследования, отслеживалась до момента родоразрешения на сроке 38 недель. В период беременности у больной не было зарегистрировано нежелательных явлений, ребенок родился здоровым.
Иммуногенность. В процессе проведения исследования ни у одного из больных в обеих группах лечения не было обнаружено нейтрализующей активности антител к имиглюцеразе. Антилекарственные антитела — антиимиглюцераза IgG в титре 1:20 — были выявлены перед включением в исследование у одного больного из группы Церезима, они не обладали нейтрализующей активностью и сохранялись в том же титре на протяжении всего исследования. В ходе исследования антиимиглюцераза IgE у всех больных отсутствовала, нейтрализующую активность антител к имиглюцеразе не обнаружили.
Обсуждение
Эффективное лечение рекомбинантными препаратами ведет к стабилизации течения заболевания, увеличению продолжительности и качества жизни больных БГ [28]. Развитие биотехнологий и создание высокоэффективных биоаналогичных лекарственных препаратов отечественного производства повышает доступность лечения и расширяет сферу их применения у больных редкими метаболическими заболеваниями.
В данном исследовании впервые сравнены эффективность и безопасность первого в мире биоаналогичного препарата Глуразим (имиглюцераза) с референтным препаратом Церезим у больных БГ 1-го типа.
Нормативные требования, предъявляемые на всех этапах разработки и производства биоаналогичного препарата, направлены на обеспечение максимальной сопоставимости разрабатываемого продукта с референтным препаратом и позволяют обосновать подобие препаратов по качеству, безопасности и эффективности в сравнительных исследованиях. Необходимым условием является доказательство сопоставимости биоаналога с оригинальным препаратом по эффективности и безопасности, что, согласно регуляторным нормам, требует использования наиболее информативных критериев для оценки динамики лечения конкретного заболевания [16-18].
По результатам исследования был проведен анализ данных в отношении показателя первичной конечной точки эффективности — увеличения концентрации гемоглобина, который показал схожее его повышение на 52-й неделе по сравнению с исходными данными в обеих группах. При этом разность изменения концентрации гемоглобина между группами составила 0,1 г/л, а 95 % ДИ для разности изменения концентрации гемоглобина составил (-6,3; 6,4) г/л и не вышел за границу не меньшей эффективности препарата, заданную на уровне -18 г/л, что указывало на не меньшую эффективность исследуемого препарата Глуразим по сравнению с препаратом Церезим.
При оценке вторичных конечных точек эффективности были выявлены сопоставимые изменения в обеих группах. В исследовании не было выявлено больных со снижением концентрации гемоглобина крови более чем на 20 % от исходных значений, а снижение количества тромбоцитов более чем на 20 % (40 % при исходном их количестве >120 х 10 9/л) было отмечено только у одного больного из всех включенных в исследование (7,1 %) в группе Глуразима. Вместе с тем выраженность изменений концентрации гемоглобина и количества тромбоцитов, а также число больных с изменением данных показателей между группами статистически значимо не различались, что подтверждало стабильность течения БГ аналогично другим исследованиям [9].
В результате лечения отмечалось уменьшение объемов печени и селезенки по результатам МРТ у большинства больных, сопоставимое в обеих группах. Случаев увеличения объема селезенки более чем на 20 % и печени более чем на 10 % на фоне лечения в обеих группах не зарегистрировано.
В обеих группах на фоне лечения отмечались схожие незначительные колебания концентрации хемокина CCL-18, которая была исходно характерно повышена для БГ 1-го типа [24]. В группе Глуразима у 10 больных (64,3 %) отмечалась тенденция к снижению концентрации хемокина CCL-18, тогда как в группе Церезима у большинства больных (60 %) отмечалось его незначительное повышение, не сопровождавшееся статистически значимыми отличиями между группами, что могло указывать на стабильное течение болезни в результате эффективного лечения [23].
Сохранение стабильности течения заболевания в обеих группах лечения подтверждалось также стабилизацией или улучшением физического и психического компонентов здоровья по данным SF-36v2® у большей части больных в обеих группах, уменьшением инфильтрации костного мозга или отсутствием изменений костной ткани по данным МРТ у больных в группах лечения, отсутствием потребности в увеличении дозы имиглюцеразы в исследовании.
На протяжении всего исследования не было зарегистрировано ни одной нежелательной реакции, в том числе не отмечено образования антилекарственных антител в обеих группах, что указывало на безопасность применения препарата Глуразим в лечении больных БГ 1-го типа и подтверждало данные полученные в клиническом исследовании I фазы [22].
Таким образом, в результате проведенного клинического исследования II-III фазы течение болезни Гоше у всех больных, завершивших исследование без значительных отклонений от протокола, оставалось стабильным при лечении обоими препаратами в дозе 15—40 ЕД/кг. Была установлена не меньшая эффективность биоаналогичного препарата Глуразим в сравнении с референтным препаратом Церезим по первичной конечной точке эффективности — разности изменения концентрации гемоглобина, а также отсутствие значимых различий по вторичным конечным точкам эффективности. Показана безопасность и отсутствие иммуногенности препарата Глуразим в течение 52 недель. Полученные данные свидетельствуют о сопоставимости препарата Глуразим и препарата Церезим по эффективности и безопасности при проведении долгосрочной ЗФТ у больных болезнью Гоше 1-го типа.
Список литературы
1. Давыдова А.В. Лизосомные болезни накопления: болезнь Гоше. Сибирский медицинский журнал. 2009; (5): 9–15.
2. Лукина Е.А. Болезнь Гоше. Практическое руководство. M.: Литтерра, 2014. 64 с.
3. Лукина Е.А. Болезнь Гоше: современная диагностика и лечение. Клиническая онкогематология. 2009; (2): 196–8.
4. Лукина Е.А. Протокол ведения пациентов с болезнью Гоше. Онкогематология. 2009; (1): 65–71.
5. Andersson H., Kaplan P., Kacena K., Yee J. Eight-year clinical outcomes of long-term enzyme replacement therapy for 884 children with Gaucher disease type 1. Pediatrics. 2008; 122(6): 1182–90.
6. Camelo Jr. J.S., Cabello J.F., Drelichman G.G. et al. Long-term effect of imiglucerase in Latin American children with Gaucher disease type 1: lessons from the International Collaborative Gaucher Group Gaucher Registry. BMC Hematol. 2014; 14: 1–10.
7. Cox T.M. Gaucher disease: clinical profile and therapeutic developments. Biologics. 2010; 4: 299–313. DOI: 10.2147/BTT.S7582.
8. Drelichman G., Ponce E., Basack N. et al. Clinical consequences of interrupting enzyme replacement therapy in children with type 1 Gaucher disease. J Pediatr. 2007; 151(2): 197–201.
9. Pastores G.M., Petakov M., Giraldo P. et al. A Phase 3, multicenter, open-label, switchover trial to assess the safety and efficacy of taliglucerase alfa, a plant cellexpressed recombinant human glucocerebrosidase, in adult and pediatric patients with Gaucher disease previously treated with imiglucerase. Blood Cells Mol Dis. 2014; 53: 253–60.
10. Mistry P.K., Weinreb N.J., Kaplan P. et al. Osteopenia in Gaucher disease develops early in life: response to imiglucerase enzyme therapy in children, adolescents and adults. Blood Cells Mol Dis. 2011; 46(1): 66–72.
11. Gaucher disease. A Strategic Collaborative Approach from EMA and FDA. 2014; 9. WWW document. URL: https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/gaucher-disease-strategic-collaborative-approach-european-medicines-agency-food-drug-administration_en.pdf.
12. Пономарев Р.В., Лукина К.А., Сысоева Е.П. и др. Поддерживающий режим заместительной ферментной терапии у взрослых больных болезнью Гоше I типа: предварительные результаты. Гематология и трансфузиология. 2019; 64(3): 331–41. DOI: 10.35754/0234-5730-2019-64-3-331-341.
13. Expert committee on biological standardization. Guidelines of evolution of similar biotherapeutic product. WHO. Geneva. 2009; 34. WWW document. URL: https://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL2010.pdf.
14. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (revision 1). EMA/CHMP/ BWP/247713/ 2012; 9. WWW document. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-similar-biological-medicinal-products-containing-biotechnology-derived-proteins-active_en-0.pdf.
15. Guideline on similar biological medicinal products containing monoclonal antibodies — non-clinical and clinical issues EMA/CHMP/BMWP/403543/2010; 16. WWW document. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-similar-biological-medicinal-products-containingmonoclonal-antibodies-non-clinical_en.pdf.
16. Guidance for Industry Scientific Considerations in Demonstrating Biosimilarity to a Reference Product CDER/CBER/ 2015; 24. WWW document. URL: https://www.fda.gov/media/82647/download.
17. Иванов Р., Секарёва Г., Кравцова О., и др. Правила проведения исследований биоаналоговых лекарственных средств (биоаналогов). Фармакокинетика и фармакодинамика. 2014. 1: 21–36.
18. Решение Совета Евразийской экономической комиссии № 89 от 03.11.2016 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза». Астана, 2016. 714 с. Режим доступа: [Электронный ресурс]. URL: http://docs.cntd.ru/document/456026116.
19. Committee for Medicinal Products for Human Use (CHMP) Guideline on the Clinical Investigation of the Pharmacokinetics of Therapeutic Proteins. 2007. London. Doc. Ref. CHMP/EWP/89249/ 2004; 11. WWW document. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-investigation-pharmacokinetics-therapeutic-proteins_en.pdf.
20. Вассарайс Р.А., Чащинова Д.В., Шамонов Н.А. и др. Современные подходы к обеспечению вирусной безопасности лекарственных препаратов, произведенных по технологии рекомбинантной ДНК в клетках млекопитающих / Биотехнология: состояние и перспективы развития Материалы международного конгресса. 2019. С. 288–289.
21. Дегтерев М.Б., Смолов М.А., Вишневский А.Ю., Шукуров Р.Р. Физикохимическая характеризация имиглюцеразы биоаналогичного и референтного препарата масс-спектрометрическими методами / Биотехнология: состояние и перспективы развития. Материалы международного конгресса. 2019. С. 302–303.
22. Фитилёв С.Б., Возжаев А.В., Шкребнева И.И. и др. Результаты открытого рандомизированного сравнительного перекрестного клинического исследования I фазы по оценке безопасности и фармакокинетики препарата Глуразим (имиглюцераза) в сравнении с референтным препаратом у здоровых добровольцев. Онкогематология. 2019; 14(4): 73–83. DOI: 10.17650/1818-8346-2019-14-4-73-83.
23. Boot R.G., Verhoek M., de Fost M., Hollak C.E. et al. Marked elevation of the chemokine CCL18/PARC in Gaucher disease: a novel surrogate marker for assessing therapeutic intervention. Blood. 2004; 103(1): 33–9. DOI: 10.1182/blood-2003-05-1612.
24. Соловьева А.А., Яцык Г.А., Пономарев Р.В. и др. Обратимые и необратимые изменения костно-суставной системы при болезни Гоше I типа. Гематология и трансфузиология. 2019; 64(1): 49–59. DOI: 10.35754/0234-57302019-64-1-49-59.
25. Ware J. E. Jr, Kosinski M., Bjorner J. B. et al. SF-36v2 ® health survey: Administration guide for clinical trial investigators. Lincoln, RI: QualityMetric Incorporated, 2008.
26. Pastores G.M., Weinreb N.J., Aerts H. et al. Therapeutic goals in the treatment of Gaucher disease. Semin. Hematol. 2004; 41: 4–14.
27. Мамаев А.Н., Кудлай Д.А. Визуализация данных в презентациях, отчетах и исследованиях. М.: Практическая медицина, 2011. 39 с.
28. Serratrice C., Carballo S., Serratrice J., Stirnemann J. Imiglucerase in the management of Gaucher disease type 1: an evidence-based review of its place in therapy. Core Evid. 2016; 11: 37–47. DOI: 10.2147/CE.S93717.
Об авторах
Е. П. СысоеваРоссия
Сысоева Елена Павловна – старший научный сотрудник, кандидат медицинских наук, врач-гематолог отделения орфанных заболеваний.
125167, Москва
Р. В. Пономарев
Россия
Пономарев Родион Викторович – научный сотрудник, врач-гематолог отделения орфанных заболеваний.
125167, Москва
тел. +7 (495) 612-43-32
К. А. Лукина
Россия
Лукина Кира Анатольевна – научный сотрудник, кандидат медицинских наук, врач-гематолог отделения орфанных заболеваний.
125167, Москва
тел. +7 (495) 612-43-32
Р. Б. Чавынчак
Россия
Чавынчак Роланда Бопуй-ооловна – врач-гематолог, заместитель заведующей отделением орфанных заболеваний.
125167, Москва
тел. +7 (495) 612-43-32
С. Б. Короткова
Россия
Короткова Светлана Борисовна – кандидат медицинских наук, младший менеджер проектов клинических исследований.
123112, Москва
тел. +7 (495) 988-47-94
М. В. Жиляева
Россия
Жиляева Мария Владимировна – научный сотрудник отдела аналитический методов.
601125, Владимирская область, п. Вольгинский
тел. +7 (49243) 7-31-04
Е. Г. Никитина
Россия
Никитина Елена Григорьевна – химик отдела аналитический методов.
601125, Владимирская область, п. Вольгинский
тел. +7 (49243) 7-31-04
О. А. Маркова
Россия
Маркова Оксана Анатольевна – начальник научного отдела.
123112, Москва
тел. +7 (495) 988-47-94
Е. В. Гапченко
Россия
Гапченко Елена Васильевна – заместитель генерального директора по вопросам клинических исследований, фармаконадзора и регистрации.
123112, Москва
тел. +7 (495) 988-47-94
А. М. Шустер
Россия
Шустер Александр Михайлович – советник генерального директора АО «ГЕНЕРИУМ» по научным разработкам, президент, член Совета директоров ООО «МБЦ «Генериум».
123112, Москва
601125, Владимирская область, п. Вольгинский
тел. +7 (495) 988-47-94
Д. А. Кудлай
Россия
Кудлай Дмитрий Анатольевич – доктор медицинских наук, профессор, генеральный директор.
123112, Москва
тел. +7 (495) 988-47-94
Е. А. Лукина
Россия
Лукина Елена Алексеевна – доктор медицинских наук, профессор, заведующая отделением орфанных заболеваний.
125167, Москва
тел. +7 (495) 612-09-23
Рецензия
Для цитирования:
Сысоева Е.П., Пономарев Р.В., Лукина К.А., Чавынчак Р.Б., Короткова С.Б., Жиляева М.В., Никитина Е.Г., Маркова О.А., Гапченко Е.В., Шустер А.М., Кудлай Д.А., Лукина Е.А. Оценка эффективности и безопасности биоаналогичного препарата Глуразим (имиглюцераза) у больных болезнью Гоше I типа. Гематология и трансфузиология. 2020;65(1):8-23. https://doi.org/10.35754/0234-5730-2020-65-1-8-23
For citation:
Sysoeva E.P., Ponomarev R.V., Lukina K.A., Chavynchak R.B., Korotkova S.B., Zhilyaeva M.V., Nikitina E.G., Markova O.A., Gapchenko E.V., Shuster A.M., Kudlay D.A., Lukina E.A. Evaluation of the efficacy and safety of the biosimilar drug Glurazyme (imiglucerase) in patients with Gaucher disease type 1. Russian journal of hematology and transfusiology. 2020;65(1):8-23. (In Russ.) https://doi.org/10.35754/0234-5730-2020-65-1-8-23











































