Перейти к:
Влияние криоконсервирования на показатели апоптоза мононуклеаров при проведении экстракорпорального фотофереза
https://doi.org/10.35754/0234-5730-2021-66-3-386-394
Аннотация
Введение. Механизм действия экстракорпорального фотофереза (ЭКФ) связан с индукцией апоптоза лимфатических клеток, которые вызывают активацию антигенпрезентирующих клеток (АПК). В результате применения ЭКФ повышается количество Т-регуляторных лимфоцитов, что индуцирует иммуносупрессивный эффект. Актуальной является проблема использования криоконсервирования мононуклеаров, подвергшихся фотооблучению.
Цель — анализ функциональных особенностей криоконсервированных после ЭКФ мононуклеаров.
Материалы и методы. В исследовании проанализированы показатели ранней и поздней стадии апоптоза в концентрате мононуклеаров разных групп в зависимости от времени забора и типа воздействия на данные концентраты мононуклеаров: непосредственно после афереза (группы 1.1 и 1.2), и после ЭКФ (группы 1.3, 2.1 и 2.2), группы 1.2 и 2.2 подвергались криоконсервированию, а 1.3 — криоконсервированию с последующим проведением ЭКФ.
Суммарно проанализировано 113 образцов концентратов мононуклеаров, полученных у 12 больных с хронической реакцией «трансплантат против хозяина» (РТПХ). Все группы образцов были культивированы для определения динамики изменения показателей ранней и поздней стадии апоптоза с течением времени.
Результаты. Доля лимфоцитов в поздней стадии апоптоза через двое суток культивирования после стандартной процедуры ЭКФ была сопоставима с долей лимфоцитов в поздней стадии апоптоза при проведении ЭКФ с последующим криоконсервированием лейкоконцентрата.
Заключение. Целесообразно проведение сбора мононуклеаров, выполнение их экстракорпорального фотооблучения и в дальнейшем разделение фотооблученных мононуклеаров на несколько частей как для криоконсервирования, так и для возврата некриоконсервированных фотооблученных мононуклеаров больному.
Ключевые слова
Для цитирования:
Васильева В.А., Кузьмина Л.А., Петинати Н.А., Дризе Н.И., Камельских Д.В., Гапонова Т.В., Никифорова К.А., Давыдова Ю.О., Капранов Н.М., Гальцева И.В., Паровичникова Е.Н., Савченко В.Г. Влияние криоконсервирования на показатели апоптоза мононуклеаров при проведении экстракорпорального фотофереза. Гематология и трансфузиология. 2021;66(3):386-394. https://doi.org/10.35754/0234-5730-2021-66-3-386-394
For citation:
Vasilyeva V.A., Kuzmina L.A., Petinati N.A., Drize N.I., Kamelskikh D.V., Gaponova T.V., Nikiforova K.A., Davidova Yu.O., Kapranov N.M., Galtceva I.V., Parovichnikova E.N., Savchenko V.G. The effect of cryopreservation on the parameters of mononuclear apoptosis during extracorporeal photopheresis. Russian journal of hematology and transfusiology. 2021;66(3):386-394. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-3-386-394
Введение
Экстракорпоральный фотоферез (ЭКФ) — это многоступенчатая циклическая процедура, в которой мононуклеары больного подвергаются облучению ультрафиолетом спектра А (УФА) (1–2 Дж/см 2) с использованием фотосенсибилизатора 8-метоксипсоралена (8-МОП) в концентрации 60–400 нг/мл. ЭКФ используют для лечения аутоиммунных заболеваний, кожных Т-клеточных лимфом, при трансплантации солидных органов с целью профилактики отторжения трансплантата и для лечения острой и хронической форм реакции «трансплантат против хозяина» (РТПХ) [1–13]. ЭКФ позволяет достичь должного ответа на терапию по сравнению с иммуносупрессивными/химиотерапевтическими агентами, но при этом легче переносится больными, безопаснее, не имеет значимых побочных явлений и длительно текущих осложнений [14–16]. В настоящее время не существует регламента, устанавливающего схему проведения процедур ЭКФ: их проводят от 1–3 раз в неделю до 4–8 в месяц [17]. План проведения устанавливается эмпирически на основании ответа на терапию [17]. Для оценки эффективности лечения РТПХ важно не количество облученных и перелитых клеток, а степень тяжести органного поражения и сроки начала терапии ЭКФ [18, 19]. У больных, у которых получен ответ на терапию ЭКФ, отмечено значимое улучшение качества жизни и выживаемости [14–16]. Учитывая периодически возникающие трудности с сосудистым доступом, длительностью процедуры, невозможностью проведения афереза лейкоцитов на фоне лейкопении у больных с острой РТПХ и высокую стоимость расходных материалов, актуальным становится вопрос о возможности криоконсервирования мононуклеаров, подвергшихся фотооблучению.
Цель настоящей работы — анализ функциональных особенностей криоконсервированных после ЭКФ мононуклеаров.
Материалы и методы
Больные
В исследование было включено 12 больных с хронической РТПХ (хрРТПХ), из них 5 женщин и 7 мужчин, в возрасте от 19 до 68 лет (медиана — 35 лет), которым в 2017–2019 гг. была выполнена терапия ЭКФ. Основным заболеванием, по поводу которого была выполнена трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК), у 10 больных был острый лейкоз, у 2 — лимфопролиферативные заболевания. У 11 больных алло-ТГСК была выполнена от полностью совместимого донора (у 5 больных — от родственных доноров и у 6 больных — от неродственных доноров) и у 1 больной — от гаплоидентичного донора. Всем больным проводили ЭКФ для лечения хрРТПХ, рефрактерной к терапии глюкокортикостероидными гормонами. Ответ на терапию хрРТПХ оценивали по 3 категориям: полный ответ — полное обратное развитие всех проявлений хрРТПХ; частичный ответ — регресс (полный или частичный) клинических проявлений хотя бы в одном органе-мишени, при отсутствии прогрессии по другим органам-мишеням; отсутствие ответа — включало в себя «отсутствие каких-либо изменений»; смешанный ответ — улучшение по ранее затронутому органу-мишени, при наличии прогрессии в другом органе-мишени и прогрессия хрРТПХ. Сочетание полного и частично ответа рассматривали как общий ответ.
У 5 больных исследование концентрата мононуклеаров проводили от 2 до 4 раз в разные дни с интервалом более 1 недели, а у 7 больных — однократно.
Аферез и процессинг мононуклеаров
Аферез мононуклеаров проводили на клеточном сепараторе «SpectraOptia» («Terumo BCT», Япония/США) в режиме сбора мононуклеаров (МНК) со следующими параметрами процедуры: соотношение кровь/антикоагулянт — 12:1; настройка сбора (collection preferred) — 40. В результате было обработано от 0,8 до 1,7 от объема циркулирующей крови (медиана — 1,19), медиана времени процедуры — 180 мин (120–250 мин), медиана объема полученного концентрата мононуклеаров составила 85 мл (60–120 мл).
Для исследования были сформированы 5 видов проб концентрата мононуклеаров (рис. 1):
1.1. Мононуклеары после афереза без замораживания и без проведения ЭКФ (n = 25 проб);
1.2. Мононуклеары после афереза после замораживания и без проведения ЭКФ (n = 19);
1.3. Мононуклеары после афереза после замораживания и c проведением ЭКФ после размораживания (n = 25);
2.1. Мононуклеары после проведения ЭКФ без замораживания (n = 25);
2.2. Мононуклеары после проведения ЭКФ с последующим замораживаем и размораживанием (n = 19).
Образцы для исследования отбирались непосредственно после афереза (группы 1.1 и 1.2), и после ЭКФ (группы 1.3, 2.1 и 2.2). Образцы групп 1.1, 1.2 и 1.3 отбирали из контейнера системы для сбора мононуклеаров («Spectra Optia Collection Set 10110», «TerumoBCT», Япония/США) во встроенный в систему контейнер для отбора проб. В оставшийся лейкоконцентрат добавляли изотонический раствор хлорида натрия до достижения общего объема продукта 300 мл, после чего в ламинарном шкафу производили отбор пробы для контроля параметров продукта на гематологическом анализаторе («Sysmex KX-21n», Япония) перед облучением: количество лейкоцитов в концентрате мононуклеаров составило 1,9–10 × 10 9 (медиана — 5,85 × 10 9), гематокрит — 0,2–2,1 % (медиана — 0,8 %). Концентрат мононуклеаров переливали в специальный контейнер для облучения с последующим удалением воздуха из него. Затем в затемненном помещении в продукт добавляли 8-МОП (METOXSALENE S. A.L.F SpA, Италия) в дозе 200 нг/мл и инкубировали в течение 5 мин. Облучали на аппарате «Macogenic G2» («Macopharma», Франция) согласно рекомендациям производителя: продолжительность облучения составила от 546 до 682 с (медиана — 606 с) в дозе 2 Дж/см 2. После облучения, также в условиях ламинарного шкафа (Nuaire, NU-481–400E, США), производили отбор образцов 2.1 и 2.2. Часть образцов анализировались сразу (группы 1.1 и 2.1), а часть замораживали при –70 °C и анализировали после размораживания (группы 1.2 и 2.2). После размораживания в пробу 1.3 добавляли 8-МОП (METOXSALENE S. A.L.F SpA, Италия) в дозе 200 нг/мл и облучали на аппарате «Macogenic G2» («Macopharma», Франция) с аналогичными параметрами облучения, а после анализировали аналогично остальным группам. По 5 образцов из каждой группы анализировали до и после 48 ч культивирования, чтобы проверить изменение показателей апоптоза в динамике.
Криоконсервирование клеток. Суспензии мононуклеаров в объеме 100 мкл замораживали в холодном растворе 6 %-ного полиглюкина с добавлением 100 мкл 10 %-ного диметилсульфоксида. Замороженные клетки хранили при температуре –70 °C не менее 2 сут. Размораживание осуществляли при 37 °C и отмывали средой RPMI1640 с 10 %-ной инактивированной человеческой сывороткой IV группы.
Культивирование мононуклеаров. Поскольку в разных популяциях лейкоцитов апоптоз запускается с различной скоростью на протяжении нескольких суток, 5 образцов из каждой группы были культивированы для определения динамики изменения показателей раннего и позднего апоптоза с течением времени. Культивирование проводили в среде RPMI1640 с добавлением 10 %-ной инактивированной человеческой сыворотки IV группы, 2 мМ глютамина, 100 ед./мл пенициллина и 50 мкг/мл стрептомицина. Клетки рассаживали по 10 6 на мл в 24-ячеечные планшеты. Мононуклеары культивировали в течение 2 сут. при температуре 37 °C и 5 % СО2. Подсчет клеток производили в камере Горяева после окраски генцианвиолетом на 3 %-ной уксусной кислоте или 0,5 %-ным трипановым синим.
Проточная цитометрия. Для оценки апоптоза клеток использовали коммерческий набор FITC Annexin V Apoptosis Detection Kit I («BD Biosciences», США), включающий аннексин V FITC и пропидия йодид (PI). Для отделения лейкоцитов использовали анти-CD45 APC–Cy7 моноклональные антитела (клон 2D1). Для окрашивания брали около 0,2 × 10 6 клеток, отмывали 1 мл среды RPMI1640 с 10 %-ной человеческой инактивированной сывороткой IV группы. Осадок ресуспендировали в 100 мкл аннексин-связывающего буфера и вносили антитела согласно инструкции к набору. Инкубировали 20 мин при комнатной температуре. После этого добавляли к образцу еще 400 мкл аннексин-связывающего буфера и проводили цитометрический анализ с помощью проточного цитофлуориметра BD FACSCanto II («BD Biosciences», США). Цитометрический анализ включал в себя выделение гейта лимфоцитов, основываясь на высоком показателе экспрессии антигена CD45 и низких показателях прямого и бокового светорассеяния этих клеток, последующее определение количества клеток на ранней и поздней стадиях апоптоза. На ранних стадиях апоптоза считались клетки, которые связывались только с аннексином V, а на поздних стадиях — с аннексином V и с пропидия йодидом [20] (рис. 2).

Рисунок 1. Схема эксперимента
Figure 1. Scheme of experiment
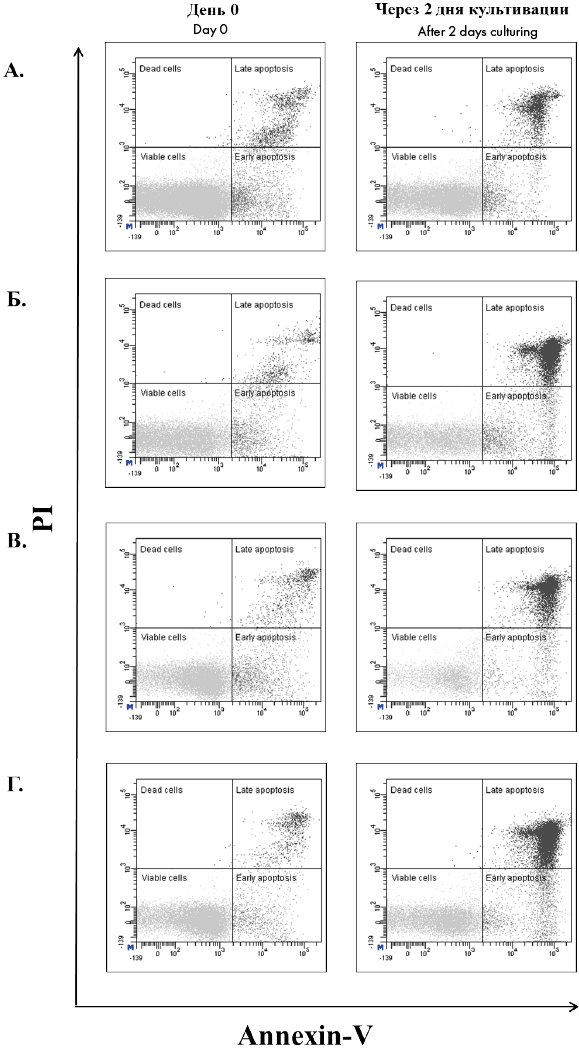
Рисунок 2. Пример цитометрического анализа маркеров апоптоза лимфоцитов в образцах лейкоконцентрата. А — отрицательный контроль (клетки без обработки и заморозки, из группы 1.1); Б — положительный контроль (клетки после ЭКФ, без замораживания, из группы 2.1); В — клетки, подвергнутые ЭКФ после замораживания и размораживания (группа 1.2); Г — клетки, подвергнутые ЭКФ, а затем замороженные и размороженные (группа 2.2)
Figure 2. An example of a cytometric analysis of lymphocytes apoptosis markers. A — negative control (cells without processing and cryopreserving, group 1.1); B — positive control (cells after ECP, without cryopreserving, group 2.1); C — cells after cryopreserving, thawing, and ECP (group 1.2); D — cells after ECP, cryopreserving and thawing (group 2.2)
Статистический анализ. Статистический анализ данных проводили с помощью GraphPad Prism 6. Проверку нормальности распределения выполняли с использованием критерия Шапиро — Уилка. Сравнение полученных данных осуществляли с помощью парного критерия Уилкоксона с поправками на множественное сравнение. Значимыми признавались отличия при p < 0,05.
Результаты
Доля клеток в ранней стадии апоптоза (рис. 3 А) была больше в образцах, подвергшихся замораживанию и размораживанию без ЭКФ (1.2), замораживанию и размораживанию с последующим ЭКФ (1.3) и ЭКФ с последующим замораживанием и размораживанием (2.2) по сравнению с образцами группы после ЭКФ без замораживания и размораживания (группа 2.1). Но при сравнении с группой контроля (1.1 — клетки после афереза) достоверные отличия были выявлены только для групп, в которых клетки только замораживали и размораживали (1.2) и замораживали после ЭКФ (2.2) (p < 0,05).
Доля клеток в поздней стадии апоптоза (рис. 3 Б) увеличивалась во всех группах, в которых проводили замораживание и размораживание (1.2, 1.3 и 2.2) по сравнению с группой контроля после афереза (1.1). При сравнении опытных групп с группой после ЭКФ без замораживания и размораживания (2.1) отмечено увеличение доли клеток в поздней стадии апоптоза как в после замораживания и размораживания (1.2), так и замораживании до ЭКФ (1.3) и после ЭКФ (2.2) (p < 0,05).
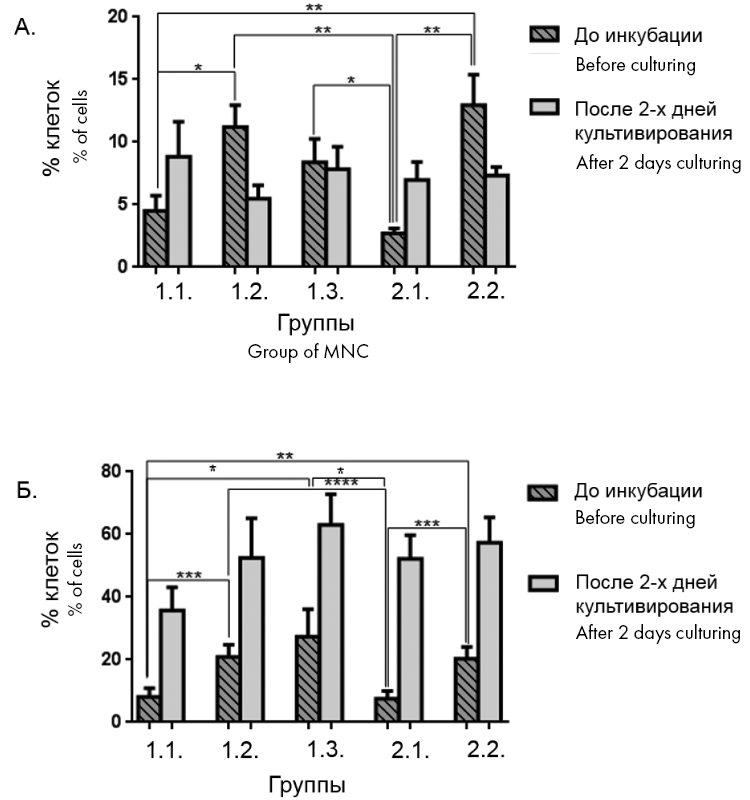
Рисунок 3. Количество лимфоцитов в ранней (А) и поздней (Б) стадиях апоптоза в исследованных лейкоконцентратах
Примечание. * — p < 0,05.
Figure 3. Lymphocytes in early (A) and late (B) apoptosis stages
Note. * — p < 0.05.
Обсуждение
Впервые в 2011 г. E. Merlin и соавт. [21] показали, что криоконсервирование мононуклеаров до ЭКФ не влияет на их иммуномодулирующие свойства после ЭКФ. С. Pochon и соавт. [22] установили, что частота достижения общего ответа у больных на терапию хрРТПХ, которым проводили трансфузии предварительно замороженных, а затем подвергнутых фотооблучению мононуклеаров, соответствует частоте достижения общего ответа у больных на терапию хрРТПХ после трансфузии мононуклеаров без предварительного замораживания, а жизнеспособность лейкоцитов была достоверно меньше после криоконсервирования. Показаниями для проведения криоконсервирования мононуклеаров были: плохой венозный доступ, бактериальные инфекции, тяжелое состояние больного, глубокая цитопения и проживание больного вдали от трансплантационного центра [22]. K. Radwanski и соавт. [23] проанализировали апоптотическую и пролиферативную способности лимфоцитов в культуре клеток, полученных от здоровых доноров, и установили, что криоконсервирование не влияло на апоптоз и антипролиферативную активность лимфоцитов, подвергшихся ЭКФ.
Механизм действия ЭКФ до сих пор неясен. Можно выделить два основных механизма действия ЭКФ, не исключающих друг друга: первый механизм — апоптоз лейкоцитов, вызванный перекрестными сшивками ДНК в клетках, обработанных 8-МОП, и элиминация аутореактивных клеток; второй механизм основан на иммуномодулирующем эффекте ЭКФ, инициации созревания дендритных клеток из моноцитов, изменении цитокинового профиля, стимуляции Т-регуляторных клеток [24]. После реинфузии эти клетки фагоцитируются антигенпрезентирующими клетками (АПК), что вызывает активацию АПК. В результате ЭКФ повышается доля Т-регуляторных лимфоцитов и уменьшается продукция интерлейкина (ИЛ)-17 Т-хелперами [19][25–30]. Также после ЭКФ отмечается уменьшение концентрации в крови провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИЛ-8, фактора некроза опухоли-α) [24][25][31][32]. Наряду с этим ЭКФ-индуцированный иммуносупрессивный эффект и уменьшение содержания в крови провоспалительных цитокинов не связаны со стимуляцией апоптоза Т-клеток, поскольку уменьшение концентрации цитокинов в крови происходит в первые часы после ЭКФ, а доля клеток, в которых запущен апоптоз, увеличивается только к концу первых суток после процедуры [33]. В исследовании L. I. Craciun и соавт. было показано, ЭКФ модифицирует аутологичные лимфоциты, индуцируя в них апоптоз, что приводит к активации моноцитов и макрофагов, что приводит к увеличению количества ИЛ-10 и ИЛ-1 [34].
В большинстве лейкоцитов процесс апоптоза запускается только через 48 ч после ЭКФ, причем чувствительность разных популяций лейкоцитов к этой процедуре различается между собой [28][35–37]. CD3+-клетки более чувствительны к ЭКФ, чем CD19+ [38]. Апоптоз в аллореактивных Т-клетках проходит быстрее, чем в покоящихся Т-клетках [39]. Медленнее всего апоптоз происходит в моноцитах. К первому дню in vitro апоптозу подвергается около 20 % популяции моноцитов и только к шестому дню — около 80 %, при этом на протяжении всего этого времени моноциты сохраняют свои основные функции (фагоцитоз, дифференцировка в дендритные клетки). ЭКФ вызывает их активацию и дифференцировку в дендритные клетки [40].
В настоящем исследовании основной задачей было сравнить группы образцов, подвергшиеся только лишь ЭКФ, и образцы, размороженные после ЭКФ, чтобы проверить, возможно ли заготавливать уже обработанные лейкоконцентраты для дальнейшего введения больным. Такой подход, во-первых, позволяет сократить длительность пребывания больного в лечебном учреждении, сократить количество процедур афереза, а во-вторых, облегчить проведение ЭКФ у больных, проживающих вдали от трансплантационного центра, посредством передачи сначала фотооблученных, а далее подверженных криоконсервированию концентратов мононуклеаров в учреждения, находящиеся в непосредственной близости к месту жительства больного. Полученные результаты показали, что на апоптоз лейкоцитов в большей степени влияет криоконсервирование, чем процедура ЭКФ. Однако при этом доля клеток, находившихся в ранней и поздней стадиях апоптоза, после культивирования во всех группах оказалась примерно одинаковой, а значит, несмотря на разные инициальные условия образцов, допустима возможность их заморозки после ЭКФ. Доля лимфоцитов в поздней стадии апоптоза спустя 2 суток культивирования после процедуры ЭКФ сопоставима с долей лимфоцитов в поздней стадии апоптоза при проведении ЭКФ с последующим криоконсервированием лейкоконцентрата, как и с долей лимфоцитов в поздней стадии апоптоза при криоконсервировании лейкоконцентрата без проведения ЭКФ. Из-за небольшого числа образцов, подвергшихся культивированию, нельзя утверждать о достоверном увеличении раннего или позднего апоптоза по сравнению с исходным уровнем (во всех случаях р > 0,06), однако можно предполагать тенденцию к увеличению количества клеток в состоянии позднего апоптоза.
Таким образом, учитывая отсутствие зависимости эффекта ЭКФ от количества облучаемых и переливаемых больному мононуклеаров, обоснованным является проведение сбора мононуклеаров, выполнение их ЭКФ и в дальнейшем разделение фотооблученных мононуклеаров на несколько частей как для криоконсервирования, так и для возврата некриоконсервированного концентрата фотооблученных мононуклеаров больному. Такая тактика позволит уменьшить количество процедур сбора мононуклеаров и обработки клеток, благодаря чему уменьшаться общие затраты на процедуру ЭКФ. Аналогичным образом могут быть использованы криоконсервированные мононуклеары, не подвергавшиеся ЭКФ.
Список литературы
1. Rook A.H., Freundlich B., Jegasothy B.V., et al. Treatment of systemic sclerosis with extracorporeal photochemotherapy. Results of a multicenter trial. Arch Dermatol. 1992; 128(3): 337–46.
2. Knobler R.M. Extracorporeal photochemotherapy for the treatment of lupus erythematosus: Preliminary observations. In: Systemic Lupus Erythematosus. Berlin, Heidelberg: Springer Berlin Heidelberg; 1995: 193–5. DOI: 10.1007/978-3-642-79622-7_13.
3. Andreu G., Leon A., Heshmati F., et al. Extracorporeal photochemotherapy: Evaluation of two techniques and use in connective tissue disorders. Transfus Sci. 1994; 15(4): 443–54. DOI: 10.1016/0955-3886(94)90178-3.
4. Heshmati F., Tavakoli R., Michel A., et al. Extracorporeal photochemotherapy: A treatment for organ graft rejection. Ther Apher. 1997; 1(2): 121–5. DOI: 10.1111/j.1744-9987.1997.tb00025.x.
5. Rossetti F., Dall’Amico R., Crovetti G., et al. Extracorporeal photochemotherapy for the treatment of graft-versus-host disease. Bone Marrow Transplant. 1996; 18(2): 175–81.
6. Rook A.H., Jegasothy B.V., Heald P., et al. Extracorporeal photochemotherapy for drug-resistant pemphigus vulgaris. Ann Intern Med. 1990; 112(4): 303–5. DOI: 10.7326/0003-4819-112-4-303.
7. de Misa R.F., Azaña J.M., Harto A., et al. Extracorporeal photochemotherapy in the treatment of severe psoriatic arthropathy. Br J Dermatol. 1992; 127(4): 448. DOI: 10.1111/j.1365-2133.1992.tb00473.x.
8. Prinz B., Nachbar F., Plewig G. Treatment of severe atopic dermatitis with extracorporeal photopheresis. Arch Dermatol Res. 1994; 287(1): 48–52. DOI: 10.1007/BF00370718.
9. Reinisch W., Nahavandi H., Santella R., et al. Extracorporeal photochemotherapy in patients with steroid-dependent Crohn’s disease: A prospective pilot study. Aliment Pharmacol Ther. 2001; 15(9): 1313–22. DOI: 10.1046/j.1365-2036.2001.01054.x.
10. Bécherel P.A., Bussel A., Chosidow O., et al. Extracorporeal photochemotherapy for chronic erosive lichen planus. Lancet. 1998; 351(9105): 805. DOI: 10.1016/s0140-6736(05)78932-7.
11. Costanzo-Nordin M.R., Hubbell E.A., O’Sullivan E.J., et al. Successful treatment of heart transplant rejection with photopheresis. Transplantation. 1992; 53(4): 808–15. DOI: 10.1097/00007890-199204000-00021.
12. Barr M.L., Meiser B.M., Eisen H.J., et al. Photopheresis for the prevention of rejection in cardiac transplantation. N Engl J Med. 1998; 339(24): 1744–51. DOI: 10.1056/NEJM199812103392404.
13. Andreu G., Achkar A., Couetil J.P., et al. Extracorporeal photochemotherapy treatment for acute lung rejection episode. J Hear Lung Transplant. 1995; 14(4): 793–6.
14. Malik M.I., Litzow M., Hogan W., et al. Extracorporeal photopheresis for chronic graft-versus-host disease: A systematic review and meta-analysis. Blood Res. 2014; 49(2): 100–6. DOI: 10.5045/br.2014.49.2.100.
15. Greinix H.T., Volc-Platzer B., Rabitsch W., et al. Successful use of extracorporeal photochemotherapy in the treatment of severe acute and chronic graft-versushost disease. Blood. 1998; 92(9): 3098–104.
16. Knobler R., Berlin G., Calzavara-Pinton P., et al. Guidelines on the use of extracorporeal photopheresis. J Eur Acad Dermatol Venereol. 2014; 28(Suppl 1): 1–37. DOI: 10.1111/jdv.12311.
17. Drexler B., Buser A., Infanti L., et al. Extracorporeal photopheresis in graft-versus-host disease. Transfus Med Hemother. 2020; 47(3): 214–25. DOI: 10.1159/000508169.
18. Berger M., Albiani R., Sini B., et al. Extracorporeal photopheresis for graftversus-host disease: The role of patient, transplant, and classifi cation criteria and hematologic values on outcome-results from a large single-center study. Transfusion. 2015; 55(4): 736–47. DOI: 10.1111/trf.12900.
19. Hart J.W., Shiue L.H., Shpall E.J., et al. Extracorporeal photopheresis in the treatment of graft-versus-host disease: Evidence and opinion. Ther Adv Hematol. 2013; 4(5): 320–34. DOI: 10.1177/2040620713490316.
20. Taverna F., Coluccia P., Arienti F., et al. Biological quality control for extracorporeal photochemotherapy: Assessing mononuclear cell apoptosis levels in ECP bags of chronic GvHD patients. J Clin Apher. 2015; 30(3): 162–70. DOI: 10.1002/jca.21357.
21. Merlin E., Hannani D., Veyrat-Masson R., et al. Cryopreservation of mononuclear cells before extracorporeal photochemotherapy does not impair their antiproliferative capabilities. Cytotherapy. 2011; 13(2): 248–55. DOI: 10.3109/14653249.2010.501787.
22. Pochon C., Reppel L., Halle P., et al. Cryopreservation as a way to maintain extracorporeal photopheresis regimen for GvHD treatment while circumventing patient temporary inability to undergo apheresis. Bone Marrow Transplant. 2017; 52(1): 167–70. DOI: 10.1038/bmt.2016.240.
23. Radwanski K., Heber C., Min K. Cryopreserved ECP-treated lymphocytes maintain apoptotic response and anti-proliferative effect. J Clin Apher. 2015; 30(3): 154–61. DOI: 10.1002/jca.21354.
24. Legitimo A., Consolini R., Failli A., et al. In vitro treatment of monocytes with 8-methoxypsolaren and ultraviolet A light induces dendritic cells with a tolerogenic phenotype. Clin Exp Immunol. 2007; 148(3): 564–72. DOI: 10.1111/j.1365-2249.2007.03372.x.
25. French L.E., Alcindor T., Shapiro M., et al. Graft-versus-host disease Identifi - cation of amplifi ed clonal T cell populations in the blood of patients with chronic graft-versus-host disease: Positive correlation with response to photopheresis. Bone Marrow Transplant. 2002; 30(8): 509–15. DOI: 10.1038/sj.bmt.1703705.
26. Liu G., Wang J., Park Y.-J., et al. High mobility group protein-1 inhibits phagocytosis of apoptotic neutrophils through binding to phosphatidylserine. J Immunol. 2008; 181(6): 4240–6. DOI: 10.4049/jimmunol.181.6.4240.
27. Xia C.-Q., Campbell K.A., Clare-Salzler M.J. Extracorporeal photopheresisinduced immune tolerance: A focus on modulation of antigen-presenting cells and induction of regulatory T cells by apoptotic cells. Curr Opin Organ Transplant. 2009; 14(4): 338–43. DOI: 10.1097/MOT.0b013e32832ce943.
28. Bladon J., Taylor P.C. Extracorporeal photopheresis: A focus on apoptosis and cytokines. J Dermatol Sci. 2006; 43(2): 85–94. DOI: 10.1016/j.jdermsci.2006.05.004.
29. Lamioni A., Parisi F., Isacchi G., et al. The immunological effects of extracorporeal photopheresis unraveled: Induction of tolerogenic dendritic cells in vitro and regulatory T cells in vivo. Transplantation. 2005; 79(7): 846–50. DOI: 10.1097/01.tp.0000157278.02848.c7.
30. Di Biaso I., Di Maio L., Bugarin C., et al. Regulatory T cells and extracorporeal photochemotherapy: Correlation with clinical response and decreased frequency of proinfl ammatory T cells. Transplantation. 2009; 87(9): 1422–5. DOI: 10.1097/TP.0b013e3181a27a5d.
31. Bladon J., Taylor P.C. Early reduction in number of T cells producing proinfl ammatory cytokines, observed after extracorporeal photopheresis, is not linked to apoptosis induction. Transplant Proc. 2003; 35(4): 1328–32. DOI: 10.1016/S0041-1345(03)00477-9.
32. Wang L., Ni M., Hückelhoven-Krauss A., et al. Modulation of B cells and homing marker on NK cells through extracorporeal photopheresis in patients with steroid-refractory/resistant graft-vs.-host disease without hampering antiviral/anti-leukemic effects. Front Immunol. 2018; 9: 2207. DOI: 10.3389/fi mmu.2018.02207.
33. Bladon J., Taylor P.C. Lymphocytes treated by extracorporeal photopheresis can down-regulate cytokine production in untreated monocytes. Photodermatol Photoimmunol Photomed. 2005; 21(6): 293–302. DOI: 10.1111/j.1600-0781.2005.00192.x.
34. Craciun L.I., Stordeur P., Schandené L., et al. Increased production of interleukin-10 and interleukin-1 receptor antagonist after extracorporeal photochemotherapy in chronic graft-versus-host disease. Transplantation. 2002; 74(7): 995–1000. DOI: 10.1097/00007890-200210150-00017.
35. Bladon J., Taylor P.C. Extracorporeal photopheresis induces apoptosis in the lymphocytes of cutaneous T-cell lymphoma and graft-versus-host disease patients. Br J Haematol. 1999; 107(4): 707–11. DOI: 10.1046/j.1365-2141.1999.01773.x.
36. Di Renzo M., Rubegni P., Sbano P., et al. ECP-treated lymphocytes of chronic graft-versus-host disease patients undergo apoptosis which involves both the Fas/FasL system and the Bcl-2 protein family. Arch Dermatol Res. 2003; 295(5): 175–82. DOI: 10.1007/s00403-003-0415-6.
37. Heshmati F. Updating ECP action mechanisms. Transfus Apher Sci. 2014; 50(3): 330–9. DOI: 10.1016/J.TRANSCI.2014.04.003.
38. Daniele N., Del Proposto G., Cerrone P., et al. Evaluation of cell death after treatment with extracorporeal photopheresis. Transfus Apher Sci. 2012; 46(1): 53–7. DOI: 10.1016/J.TRANSCI.2011.11.002.
39. Hannani D., Merlin E., Gabert F., et al. Photochemotherapy induces a faster apoptosis of alloreactive activated T cells than of nonalloreactive resting T cells in graft versus host disease. Transplantation. 2010; 90(11): 1232–8. DOI: 10.1097/tp.0b013e3181fa4eb6.
40. Hannani D., Gabert F., Laurin D., et al. Photochemotherapy induces the apoptosis of monocytes without impairing their function. Transplantation. 2010; 89(5): 492–9. DOI: 10.1097/TP.0b013e3181c6ffd3.
Об авторах
В. А. ВасильеваРоссия
Васильева Вера Алексеевна,* кандидат медицинских наук, заведующая отделением иммунохимиотерапии для больных после ТКМ и группой поиска потенциальных доноров
125167, Москва
Л. А. Кузьмина
Россия
Кузьмина Лариса Анатольевна, кандидат медицинских наук, заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга
125167, Москва
Н. А. Петинати
Россия
Петинати Наталия Арнольдовна, кандидат медицинских наук, старший научный сотрудник лаборатории физиологии кроветворения
125167, Москва
Н. И. Дризе
Россия
Дризе Нина Иосифовна, доктор биологических наук, заведующая лабораторией физиологии кроветворения
125167, Москва
Д. В. Камельских
Россия
Камельских Денис Владимирович, врач-трансфузиолог отделения переливания крови
125167, Москва
Т. В. Гапонова
Россия
Гапонова Татьяна Владимировна, кандидат медицинских наук, первый заместитель генерального директора
125167, Москва
К. А. Никифорова
Россия
Никифорова Ксения Александровна, биолог, лаборатория иммунофенотипирования клеток крови и костного мозга
125167, Москва
Ю. О. Давыдова
Россия
Давыдова Юлия Олеговна, кандидат медицинских наук, врач клинической лабораторной диагностики лаборатории иммунофенотипирования клеток крови и костного мозга
125167, Москва
Н. М. Капранов
Россия
Капранов Николай Михайлович, кандидат биологических наук, медицинский физик лаборатории иммунофенотипирования клеток крови и костного мозга
125167, Москва
И. В. Гальцева
Россия
Гальцева Ирина Владимировна, кандидат медицинских наук, заведующий лабораторией иммунофенотипирования клеток крови и костного мозга
125167, Москва
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, заведующая отделом химиотерапии гемобластозов, депрессий кроветворения и ТКМ, и. о. генерального директора
125167, Москва
В. Г. Савченко
Россия
Савченко Валерий Григорьевич , доктор медицинских наук, профессор, академик РАН, генеральный директор
125167, Москва
Рецензия
Для цитирования:
Васильева В.А., Кузьмина Л.А., Петинати Н.А., Дризе Н.И., Камельских Д.В., Гапонова Т.В., Никифорова К.А., Давыдова Ю.О., Капранов Н.М., Гальцева И.В., Паровичникова Е.Н., Савченко В.Г. Влияние криоконсервирования на показатели апоптоза мононуклеаров при проведении экстракорпорального фотофереза. Гематология и трансфузиология. 2021;66(3):386-394. https://doi.org/10.35754/0234-5730-2021-66-3-386-394
For citation:
Vasilyeva V.A., Kuzmina L.A., Petinati N.A., Drize N.I., Kamelskikh D.V., Gaponova T.V., Nikiforova K.A., Davidova Yu.O., Kapranov N.M., Galtceva I.V., Parovichnikova E.N., Savchenko V.G. The effect of cryopreservation on the parameters of mononuclear apoptosis during extracorporeal photopheresis. Russian journal of hematology and transfusiology. 2021;66(3):386-394. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-3-386-394











































