Перейти к:
Саркома Капоши у ВИЧ-негативного больного первичным миелофиброзом
https://doi.org/10.35754/0234-5730-2021-66-3-433-444
Аннотация
Введение. Саркома Капоши (СК) — опухоль сосудистого происхождения с поражением кожных покровов, вовлечением внутренних органов и лимфатических узлов.
Цель — описать развитие СК у больного первичным миелофиброзом (ПМФ), развившейся на фоне лечения преднизолоном.
Основные сведения. Для верификации диагноза СК у больного ПМФ были использованы: гистологическое, иммуногистохимическое исследования биоптатов кожи и полимеразная цепная реакция с детекцией флуоресцентного сигнала в режиме «реального времени» в количественном формате при тестировании биологических образцов (периферическая кровь, мазок со слизистой оболочки ротоглотки, биоптаты из очагов поражений кожи) для определением активности вируса герпеса человека 8. Обследование позволило установить окончательный диагноз.
Ключевые слова
Для цитирования:
Егорова Е.К., Меликян А.Л., Суборцева И.Н., Домонова Э.А., Сильвейстрова О.Ю., Чеботарев Д.И., Ковригина А.М. Саркома Капоши у ВИЧ-негативного больного первичным миелофиброзом. Гематология и трансфузиология. 2021;66(3):433-444. https://doi.org/10.35754/0234-5730-2021-66-3-433-444
For citation:
Egorova E.K., Melikyan A.L., Subortseva I.N., Domonova E.A., Silveystrova O.Y., Chebotarev D.I., Kovrigina A.M. Kaposi’s sarcoma in HIV-negative patient with primary myelofibrosis. Russian journal of hematology and transfusiology. 2021;66(3):433-444. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-3-433-444
Введение
Саркома Капоши (СК) — многоочаговая злокачественная опухоль сосудистого происхождения с преимущественным поражением кожных покровов, вовлечением внутренних органов и лимфатических узлов. Болезнь впервые была описана в 1872 г. M. Kaposi и названа его именем, встречается с частотой не более, чем 1 % от всех случаев злокачественных новообразований [1]. До открытия вируса этиология СК оставалась неизвестной. В 1994 г. Y. Chang и соавт. [2] при исследовании участков поражений кожи ВИЧ-позитивных больных СК обнаружили фрагменты вирусной ДНК. Вирус получил название — ассоциированный с СК вирус герпеса человека или вирус герпеса человека 8-го типа (ВГЧ-8, Human herpesvirus 8, HHV-8). В 2016 г. HHV-8 получил видовое название Human gammaherpesvirus 8, относится к семейству Herpesviridae, подсемейству Gammaherpesvirinae, роду Rhadinovirus [3]. Геном вируса представлен двухцепочечной ДНК размером 170 т. п.н., которая кодирует более 80 вирусных белков [3][4]. Выделяют 6 основных подтипов HHV-8: А, В, С, D, E, F. Подтип А чаще выявляют при классической СК и СПИД-ассоциированных поражениях кожи и внутренних органов, подтипы В и С — при лимфопролиферативных заболеваниях (лимфомы, болезнь Кастлемана) [5][6]. В геноме HHV-8 выделяют литические и латентные гены, кодирующие белки, которые характеризуют соответствующие стадии развития инфекции. Литические гены кодируют белки, в ходе реактивации которых происходит активация каскада нижестоящих генов и стимуляция микроокружения для репликации вируса, усиление метаболизма нуклеиновых кислот и модуляция клеточных функций [2]. Подробно изученным среди латентных белков является ОRF73 (LANA-1, LNA или LNA-1) — латентный ядерный антиген. LANA-1, связываясь с белком р53, угнетает его транскрипционную активность, препятствует апоптозу клеток, зараженных HHV-8 [7].
Изучение роли вирусных цитокинов в онкогенезе позволило доказать развитие ассоциированных с HHV-8 заболеваний: СК, мультицентрическая болезнь Кастлемана, первичная лимфома серозных оболочек [8–10]. Среди вирусных цитокинов К2 или вирусный интерлейкин-6 является ключевым в патогенезе СК [11][12]. ДНК вируса встраивается в геном эндотелиальных и эпителиальных клеток, В-лимфоцитов, моноцитов, кератиноцитов [13]. Активная репликация вируса доказана в клетках слизистой оболочки ротоглотки [5][6]. Основные пути передачи HHV-8 — половой и трансплантационный. Доказано наличие контактно-бытового пути передачи вируса через слюну и грудное молоко, что имеет большое значение при заражении детей в эндемичных районах [14–16]. Возможна также трансплацентарная передача вируса от матери к плоду [5, 6]. HHV-8-инфекция распространена во всем мире, хотя имеются существенные различия в показателях для различных человеческих популяций: от 10 % вне эндемичных регионов (страны Северной Европы и американского континента), до 70 % — в высокоэндемичных регионах (страны Африки и Средней Азии). Частота распространения классической формы СК варьирует от 0,4 до 10,5 на 1 млн мужчин и 2,7 млн женщин. Наибольшая частота встречаемости СК наблюдается в странах центральной Африки (эндемическая СК) и средиземноморского бассейна (классическая СК) [17][18].
Выделяют 4 основных варианта СК [19]:
- Классическая (идиопатическая, спорадическая, европейская) СК — встречается чаще у пожилых мужчин, характеризуется бессимптомным или малосимптомным течением, появлением пятен на нижних конечностях, в дальнейшем могут появляться болезненные образования в мягких тканях и увеличение лимфатических узлов. Прогноз — благоприятный.
- Эндемическая (африканская) СК — развивается у детей и молодых людей из африканских стран, характеризуется агрессивным течением, формированием множественных подкожных узлов и язв, поражением легких, желудочно-кишечного тракта, печени и селезенки. Прогноз — неблагоприятный.
- Эпидемическая (СПИД-ассоциированная) СК — развивается у ВИЧ-инфицированных больных. Характеризуется быстрым течением, появлением высыпаний на коже головы (нос, ушные раковины, веки) и туловище, в 10–15 % случаев возможно появление элементов на твердом и мягком небе, корне языка. Очаги поражения быстро изъязвляются, что приводит к появлению болевого синдрома и нарушению функции вовлеченного органа. Прогноз — неблагоприятный.
- Иммуносупрессивая (ятрогенная) СК — развивается у иммунокомпрометированных больных (исключение — ВИЧ-инфекция), например, у перенесших трансплантацию солидных органов (почка, печень) и получающих иммуносупрессивную терапию. Характеризуется ограниченным поражением кожных покровов в дебюте, с последующим изъявлением и появлением болевого синдрома. Отмена иммуносупрессивных препаратов приводит к регрессу новообразований.
Новообразования при СК имеют пурпурную окраску, но их цвет может варьировать от красного до фиолетового или бурого. Элементы могут быть плоскими или возвышаться над поверхностью кожных покровов, представлять собой безболезненные пятна, узелки, узлы с возможным их изъязвлением. Новообразования почти всегда располагаются на коже, реже — во внутренних органах. Гистологическая структура опухоли характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер опухоли резко увеличивает риск кровотечений [6, 8].
Для лечения больных СК используют цитостатические, иммуносупрессивные и противовирусные препараты [19]. Стандартная терапия СК включает использование в виде монорежима или в виде различных комбинаций цитостатических препаратов (алкалоидов — винкристин, винбластин, антрациклиновых антибиотиков — адриамицин, доксорубицин, даунорубицин, этопозид), препаратов интерферона альфа-2b, таксанов (паклитаксел или доцетаксел) и приводит к достижению хорошего, но не длительного ответа, безрецидивная выживаемость не превышает года [19]. В настоящее время исследуются таргетные препараты, влияющие на патогенетические механизмы СК, на репликацию HHV-8 и блокаду сигнальных путей VEGF, c-Kit, m-TOR (талидомид, интерлейкин-12, hCG Angiogenesis inhibitors (SU5416, IM862, fumagillin) MMP-inhibitors (Col-3), integrin-inhibitors (EMP 121976)) [20]. Продолжается поиск противовирусных препаратов в связи с неудачей применения цидофовира и фоскарнета. Интерес представляют препараты из группы ингибиторов гистон деацетилазы, способные вызывать литическую репликацию, инфицированных клеток в латентной фазе [19][20].
Наиболее изучены и описаны случаи развития иммуносупрессивной и эпидемической СК. Основной причиной развития иммуносупрессивного варианта является применение лекарственных препаратов у реципиентов донорских солидных органов [20][21]. Развитие СК у гематологических больных считается редким событием. Описаны случаи развития СК в результате приема иммуносупрессантов после трансплантации гемопоэтических стволовых клеток [22], у больного хроническим миелоидным лейкозом при проведении длительной терапии иматинибом [23], два случая СК после длительной терапии руксолитинибом по поводу первичного миелофиброза (ПМФ) [24][25]. Есть сообщения о развитии иммуносупрессивного варианта СК у больных с сопутствующей патологией (сахарный диабет, артриты) на фоне длительного приема кортикостероидных гормонов [26][27].
Цель — описать развитие СК у больного ПМФ, развившейся на фоне лечения преднизолоном.
Клиническое наблюдение
У больного, 1947 года рождения, в 2007 г. были впервые выявлены гепатомегалия (увеличение правой доли печени до 180 мм), спленомегалия (селезенка — 164 × 84 мм), признаки портальной гипертензии (увеличение диаметра воротной вены до 17 мм, селезеночной — до 13 мм). С 2015 г. у больного отмечено появление подагрического артрита, двухростковой цитопении неясной этиологии, в связи с чем был обследован гематологом. В крови: лейкоциты — 2,0 × 10 9/л, гемоглобин — 102 г/л, эритроциты — 3,22 × 10 12/л, тромбоциты — 370 × 10 9/л, миелоциты — 1 %, палочкоядерные — 23 %, сегментоядерные — 29 %, лимфоциты — 34 %, моноциты — 10 %, СОЭ — 19 мм/час, общий белок — 68 г/л, маркеры вирусных гепатитов и ВИЧ — отрицательные. В миелограмме: пунктат костного мозга был беден клеточными элементами, бластные клетки — 3 %, отмечалась задержка созревания гранулоцитов, плазматические клетки составили 28 %. По результатам иммунохимического анализа белков сыворотки крови и концентрированной мочи было выявлено уменьшение концентрации IgM в сыворотке крови до 56 МЕ/мл, при отсутствии моноклональной секреции в сыворотке крови и белка Бенс-Джонса в моче. При гастроскопии выявлены смешанный рефлюкс-гастрит, дуоденит, при колоноскопии — долихосигма, внутренний геморрой в стадии обострения. На основании результатов обследования, проведенного по месту жительства, была заподозрена множественная миелома. В 2016 г. было выполнено обследование, включавшее в себя пункцию костного мозга, его цитологическое и иммунофенотипическое исследования. По данным миелограммы, количество плазматических клеток соответствовало норме, иммунофенотипическое исследование не выявило наличия аберрантных В-лимфоцитов и Т-лимфоцитов. Отмечалось увеличение размеров селезенки до 175 × 95 мм. Окончательный диагноз установлен не был, в связи с чем до 2017 г. больной не получал цитостатическую терапию.
В октябре 2017 г. больной был направлен в ФГБУ «НМИЦ гематологии» для уточнения диагноза и определения дальнейшей тактики лечения. При обращении предъявлял жалобы на боли в поясничном отделе позвоночника и тазобедренных суставах, слабость и повышенную утомляемость, рецидивирующий стоматит. При осмотре состояние было расценено как средней степени тяжести, кожные покровы были обычной окраски, чистые. Периферические лимфатические узлы не пальпировались. Живот был увеличен в объеме за счет гепатомегалии и спленомегалии (печень на 5 см выступала из-под края реберной дуги, селезенка — на 8 см). В анализе крови: гемоглобин — 100 г/л; эритроциты — 3,29 × 10 12/л; тромбоциты — 270 × 10 9/л; лейкоциты — 1,79 × 10 9/л, лактатдегидрогеназа (ЛДГ) — 865,1 Ед/л. При молекулярно-генетическом исследовании клеток крови была обнаружена мутация типа 2 (инсерция) в 9-м экзоне гена CALR. В миелограмме: пунктат костного мозга был умеренно-клеточный, бластные клетки составляли 3,6 %, резко сужен гранулоцитарный росток (8,4 %), лимфоциты — 16,8 %, моноциты — 2,4 %, значительно расширен эритроидный росток (68,8 %), мегакариоциты — в достаточном количестве, плазматические клетки — 0,4 %. При стандартном цитогенетическом исследовании пунктата костного мозга выявлен кариотип 46XY [20]. При гистологическом исследовании трепанобиоптата костного мозга морфологическая картина соответствовала миелопролиферативному заболеванию, ПМФ, фиброзная/остеосклеротическая стадия, степень фиброза стромы при гистохимическом исследовании с импрегнацией серебром составила более 50 %. По данным ультразвукового исследования (УЗИ) органов брюшной полости выявлены гепатомегалия (левая доля печени — 130 × 63 мм, правая — 185 × 111 мм), спленомегалия (размеры селезенки — 195 × 74 мм), портальная гипертензия (диаметр воротной вены — 18 мм, селезеночной вены — 18 мм). На основании результатов обследования, согласно критериям ВОЗ [28], был установлен диагноз Ph-негативное хроническое миелопролиферативное заболевание (ХМПЗ): ПМФ, промежуточная — 2-я группа риска (3 балла по DIPSS) [29]. По данным иммунохимического исследования белков сыворотки крови и концентрированной мочи в сыворотке крови была выявлена следовая моноклональная секреция А каппа, уменьшение концентрации иммуноглобулина М, увеличение концентрации бета-2-микроглобулина до 3,96 мг/л. При низкодозовой компьютерной томографии (КТ) костей скелета были обнаружены единичные участки разрежения костной ткани, наиболее крупные в проекции задней верхней ости подвздошной кости, размерами 16,5 × 10,5 мм, в верхней правой лонной кости — 18 × 11 мм, в теле третьего сакрального позвонка — 18 × 14 мм, солитарное образование в левой половине лобной пазухи размерами 30,5 × 11 × 16 мм, мягкотканной плотности, а также мягкотканные компоненты в костномозговых каналах большеберцовых и плечевых костей. От проведения биопсии мягкотканных компонентов больной отказался. Согласно критериям ВОЗ [28] был установлен сопутствующий диагноз «моноклональная гаммапатия неясного значения» (МГНЗ) [30].
Наличие у больного глубокой лейкопении не укладывалось в типичную картину ПМФ и было расценено как проявление гиперспленизма, возникшего на фоне длительной портальной гипертензии. Отнесение больного в промежуточную 2-ю группу риска по шкале DIPSS [29] послужило показанием к назначению с февраля 2018 г. терапии ПМФ: гидроксикарбамид — 1000 мг/сут., преднизолон — 20 мг/сут. в течение 2 мес. с последующей полной отменой в течение 1 мес. [31]. Однако больной не выполнил рекомендации по быстрой отмене глюкокортикостероидных гормонов и дальнейший прием преднизолона контролировал самостоятельно. Терапия глюкокортикостероидами осложнилась кровотечением из прямой кишки в октябре 2018 г., а в ноябре 2018 г. при фиброгастроскопии было выявлено кровотечение из ангиоэктазии желудка. При проведении лечения с конца 2018 г. больной отметил появление потливости и синюшных, плотных, бугристых образований на коже предплечий (рис. 1). По месту жительства была выполнена биопсия новообразования на левом предплечье. При гистологическом исследовании биоптата морфологическая картина была расценена как лейомиома. В ноябре 2018 г. больной прекратил прием преднизолона и отметил кратковременное улучшение состояния в виде уменьшения потливости, стабилизации количества и размеров образований на коже.
В 2019 г. в связи с увеличением количества кожных элементов на предплечьях и голенях по месту жительства была выполнена биопсия новообразований кожи на голени и на левом предплечье (рис. 2). При гистологическом исследовании, хотя опять была заподозрена лейомиома, проводился дифференциальный диагноз между СК и веретеноклеточной гемангиомой. Для уточнения причины поражения кожных покровов больной был повторно направлен в ФГБУ «НМИЦ гематологии». При обращении в ФГБУ «НМИЦ гематологии» в июне 2019 г. предъявлял жалобы на потливость, стоматит, многочисленные образования на кожных покровах кистей, предплечий и в области левого коленного сустава. При осмотре кожные покровы были обычной окраски, влажные, на кистях, предплечьях, левой нижней конечности в области коленного сустава определялись многочисленные элементы, синюшного цвета, выступавшие над поверхностью кожи с шелушением в центре. Живот был увеличен в объеме за счет гепатоспленомегалии (печень выступала из-под края реберной дуги на 7 см, селезенка — на 10 см). Продолжал принимать гидроксикарбамид в дозе 1000 мг через день.
Было проведено рестадирование ПМФ, включавшее подсчет миелограммы, гистологическое и гистохимическое исследования трепанобиоптата костного мозга, молекулярно-генетическое исследование клеток крови, УЗИ органов брюшной полости. При обследовании не было выявлено прогрессии ПМФ. Повторно выполненное иммунохимическое исследование белков сыворотки крови не выявило усугубления моноклональной гаммапатии, при низкодозовой КТ костей скелета не обнаружили увеличения количества и размеров мягкотканных очагов. Для уточнения генеза поражения кожи были пересмотрены гистологические препараты биоптата новообразования от июня 2019 г. В срезах кожи определялось интрадермальное узловое, четко очерченное новообразование, которое было представлено пролиферацией сосудов с эпителиоподобной морфологией эндотелия, с участками веретеноклеточного строения и ветвящихся сосудов мышечного типа мелкого и среднего калибра с утолщенной стенкой (рис. 3). Морфологическая картина характеризовала субстрат новообразования сосудистой природы. Иммуногистохимическое исследование с антителами к CD34 и LANA-1 HHV-8 подтвердило сосудистую природу новообразования и выявило инфицированность опухолевых эндотелиоцитов вирусом HHV-8 (рис. 4). В результате на основании иммуногистохимического исследования биоптата кожи была диагностирована СК. Для определения вирусной активности методом полимеразной цепной реакции (ПЦР) с детекцией флуоресцентного сигнала в режиме «реального времени» (ПЦР-РВ) в образцах биологического материала выявили и количественно определили ДНК HHV-8 в периферической крови, мазках со слизистой оболочки ротоглотки и в биоптатах кожи из очагов поражений (из двух локусов), фиксированных в парафиновых блоках. Экстракцию ДНК выполняли с использованием набора реагентов «Рибо-преп». При исследовании биоптатов кожи, фиксированных в парафиновых блоках, проводили предварительную депарафинизацию 1 М раствором NaOH. ПЦР-исследование выполняли согласно методике, разработанной в ФБУН ЦНИИЭ Роспотребнадзора, используя набор реагентов «АмплиСенс® HHV8-скрин/монитор-FL». Постановку и анализ результатов амплификации проводили на приборе «Rotor-Gene Q» (Qiagen, Германия). ДНК HHV-8 была выявлена в различных концентрациях во всех типах протестированного биологического материала больного, максимальная вирусная нагрузка была обнаружена в биоптатах кожи (табл. 1, рис. 5). Подтип HHV-8 в данной работе не определялся в связи с отсутствием необходимых реактивов.
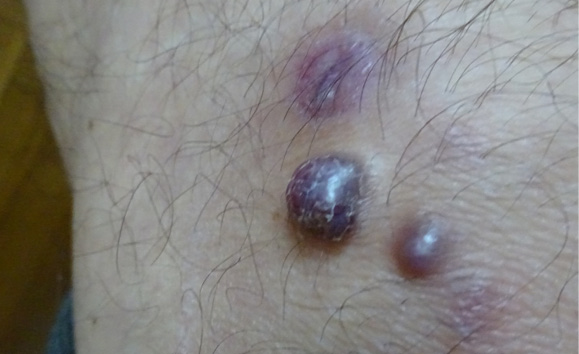
Рисунок 1. Новообразования синюшного цвета на левом предплечье
Figure 1. Cyanotic neoplasms on the left forearm
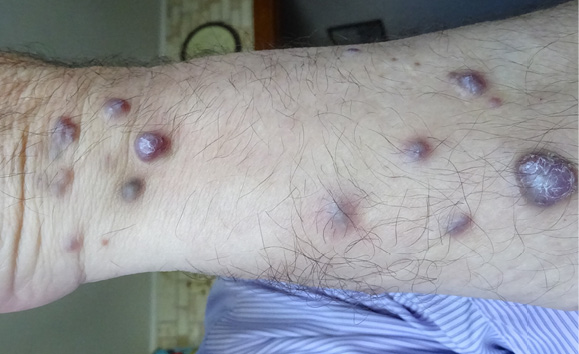
Рисунок 2. Многочисленные бугристые новообразования синюшного цвета на левом предплечье
Figure 2. Numerous tuberous neoplasms of cyanotic color on the left forearm
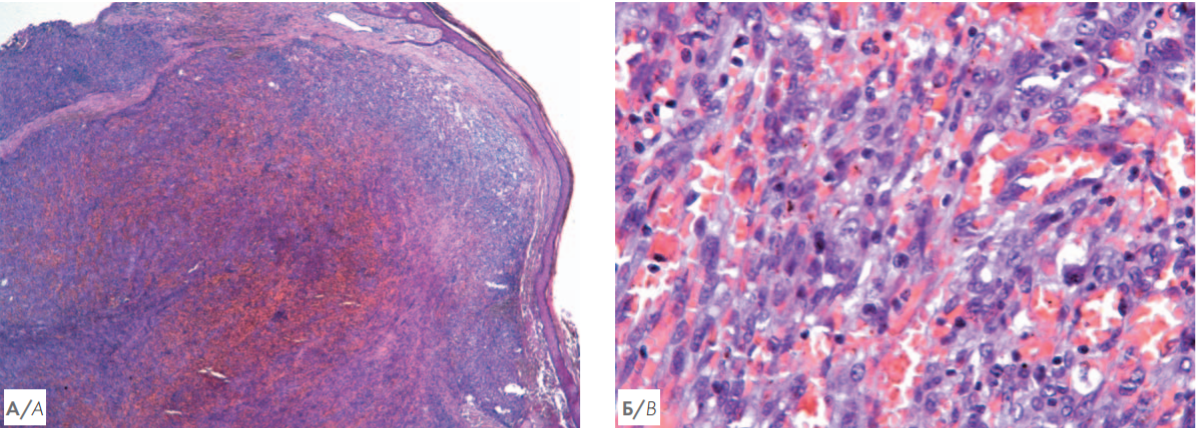
Рисунок 3. А — гистологическое исследование биоптата кожи. Гематоксилин и эозин. Увеличение ×50. Массивный узловой пролиферат в дерме (указан стрелкой), отмечается формирование множественных сосудистых пространств; Б — гистологическое исследование биоптата кожи. Гематоксилин и эозин. Увеличение ×400. На большем увеличении визуализируются участки веретеноклеточной и эпителиоидной морфологии опухолевых клеток, формирующих сосудистые щели
Figure 3. А — histological examination of skin biopsy. Hematoxylin and eosin. Magnification ×50. Massive nodular proliferate in the dermis (indicated by an arrow), the formation of multiple vascular spaces is noted; B — histological examination of skin biopsy. Hematoxylin and eosin. Magnification ×400. At a larger magnification, spindle cell and epithelioid morphology of tumor cells forming vascular slots are visualized
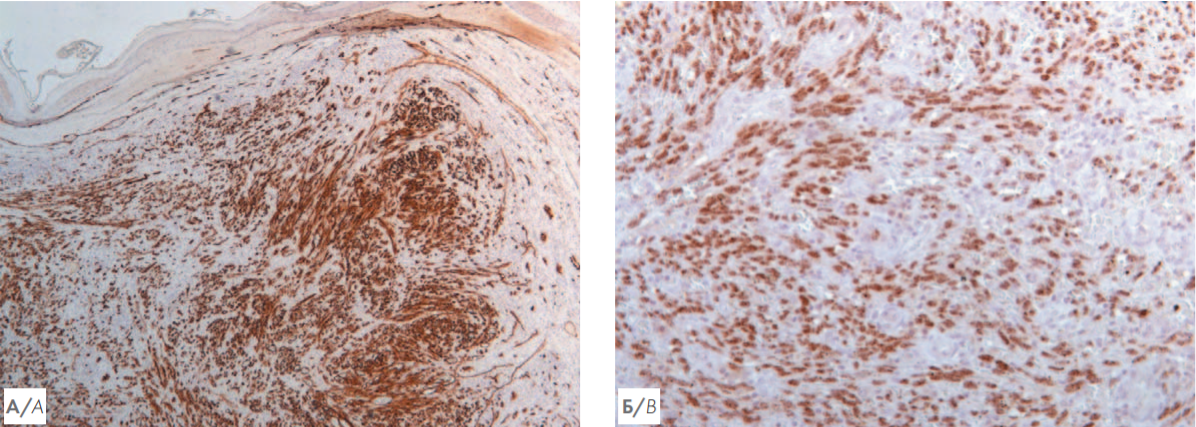
Рисунок 4. А — иммуногистохимическое исследование биоптата кожи с антителами к CD34. Увеличение ×100. Клетки пролиферата представлены эндотелиоцитами, экспрессируют CD34 (мембранная реакция); Б — иммуногистохимическое исследование биоптата кожи с антителами к LANA-1 HHV-8. Увеличение ×200. Выявлена ядерная реакция опухолевых клеток с антителами к LANA-1 HHV-8
Figure 4. А — immunohistochemical study of skin biopsy. CD34. Magnification ×100. Both spindle and epithelioid-like cells are represented by atypical endothelial cells which are expressing CD34 (membranous stain); B — immunohistochemical study of skin biopsy. LANA-1 HHV-8. Magnification ×200. A nuclear stain of tumor cells represents an HHV-8-infected cells
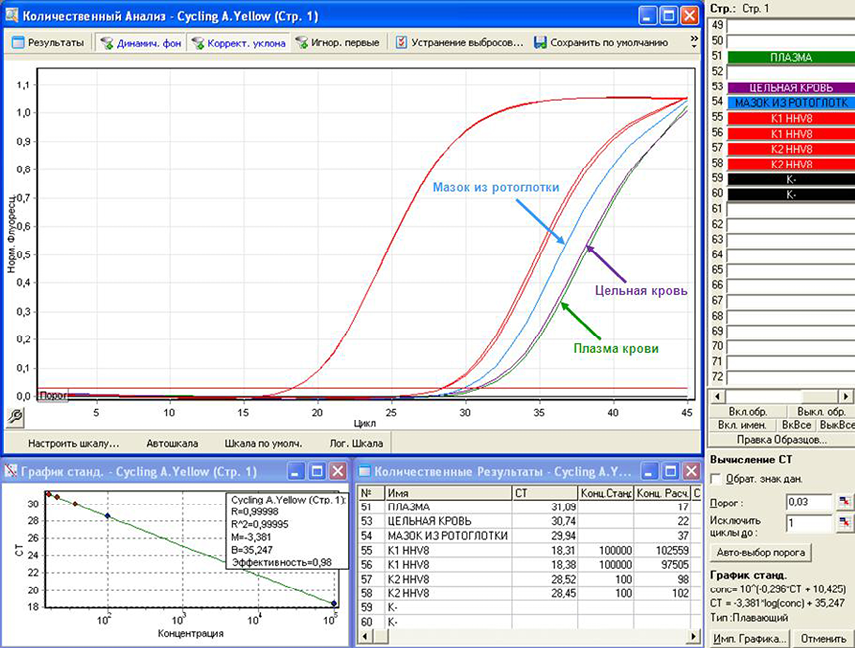
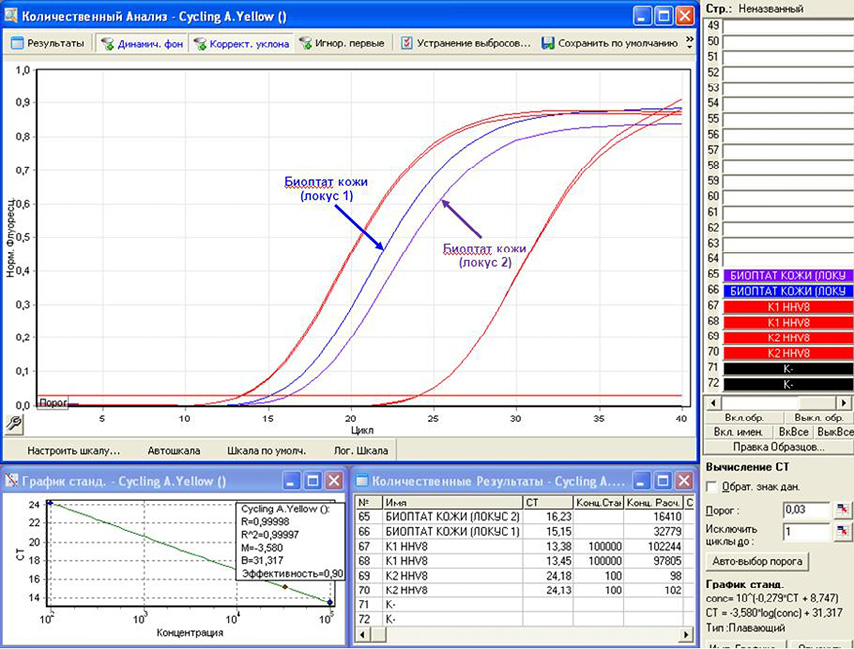
Рисунок 5. А — анализ результатов исследования образцов цельной крови, плазмы крови, мазков со слизистой оболочки ротоглотки, полученных методом ПЦР в реальном времени; Б — анализ результатов исследования образцов биоптатов кожи из очагов поражений, полученных методом ПЦР в реальном времени
Figure 5. А — analysis of the results of the study of samples of whole blood, blood plasma, smears from the mucous membrane of the oropharynx obtained by real-time PCR; B — analysis of the results of the study of samples of skin biopsy samples from lesions obtained by real-time PCR
Таблица 1. Результаты количественного определения ДНК HHV-8 методом ПЦР-РВ в различных типах биологического материала больного
Table 1. The results of the quantitative determination of HHV-8 DNA by PCR-RT in various types of patient biological material
Тип биологического материала Type of biological material | Цельная кровь Whole blood | Плазма крови Blood plasma | Мазок из ротоглотки Oropharyngeal swab | Биоптат кожи из первого локуса Skin biopsy | Биоптат кожи из второго, локуса Skin biopsy |
Единицы измерения Units | lg копий/10 5 клеток lg copies/10 5 cells | копий/мл copies/ml | копий/мл copies/ml | lg копий/10 5 клеток lg copies/10 5 cells | lg копий/10 5 клеток lg copies/10 5 cells |
Концентрация ДНК HHV-8 HHV-8 DNA concentration | 1,97 | 1,7 × 10 3 | 3,7 × 10 3 | 6,96 | 6, 47 |
Проведенное обследование позволило диагностировать СК у ВИЧ-негативного больного ПМФ и МГНЗ, развившуюся во время лечения гидроксикарбамидом, длительного бесконтрольного приема глюкокортикостероидных гормонов. Установить вариант СК трудно. С одной стороны, у больного был вторичный иммунодефицит, обусловленный наличием двух гематологических заболеваний (ПМФ и МГНЗ), по поводу одного из которых он получал глюкокортикостероидную терапию; с другой стороны, пожилой возраст, мужской пол, классическая клиническая картина и отсутствие регресса кожных новообразований после прекращения приема преднизолона не позволили однозначно определить какой вариант СК, иммуносупрессивный или классический, был у больного в конкретном случае.
В связи с наличием гепатоспленомегалии терапия гидроксикарбамидом была продолжена в сниженной дозе по 500 мг через день. Из-за пожилого возраста, сопутствующей патологии и лейкопении стандартная терапия СК была заменена на местное лечение проспидиновой мазью. В результате отмечена стабилизация размеров и количества новообразований.
Обсуждение
СК представляет собой мультифакторную опухоль эндотелиального происхождения [32]. В настоящее время доказана роль HHV-8 как этиологического фактора СК. HHV-8 обладает наибольшей тропностью к сосудистым и лимфатическим эндотелиальным клеткам, а также к различным видам гемопоэтических клеток [33]. Период от инфицирования HHV-8 до развития СК зависит от клинического варианта опухоли. Иммуносупрессия ведет к манифестации болезни у больных, перенесших трансплантацию органов, в течение 1–2 лет, а у больных, инфицированных ВИЧ, — в течение 5–10 лет от момента инфицирования [33]. В представленном клиническом наблюдении СК развилась у больного ПМФ и МГНЗ через 10 мес. от начала терапии гидроксикарбамидом и глюкокортикостероидами. Внезапное появление новообразований на коже послужило основанием для обследования на ВИЧ-инфекцию и гистологического исследования для установления диагноза. Изменения кожи — характерное проявление СК [34]. Чаще всего встречаются пятна, узелки, бляшки, узлы и опухоли; значительно реже наблюдаются веррукозные, буллезные и везикулезные элементы. Наиболее характерно появление красновато-синюшных или красновато-бурых (гематомоподобных) слегка возвышающихся пятен величиной от чечевицы до 10-копеечной монеты. Относительно частым ранним проявлением СК могут быть узелки сферической или полусферической формы, величиной от просяного зерна до мелкой горошины. Короткое время узелки сохраняют розовый цвет, затем очень быстро меняют его на красновато-синюшный с коричневатым оттенком. Консистенция узелков плотноэластическая. Узелки, как правило, располагаются изолированно, но сгруппированно. В описываемом клиническом наблюдении элементы были представлены новообразованиями синюшного цвета, выступавшими над поверхностью кожи с шелушением в центре, с локализацией на предплечьях и голенях. Учитывая факт, что больной относился к группе риска (ПМФ, МГНЗ, иммуносупрессивная терапия), была заподозрена СК.
При всех вариантах СК патоморфологическая картина характеризуется хаотичным незавершенным ангиогенезом, пролиферацией веретенообразных клеток с маркерными признаками эндотелия, иммуноклеточной мононуклеарной инфильтрацией. При СК описаны изменения, которые трудно отличать от ангиосаркомы [35]. В описываемом случае потребовались повторная биопсия, гистологическое и иммуногистохимическое исследования новообразований кожи. Выявление маркеров HHV-8 в периферической крови, мазках со слизистой оболочки ротоглотки и в биоптатах кожи из двух локусов явилось дополнительным критерием для установления диагноза СК.
Представленный клинический случай демонстрирует развитие СК у 70-летнего ВИЧ-негативного больного с ХМПЗ и МГНЗ на фоне вторичного иммунодефицита и длительной терапии преднизолоном. Прекращение терапии глюкокортикостероидными гормонами не позволило добиться обратного развития СК. Наличие гематологического заболевания, ПМФ, сопровождающегося двухростковой цитопенией (анемия и лейкопения), гепатоспленомегалией с портальной гипертензией ограничивало терапевтические возможности при СК. Дерматологам, гематологам, инфекционистам и врачам других специальностей следует учитывать, что СК может развиваться не только у HHV-8-инфицированных ВИЧ-позитивных больных, но и у ВИЧ-негативных больных с выраженным вторичным иммунодефицитом, обусловленным наличием гематологических заболеваний, сахарного диабета, патологии сосудов, или у больных, длительно принимающих глюкокортикостероидные гормоны.
Список литературы
1. Basalely D., Khan K.H., Cavazos G.J., et al. Pedal presentation of Kaposi’s sarcoma in a non-HIV Hispanic female: A case report and literature review. J Foot Ankle Surg. 2012; 51(3): 365–8. DOI: 10.1053/j.jfas.2012.01.012.
2. Chang Y., Cesarman E., Pessin M.S., et al. Identification of herpesviruslike DNA sequences in AIDS-associated Kaposi’s sarcoma. Science. 1994; 266(5192): 1865–9. DOI: 10.1126/science.7997879.
3. Orenstein J.M., Alkan S., Blauvelt A., et al. Visualization of human herpesvirus type 8 in Kaposi’s sarcoma by light and transmission electron microscopy. AIDS. 1997; 11(5): 35–45. DOI: 10.1097/00002030-199705000-00001.
4. Renne R., Lagunoff M., Zhong W., et al. The size and conformation of Kaposi’s sarcoma- associated herpesvirus (human herpesvirus 8) DNA in infected cells and virions. J Virol. 1996; 70(11): 8151–4. DOI: 10.1128/JVI.70.11.8151-8154.1996.
5. Kadyrova E., Lacoste V., Duprez R., et al. Molecular epidemiology of Kaposi’s sarcoma-associated herpesvirus/human herpesvirus 8 strains from Russian patients with classic, posttransplant, and AIDS-associated Kaposi’s sarcoma. J Med Virol. 2003; 71(4): 548–56. DOI: 10.1002/jmv.10530.
6. Гурцевич В.Э., Яковлева Л.С., Галецкий С.А. и др. Клиниковирусологические особенности заболеваний, ассоциированных с вирусом саркомы Капоши. Инфекция и иммунитет. 2011; 1(2): 151–160.
7. Hu J., Renne R. Characterization of the minimal replicator of Kaposi’s sarcoma-associated herpesvirus latent origin. J Virol. 2005; 79(4): 2637–42. DOI: 10.1128/JVI.79.4.2637-2642.2005.
8. Du M.Q., Bacon C.M., Isaacson P.G. Kaposi sarcoma-associated herpesvirus/human herpesvirus 8 and lymphoproliferative disorders. J Clin Pathol. 2007; 60(12): 1350–7. DOI: 10.1136/jcp.2007.047969.
9. Melikyan A.L., Egorova E.K., Julhakyan H.L., Kovrigina A.M. Human herpesvirus type 8 positive multicentric Castleman disease. Clin Lymphoma Myeloma Leuk. 2016; 16(Suppl): S159–65. DOI: 10.1016/j.clml.2016.03.009.
10. Меликян А.Л, Егорова Е.К., Ковригина А.М. и др. Клиникоморфологические особенности различных вариантов болезни Кастлемана. Терапевтический архив. 2015: 87: 64–71. DOI: 10.17116/terarkh201587764-71.
11. Cai Q., Verma S.C., Lu J., et al. Molecular biology of Kaposi’s sarcoma herpesvirus and related oncogenesis. Adv Virus Res. 2010; 78: 87–142. DOI: 10.1016/B978-0-12-385032-4.00003-3.
12. Sakakibara S., Tosato G. Viral interleukin-6: role in Kaposi’s sarcoma-associated herpesvirus-associated malignancies. J Interferon Cytokine Res. 2011; 31(11):791–801. DOI: 10.1089/jir.2011.0043.
13. Soulier J., Grollet L., Oksenhendler E., et al. Kaposi’s sarcoma-associated herpesvirus-like DNA sequences in multicentric Castleman’s disease. Blood. 1995: 86(4): 1276–80.
14. Plancoulaine S., Abel L., van Beveren M., et al. Human herpesvirus 8 transmission from mother to child and between siblings in an endemic population. Lancet. 2000; 356(9235): 1062–5. DOI: 10.1016/S0140-6736(00)02729-X.
15. Brayfield B.P., Kankasa C., West J.T., et al. Distribution of Kaposi sarcomaassociated herpesvirus/human herpesvirus 8 in maternal saliva and breast milk in Zambia: Implications for transmission. J Infect Dis. 2004; 189(12): 2260–70. DOI: 10.1086/421119.
16. Butler L.M., Were W.A., Balinandi S., et al. Human herpesvirus 8 infection in children and adults in a population-based study in rural Uganda. J Infect Dis. 2011; 203(5): 625–34. DOI: 10.1093/infdis/jiq092.
17. Ablashi D.V., Chatlynne L.G., Whitman J.E. Jr., Cesarman E. Spectrum of Kaposi’s sarcoma-associated herpesvirus, or human herpesvirus 8, diseases. Clin Microbiol Rev. 2002; 15(3): 439–64. DOI: 10.1128/cmr.15.3.439-464.2002.
18. Martin J.N. Epidemiology of Kaposi’s sarcoma-associated herpesvirus infection. In: Volberding P.A., Palevsky J.M., Walsh C.C. (eds). Viral and immunological malignancies. Hamilton: BC Decker Inc; 2006: 67–88.
19. Akasbi Y., Awada A., Arifi S., et al. Non-HIV Kaposi’s sarcoma: A review and therapeutic perspectives. Bull Cancer. 2012; 99(10): 93–9. DOI: 10.1684/bdc.2012.1636.
20. Сапожников А.Д., Перлина А.Д., Дымков И.Н. Регрессия саркомы Капоши после длительного лечения ингибиторами m-TOR и полной отмены иммуносупрессии у реципиента после трансплантации почки. Вестник трансплантологии и искусственных органов. 2019; 21(2): 121–4. DOI: 10.15825/1995-1191-2019-2-121-124.
21. Ватазин А.В., Молочков В.А., Казанцева И.А. и др. Саркома Капоши у больных после трансплантации почки (опыт одного центра). Нефрология и диализ. 1999; 1(2, 3): 155–63.
22. Heyrman B., De Becker A., Schots R. A case report of immunosuppressionrelated Kaposi’s sarcoma after autologous stem cell transplantation. BMC Res Notes. 2016; 9: 188. DOI: 10.1186/s13104-016-1991-9.
23. Campione E., Diluvio L., Paternò E.J., et al. Kaposi’s sarcoma in a patient treated with imatinib mesylate for chronic myeloid leukemia. Clin Ther. 2009; 31(11):2565–9. DOI: 10.1016/j.clinthera.2009.11.018.
24. Omine T., Yamaguchi S., Yasumura R., et al. Iatrogenic Kaposi’s sarcoma in a myelofibrosis patient treated with ruxolitinib. J Dermatol. 2020; 47(4): e131–2. DOI: 10.1111/1346-8138.15259.
25. Loscocco G.G., Vannucchi M., Paoli C., et al. Kaposi sarcoma in a patient treated with ruxolitinib. Ann Oncol. 2017; 28(7): 1670–1. DOI: 10.1093/annonc/mdx188.
26. Wani G.M., Ahmad S.M., Qayoom S., et al. Corticosteroid induced, HHV-8 positive Kaposi’s sarcoma in a non-HIV elderly patient. J IMA. 2012; 44(1): 44-1-9317. DOI: 10.5915/44-1-9317.
27. Endo G., Nagata N. Corticosteroid-induced Kaposi’s sarcoma revealed by severe anemia: A case report and literature review. Intern Med. 2019; 59(5): 625–31. DOI: 10.2169/internalmedicine.3394-19.
28. WHO Classification of tumours of lymphoid and hematopoietic tissues. Lyon: IARC; 2017: 585.
29. Passamonti F., Cervantes F., Vannucchi A.M., et al. Dynamic International Prognostic Scoring System (DIPSS) predicts progression to acute myeloid leukemia in primary myelofibrosis. Blood. 2010; 116(15): 2857–8. DOI: 10.1182/blood-2010-06-293415.
30. Менделеева Л.П., Вотякова О.М, Покровская О.С. и др. Национальные клинические рекомендации по диагностике и лечению множественной миеломы. Гематология и трансфузиология. 2016; 61(1, Прил. 2): 1–24.DOI: 10.18821/0234-5730-2016-61-1.
31. Меликян А.Л., Туркина А.Г., Ковригина А.М. и др. Клинические рекомендации по диагностике и терапии Ph-негативных миелопролиферативных заболеваний (истинная полицитемия, эссенциальная тромбоцитемия, первичный миелофиброз) (редакция 2016 г.). Гематология и трансфузиология. 2017; 62(1, Прил. 1): 1–60.
32. Kaposi M. Idiopathisches multiples Pigmentsarkom der Haut. Arch Dermatol Syph. 1872; 4(0): 265–73.
33. Вольф К., Голдсмит Л.А., Кац С.И. и др. Дерматология Фицпатрика в клинической практике. Т. 2. Пер. с англ. М.: БИНОМ; 2012; 1838.
34. Каламкарян А.А., Акимов В.Г., Казанцева И.А. Саркома Капоши. Новосибирск: Наука; 1986: 111.
35. Ламоткин И.А. Опухоли и опухолевидные поражения кожи: атлас. М.: БИНОМ; 2006: 166.
Об авторах
Е. К. ЕгороваРоссия
Егорова Елена Константиновна, кандидат медицинских наук, врач-гематолог отделения стандартизации методов лечения
125167, Москва
А. Л. Меликян
Россия
Меликян Анаит Левоновна, доктор медицинских наук, заведующая отделением стандартизации методов лечения
125167, Москва
И. Н. Суборцева
Россия
Суборцева Ирина Николаевна, кандидат медицинских наук, научный сотрудник, отделение стандартизации методов лечения
125167, Москва
Э. А. Домонова
Россия
Домонова Эльвира Алексеевна, кандидат биологических наук, старший научный сотрудник отдела молекулярной диагностики и эпидемиологии
111123, Москва
О. Ю. Сильвейстрова
Россия
Сильвейстрова Ольга Юрьевна, младший научный сотрудник отдела молекулярной диагностики и эпидемиологии
111123, Москва
Д. И. Чеботарев
Россия
Чеботарев Дмитрий Ильич, патологоанатом, патологоанатомическое отделение
125167, Москва
А. М. Ковригина
Россия
Ковригина Алла Михайловна, доктор биологических наук, заведующая патологоанатомическим отделением
125167, Москва
Рецензия
Для цитирования:
Егорова Е.К., Меликян А.Л., Суборцева И.Н., Домонова Э.А., Сильвейстрова О.Ю., Чеботарев Д.И., Ковригина А.М. Саркома Капоши у ВИЧ-негативного больного первичным миелофиброзом. Гематология и трансфузиология. 2021;66(3):433-444. https://doi.org/10.35754/0234-5730-2021-66-3-433-444
For citation:
Egorova E.K., Melikyan A.L., Subortseva I.N., Domonova E.A., Silveystrova O.Y., Chebotarev D.I., Kovrigina A.M. Kaposi’s sarcoma in HIV-negative patient with primary myelofibrosis. Russian journal of hematology and transfusiology. 2021;66(3):433-444. (In Russ.) https://doi.org/10.35754/0234-5730-2021-66-3-433-444











































