Перейти к:
Применение экстракорпорального фотофереза в лечении хронической формы реакции «трансплантат против хозяина»
https://doi.org/10.35754/0234-5730-2022-67-2-202-215
Аннотация
Введение. Хроническая форма реакции «трансплантат против хозяина» (хрРТПХ) — частое осложнение после трансплантации аллогенных гемопоэтических клеток, ассоциирована со снижением качества жизни, необходимостью длительного приема иммуносупрессивных препаратов. В качестве второй линии лечения используют экстракорпоральный фотоферез (ЭКФ).
Цель — оценить достижение ответа на лечение ЭКФ у больных с резистентной к терапии глюкокортикостероидами (ГКС), ГКС-зависимой, ГКС-интолерантной хрРТПХ.
Материалы и методы. В исследование включено 24 больных с ГКС-резистентной, ГКС-зависимой, ГКС-интолерантной формой хрРТПХ. У 9 больных была хрРТПХ средней степени тяжести, у 15 — тяжелая форма. Наиболее частыми органами-мишенями были кожа (21 из 24 больных) и слизистые оболочки (20 из 24 больных), поражение печени было выявлено у 8 больных. Максимальная продолжительность лечения ЭКФ составила 33 мес. (медиана — 8,5 мес.). Число процедур ЭКФ варьировало от 6 до 48 (медиана — 22).
Результаты. Ответ на терапию оценен у 23 больных, одна больная была исключена из оценки ответа на терапию в связи с рецидивом острого лейкоза. В результате применения ЭКФ у 16 (69,5 %) больных удалось достичь ответа на лечение ЭКФ, из них у 3 констатирован полный ответ и отменена иммуносупрессивная терапия. При оценке орган-специфического ответа чаще всего отмечалось улучшение со стороны слизистых оболочек — 17 больных (89,4 %), кожи — 17 (85 %) и печени — 7 (75 %). Наряду с достижением общего ответа, 78,2 % больных удалось уменьшить дозы или полностью прекратить применение иммуносупрессивных препаратов.
Заключение. ЭКФ является эффективным методом лечения больных с ГКС-резистентной, ГКС-зависимой, ГКЧ-интолерантной формами хрРТПХ, в результате которого удается добиться ответа на лечение, уменьшить дозы или полностью прекратить применение иммуносупрессивных препаратов.
Ключевые слова
Для цитирования:
Васильева В.А., Кузьмина Л.А., Дроков М.Ю., Довыденко М.В., Королева О.М., Дубняк Д.С., Дмитрова А.А., Никифорова Н.М., Старикова О.С., Камельских Д.В., Щербакова А.А., Гапонова Т.В., Паровичникова Е.Н., Савченко В.Г. Применение экстракорпорального фотофереза в лечении хронической формы реакции «трансплантат против хозяина». Гематология и трансфузиология. 2022;67(2):202-215. https://doi.org/10.35754/0234-5730-2022-67-2-202-215
For citation:
Vasilyeva V.A., Kuzmina L.A., Drokov M.Yu., Dovydenko M.V., Koroleva O.M., Dubnyak D.S., Dmitrova A.A., Nikiforova N.M., Starikova O.S., Kamelskikh D.V., Sherbakova A.A., Gaponova T.V., Parovichnikova E.N., Savchenko V.G. Extracorporeal photopheresis in the treatment of chronic graft-versus-host-disease. Russian journal of hematology and transfusiology. 2022;67(2):202-215. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-2-202-215
Введение
Хроническая форма реакции «трансплантат против хозяина» (хрРТПХ) возникает, как правило, в течение 2 лет после трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) у 30–90 % реципиентов и ассоциирована со снижением качества жизни, с необходимостью продолжения приема иммуносупрессивных препаратов, а также увеличением летальности, несвязанной с основным заболеванием [1–4]. Синдромы и симптомы хрРТПХ схожи с аутоиммунными заболеваниями. Патогенез хрРТПХ сложен и представляет собой дисбаланс иммунологической толерантности Т- и В-клеточных популяций [5][6]. Манифестация хрРТПХ характеризуется как поражением одного органа/системы, так и многих органов и систем и тяжелым течением патологического процесса [5][6]. Для лечения хрРТПХ существует огромный потенциал терапевтических воздействий. Однако рекомендуемой первой линией терапии хрРТПХ средней и тяжелой формы являются глюкокортикостероиды (ГКС), в частности, преднизолон в дозе 1 мг/кг в сутки [7][8]. Примерно у половины больных с хрРТПХ достигается ответ на терапию ГКС; у другой констатируют ГКС-резистентную форму хрРТПХ, при которой требуется назначение второй линии лечения [9][10].
Оптимальным решением при выборе второй линии лечения является метод с максимальным лечебным эффектом и минимальным патологическим действием на организм, каковым является экстракорпоральный фотоферез (ЭКФ) [11]. Эффективность ЭКФ в лечении хрРТПХ достигает 29–100 %, что делает возможным уменьшение доз системных иммуносупрессивных препаратов и снижает издержки на длительную терапию хрРТПХ [12–15]. ЭКФ — это многоступенчатая циклическая процедура, во время которой мононуклеары периферической крови больного после обработки фотосенсибилизатором 8-метоксипсораленом (8-МОП) в концентрации 60–200 нг/мкл подвергаются облучению ультрафиолетом спектра А (УФА) (1–2 Дж/см 2) и возвращаются больному [16].
Фотохемотерапия стала применяться уже 5000 лет назад египтянами, которые использовали растение Ammi majus для лечения депигментированных участков на теле одновременно с солнечными ваннами [17]. 8-МОП или аммоидин впервые был выделен из разных видов растений в 1911 г., а синтезирован в 1933 г. [18][19]. После 1950-х гг. пероральную форму 8-МОП начали активно использовать для лечения витилиго [18]. В. А. Gilchrest [20] показал, что ПУВА-терапия эффективна для лечения кожных Т-клеточных лимфом. В 1987 г. R. Edelson и соавт. [21] использовали прибор для терапии кожных Т-клеточных лимфом, при котором вначале проводили лейкоцитаферез, а в последующем — облучение УФА (ЭКФ) в одном приборе, при этом больной предварительно принимал 8-МОП. При использовании этого метода у 27 из 37 включенных в исследование больных отмечен ответ на лечение в течение 22,4 ± 9,6 нед., при этом у 28 из 37 больных не было эффекта на проводимую ранее терапию, а у 6 больных отмечалась ухудшение состояния кожных покровов, и у 4 не было получено эффекта [21]. В 1990-х гг. во Франции был предложен другой метод ЭКФ, при котором сначала проводили сбор мононуклеаров крови с помощью приборов для цитафереза, а затем собранные клетки переливали в специальный стерильный мешок для облучения, в который добавляли растворимую форму 8-МОП, после чего проводили УФА-облучение [22][23]. В дальнейшем и в американской системе начали использовать растворимый 8-МОП, с целью достижения наилучшей терапевтической концентрации и уменьшения побочных эффектов [17].
Область применения ЭКФ в настоящее время очень широкая: аутоиммунные заболевания, кожные Т-клеточные лимфомы, профилактики отторжения при трансплантации солидных органов (легких, сердца, почек), лечение острой РТПХ (оРТПХ) и хрРТПХ [22][24–35]. Применение ЭКФ при лечении оРТПХ имеет уровень доказательности 1 С, в то время как при хрРТПХ — 1 В [16].
Впервые в 1994 г. M. Owsianowski и соавт. [36] описали использование ЭКФ у больной склеродермной формой хрРТПХ, резистентной к ГКС. Учитывая преимущества ЭКФ, а именно хорошую переносимость, безопасность, отсутствие значимых побочных явлений и длительно текущих осложнений по сравнению с другими иммуносупрессивными агентами, эта процедура стала широко применяться у больных как с ГКС-резистентной формой РТПХ, так и в качестве сочетанного лечения первой линии. Не выявлено дозозависимого эффекта ЭКФ в зависимости от облучаемого и переливаемого объема, количества продукта ЭКФ или использования разных устройств. Однако, помимо органного поражения, на эффективность ЭКФ при хрРТПХ влияет раннее включение этого метода в схему лечения [11][37][38]. Показано улучшение качества жизни и выживаемости больных с хрРТПХ, ответивших на лечение ЭКФ [11][12][39].
Целью настоящей работы явилась оценка достижения ответа на лечение больных с ГКС-резистентной, ГКС-зависимой, ГКС-интолерантной формой РТПХ.
Материалы и методы
C января 2017 г. по сентябрь 2019 г. в исследование эффективности ЭКФ были включены 24 больных с ГКС-резистентной, ГКС-зависимой, ГКС-интолерантной формой хрРТПХ, получавших лечение в ФГБУ «НМИЦ гематологии». Характеристика больных представлена в таблице 1. ГКС-резистентная форма хрРТПХ определена как отсутствие ответа или прогрессия хрРТПХ после назначения преднизолона в дозе не менее 1 мг/кг/сут. или метилпреднизолона в эквивалентной дозе. ГКС-зависимой формой хрРТПХ считалась хрРТПХ, при которой для контроля проявлений хрРТПХ требовалось более 10 мг/сут. преднизолона или метилпреднизолона в эквивалентной дозе, и невозможно уменьшить дозу ГКС ниже этого порога. ГКС-интолерантную форму хрРТПХ определяли как развитие тяжелых осложнений в результате приема ГКС, таких как асептический некроз головки бедренной кости, тяжелая миопатия, неконтролируемый сахарный диабет, системная вирусная или грибковая инфекция 3–4-й степени тяжести в соответствии с общими терминологическими критериями для неблагоприятных событий (CTCAE v5.0) [40][41].
Таблица 1. Характеристика больных, включенных в исследование
Table 1. Characteristics of patients included in the study
|
Параметры Parameters |
Количество больных Number of patients (n = 24) |
|
Возраст/Age (Me) |
21–58 (42,5) |
|
Мужчины: женщины/Males: Females |
11 : 13 |
|
Диагноз/Diagnosis |
|
|
Острый лейкоз/Acute leukemia |
17 |
|
Хронический миелолейкоз, миелодиспластический синдром, миелопролиферативное заболевание/Chronic myeloid leukaemia, Myelodysplastic syndrome, Myeloproliferative disorders |
3 |
|
Лимфопролиферативные заболевания/Lymphoproliferative diseases |
4 |
|
Номер алло-ТГСК/Number of allogenic hematopoetic cell transplantation |
|
|
Первая/First |
20 |
|
Вторая/Second |
4 |
|
Тип донора/Donor type |
|
|
Родственный полностью совместимый/Relative full matched |
10 |
|
Неродственный совместимый/частично-совместимый/Unrelative full matched/mismatched |
10/4 |
|
Вид кондиционирования/Conditioning regimen |
|
|
Миелоаблативный/Myeloablative |
3 |
|
Пониженной интенсивности/Reduced intensity |
21 |
|
Источник трансплантата/Graft source |
|
|
Стволовые клетки крови/Peripheral blood stem cells |
12 |
|
Костный мозг/Bоne marrow |
12 |
ЭКФ в качестве 2-й линии лечения был у 7 больных, 3-й линии — у 13, ≥ 4-й линии — у 4 больных. У больных, получавших ЭКФ в качестве третьей и более линий лечения, на предшествующих этапах проводили терапию следующими препаратами: ГКС, ингибиторы кальциневрина (такролимус, циклоспорин), азатиоприн, микофенолата мофетил, иматиниб. Время от диагностики хрРТПХ до начала терапии ЭКФ составило от 1 до 177,6 мес. (медиана — 19,1 мес.).
Для оценки тяжести хрРТПХ использовали балльную систему, разработанную Национальным институтом здоровья США [5]. Легкую степень хрРТПХ устанавливали при поражении не более двух органов-мишеней (кроме легких), с максимальной оценкой 1 балл. Среднюю степень хрРТПХ устанавливали при поражении одного органа-мишени (максимальная оценка — 2 балла), либо поражении ≥ 3 органов-мишеней (максимальная оценка — 1 балл), либо при поражении легких (1 балл). Тяжелую степень хрРТПХ устанавливали при поражении хотя бы одного органа-мишени (с оценкой в 3 балла) либо при поражении легких (оценка — 2 балла и более).
Из 24 больных, которым проводили ЭКФ, у 9 больных была хрРТПХ средней степени тяжести, у 15 больных — тяжелая форма хрРТПХ. Наиболее частыми органами-мишенями были кожа (21 из 24 больных) и слизистые оболочки (20 из 24 больных), поражение печени было выявлено у 8 больных, у 6 больных отмечено поражение легких, у 5 были вовлечены фасции и суставы, поражение костного мозга было у 3 больных, у 1 больного выявлено поражение кишечника как исход оРТПХ и у 1 больного был полисерозит. У 21 (87,5 %) больных была комбинация поражения нескольких органов-мишеней.
Лечение ЭКФ проводили по схеме: первый месяц — еженедельные процедуры, далее 2 процедуры в месяц, суммарно — до 20 процедур, далее процедуры продолжали 1 раз в месяц или реже [42]. Каждая процедура ЭКФ включала в себя 3 этапа: 1) аферез мононуклеаров проводили на клеточном сепараторе SpectraOptia (Terumo BCT, Япония/США) в режиме сбора мононуклеаров со следующими параметрами процедуры: соотношение кровь/антикоагулянт — 12:1; настройка сбора (collection preferred) — 40, 2) облучение на аппарате Macogenic G2 (Macopharma, Франция) согласно рекомендациям производителя, 3) введение облученных мононуклеаров больному. Контрольными точками для оценки ответа и определения дальнейшего продолжения терапии являлась оценка состояния больного после 10-й процедуры (в случае прогрессии лечение ЭКФ больному прекращали), после 20-й процедуры (в случае прогрессии, при наличии смешанного ответа, стабилизации состояния и частичного ответа без отмены иммуносупрессивной терапии, а также в случае полного ответа и отмены иммуносупрессивной терапии (ИСТ) — лечение ЭКФ больному прекращали), после проведения 40 процедур ЭКФ и при условии полной отмены ИСТ лечение ЭКФ больному прекращали. Продолжение ЭКФ после 40-й процедуры определялось по индивидуальным показаниям и решению исследователя. Процедуры также прекращались в следующих случаях: отказ больного, прогрессия хрРТПХ на любых сроках, констатация прогрессии основного заболевания (рис. 1).

Рисунок 1. Распределение больных в соответствии с дизайном исследования
Figure 1. Distribution of patients according with the study design
Notes. сCVHD — chronic Graft-Versus-Host-Disease, ECP — extracorporeal photopheresis
Ответ оценивали по 3 категориям: полный ответ — полное обратное развитие всех проявлений хрРТПХ; частичный ответ — регресс (полный или частичный) клинических проявлений хотя бы в одном органе-мишени, при отсутствии прогрессии по другим органам мишеням, частичный и полный ответ составляют общий ответ на лечение; отсутствие ответа включало в себя «отсутствие каких-либо изменений», смешанный ответ (улучшение по ранее затронутому органу-мишени, при наличии прогрессии в другом органе-мишени) и прогрессия хрРТПХ [6]. Отдельно проведена оценка ответа в конкретных органах-мишенях, категории ответа соответствовали категориям общего ответа, а в качестве органов-мишеней были выбраны органы: кожа, слизистые, печень, легкие [6]. Ответ не оценивали у больных, у которых развился рецидив основного заболевания. Для оценки ответа на лечение использовали специально разработанные опросники как для врача, так и для больного: для оценки активности хрРТПХ врачами — опросник S. Lee и соавт. [6][42], для оценки ответа на терапию по мнению больного — адаптированный опросник по S. Lee и соавт. [6]. Опросники врач и больной заполняли 1 раз в 4 процедуры. Оценка состояния больного включала также фиксирование неблагоприятных событий, побочных явлений, систематические анализы крови, инструментальные методы исследования и консультации смежных специалистов.
Статистический анализ. Статистический анализ данных проводился с использованием программы R (версия 4.1). Были использованы методы описательной статистики. Данные о возрасте представлены в виде медианы, минимальных и максимальных значений. Значимыми признавались отличия при p < 0,05.
Результаты
Максимальная продолжительность лечения ЭКФ составила 33 мес. (медиана — 8,5 мес.). Количество выполненных процедур варьировало от 6 до 48 (медиана — 22). Ответ на терапию определен у 23 больных, одна больная была исключена из оценки ответа на терапию в связи с диагностикой рецидива острого лейкоза. В результате лечения у 16 (69,5 %) больных, удалось достичь ответа на лечение ЭКФ, из них у 3 констатирован полный ответ и отменена ИСТ. В группе больных с хрРТПХ средней степени тяжести у 8 больных был достигнут частичный ответ, у одного больного — полный ответ, у 7 больных удалось уменьшить дозы иммуносупрессивных препаратов, а у 2 — полностью отменить. Среди больных с тяжелой формой хрРТПХ у 7 был получен ответ, у 2 из них — полный (табл. 2).
При оценке орган-специфического ответа чаще всего отмечалось улучшение со стороны слизистых оболочек — 17 больных (89,4 %), кожи — 17 (85 %) и печени — 7 (75 %). У больных с поражением легких в 80 % случаев (4 больных) отсутствовал ответ на лечение ЭКФ (табл. 3).
Таблица 2. Ответ на лечение ЭКФ
Table 2. Response to ECP treatment
|
Вариант ответа Type of response |
Количество больных Number of patients (n = 23) |
Степень тяжести хрРТПХ Severity of chronic GVHD |
|
|
Средняя/Moderate (n = 9) |
Тяжелая/Severe (n = 14) |
||
|
Полный ответ Complete response |
3 (13 %) |
1 (11 %) |
2 (14 %) |
|
Частичный ответ Partial response |
13 (56,5 %) |
8 (89 %) |
5 (36 %) |
|
Отсутствие ответа No response |
7 (30,5 %) |
– |
7 (50 %) |
Таблица 3. Ответ на лечение ЭКФ в зависимости от органа-мишени хрРТПХ
Table 3. Organ specific response to ECP treatment depending on the GVHD target organ
|
Вариант ответа Type of response |
Кожа/Skin (n = 20) |
Слизистые/Mucosa |
Печень/Liver |
Легкие/Lungs |
|
Полный ответ Complete response |
5 (25 %) |
4 (21 %) |
3 (37,5 %) |
– |
|
Частичный ответ Partial response |
12 (60 %) |
13 (68,4 %) |
3 (37,5 %) |
1 (20 %) |
|
Отсутствие ответа No response |
3 (15 %) |
2 (10,6 %) |
2 (25 %) |
4 (80 %) |
Проанализированы опросники, заполняемые врачами и больными. Больные, ответившие на лечение, от процедуры к процедуре имели меньшее количество баллов активности хрРТПХ (общей и конкретного органа-мишени) как по объективному мнению врача, так и по субъективному мнению больного (рис. 2).
При анализе частоты достижения ответа на лечение ЭКФ хрРТПХ в зависимости от наличия оРТПХ в анамнезе достоверных различий не получено (56,25 % против 100 %) (рис. 3).
Более ранее включение в терапию ЭКФ не являлось предиктором ответа на лечение. Наоборот, у больных, достигших общего ответа, медиана наблюдения от диагностики хрРТПХ до лечения ЭКФ составила 16,3 мес., в то время как у больных, не достигших общего ответа, — 2,7 мес. Как было показано ранее, в группу больных, у которых не достигнут ответ на терапию, в большей степени вошли больные с тяжелой степенью тяжести хрРТПХ, и в этой группе больных, вероятно, введение в схему лечения новых иммуносупрессивных агентов, в том числе и ЭКФ, было связано с неудачей предшествующих линий терапии.
Не выявлено значимых различий в достижении общего ответа в зависимости от линии лечения, но ответ был достигнут у всех больных, у которых ЭКФ был четвертой и более линией лечения. В эту группу вошли больные со средней степенью тяжести хрРТПХ и менее агрессивным течением хрРТПХ, что позволяло проводить им разные виды терапии на предыдущих этапах (рис. 4). Удалось редуцировать ИСТ, которая была полностью прекращена у 5 больных и частично — у 13 больных.
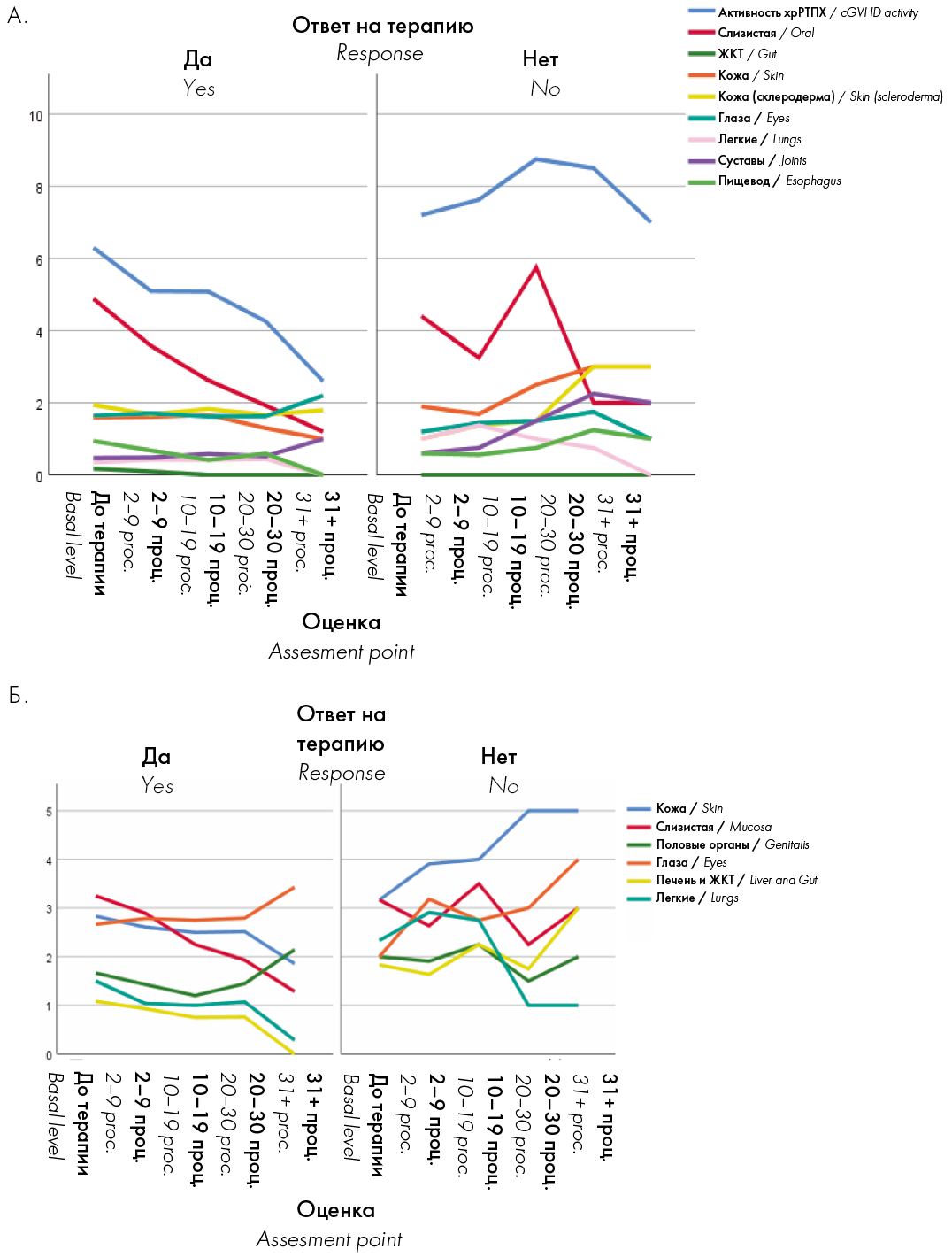
Рисунок 2. Оценка активности хрРТПХ по мнению врача (А) и по мнению пациента (Б) в зависимости от количества выполненных процедур. ЖКТ — желудочно-кишечный тракт
Figure 2. Assessment of the activity of cGVHD according to the doctor’s opinion (A) and according to the patient’s opinion (B), depending on the number of procedures performed
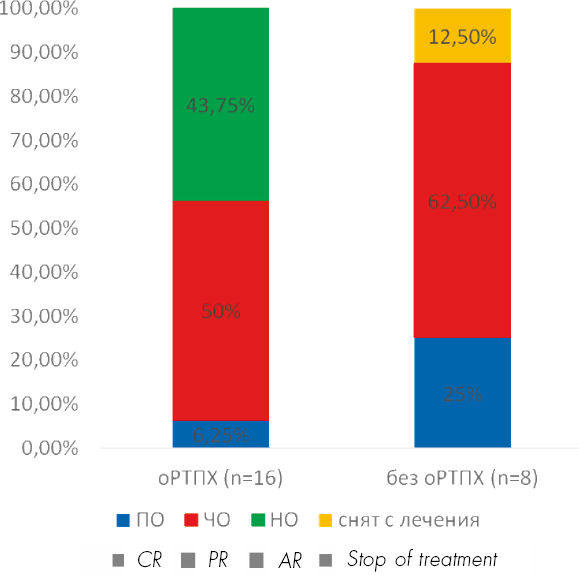
Рисунок 3. Достижение общего ответа в зависимости от наличия острой РТПХ в анамнезе
Figure 3. Overall response rate depending on aGVHD in anamnesis
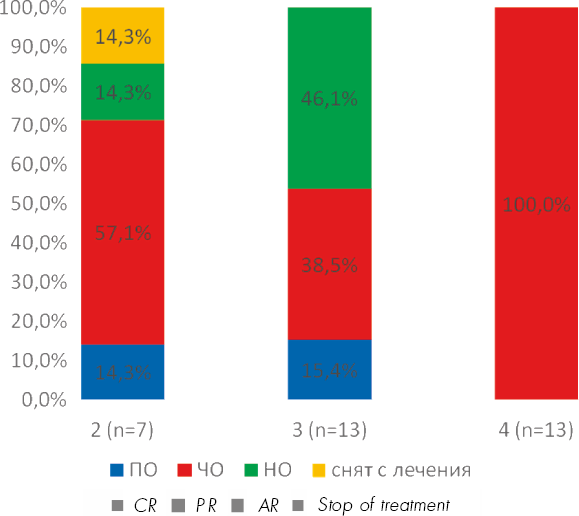
Рисунок 4. Достижение общего ответа в зависимости от проведенных линий терапии перед ЭКФ. ПО— полный ответ, ЧО — частичный ответ, НО — нет ответа
Figure 4. Overall response rate depending on ECP as a line of the therapy. CR —complete response, PR — partial response, AR — absence of response
Двухлетняя общая выживаемость в этой группе больных составила 88 %. Умерли 3 больных: 2 больных умерли от резистентной хрРТПХ с поражением легких и сопутствующих инфекционных осложнений, 1 больной — от рецидива заболевания.
Проведение процедур ЭКФ прекращено у 19 больных: у 6 больных констатировано отсутствие ответа, в том числе прогрессия хрРТПХ; у 1 больного диагностирован рецидив острого лейкоза; у 7 больных достигнут частичный ответ и выполнена редукция доз иммуносупрессивных препаратов; у 3 больных достигнут полный ответ и полностью отменена ИСТ; двое больных отказались от проведения терапии, при этом у 1 больного был достигнут частичный эффект и выполнена редукция доз иммуносупрессивных препаратов. Процедуры ЭКФ продолжаются у 5 больных, у всех достигнут частичный ответ, у 4 больных выполнена редукция доз иммуносупрессивных препаратов, а у 1 больного — полная их отмена.
Обсуждение
хрРТПХ — распространенное осложнение после алло-ТГСК, которое значительно ухудшает качество жизни больного, и для лечения которого требуется проведение ИСТ. Достижение общего ответа на терапию ЭКФ составляет 60–65 % [43]. Полученные в настоящем исследовании данные не отличаются от результатов других исследователей — общий ответ составил 69,5 %. В мультицентровое рандомизированное контролируемое, проспективное исследование, выполненное M. Flowers и соавт. [14], было включено 95 больных с ГКС-резистентной, ГКС-зависимой или ГКС-интолерантной хрРТПХ, в котором частичный или полный ответ к 12-й неделе терапии достоверно чаще отмечен у больных, которым проводили лечение ЭКФ, по сравнению с контрольной группой, в которой больные получали такролимус, циклоспорин А или микофенолата мофетил.
Одним из главных предикторов ответа на лечение ЭКФ считают органное поражение при хрРТПХ. Наилучший орган-специфический ответ на лечение ЭКФ достигается при поражениях кожи (как при лихеноидном, так и склеродермном поражении), он составляет 60–70 %, при поражениях слизистых — 60–65 %, печени — 50–60 %, при поражениях легких ответ достигается в 0–50 % случаев [43]. J. J. Scarisbrick и соавт. [15] проанализировали 23 исследования, включавшие 633 больных, которым проводили ЭКФ с целью лечения хрРТПХ. Общий ответ при кожной форме хрРТПХ составил 68 % (29–100 %) в 18 исследованиях, в то время как у больных хрРТПХ с поражением печени общий ответ составил 63 % в 10 исследованиях, аналогичный общий ответ наблюдали при поражении слизистых в 9 исследованиях. По нашим данным, орган-специфический ответ при поражении слизистых оболочек составил 89,4 %, кожи — 85 %, печени — 75 %, легких — 20 %. Несмотря на то, что у 80 % больных с хрРТПХ легких отсутствовал ответ на лечение ЭКФ, 40 % из них в результате этого лечения терапии не имели прогрессии хрРТПХ легких. Полученный результат свидетельствует, что для лечения хрРТПХ с поражением легких необходим поиск других подходов. Опыт лечения ЭКФ легочной формы хрРТПХ ограничен небольшим числом наблюдений: из 100 больных общий ответ был достигнут у 51 %, включая 14 полных ответов [39].
В настоящей работе были проанализированы факторы, которые могли влиять на эффективность лечения ЭКФ, такие как оРТПХ в анамнезе, время от диагностики хрРТПХ до начала лечения ЭКФ и количество предшествующих линий терапии. В отличие от проведенных исследований, в которых была показана успешность ЭКФ в зависимости от более раннего включения в терапию ЭКФ [13][44], такой закономерности не выявлено. Наоборот, у больных, которым ЭКФ проводили по прошествии более длительного времени и в качестве 4-й и более линии лечения, был получен наилучший ответ. В эту группу вошли больные с менее продвинутой стадией хрРТПХ, что, по-видимому, в большей степени повлияло на ответ, но эта группа состояла только из 4 человек. У больных с более продвинутой стадией хрРТПХ по классификации Национального института здоровья США 2015 г. [5], реже достигали ответ на лечение: 50 % с тяжелой степенью тяжести хрРТПХ против 100 % больных со средней степенью тяжести. Аналогичные данные получены в исследовании M. Berger и соавт. [38], но на момент публикации их работы авторы использовали классификацию NIH 2005 г. [7], а также сиэтловскую классификацию хрРТПХ (экстенсивная и лимитированная форма) [45], в которой больные лимитированной формой и средней степенью тяжести имели большую вероятность достижения общего ответа. В настоящем исследовании, наряду с общим ответом, у 78,2 % больных удалось редуцировать или полностью отменить ИСТ, что является значимым преимуществом ЭКФ перед другими воздействиями. Схожие результаты опубликовали и другие авторы, которые лечили больных ЭКФ [14][46][47].
Таким образом, больные хрРТПХ имеют ограниченное количество лечебных опций. ЭКФ в рамках лечения хрРТПХ является перспективным методом лечения, в результате которого даже у больных с ГКС-резистентной, ГКС-зависимой, ГКС-интолерантной формами хрРТПХ достигнут ответ в 69,5 % случаев без дополнительного назначения ИСТ, а в 78,2 % случаев удалось редуцировать или полностью отменить ИСТ, что улучшает качество жизни больных.
Список литературы
1. Socié G., Stone J.V., Wingard J.R., et al. Long-term survival and late deaths after allogeneic bone marrow transplantation. N Engl J Med. 1999; 341(1): 14–21. DOI: 10.1056/NEJM199907013410103.
2. Sullivan K.M., Witherspoon R.P., Storb R., et al. Alternating-day cyclosporine and prednisone for treatment of high-risk chronic graft-v-host disease. Blood. 1988; 72(2): 555–61.
3. Lee S.K., Cook E.F., Soiffer R., et al. Development and validation of a scale to measure symptoms of chronic graft-versus-host disease. Biol Blood Marrow Transplant. 2002; 8(8): 444–52. DOI: 10.1053/bbmt.2002.v8.pm12234170.
4. Sutherland H., Fyles G., Adams G., et al. Quality of life following bone marrow transplantation: A comparison of patient reports with population norms. Bone Marrow Transplant. 1997; 19(11): 1129–36. DOI: 10.1038/sj.bmt.1700806.
5. Jagasia M.H., Greinix H.T., Arora M., et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. The 2014 Diagnosis and Staging Working Group Report. Biol Blood Marrow Transplant. 2015; 21(3): 389–401.e1. DOI: 10.1016/j.bbmt.2014.12.001.
6. Lee S.J., Wolff D., Kitko C., et al. Measuring therapeutic response in chronic graft-versus-host disease. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: IV. The 2014 Response Criteria Working Group Report. Biol Blood Marrow Transplant. 2015; 21(6): 984–99. DOI: 10.1016/j.bbmt.2015.02.025.
7. Filipovich A.H., Weisdorf D., Pavletic S., et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant. 2005; 11(12): 945–56. DOI: 10.1016/j.bbmt.2005.09.004.
8. Dignan F.L., Amrolia P., Clark A., et al. Diagnosis and management of chronic graft-versus-host disease. Br J Haematol. 2012; 158(1): 46–61. DOI: 10.1111/j.1365-2141.2012.09128.x.
9. Vogelsang G.B. How I treat chronic graft-versus-host disease. Blood. 2001; 97(5): 1196–201. DOI: 10.1182/blood.v97.5.1196.
10. Wolff D., Schleuning M., von Harsdorf S., et al. Consensus conference on clinical practice in chronic GVHD: Second-line treatment of chronic graft-versus-host disease. Biol Blood Marrow Transplant. 2011; 17(1): 1–17. DOI: 10.1016/j.bbmt.2010.05.011.
11. Malik M.I., Litzow M., Hogan W., et al. Extracorporeal photopheresis for chronic graft-versus-host disease: A systematic review and meta-analysis. Blood Res. 2014; 49(2): 100–6. DOI: 10.5045/br.2014.49.2.100.
12. Greinix H.T., Volc-Platzer B., Rabitsch W., et al. Successful use of extracorporeal photochemotherapy in the treatment of severe acute and chronic graft-versus-host disease. Blood. 1998; 92(9): 3098–104.
13. Couriel D.R., Hosing C., Saliba R., et al. Extracorporeal photochemotherapy for the treatment of steroid-resistant chronic GVHD. Blood. 2006; 107(8): 3074–80. DOI: 10.1182/blood-2005-09-3907.
14. Flowers M.E.D., Apperley J.F., van Besien K., et al. A multicenter prospective phase 2 randomized study of extracorporeal photopheresis for treatment of chronic graft-versus-host disease. Blood. 2008; 112(7): 2667–74. DOI: 10.1182/blood-2008-03-141481.
15. Scarisbrick J.J., Taylor P., Holtick U., et al. U.K. consensus statement on the use of extracorporeal photopheresis for treatment of cutaneous T-cell lymphoma and chronic graft-versus-host disease. Br J Dermatol. 2008; 158(4): 659–78. DOI: 10.1111/j.1365-2133.2007.08415.x.
16. Schwartz J., Padmanabhan A., Aqui N., et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Seventh Special Issue. J Clin Apher. 2016; 31(3): 149–62. DOI: 10.1002/jca.21470.
17. Heshmati F., Andreu G. Extracorporeal photochemotherapy: A historical perspective. Transfus Apher Sci. 2003; 28(1): 25–34. DOI: 10.1016/S1473-0502(02)00097-6.
18. Fitzpatrick T.B., Pathak M.A. Part IV: Basic considerations of the psoralens: Historical aspects of methoxsalen and other furocoumarins. MSc (Tech). 1959; 32(2): 229–31. DOI: 10.1038/jid.1959.40.
19. Fahmy I.R., Abu-Shady H. Ammi majus Linn.; pharmacognostical study and isolation of a crystalline constituent, ammoidin. Q J Pharm Pharmacol. 1947; 20(3): 281–91.
20. Gilchrest B.A. Methoxsalen photochemotherapy for mycosis fungoides. Cancer Treat Rep. 1979; 63(4): 663–7.
21. Edelson R., Berger C., Gasparro F., et al. Treatment of cutaneous T-cell lymphoma by extracorporeal photochemotherapy. N Engl J Med. 1987; 316(6): 297–303. DOI: 10.1056/NEJM198702053160603.
22. Andreu G., Leon A., Heshmati F., et al. Extracorporeal photochemotherapy: Evaluation of two techniques and use in connective tissue disorders. Transfus Sci. 1994; 15(4): 443–54. DOI: 10.1016/0955-3886(94)90178-3.
23. Karolak L., Tod M., Leon A., et al. In vitro kinetics of 8-methoxypsoralen penetration into human lymphoid cells. Photodermatol Photoimmunol Photomed. 1992; 9(2): 58–60.
24. Rook A.H., Freundlich B., Jegasothy B.V., et al. Treatment of systemic sclerosis with extracorporeal photochemotherapy. Results of a multicenter trial. Arch Dermatol. 1992; 128(3): 337–46.
25. Andreu G., Achkar A., Couetil J.P., et al. Extracorporeal photochemotherapy treatment for acute lung rejection episode. J Hear Lung Transplant. 1995; 14(4): 793–6.
26. Heshmati F., Tavakoli R., Michel A., et al. Extracorporeal photochemotherapy: A treatment for organ graft rejection. Ther Apher. 1997; 1(2): 121–5. DOI: 10.1111/j.1744-9987.1997.tb00025.x.
27. Rossetti F., Dall’Amico R., Crovetti G., et al. Extracorporeal photochemotherapy for the treatment of graft-versus-host disease. Bone Marrow Transplant. 1996; 18(Suppl 2): 175–81.
28. Knobler R.M. Extracorporeal photochemotherapy for the treatment of lupus erythematosus: Preliminary observations. In: Systemic Lupus Erythematosus. Berlin, Heidelberg: Springer Berlin Heidelberg; 1995: 193–5. DOI: 10.1007/978-3-642-79622-7_13.
29. Rook A.H., Jegasothy B.V., Heald P., et al. Extracorporeal photochemotherapy for drug-resistant pemphigus vulgaris. Ann Intern Med. 1990; 112(4): 303–5. DOI: 10.7326/0003-4819-112-4-303.
30. de Misa R.F., Azaña J.M., Harto A., et al. Extracorporeal photochemotherapy in the treatment of severe psoriatic arthropathy. Br J Dermatol. 1992; 127(4): 448. DOI: 10.1111/j.1365-2133.1992.tb00473.x.
31. Prinz B., Nachbar F., Plewig G. Treatment of severe atopic dermatitis with extracorporeal photopheresis. Arch Dermatol Res. 1994; 287(1): 48–52. DOI: 10.1007/BF00370718.
32. Reinisch W., Nahavandi H., Santella R., et al. Extracorporeal photochemotherapy in patients with steroid-dependent Crohn’s disease: A prospective pilot study. Aliment Pharmacol Ther. 2001; 15(9): 1313–22. DOI: 10.1046/j.1365-2036.2001.01054.x.
33. Bécherel P.A., Bussel A., Chosidow O., et al. Extracorporeal photochemotherapy for chronic erosive lichen planus. Lancet (London, England). 1998; 351(9105): 805. DOI: 10.1016/s0140-6736(05)78932-7.
34. Costanzo-Nordin M.R., Hubbell E.A., O’Sullivan E.J., et al. Successful treatment of heart transplant rejection with photopheresis. Transplantation. 1992; 53(4): 808–15. DOI: 10.1097/00007890-199204000-00021.
35. Barr M.L., Meiser B.M., Eisen H.J., et al. Photopheresis for the prevention of rejection in cardiac transplantation. Photopheresis Transplantation Study Group. N Engl J Med. 1998; 339(24): 1744–51. DOI: 10.1056/NEJM199812103392404.
36. Owsianowski M., Gollnick H., Siegert W., et al. Successful treatment of chronic graft-versus-host disease with extracorporeal photopheresis. Bone Marrow Transplant. 1994; 14(5): 845–8.
37. Edelson R.L. Mechanistic insights into extracorporeal photochemotherapy: Efficient induction of monocyte-to-dendritic cell maturation. Transfus Apher Sci. 2014; 50(3): 322–9. DOI: 10.1016/j.transci.2013.07.031.
38. Berger M., Albiani R., Sini B., et al. Extracorporeal photopheresis for graftversus-host disease: The role of patient, transplant, and classification criteria and hematologic values on outcome-results from a large single-center study. Transfusion. 2015; 55(4): 736–47. DOI: 10.1111/trf.12900.
39. Knobler R., Berlin G., Calzavara-Pinton P., et al. Guidelines on the use of extracorporeal photopheresis. J Eur Acad Dermatol Venereol. 2014; 28(Suppl 1): 1–37. DOI: 10.1111/jdv.12311.
40. Hildegard T., Greinix R.K. (ed.). Extracorporeal photopheresis: cellular photoimmunotherapy. Walter de Gruyter GmbH&Co. KG, Berlin/Boston; 2012: 227.
41. Cancer Institute N. Common Terminology Criteria for Adverse Events (CTCAE) v5.0. 2017. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf
42. Савченко В.Г. Протоколы трансплантации аллогенных гемопоэтических стволовых клеток. М.: Практика; 2020: 320.
43. Rafei H., Kharfan-Dabaja M.A., Nishihori T. A critical appraisal of extracorporeal photopheresis as a treatment modality for acute and chronic graft-versus-host disease. Biomedicines. 2017; 5(4): 60. DOI: 10.3390/biomedicines5040060.
44. Apisarnthanarax N., Donato M., Körbling M., et al. Extracorporeal photopheresis therapy in the management of steroid-refractory or steroid-dependent cutaneous chronic graft-versus-host disease after allogeneic stem cell transplantation: Feasibility and results. Bone Marrow Transplant. 2003; 31(6): 459–65. DOI: 10.1038/sj.bmt.1703871.
45. Shulman H.M., Sullivan K.M., Weiden P.L., et al. Chronic graft-versus-host syndrome in man. A long-term clinicopathologic study of 20 Seattle patients. Am J Med. 1980; 69(2): 204–17. DOI: 10.1016/0002-9343(80)90380-0.
46. Greinix H.T., van Besien K., Elmaagacli A.H., et al. Progressive improvement in cutaneous and extracutaneous chronic graft-versus-host disease after a 24-week course of extracorporeal photopheresis — results of a crossover randomized study. Biol Blood Marrow Transplant. 2011; 17(12): 1775–82. DOI: 10.1016/j.bbmt.2011.05.004.
47. Foss F.M., DiVenuti G.M., Chin K., et al. Prospective study of extracorporeal photopheresis in steroid-refractory or steroid-resistant extensive chronic graftversus-host disease: Analysis of response and survival incorporating prognostic factors. Bone Marrow Transplant. 2005; 35(12): 1187–93. DOI: 10.1038/sj.bmt.1704984.
Об авторах
В. А. ВасильеваРоссия
Васильева Вера Алексеевна, кандидат медицинских наук, заведующая отделением иммунохимиотерапии с дневным стационаром для больных после ТКМ и группой поиска потенциальных доноров
125167, Москва
Л. А. Кузьмина
Россия
Кузьмина Лариса Анатольевна, кандидат медицинских наук, врач-гематолог, заведующая отделением интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром
125167, Москва
М. Ю. Дроков
Россия
Дроков Михаил Юрьевич, кандидат медицинских наук, руководитель сектора по изучению иммунных воздействий и осложнений после ТКМ
125167, Москва
М. В. Довыденко
Россия
Довыденко Мария Вячеславовна, кандидат медицинских наук, врач отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром
125167, Москва
О. М. Королева
Россия
Королева Ольга Михайловна, врач отделения иммунохимиотерапии с дневным стационаром для больных после ТКМ и группой поиска потенциальных доноров
125167, Москва
Д. С. Дубняк
Россия
Дубняк Дарья Станиславовна, врач отделения иммунохимиотерапии с дневным стационаром для больных после ТКМ и группой поиска потенциальных доноров
125167, Москва
А. А. Дмитрова
Россия
Дмитрова Анна Александровна, врач отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром
125167, Москва
Н. М. Никифорова
Россия
Никифорова Наталия Михайловна, врач-гематолог отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром
125167, Москва
О. С. Старикова
Россия
Старикова Ольга Станиславовна, врач-ординатор отделения интенсивной высокодозной химиотерапии и трансплантации костного мозга с круглосуточным стационаром
125167, Москва
Д. В. Камельских
Россия
Камельских Денис Владимирович, врач отделения забора гемопоэтических стволовых клеток, обработки и хранения костного мозга и (или) гемопоэтических стволовых клеток
125167, Москва
А. А. Щербакова
Россия
Щербакова Александра Александровна, врач отделения забора гемопоэтических стволовых клеток, обработки и хранения костного мозга и (или) гемопоэтических стволовых клеток
125167, Москва
Т. В. Гапонова
Россия
Гапонова Татьяна Владимировна, кандидат медицинских наук, первый заместитель генерального директора, заведующая отделом процессинга клеток крови и криоконсервирования
125167, Москва
Е. Н. Паровичникова
Россия
Паровичникова Елена Николаевна, доктор медицинских наук, генеральный директор
125167, Москва
В. Г. Савченко
Россия
Савченко Валерий Григорьевич , доктор медицинских наук, профессор, академик РАН, генеральный директор
125167, Москва
Рецензия
Для цитирования:
Васильева В.А., Кузьмина Л.А., Дроков М.Ю., Довыденко М.В., Королева О.М., Дубняк Д.С., Дмитрова А.А., Никифорова Н.М., Старикова О.С., Камельских Д.В., Щербакова А.А., Гапонова Т.В., Паровичникова Е.Н., Савченко В.Г. Применение экстракорпорального фотофереза в лечении хронической формы реакции «трансплантат против хозяина». Гематология и трансфузиология. 2022;67(2):202-215. https://doi.org/10.35754/0234-5730-2022-67-2-202-215
For citation:
Vasilyeva V.A., Kuzmina L.A., Drokov M.Yu., Dovydenko M.V., Koroleva O.M., Dubnyak D.S., Dmitrova A.A., Nikiforova N.M., Starikova O.S., Kamelskikh D.V., Sherbakova A.A., Gaponova T.V., Parovichnikova E.N., Savchenko V.G. Extracorporeal photopheresis in the treatment of chronic graft-versus-host-disease. Russian journal of hematology and transfusiology. 2022;67(2):202-215. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-2-202-215











































