Перейти к:
Промежуточные результаты терапии первичной медиастинальной В-крупноклеточной лимфомы по протоколам «ПМЛ-16» и «ПМЛ-19»
https://doi.org/10.35754/0234-5730-2022-67-3-328-350
Аннотация
Введение. Первичная медиастинальная лимфома (ПМЛ) — агрессивная В-крупноклеточная лимфоидная опухоль, успех лечения которой определяется индукционной терапией. Применение ни одной из существующих схем химиотерапии (ХТ) не показало преимуществ в эффективности. Интенсивные программы терапии сопряжены с высокой токсичностью.
Цель — оценить эффективность применения двух пилотных проспективных протоколов лечения ПМЛ («ПМЛ-16» и «ПМЛ-19»), а также возможность использования анализа свободно циркулирующей опухолевой ДНК (соДНК) для оценки минимально остаточной болезни у больных ПМЛ.
Материалы и методы. С января 2016 г. по январь 2022 г. в исследование были последовательно включены 34 больных ПМЛ, ранее не получавших лечение; средний возраст — 32 года; стадия > I — у 60 %; экстрамедиастинальные очаги поражения — у 14,7 %; массивное поражение лимфатических узлов средостения (bulky disease) — у 73,5 % больных. Для оценки полноты ремиссии выполняли позитронно-эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ-КТ), определяли соДНК.
Результаты. 18 больных получили лечение по протоколу «ПМЛ-16» (6 курсов ХТ; 2 блока «R-mNHL-BFM-90» + 4 курса «R-EPOCH»). После окончания терапии у всех 18 больных была достигнута ПЭТ-КТ-негативная ремиссия. Следующие 16 больных получили лечение по протоколу «ПМЛ-19» (4 курса ХТ; 2 блока «R-mNHL-BFM-90» + 2 курса «R-EPOCH») в комбинации с леналидомидом. После окончания терапии у 9 (56 %) больных была достигнута ПЭТ-негативная ремиссия; у 7 (44 %) сохранялась патологическая активность (D4–5 баллов). Через 3 и 6 мес. у 15 (94 %) больных достигнута нормализация метаболической активности. Учитывая высокую частоту ложнопозитивных результатов у больных ПМЛ, для определения глубины ремиссии у 15 больных было выполнено исследование соДНК. После окончания терапии у всех 15 больных произошла полная элиминация соДНК. Из них у 5 (33 %) после лечения сохранялась ПЭТ-КТ-позитивность. При дальнейшем наблюдении через 3–6 мес. у 4 больных метаболическая активность снизилась до физиологического уровня без применения консолидирующей терапии. Одна больная после окончания терапии перенесла новую коронавирусную инфекцию. Через месяц у нее в средостении сохранялось остаточное образование (стандартизированный уровень накопления — standardized uptake value, SUV) — SUVmax 14,2; больная находится под наблюдением. При медиане наблюдения 39 мес. (95%-ный доверительный интервал (95% ДИ): 26–47) для общей, беспрогрессивной и бессобытийной выживаемости и медиане наблюдения 36 мес. (95% ДИ: 22–43) для безрецидивной выживаемости все 34 больных живы, у них сохраняется ремиссия заболевания.
Заключение. Эффективность «ПМЛ-16» позволила отказаться от проведения консолидирующей терапии и опровергла представление о необходимости проведения 6 курсов ХТ. Сочетание программ, основанных на применении принципа высокодозной коротко-импульсной индукции ремиссии (R-mNHL-BFM-90) в сочетании с продленным введением средних доз (R-EPOCH), имело решающее значение для достижения успешного результата. Включение леналидомида в программу «ПМЛ-19» позволило достичь ремиссии в 100 % случаев после 4 курсов. Показана возможность использования анализа соДНК для оценки МОБ у больных ПМЛ.
Для цитирования:
Габеева Н.Г., Королева Д.А., Татарникова С.А., Смольянинова А.К., Бадмажапова Д.С., Смирнова С.Ю., Никулина Е.Е., Беляева А.В., Гемджян Э.Г., Лапин В.А., Москалец Э.Р., Костина И.Э., Мангасарова Я.К., Шутов С.А., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Ковригина А.М., Галстян Г.М., Звонков Е.Е. Промежуточные результаты терапии первичной медиастинальной В-крупноклеточной лимфомы по протоколам «ПМЛ-16» и «ПМЛ-19». Гематология и трансфузиология. 2022;67(3):328-350. https://doi.org/10.35754/0234-5730-2022-67-3-328-350
For citation:
Gabeeva N.G., Koroleva D.A., Tatarnikova S.A., Smolianinova A.K., Badmazhapova D.S., Smirnova S.Yu., Nikulina E.E., Belyaeva A.V., Gemdzhian E.G., Lapin V.A., Moskalets E.R., Kostina I.E., Mangasarova Y.K., Shutov S.A., Biderman B.V., Sudarikov A.B., Obukhova T.N., Kovrigina A.M., Galstyan G.M., Zvonkov E.E. Interim results of the PML-16, PML-19 protocols for primary mediastinal large B-cell lymphoma therapy. Russian journal of hematology and transfusiology. 2022;67(3):328-350. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-328-350
Введение
Первичная медиастинальная В-крупноклеточная лимфома (ПМЛ) является одной из наиболее частых лимфоидных опухолей средостения среди больных в возрасте от 20 до 40 лет. ПМЛ является химиочувствительной опухолью. Частота достижения полного ответа при применении современных программ химиотерапии (ХТ) достигает 85–90 % [1–6]. Однако в реальной клинической практике 15–20 % больных получают терапию второй линии в качестве консолидации или для лечения рецидива/прогрессии. Несмотря на высокую химиочувствительность, результаты лечения больных ПМЛ при развитии прогрессии/рецидива неудовлетворительны, а при сравнении с сопоставимой группой больных диффузной В-крупноклеточной лимфомой (ДВККЛ) — значимо хуже [7]. Даже при применении высокодозной ХТ с трансплантацией аутологичных/аллогенных гемопоэтических стволовых клеток (ауто/алло-ТГСК) менее чем у половины больных удалось достичь ремиссию [8][9]. Лечение ингибиторами иммунных контрольных точек, моноклональными антителами и Т-клетками с химерным антигенным рецептором (Chimeric Antigen Receptor T-cells, CAR-T) больных с рефрактерным/рецидивным течением ПМЛ показало низкую эффективность и требует дальнейшей оценки [10–13]. Рецидив с поражением центральной нервной системы (ЦНС) развивается редко, в 3–6 % случаев, но представляет наиболее сложную терапевтическую проблему, поскольку большинство больных умирает в течение года [14, 15]. Учитывая низкую эффективность противорецидивной терапии, достижение полной ремиссии (ПР) в первой линии лечения является принципиально важной задачей. Попытки улучшить результаты лечения с помощью интенсивных программ ХТ, лучевой терапии или высокодозной консолидации с ауто-ТГСК сопряжены с высокой токсичностью и повышением риска развития отдаленных кардиопульмональных осложнений и вторых опухолей [16–18].
Опыта применения таргетных препаратов в первой линии терапии ПМЛ в настоящее время нет [19]. Однако известно, что одним из ведущих механизмов в патогенезе ПМЛ является активация сигнального пути NF-kB. Высокая экспрессия транскрипционного фактора MUM1 при ПМЛ дает основание для включения в терапию леналидомида [20][21].
В связи с редкостью заболевания оценка эффективности различных программ терапии основывается на ретроспективных данных и исторической разнице в методах оценки ПР. Большинство факторов, традиционно используемых для определения прогноза, не применимы при ПМЛ в силу возрастных характеристик и локальности поражения [22]. Значительные успехи в исследовании биологических механизмов развития ПМЛ пока не привели к выделению значимых молекулярно-генетических факторов как основания для стратификации терапии. Аномалии генов TP53 и c-MYC, как и при других лимфомах, приводят к развитию химиорезистентности, однако являются редким событием при ПМЛ [23][24].
Редкая встречаемость и отсутствие надежных методов оценки полноты ремиссии затрудняют разработку риск-адаптированных программ лечения. Внедрение в клиническую практику позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ), позволило значительно улучшить визуализацию очагов опухолевого поражения. Показано, что негативное прогностическое значение ПЭТ-КТ при ПМЛ составляет 98 % [25]. Однако в группе больных с ПЭТ-КТ-позитивным остаточным образованием количество ложнопозитивных случаев составляет 80 % [26], что приводит к необоснованному проведению консолидирующей терапии. Результаты исследований, касающихся значений промежуточной ПЭТ-КТ для определения прогноза, противоречивы и требуют дополнительной оценки [27][28].
В последние годы показана возможность исследования свободно циркулирующей опухолевой ДНК (соДНК) плазмы крови для оценки минимальной остаточной болезни (МОБ) и прогнозирования резистентности/рецидива при лимфоидных опухолях [29–32]. Показано, что анализ соДНК при ДВККЛ позволяет идентифицировать больных с высоким риском развития рецидива задолго до клинических проявлений [33]. Данных о применении этого метода для оценки полноты ремиссии при лечении ПМЛ нет.
До настоящего времени проблемы выбора наиболее рациональной программы лечения ПМЛ, использования ПЭТ-КТ и соДНК в качестве инструментов для оценки результатов терапии остаются нерешенными. Представляется перспективным применение принципа максимальной интенсификации в начале терапии и подбор наиболее рационального таргетного препарата.
Целью настоящей работы было оценить эффективность применения двух пилотных проспективных протоколов лечения — «ПМЛ-16» и «ПМЛ-19», а также возможность использования анализа соДНК для оценки МОБ у больных ПМЛ.
Материалы и методы
В период с января 2016 г. по декабрь 2021 г. в ФГБУ «НМИЦ гематологии» Минздрава России в исследование были включены 18 больных, которые получали лечение по протоколу «ПМЛ-16», и 16 больных — по протоколу «ПМЛ-19» в возрасте старше 18 лет с впервые установленным диагнозом ПМЛ. Все больные подписали информированное согласие перед проведением ХТ. Протокол лечения «ПМЛ-16» включал 6 курсов ХТ: фазу индукции ремиссии, в ходе которой больные получали 2 блока А и В «R-mNHL-BFM-90», и фазу консолидации, состоящую из 4 курсов «R-EPOCH». С июня 2019 г. стали применять протокол «ПМЛ-19»: в программу лечения был включен леналидомид в дозе 25 мг ежедневно с 1-го по 10-й день каждого цикла, а количество консолидирующих курсов «R-EPOCH» сокращено до 2 (рис. 1).
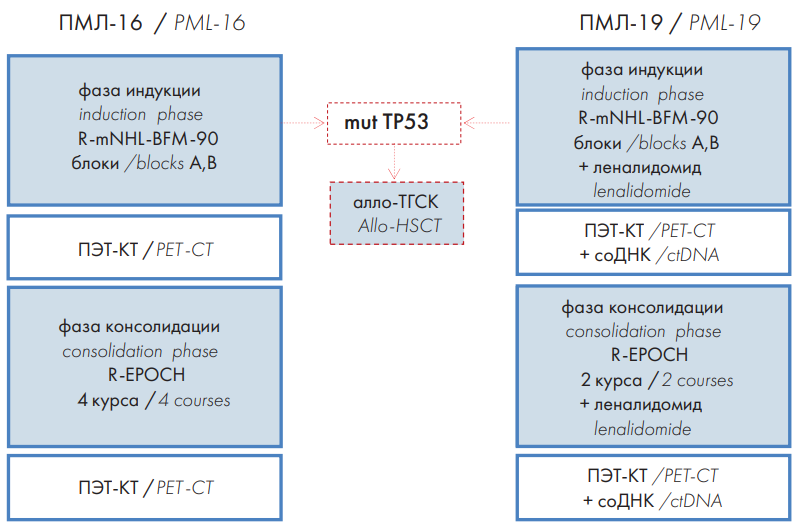
Рис. 1. Протоколы лечения ПМЛ-16, ПМЛ-19
Fig. 1. Treatment protocols: PML-16, PML-19
Перед первым курсом ХТ всем 34 больным проводили предфазу (дексаметазон, циклофосфамид). Программу химиотерапии и сопроводительную терапию проводили согласно протоколам, принятым в ФГБУ «НМИЦ гематологии» Минздрава России [34].
Большинство больных поступили с клиническими проявлениями синдрома сдавления верхней полой вены, тромбоза подключичных, яремных, брахиоцефальных вен. Тяжесть состояния больных требовала срочного начала ХТ, массивной инфузионной нагрузки. Из-за невозможности катетеризировать верхнюю полую вену у 12 больных использовали бедренный сосудистый доступ.
Диагноз ПМЛ устанавливали на основании результатов гистологического и иммуногистохимического (ИГХ) исследований в соответствии с критериями ВОЗ 2017 г. [35]. Проводили дифференциальную диагностику с ДВККЛ, В-клеточной лимфомой, неклассифицируемой (медиастинальной лимфомой «серой зоны»). ИГХ-исследование проводили с использованием в различном сочетании антител к CD20, CD23, CD10, CD30, CD15, BCL2, BCL6, MUM1, PAX5, OCT2, IgM, Ki-67. У 94 % больных диагностическая биопсия опухоли и ИГХ-исследования были выполнены в других стационарах. Все гистологические и иммуногистохимические препараты были пересмотрены в патологоанатомическом отделении ФГБУ «НМИЦ гематологии» Минздрава России; у 5 больных потребовалось проведение повторной биопсии в связи с недостаточным объемом и/или плохим качеством биопсийного материала.
Перед началом ХТ больным проводили обследование в соответствии с принятым в ФГБУ «НМИЦ гематологии» Минздрава России протоколом [34]. Обязательными перед началом терапии являлись: проведение магнитно-резонансной томографии головного мозга; ПЭТ-КТ; определение В-клеточной клональности в опухолевом образце, периферической крови и костном мозге; при наличии материала — проведение флуоресцентной гибридизации in situ (fluorescence in situ hybridization, FISH) на срезах парафиновых блоков или клеточной суспензии опухолевых биоптатов для детекции транслокаций с вовлечением локусов генов с-Myc/8q24, BCL2/18q21, BCL6/3q27 и делеции локуса гена TP53/17 р13. При наличии клеточной суспензии опухоли проводили стандартное цитогенетическое исследование (СЦИ).
17 больным было выполнено молекулярно-генетическое исследование мутаций в гене ТР53 методом секвенирования нового поколения (Next-Generation Sequencing, NGS) согласно протоколу S. Pavlova и соавт. [36]. Вероятную патогенность полученных вариантов анализировали с помощью онлайн-баз данных IARC [37] и SESHAT [38].
Оценку токсичности проводили по шкале токсичности NCIC — CTC (National Cancer Institute — Common Toxicity Criteria) [39].
Для оценки эффективности терапии всем больным планировали проводить ПЭТ-КТ-исследование исходно (ПЭТ-КТ-1), после окончания фазы индукции (ПЭТ-КТ-2) и через 1 месяц от окончания ХТ (ПЭТ-КТ-3). Полностью оценка метаболической активности опухоли на этапах диагностики и лечения была проведена у 25 (73,5 %) из 34 больных. У остальных больных исследование не выполнили в связи с тяжестью состояния или высоким риском развития новой коронавирусной инфекции COVID-19. Больным, у которых результат ПЭТ-КТ-3 составлял D4–5, выполняли контрольное исследование через месяц (ПЭТ-КТ-4). Остальным больным после окончания лечения контроль ПЭТ-КТ проводили через 3, 6 и 12 мес. Оценка результатов терапии по данным ПЭТ-КТ проводилась в соответствии с рекомендациями Международной рабочей группы по критериям ответа 2014 г. [40].
Для оценки МОБ использовали В-клеточную клональность, которую определяли по наличию клональных перестроек генов тяжелой и легких каппа/лямбда цепей иммуноглобулинов согласно протоколу BIOMED-2. В-клеточную клональность оценивали в опухолевом материале (биоптат или срезы с парафинового блока), периферической крови, костном мозге, свободно циркулирующей ДНК плазмы крови (сцДНК) до начала терапии и на этапах терапии. Плазму получали из цельной крови, набранной в пробирки с ЭДТА, методом центрифугирования. Выделение сцДНК проводили коммерческим набором (Quagen, Германия) из плазмы крови. Концентрацию сцДНК определяли на флуориметре «Qubit» и амплификацией с контрольным геном бета-глобина. Наличие в плазме клонального продукта, совпадающего с выявленным в опухолевом образце, расценивалось как наличие соДНК.
Статистический анализ. Статистический анализ проведен с использованием методов описательной статистики и анализа выживаемости по методу Каплана — Мейера. Для бессобытийной выживаемости (БСВ) событием являлось развитие рецидива, прогрессии или смерти от любой причины, время отсчитывали от начала ХТ; для безрецидивной выживаемости время отсчитывали от достижения ремиссии. Для расчетов использовали статистическую программу StatView 4.1.
Результаты
Характеристика больных ПМЛ. В исследование включены 34 больных (10 мужчин, 24 женщины). Клинико-лабораторные характеристики больных, получавших терапию по протоколам «ПМЛ-16» и «ПМЛ-19», представлены в таблице 1. Медиана возраста составила 33 года (от 19 до 55 лет) в группе «ПМЛ-16» и 32 года (от 18 до 50 лет) — в группе «ПМЛ-19». У большинства больных были клинико-лабораторные признаки опухолевой интоксикации: В-симптомы, повышение активности сывороточной лактатдегидрогеназы (ЛДГ), концентрации ß2-микроглобулина. Стадию IV по шкале Ann Arbor [41] определили у 9 (26 %) больных. В соответствии с международным прогностическим индексом (МПИ) [42], к группе низкого и промежуточно низкого риска был отнесен 21 (62 %) больной, к группе промежуточно высокого и высокого — 13 (38 %) больных. У 16 (47 %) больных соматический статус по шкале ECOG [43] соответствовал > 2 баллам. По результатам инструментального обследования (ПЭТ-КТ, КТ), максимальный диаметр опухолевого образования > 10 см (bulky disease) выявили у 73,5 % больных; у большинства определялось вовлечение экстранодальных органов по протяжению (легкие, перикард, плевра, мягкие ткани); у 5 (15 %) больных выявлены отдаленные очаги опухолевого поражения — почки, кишечник, желудок. Ни у одного больного по результатам исследования до начала лечения не было получено данных за поражение костного мозга и ЦНС.
При ИГХ-исследовании экспрессия CD30 и СD23 определялась в 93 и 86 % случаев соответственно; в 100 % опухолевые клетки были негативны к CD15, CD10 и sIg; экспрессия MUM1 выявлялась в 89 %; в 3 из 7 случаев отмечалась гиперэкспрессия MYC; в 84 % случаев индекс пролиферативной активности Ki67 превышал 80 % (табл. 1).
СЦИ было выполнено 4 больным: в 1 случае был выявлен комплексный кариотип с аномалиями 6, 8, 9, 14 и Х хромосом. FISH-исследование было проведено 15 больным: у 1 (6,6 %) больной была выявлена транслокация с вовлечением локуса гена MYC/8q24; у 11 (73 %) — множественные несбалансированные хромосомные аномалии (трисомия, дупликация, амплификация) в локусах генов MYC/8q24, BCL2/18q21, BCL6/3q27. Структурные аномалии 17-й хромосомы в локусе гена ТР53 не были выявлены ни в одном случае.
У 1 (5,9 %) из 17 больных обнаружены две мутации в 8-м экзоне гена TP53. Первая мутация c.G856A, p.E286K, аллельная нагрузка — 36 %. Согласно актуальным базам данных [37][38], существуют доказательства для классификации этого варианта как патогенного. Вторая — с.G915A, p.K305K, аллельная нагрузка составила 32 %. Данная мутация является синонимной, т. е. не приводит к замене аминокислоты. Согласно имеющимся данным [37, 38], нет доказательств для классификации этого варианта как патогенного или безвредного. При ПМЛ оценить клиническое значение мутаций в гене ТР53 особенно сложно, учитывая редкость выявления данного события и сложность трактовки результатов исследования на материале ДНК, полученной в большинстве случаев из парафиновых блоков. В данном случае были выявлены сразу 2 мутации, определить принадлежность которых к одному или к различным клонам с помощью NGS не представлялось возможным. Поэтому для больных с мутацией в гене ТР53 в протоколе лечения было предусмотрено выполнение алло-ТГСК только в случае рецидива/прогрессии.
Результаты лечения. Лечение закончено у всех 34 больных, включенных в протоколы «ПМЛ-16» и «ПМЛ-19». В настоящее время при среднем сроке наблюдения 36 мес. (от 10 до 77 мес.) все 34 (100 %) больных живы, у них сохраняется ремиссия ПМЛ (рис. 2).
В протокол «ПМЛ-16» было включено 18 больных. У всех больных закончили терапию; из них полностью программа (6 курсов) выполнена у 13 (72 %) больных. Еще 5 (27,7 %) больных получили от 2 до 5 курсов ХТ в связи с развитием инфекционных осложнений на фоне длительной цитопении после курсов «R-EPOCH». Из них до начала лечения 1 больной по месту жительства была выполнена резекция опухоли с тимомэктомией, 1 — пульмолобэктомия, 1 больная в течение месяца получала глюкокортикостероиды. Решение о прекращении лечения принимали на основании результатов ПЭТ-КТ. По окончании терапии у всех 18 больных была достигнута ПЭТ-КТ-негативная ремиссия независимо от количества курсов. При медиане наблюдения 48 мес. (от 20 до 77 мес.) все 18 больных живы, у них сохраняется ремиссия заболевания.
В протокол «ПМЛ-19» были включены 16 больных. Все больные получали леналидомид в дозе 25 мг/сут. с 1-го по 10-й день каждого курса. У 15 (94 %) больных программа выполнена полностью; 1 больному было проведено только 3 курса в связи с развитием длительной тромбоцитопении после курса «R-EPOCH». После окончания терапии у 9 (56 %) больных была достигнута ПЭТ-КТ-негативная ремиссия. У 7 (44 %) больных сохранялась высокая метаболическая активность (D4–5 баллов); у 6 из них в течение последующих 3–6 мес. отмечалось снижение до D3 без проведения консолидирующей терапии. При медиане наблюдения 19 мес. (от 10 до 31 мес.) 16 больных находятся в ремиссии заболевания. У 1 больной через 3 мес. от окончания лечения сохранялась D5. Предполагается, что высокая метаболическая активность остаточного образования может быть связана с перенесенной COVID-19 инфекцией через месяц после окончания лечения. В настоящее время больная находится под наблюдением.
В общей группе больных 3- и 5-летняя общая выживаемость, выживаемость без прогрессии и БСВ составили 100 % при медиане наблюдения 39 мес. (95% ДИ: 26–47) и диапазоне наблюдений от 10 до 77 мес.; безрецидивная выживаемость составила 100 % при медиане наблюдения 36 мес. (95% ДИ: 22–43) и диапазоне наблюдений от 8 до 73 мес.
Результаты лечения по данным ПЭТ-КТ. Полный анализ динамики метаболической активности опухоли на этапах диагностики и лечения был проведен у 25 из 34 больных: 14 (ПМЛ-16) и 11 (ПМЛ-19) (табл. 2). ПЭТ-КТ-1-исследование не было выполнено у 7 больных в связи с тяжестью состояния и необходимостью начать ХТ по жизненным показаниям; ПЭТ-КТ-2 — у 4 больных в связи с высоким риском инфицирования в период пандемии COVID-19. ПЭТ-КТ-3 и последующие контрольные исследования выполнены всем 34 больным, у которых закончили терапию.
В общей группе больных средний максимум стандартизированного уровня накопления (standardized uptake value, SUVmax) до начала терапии (ПЭТ-КТ-1) составил 23,2 (от 7,8 до 47,1); после фазы индукции (ПЭТ-КТ-2) — 3,8 (от 1,14 до 8,18); по окончании лечения (ПЭТ-КТ-3) — 2,3 (от 0,5 до 8,3). Снижение метаболической активности опухоли (ΔSUVmax) происходило в среднем на 81 % (от 65 до 97 %) после 2 индукционных курсов, и только на 31 % (от 3 до 75 %) — после окончания консолидации.
При сравнении результатов ПЭТ-КТ в зависимости от протокола лечения обращало внимание, что средние показатели SUVmax при лечении по программе «ПМЛ-19» оказались выше по сравнению с «ПМЛ-16» как после индукции ремиссии (4,3 против 3,4), так и после окончания лечения (3,0 против 1,7). Среди 14 больных, получивших терапию по протоколу «ПМЛ-16», по окончанию индукции ремиссии полный метаболический ответ (D1–3) был получен у 6 (42,8 %), частичный (D4) — у 8 (57,2 %); после окончания лечения у всех больных 14 (100 %) достигнута ПЭТ-КТ-негативная ремиссия. Из 11 больных, получивших лечение по протоколу «ПМЛ-19», после индукции ремиссии полный метаболический ответ (D1–3) получен у 2 (18,2 %); частичный (D4) — у 8 (72,8 %); у 1 (9 %) больной результат ПЭТ-КТ-2 соответствовал D5. После окончания лечения полный ответ (D1–3) получен у 7 (63,6 %), частичный (D4) — у 3 (27,4 %); у 1 (9 %) больной наблюдалась отрицательная динамика в виде увеличения SUVmax до 8,3 (D5) (табл. 3).
Итоговая оценка ПЭТ-КТ результатов лечения была проведена у всех 34 больных. У всех 18 (100 %) больных, получивших лечение по протоколу «ПМЛ-16», была достигнута ПЭТ-КТ-негативная ремиссия независимо от промежуточных результатов ПЭТ-КТ-2 и количества курсов ХТ. В группе больных, у которых была окончена терапия по протоколу «ПМЛ-19», у 9 (56 %) была достигнута ПЭТ-КТ-негативная ремиссия. У 7 (44 %) больных регистрировался позитивный (D4–5) результат ПЭТ-КТ; из них у 6 — через 3–6 мес. наблюдения метаболическая активность снизилась до физиологического уровня. Таким образом, ПЭТ-КТ-негативная ремиссия была достигнута у 15 (94 %). Одна больная находится под наблюдением, планируется контрольное ПЭТ-КТ-исследование.
Результаты лечения по данным исследования соДНК. Для оценки ремиссии исходно и на этапах терапии у части больных определяли соДНК. В соответствии с протоколом, исходно, на этапе диагностики, всем больным проводили исследование клональной реаранжировки генов Ig опухолевых биоптатов, периферической крови и костного мозга. Из 34 больных, включенных в протокол, доступные для анализа опухолевые образцы имелись у 26 больных; из них у 22 (85 %) больных выявлена клональная перестройка генов Ig. Ни у одного больного клональный продукт не определялся ни в крови, ни в костном мозге.
Исследование клональных реаранжировок генов тяжелых и легких цепей Ig соДНК плазмы крови на всех этапах терапии выполнено у 15 больных. У всех 15 (100 %) больных клональные продукты полностью совпадали с выявленными в образцах опухоли. У 10 больных в опухолевом материале и в соДНК до лечения выявлены клональные перестройки генов IgH, у 5 — реаранжировки генов IgK. После индукции ремиссии соДНК не определялась у 13 (87 %) больных, в том числе у больного с мутациями в гене TP53. После окончания терапии у всех 15 (100 %) больных соДНК плазмы полностью элиминировалась (табл. 4).
Таблица 1. Характеристика больных
Table 1. Characteristics of patients
|
Характеристики/Characteristics |
ПМЛ-16/PML-16, n (%) |
ПМЛ-19/PML-19, n (%) |
|
Возраст, медиана (диапазон), годы Age, Median (range), years |
33 (19–55) |
32 (18–50) |
|
Мужчины/женщины / Males/females |
5/13 |
5/11 |
|
Стадия (Ann Arbor) / Stage (Ann Arbor) n (%) I–II IV |
13 (72) 5 (28) |
12 (75) 4 (25) |
|
Баллы по шкале ECOG > 2 / ECOG score >2, n (%) |
8 (44) |
8 (50) |
|
МПИ >2 / IPI >2, n (%) |
7 (38) |
6 (37) |
|
Диаметр >10 см / Bulky disease, n (%) |
13 (72) |
12 (75) |
|
Экстранодальные поражения по протяжению, n (%) Extranodal invasion of adjacent tissue, n (%) |
13 (72) |
12 (75) |
|
Внемедиастинальные поражения, n (%) Extramediastinal lesion, n (%) |
2* (11) |
3 (19) |
|
Селезенка / Spleen |
1 |
1 |
|
Почки / Kidney |
1 |
1 |
|
Желудок / Stomach |
1 |
0 |
|
Поджелудочная железа / Pancreas |
1 |
0 |
|
Кишечник / Gut |
1 |
1 |
|
В симптомы / B-symptoms, n (%) |
14 (77) |
13 (81) |
|
Поражение костного мозга, n (%) Bone marrow involvement, n (%) |
0 |
0 |
|
ЛДГ > нормы / LDH > normal range, n (%) |
17 (89) |
16 (100) |
|
ß2-микроглобулин > нормы, n (%) ß2-microglobulin > normal range, n (%) |
14 (45 %) |
|
|
CD15 |
0 |
0 |
|
CD30 |
13/16 (87 %) |
10/12 (83 %) |
|
CD23 |
14/16 (87 %) |
11/13 (84 %) |
|
sIgM neg |
17/17 (100 %) |
14/14 (100 %) |
|
MUM1 >30 % |
11/12 (92 %) |
16/16 (100 %) |
|
MYC >40 % |
2/4 (50 %) |
1/3 (33 %) |
|
Ki67 ≥80 % |
13/16 (81 %) |
13/15 (87 %) |
|
FISH перестройка / rearrangement MYC BCL6 BCL2 |
|
|
|
0 |
1/10 (10 %) |
|
|
1/5 (20 %) |
0 |
|
|
0 |
0 |
|
|
Трисомия/дупликация/амплификация Trisomy/duplication/amplification MYC/BCL6/BCL2 |
3/5 (60 %) |
7/10 (70 %) |
|
Комплексный кариотип / Complex karyotype |
1/4 (25 %) |
0 |
|
mutTP53 |
0/6 (0 %) |
1/11 (9 %) |
Notes. ECOG — Eastern Cooperative Oncology Group, LDH — lactated-hydrogenase; FISH — fluorescence in situ hybridization, IPI — International prognostic index, 2* — extramediastinal lesion in 2 patients (1 — spleen and kidney, 2 — stomach, pancreas and intestines).
Таблица 2. Динамика показателей ПЭТ-КТ 25 больных при проведении терапии по протоколам «ПМЛ-16» и «ПМЛ-19»
Table 2. Dynamics of PET-CT parameters in 25 patients during therapy according to the PML-16 and PML-19 protocols
|
№ |
ПЭТ-КТ-1 PET-СТ-1 SUVmax |
ПЭТ-КТ-2 PET-СТ-2 SUVmax |
ΔSUVmax % |
D |
ПЭТ-КТ-3 PET-СТ-3 SUVmax |
ΔSUVmax % |
D |
|
ПМЛ-16 |
|||||||
|
1 |
43,0 |
1,14 |
41,86 (97 %) |
1 |
0,5 |
0,64 (56 %) |
1 |
|
2 |
47,1 |
1,2 |
45,9 (97 %) |
1 |
1,1 |
0,1 (8 %) |
1 |
|
3 |
12,4 |
2,57 |
09,83 (79 %) |
3 |
2,26 |
0,31 (12 %) |
3 |
|
4 |
28,3 |
4,1 |
24,2 (86 %) |
4 |
2,4 |
1,7 (41 %) |
2 |
|
5 |
27,2 |
2,94 |
24,26 (89 %) |
4 |
2,34 |
0,6 (20 %) |
3 |
|
6 |
28,5 |
2,8 |
25,7 (90 %) |
3 |
1,5 |
1,3 (46 %) |
2 |
|
7 |
29,8 |
3,5 |
26,3 (88 %) |
4 |
2,8 |
0,7 (20 %) |
3 |
|
8 |
16,9 |
4,6 |
12,3 (73 %) |
4 |
1,6 |
3,0 (65 %) |
3 |
|
9 |
15,7 |
4,0 |
11,7 (75 %) |
4 |
1,0 |
3,0 (75 %) |
3 |
|
10 |
16,7 |
6,2 |
10,5 (69 %) |
3 |
2,0 |
4,2 (80 %) |
1 |
|
11 |
20,23 |
4,56 |
15,6 (78 %) |
4 |
1,96 |
2,6 (56 %) |
3 |
|
12 |
7,8 |
1,86 |
05,9 (76 %) |
3 |
1,5 |
0,36 (19 %) |
2 |
|
13 |
25,0 |
3,37 |
21,63 (86 %) |
4 |
1,4 |
1,97 (58 %) |
3 |
|
14 |
28,5 |
4,74 |
23,76 (83 %) |
4 |
3,63 |
1,11 (23 %) |
3 |
|
средняя |
24,8 |
3,4 |
83 % |
|
1,7 |
41 % |
|
|
ПМЛ-19 |
|||||||
|
1 |
21,3 |
2,3 |
19,0 (89 %) |
3 |
2,2 |
0,1 (4 %) |
2 |
|
2 |
37,7 |
3,35 |
34,3 (91 %) |
4 |
2,47 |
0,88 (26 %) |
3 |
|
3 |
12,84 |
3,87 |
8,97 (70 %) |
4 |
2,99 |
0,25 (14 %) |
3 |
|
4 |
26,65 |
3,94 |
22,71 (85 %) |
4 |
3,81 |
0,13 (3 %) |
3 |
|
5 |
28,81 |
8,18 |
20,63 (72 %) |
5 |
4,66 |
3,52 (43 %) |
4 |
|
6 |
15,76 |
5,5 |
10,26 (65 %) |
4 |
5,26 |
0,24 (4 %) |
4 |
|
7 |
21,72 |
3,71 |
18,01 (83 %) |
4 |
2,4 |
1,31 (35 %) |
3 |
|
8 |
22.0 |
4,32 |
17,68 (80 %) |
4 |
3,0 |
1,32 (30 %) |
4 |
|
9 |
20,7 |
6,75 |
13,95 (67 %) |
4 |
1,75 (средостение) 8,3 (легкое) |
+1,5 |
5 |
|
10 |
18,0 |
2,8 |
16,8 (93 %) |
3 |
2,7 |
0,1 (3,6 %) |
3 |
|
11 |
9,2 |
3,1 |
6,1 (66 %) |
4 |
2,2 |
0,9 (17 %) |
3 |
|
средняя |
21,3 |
4,3 |
78 % |
|
3,0 |
18 % |
|
Notes. SUV — standardized uptake value; D — Deauville.
Таблица 3. Динамика результатов ПЭТ-КТ исследований 25 больных при проведении терапии по протоколам «ПМЛ-16» и «ПМЛ-19»
Table 3. Comparative dynamics of the results of PET-CT studies of 25 patients during therapy according to the PML-16 and PML-19 protocols
|
Протокол Protocol |
ПЭТ-КТ-2 / PET-СТ-2 |
ПЭТ-КТ-3 / PET-СТ-3 |
ПЭТ-КТ-4 / PET-СТ-4 |
|
D1–3 |
D1–3 |
D1–3 |
|
|
ПМЛ-16 (n = 14) |
42,8 % |
100 % |
100 % |
|
ПМЛ-19 (n = 11) |
18,2 % |
63,6 % |
91 % |
Таблица 4. Динамика показателей ПЭТ-КТ и соДНК плазмы на этапах терапии и при наблюдении
Table 4. Dynamics of PET-CT and plasma ctDNA parameters at the stages of therapy and during follow-up
|
Больные Patients |
ПЭТ-КТ-2 PET-СТ-2 (D) |
соДНК после 2 курсов ctDNA after 2 courses (n) |
ПЭТ-КТ –3 PET-СТ-3 (D) |
соДНК после лечения ctDNA after treatment (n) |
ПЭТ-KT-4 PET-CT-4 (D) |
|
1 |
4 |
+ |
3 |
– |
2 |
|
2 |
4 |
– |
3 |
– |
3 |
|
3 |
4 |
– |
3 |
– |
2 |
|
4 |
4 |
– |
3 |
– |
2 |
|
5 |
3 |
– |
2 |
– |
2 |
|
6 |
4 |
– |
3 |
– |
1 |
|
7 |
4 |
– |
3 |
– |
2 |
|
8 |
4 |
– |
3 |
– |
2 |
|
9 |
5 |
– |
4 |
– |
2 |
|
10 |
4 |
+ |
5 |
– |
3 |
|
11 |
3 |
– |
3 |
– |
2 |
|
12 |
4 |
– |
3 |
– |
3 |
|
13 |
н/д |
– |
4 |
– |
3 |
|
14 |
н/д |
– |
4 |
– |
3 |
|
15 |
н/д |
– |
5 |
– |
5 |
Сравнение результатов ПЭТ-КТ и соДНК. При сопоставлении результатов ПЭТ-КТ и соДНК оказалось, что после завершения лечения у 5 из 15 больных сохранялась ПЭТ-КТ-позитивность. У 4 из 5 больных при дальнейшем наблюдении результат ПЭТ-КТ стал негативным; 1 больная остается под наблюдением (рис. 2). Был проведен ретроспективный анализ клинико-лабораторных данных этих больных. У всех больных было массивное поражение лимфатических узлов средостения (bulky disease), все больные получали лечение по протоколу «ПМЛ-19». Ни по одному из других факторов не было разницы по сравнению с больными, у которых была достигнута ПЭТ-КТ-негативность.
В качестве примера приводим описание 2 клинических наблюдений, в которых отсутствие выявления соДНК в плазме, несмотря на позитивный результат ПЭТ-КТ, позволило прекратить ХТ и сделать выбор в пользу динамического наблюдения.
Первая больная поступила в клинику в тяжелом состоянии. У нее было массивное образование средостения размерами 247 × 160 × 214 мм, сдавливавшее верхнюю полую вену, что привело к обструкции верхнедолевого бронха и формированию ателектаза верхней доли правого легкого. Образование прорастало в паренхиму обоих легких, сдавливало пищевод; SUVmax — 28,81; MTV (метаболический объем опухоли) — 949 мм 3 (рис. 3) После завершения фазы индукции по протоколу «ПМЛ-19»было выполнено промежуточное ПЭТ-КТ-2 исследование. Несмотря на уменьшение размеров образования более чем на 50 %, метаболическая активность опухоли сохранялась высокой, составляя D5. Однако, учитывая, что соДНК перестала определяться, изменения расценены как положительная динамика, и лечение было продолжено. Результат ПЭТ-КТ после окончания терапии соответствовал D4; еще через 3 месяца — D2.
У второй больной исходно определялся опухолевый конгломерат размерами 155 × 84 × 149 мм с вовлечением верхней доли левого легкого, мягких тканей передней грудной стенки, перикарда, SUVmax — 20,7; выявлялись очаги гиперметаболизма в селезенке, стенках слепой кишки (рис. 4). После 2 курсов ХТ отмечено уменьшение размеров образования и SUVmax до 6,75 (D4) и полное исчезновение очагов гиперметаболизма в органах ниже диафрагмы. На этом этапе у больной сохранялась соДНК плазмы. Через месяц после окончания лечения (ПЭТ-КТ-3) при наличии полного метаболического ответа в образовании средостения (SUV — 1,75) была обнаружена отрицательная динамика в виде зоны патологической метаболической активности в ателектазе верхней доли левого легкого SUV — 8,3 (D5). Однако клональный продукт соДНК плазмы уже не определялся. Через 6 мес. наблюдения уровень SUVmax уменьшился до 4,1 (D3).
По результатам контрольной ПЭТ-КТ у обеих больных достигнут полный метаболический ответ, который сохраняется 23 и 15 мес.
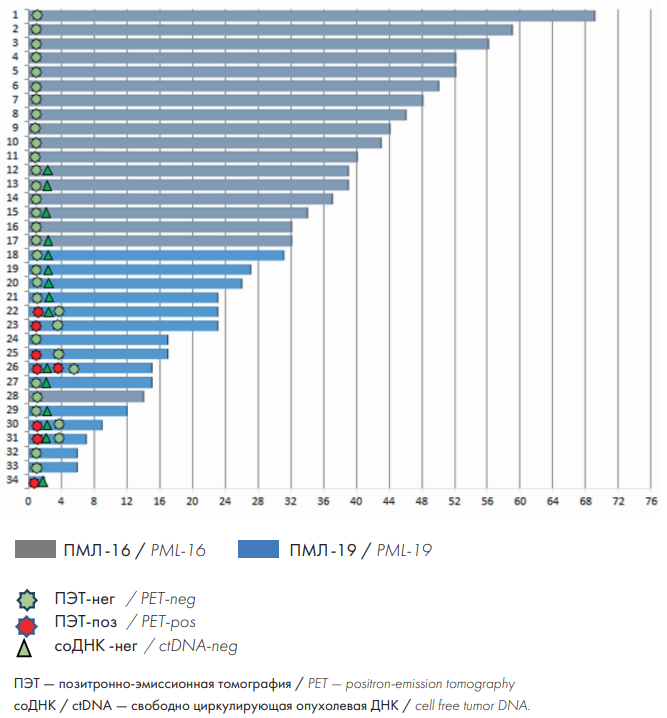
Рисунок 2. Результаты лечения больных по протоколам ПМЛ-16 и ПМЛ-19
Figure 2. Results of treatment of patients according to the PML-16 and PML-19 protocols
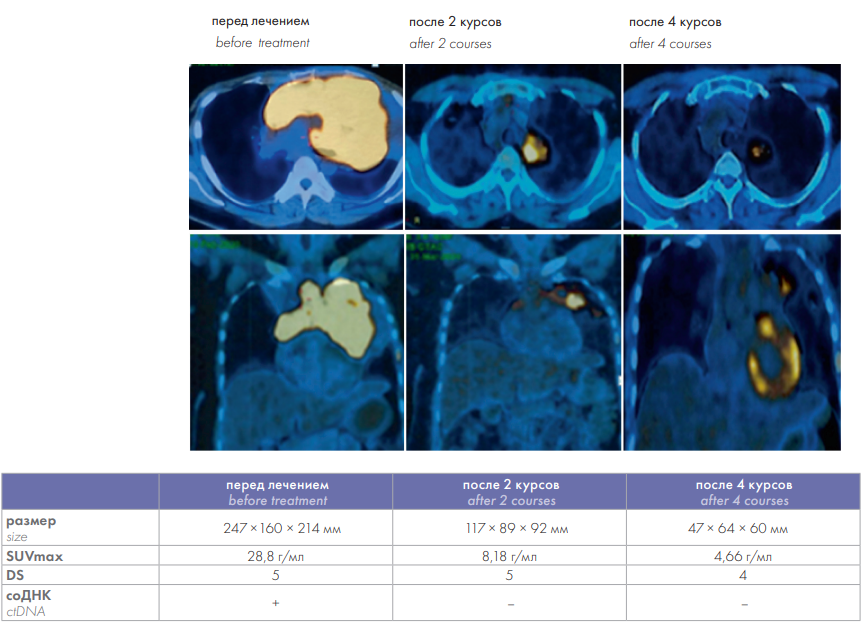
Рисунок 3. Эффекты лечения у больной в первом клиническом наблюдении.
Figure 3. Treatment effects in the patient in the first clinical case
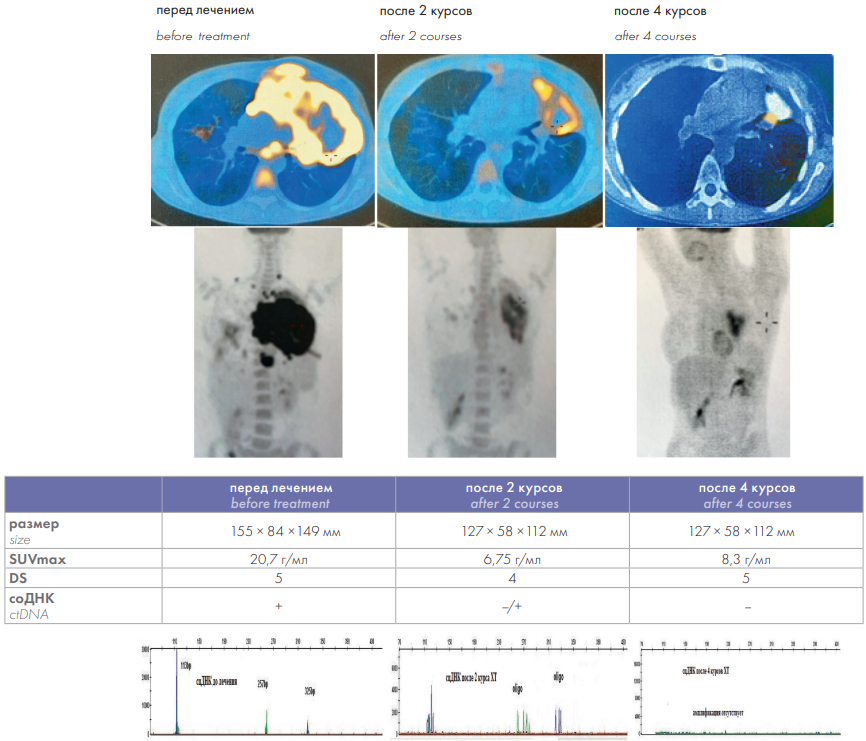
Рисунок 4. Эффекты лечения у больной во втором клиническом наблюдении
Figure 4. Treatment effects in the patient in the second clinical case
Сравнительная оценка токсичности протоколов «ПМЛ-16» и «ПМЛ-19». Степень гематологической токсичности при проведении обоих протоколов оценивали в соответствии с критериями NCIC — CTC [39]. При лечении по протоколу «ПМЛ-16» гематологическая токсичность III–IV степени после блока А развилась у 18 (100 %) больных, средняя продолжительность — 9 дней (от 5 до 13 дней); после блока В — у 6 (33 %) больных, средняя продолжительность — 2 дня (от 0 до 5 дней); после курса «EPOCH» — у 8 (44 %) больных, средняя продолжительность — 12 дней (от 4 до 35 дней).
При лечении по протоколу «ПМЛ-19» гематологическая токсичность III–IV степени отмечена у 13 (87 %) больных после блока А, средняя продолжительность — 4 дня (от 1 до 6 дней); после блока В — у 3 (19 %) больных, средняя продолжительность — 2 дня (от 0 до 5 дней); после курса «EPOCH» — у 7 (46 %) больных, средняя продолжительность — 8 дней (от 4 до 25 дней).
При проведении индукции ремиссии по протоколу «ПМЛ-19» частота развития и средняя продолжительность лейкопении 4-й степени была меньше по сравнению с программой «ПМЛ-16» (после блока А — 87 % и 4 дня, против 100 % и 7 дней; после блока В — 19 % и 2 дня против 33 % и 2 дней, соответственно). Частота развития тромбоцитопении 3–4-й степени после индукционных курсов была одинаковой при применении обоих протоколов и составила 87 %, продолжительность — 6 дней. После курсов «R-EPOCH» частота глубокой тромбоцитопении была меньше, однако была больше продолжительность по сравнению с индукционными курсами (15 дней и 13 дней против 6 соответственно). Анемия 3–4-й степени чаще (33 %) развивалась после курсов «R-EPOCH» (табл. 5).
Инфекционные и токсические осложнения (мукозит — 50 %, энтеропатия — 30 %, пневмония — 26 %, эзофагит — 3 %, повышение сывороточной концентрации аминотрансфераз — 36 %) наблюдались преимущественно после блока А. Частота развития и тяжесть негематологических осложнений после блока В и «R-EPOCH» не различалась (табл. 6).
В целом, частота и спектр негематологических осложнений, развившихся при проведении терапии по протоколу «ПМЛ-19», не отличались от таковых при лечении по протоколу «ПМЛ-16». При проведении индукции ремиссии у 2 больных отмечалась кожная сыпь, обусловленная токсическим действием леналидомида, которая не потребовала медикаментозной коррекции и регрессировала самостоятельно после окончания приема препарата. Прием леналидомида при дальнейшем лечением не вызвал повторных кожных реакций.
Таблица 5. Гематологическая токсичность при лечении по протоколам «ПМЛ-16» и «ПМЛ-19»
Table 5. Hematological toxicity on PML-16 and PML-19 protocols
|
% больных, средняя продолжительность % of patients, average duration |
ПМЛ-16 / PML-16 (n = 18) |
ПМЛ-19 / PML-19 (n = 16) |
|||||
|
блок А block A |
блок В block B |
ЕРОСН |
блок А block A |
блок В block B |
ЕРОСН |
||
|
Лейкопения 4-й степени Leukopenia grade 4 |
% |
100 % |
33 % |
44 % |
87 % |
19 % |
46 % |
|
дней days |
7 |
2 |
6 |
4 |
2 |
5 |
|
|
Тромбоцитопения 3–4-й степени Thrombocytopenia grade 3–4 |
% |
87 % |
12 % |
38 % |
87 % |
13 % |
47 % |
|
дней days |
6 |
3 |
15 |
6 |
2 |
13 |
|
|
Анемия 3–4-й степени Anemia grade 3–4 |
% |
25 % |
11 % |
25 % |
30 % |
20 % |
33 % |
Таблица 6. Негематологическая токсичность при лечении по протоколам «ПМЛ-16» и «ПМЛ-19»
Table 6. Non-haematological toxicity on the PML-16 and PML-19 protocols
|
Токсичность |
Блок ± Лен Block A ± Len (n) |
Блок B ± Лен Block B ± Len (n) |
ЕРОСН ± Лен ЕРОСН ± Len (n) |
|
Энтеропатия / Enteropathy |
4/5 |
2/0 |
3/0 |
|
Мукозит / Mucositis |
8/10 |
3/3 |
3/2 |
|
Эзофагит / Esophagitis |
1/0 |
|
|
|
Пневмония / Pneumonia |
5/3 |
1/1 |
2/1 |
|
Грибковая инфекция / Fungal infection |
|
|
1/0 |
|
Вирусная инфекция / Viral infection |
1 |
1 |
0/0 |
|
КАИК / CABSI |
1/1 |
0/0 |
0/0 |
|
Tоксический гепатит / Toxic hepatitis |
6/5 |
1/2 |
1/0 |
Notes. Len — lenalidomide, CABSI — catheter assoсiated blood stream infections.
Обсуждение
ПМЛ является уникальной по своей биологии лимфомой. До 2008 г. в классификациях лимфоидных опухолей ПМЛ была представлена как подвариант ДВККЛ, однако ярко выраженные иммуноморфологические и молекулярно-генетические особенности заболевания стали основанием для выделения ее в отдельную нозологическую единицу [35][44]. Патологическая активация сигнального пути JAK/STAT и механизмов «ускользания» от иммунного контроля, схожий профиль экспрессии генов и мутационный статус лежат в основе современных представлений о происхождении ПМЛ и лимфомы Ходжкина из единой клетки-предшественницы — В-лимфоцита мозгового слоя тимуса [45][46]. В то же время ПМЛ относится к числу агрессивных неходжкинских лимфом. Подобно ДВККЛ из активированных лимфоцитов (АВС-ДВККЛ), маркерами принадлежности опухолевых клеток к В-лимфоцитам постгерминального этапа дифференцировки являются активация сигнального пути NF-kB и высокая ядерная экспрессия транскрипционного фактора MUM1/IRF4 (multiple myeloma 1/interferon regulatory factor 4) [20][21][47].
Общие принципы терапии ПМЛ остаются практически неизменными в течение более двух десятилетий, что отчасти обусловлено редкостью заболевания и отсутствием рандомизированных исследований. Как и при лимфоме Ходжкина, терапия больных ПМЛ определяется стандартами, которые, с учетом возраста, химиочувствительности опухоли и локальности поражения, нацелены на минимизацию токсичности системного цитостатического воздействия у большинства больных, и последующей консолидацией в случае необходимости. Такая тактика представляется оправданной, т. к. эффективность терапии при применении режимов «R-CHOP», «R-CHOЕP», «R-MACOP-В» с или без лучевой терапии высока: частота стойких ремиссий составляет 80–85 % [1–6]. Лучевая терапия опухолевого образования средостения долгое время рассматривалась как необходимый компонент лечения ПМЛ, ее получали 80–90 % больных.
В разное время пытались применить интенсивную терапию, основанную на педиатрическом протоколе лечения В-ОЛЛ («GMALL-ALL/NHL»), 5-летняя БСВ достигала 88–93 % [48–50]. Однако строгий анализ эффективности данной терапии провести невозможно, т. к. в зависимости от принятых в различных учреждениях протоколов больные получали от 6 до 8 курсов в разной комбинации (АВ/АВС/АС); курсовые дозы метотрексата варьировали от 1000 до 5000 мг/м 2, а суммарные дозы антрациклинов — от 150 до 300 мг/м 2. Кроме того, до внедрения ПЭТ-КТ части больным в качестве консолидации была проведена лучевая терапия или ауто-ТГСК, основываясь только на основании выбора врача. Из-за высокой токсичности программа не получила распространение в клинической практике.
В 2013 г. K. Dunleavy и соавт. [6] опубликовали результаты лечения больных ПМЛ по программе «R-DA-EPOCH»: 94 % ПР, 3-летняя БСВ — 93 %. Однако первые обнадеживающие результаты не получили подтверждения в реальной клинической практике. По данным нескольких многоцентровых ретроспективных исследований, применение программы «R-DA-EPOCH» не выявило значимого преимущества по сравнению с другими программами, а частота развития рецидивов с вовлечением ЦНС при применении программы «R-DA-EPOCH» достигала 4 % [51][52].
Таким образом, преимущества и недостатки различных видов индукционной терапии и консолидации являются предметом постоянных дебатов. Оценка эффективности различных программ терапии основывается преимущественно на ретроспективных данных и исторической разнице в методах оценки полноты ремиссии.
В ФГБУ «НМИЦ гематологии» Минздрава России также была предпринята попытка проведения терапии по протоколу «R-DA-EPOCH». По результатам Я. К. Мангасаровой и соавт. [53], у 20 % больных потребовалось проведение ауто-ТГСК. У одной больной, которую не смогли включить в протокол в связи с беременностью, через 2 мес. после окончания терапии по программе DA-EPOCH развился рецидив с поражением ЦНС. Этой больной была проведена CAR-T-терапия [54][55].
Постепенное наращивание доз химиопрепаратов к концу терапии, по мнению сторонников программы R-DA-EPOCH, является главным преимуществом [56][57]. Начало терапии с курсов меньшей интенсивности у большинства больных ПМЛ позволяет снизить тяжесть специфических осложнений, связанных с наличием тромбозов в системе верхней полой вены, нарушением дренажной функции бронхиального дерева и развитием пневмонии, частым развитием синдрома распада опухоли. Кроме того, такой подход, по сути, является аналогом высокодозной консолидации. Однако, по данным различных авторов [6][51][58], в связи с нарастающей от курса к курсу миелотоксичностью не более 60 % больных получают четвертый уровень повышения доз, а начало лечения с менее интенсивных доз вносит вклад в формирование резистентности опухоли к ХТ, о чем свидетельствует наличие случаев прогрессии на фоне терапии.
Главная цель, которую ставили перед собой, приступая к новому протоколу лечения, — это максимальное повышение эффективности терапии первой линии. В этом протоколе принципиально изменили стратегию лечения ПМЛ, сделав акцент на достижении максимальной редукции опухоли в фазу индукции ремиссии как наиболее значимом факторе, определяющем успех в терапии агрессивных лимфом — программа «R-mNHL-BFM-90». Вторая цель — профилактика поражения ЦНС при рецидиве заболевания. Включение в программу метотрексата и леналидомида («ПМЛ-19») позволило нивелировать риск развития рецидива с вовлечением ЦНС. Третья цель — уменьшение токсичности ХТ. В качестве консолидации применили менее токсичную программу, основанную на длительном введении химиопрепаратов — курс «R-EPOCH» без эскалации доз.
Тяжесть состояния больных ПМЛ определялась локализацией опухоли. Особую сложность представляли больные, которым, несмотря на тяжесть состояния, с диагностической целью потребовалось проведение повторной биопсии опухоли. Благодаря сопроводительной терапии и обеспечению венозного доступа удалось избежать жизнеугрожающих осложнений даже у тех больных, которым ХТ была начата в условиях отделения реанимации и интенсивной терапии.
Программа «ПМЛ-16» не была выполнена полностью у 5 больных. В настоящее время все они живы, у них сохраняется ремиссия заболевания более 2 лет (от 28 до 46 мес.). Возможность излечения менее чем после 6 курсов ХТ стала основанием для создания нового протокола лечения («ПМЛ-19»), в котором количество курсов «R-EPOCH» было сокращено до двух.
Исходя из схожести биологических характеристик ПМЛ и лимфомы Ходжкина, обсуждалось включение в программу таргетных препаратов или ингибиторов контрольных точек. Однако, по сравнению с лимфомой Ходжкина, при наличии тех же мишеней (CD30, PD-L1, PD-L2, Jak2) опухолевые клетки ПМЛ оказались менее чувствительны к таким препаратам, как брентуксимаб ведотин, пембролизумаб, ниволумаб, руксолитиниб [10][12][59][60].
В результате полноэкзомного секвенирования показано, что в отличие от других типов лимфом, нарушение драйверных генов при ПМЛ осуществляется множеством различных механизмов, что затрудняет выделение ведущих факторов опухолевой прогрессии [61]. Прогностическое значение наиболее часто встречающихся аберраций генов CIITA, TNFAIP3, B2M, NFKBIE, PD-L1/PD-L2/JAK2, микросателлитной нестабильности сложно оценить из-за малочисленности анализируемых групп и разнообразия вариантов генетических поломок [62–65].
Однако в эксперименте на клеточных линиях была показана низкая эффективность ингибитора Jak2 и, наоборот, быстрая гибель опухолевых клеток в результате ингибирования киназного комплекса IkB, что дает основание предположить важную роль активации сигнального пути NF-kB в молекулярном патогенезе ПМЛ [59][66]. Наличие мутаций в генах BCL6, IKBA, REL, TNFAIP3 и NF-kB указывает на патогенетические сходства между ПМЛ и АВС-ДВККЛ [20][21][45][67]. Поэтому по аналогии с АВС-ДВККЛ в программу терапии был включен леналидомид [68]. Лечение АВС-ДВККЛ с факторами неблагоприятного прогноза программа R-mNHL-BFM-90 в комбинации с леналидомидом продемонстрировало высокую эффективность и приемлемую токсичность [69].
Протокол «ПМЛ-19» имеет преимущество в виде меньшей токсичности, поскольку при нем проводится только 4 курса. Однако, в отличие от протокола «ПМЛ-16», результаты ПЭТ-КТ-2 и ПЭТ-КТ-3 оказались хуже: полного метаболического ответа после индукции ремиссии достигли только 18 % больных, а по окончании терапии — 63 %, в то время как при использовании протокола «ПМЛ-16» эти показатели составили 43 и 100 % соответственно. Вероятно, этот эффект был обусловлен применением леналидомида. По данным литературы [70–72], развитие транзиторного усугубления клинических проявлений опухоли (tumor flare reaction, TFR) при монотерапии леналидомидом в течение первых недель лечения достигает 30–40 %, с развитием лихорадки, сыпи, лейкоцитоза, лимфаденопатии. В комбинации с интенсивной терапией эта реакция может протекать с минимальными клиническими симптомами в виде субфебрилитета и сыпи, которые наблюдались у больных. Описаний характерных ПЭТ-КТ-изменений, сопутствующих TFR, в литературе нет.
С широким внедрением в практику ПЭТ-КТ стало понятно, что достижение полного метаболического ответа является предиктором хорошего прогноза, а риск развития рецидива практически равен нулю. Иначе обстоят дела в группе больных с ПЭТ-КТ-позитивным остаточными опухолями. По данным М. Martelli и соавт. [73], у больных ПМЛ с D4–5 баллов 5-летняя выживаемость без прогрессирования оказалась значительно хуже и составила 68 % против 99 % при D1–3.
Однако только у части больных с D4–5 развивается рецидив. По данным разных авторов [25][26], у 30–35 % больных после терапии R-DA-EPOCH сохранялась повышенная метаболическая активность D4–5; из них только у 20–45 % развился рецидив. Части из этих больных выполняют повторную биопсию, часть наблюдают до появления картины уже развернутого рецидива, остальные в качестве консолидации получают лучевую терапию или высокодозную ХТ с ауто-ТГСК. Иными словами, около трети больных ПМЛ подвергаются неоправданному риску повторных инвазивных процедур, непосредственной или отдаленной токсичности лучевой терапии и ауто-ТГСК.
Изучение соДНК в различных биологических жидкостях приобретает в последние годы все больший интерес. Во множестве исследований показаны потенциальные возможности применения соДНК для определения молекулярно-генетических характеристик опухоли, прогнозировании рецидива и оценки полноты ремиссии [29]. На примере ДВККЛ показано, что достижение раннего молекулярного ответа, определяемого по отсутствию соДНК, является значимым прогностическим фактором: 2-летняя БСВ при этом составляет 83 %, в то время как при сохраняющейся соДНК — всего 50 % [74][75]. В настоящем исследовании для оценки динамики соДНК в качестве молекулярного маркера использовалось определение клональных перестроек генов тяжелой и легких каппа/лямбда цепей иммуноглобулинов. После индукции ремиссии только у 2 больных сохранялась соДНК. После окончания терапии вне зависимости от промежуточных и итоговых результатов ПЭТ-КТ соДНК не определялась ни у одного больного.
Таким образом, в настоящей работе представлен успешный опыт лечения 34 больных ПМЛ по протоколам «ПМЛ-16» и «ПМЛ-19». Кумуляция больных в рамках одного исследовательского центра позволила унифицировать подходы к диагностике, оценке результатов лечения и минимизировать риски невыполнения программы, связанные с различными подходами к сопроводительной терапии. Протоколы лечения демонстрируют преемственность и эволюцию терапевтических подходов в лечении редкой и во многом уникальной лимфоидной опухоли. Учитывая высокую химиочувствительность, целью любого исследовательского протокола в настоящее время должно быть достижение ремиссии у 100 % больных ПМЛ.
Анализ полученных результатов позволяет сделать несколько выводов:
- Высокая эффективность протокола «ПМЛ-16» позволила не только отказаться от проведения консолидирующей терапии, но и опровергла представление о необходимости проведения 6 курсов ХТ. Сочетание двух уникальных программ, основанных на применении принципа высокодозной коротко-импульсной индукции ремиссии (R-mNHL-BFM-90) в сочетании с продленным введением средних доз (R-EPOCH) имело решающее значение для достижения успешного результата.
- Включение леналидомида в программу интенсивной ХТ для лечения ПМЛ в рамках протокола «ПМЛ-19» позволило достичь полной ремиссии в 100 % случаев после 4 курсов. Несмотря на небольшой срок наблюдения, большая часть больных пережила 12 мес., находясь в состоянии ремиссии, без применения консолидирующей терапии.
- В рамках протоколов «ПМЛ-16» и «ПМЛ-19» была впервые продемонстрирована возможность использования анализа соДНК в качестве надежного метода оценки МОБ у больных ПМЛ. В группе больных с ПЭТ-КТ-позитивными остаточными опухолями исчезновение клонального продукта соДНК в плазме после окончания лечения позволяет отказаться от проведения консолидирующей лучевой терапии или ауто-ТГСК, которые в настоящее время доступны только в единичных центрах России. Перспективна дальнейшая разработка протоколов лечения с применением соДНК в качестве основания для «стоп-терапии» уже после 3 курсов ХТ у больных с длительными цитопениями и/или тяжелыми инфекционными осложнениями.
Список литературы
1. Vassilakopoulos T.P., Pangalis G.A., Katsigiannis A., et al. Rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone with or without radiotherapy in primary mediastinal large B‐cell lymphoma: The emerging standard of care. Oncologist. 2012; 17(2): 239–49. DOI: 10.1634/theoncologist.2011-0275.
2. Zinzani P.L., Stefoni V., Finolezzi E., et al. Rituximab combined with MACOPB or VACOP-B and radiation therapy in primary mediastinal large B-cell lymphoma: A retrospective study. Clin Lymphoma Myeloma. 2009; 9(5): 381–5. DOI: 10.3816/CLM.2009.n.074.
3. Malenda A., Kołkowska-Leśniak A., Puła B., et al. Outcomes of treatment with dose-adjusted EPOCH-R or R-CHOP in primary mediastinal large B-cell lymphoma. Eur J Haematol. 2020; 104(1): 59–66. DOI: 10.1111/ejh.13337.
4. Gleeson M., Hawkes E.A., Cunningham D., et al. Rituximab, cyclophosphamide, doxorubicin, vincristine and prednisolone (R-CHOP) in the management of primary mediastinal B-cell lymphoma: A subgroup analysis of the UK NCRI R-CHOP 14 versus 21 trial. Br J Haematol. 2016; 175(4): 668–72. DOI: 10.1111/ bjh.14287.
5. Rieger M., Österborg A., Pettengell R., et al. Primary mediastinal B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: Results of the Mabthera International Trial Group study. Ann Oncol. 2011; 22(3): 664– 70. DOI: 10.1093/annonc/mdq418.
6. Dunleavy K., Pittaluga S., Maeda L.S., et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma. N Engl J Med. 2013; 368(15): 1408–16. DOI: 10.1056/NEJMoa1214561.
7. Kuruvilla J., Pintilie M., Tsang R., et al. Salvage chemotherapy and autologous stem cell transplantation are inferior for relapsed or refractory primary mediastinal large B-cell lymphoma compared with diffuse large B-cell lymphoma. Leuk Lymphoma. 2008; 49(7): 1329–36. DOI: 10.1080/10428190802108870.
8. Soumerai J.D., Hellmann M.D., Feng Y., et al. Treatment of primary mediastinal B-cell lymphoma with rituximab, cyclophosphamide, doxorubicin, vincristine and prednisone is associated with a high rate of primary refractory disease. Leuk Lymphoma. 2014; 55(3): 538–43. DOI: 10.3109/10428194.2013.810738.
9. Zinzani P.L., Broccoli A. Optimizing outcomes in primary mediastinal B-cell lymphoma. Hematol Oncol Clin North Am. 2016; 30(6): 1261–75. DOI: 10.1016/j. hoc.2016.07.011.
10. Armand P., Rodig S., Melnichenko V., et al. Pembrolizumab in relapsed or refractory primary mediastinal large B-cell lymphoma. J Clin Oncol. 2019; 37(34): 3291–9. DOI: 10.1200/JCO.19.01389.
11. Zinzani P.L., Santoro A., Gritti G., et al. Nivolumab combined with brentuximab vedotin for relapsed/refractory primary mediastinal large B-cell lymphoma: Efficacy and safety from the phase II CheckMate 436 Study. J Clin Oncol. 2019; 37(33): 3081–9. DOI: 10.1200/JCO.19.01492.
12. Zinzani P.L., Pellegrini C., Chiappella A., et al. Brentuximab vedotin in relapsed primary mediastinal large B-cell lymphoma: Results from a phase 2 clinical trial. Blood. 2017; 129(16): 2328–30. DOI: 10.1182/blood-2017-01-764258.
13. Neelapu S.S., Locke F.L., Bartlett N.L., et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med. 2017; 377(26): 2531–44. DOI: 10.1056/NEJMoa1707447.
14. Bishop P.C., Wilson W.H., Pearson D., et al. CNS involvement in primary mediastinal large B-cell lymphoma. J Clin Oncol. 1999; 17(8): 2479–85. DOI: 10.1200/jco.1999.17.8.2479.
15. Stefoni V., Broccoli A., Pellegrini C., et al. CNS recurrence of primary mediastinal large b-cell lymphoma after complete remission. J Neurooncol. 2009; 95(1): 135–9. DOI: 10.1007/s11060-009-9898-0.
16. Goldschmidt N., Kleinstern G., Orevi M., et al. Favorable outcome of primary mediastinal large B-cell lymphoma patients treated with sequential RCHOP-RICE regimen without radiotherapy. Cancer Chemother Pharmacol. 2016; 77(5): 1053–60. DOI: 10.1007/s00280-016-3024-8.
17. Camus V., Rossi C., Sesques P., et al. Outcomes after first-line immunochemotherapy for primary mediastinal B-cell lymphoma: A LYSA study. Blood Adv. 2021; 5(19): 3862–72. DOI: 10.1182/bloodadvances.2021004778.
18. De Sanctis V., Alfò M., Di Rocco A., et al. Second cancer incidence in primary mediastinal B-cell lymphoma treated with methotrexate with leucovorin rescue, doxorubicin, cyclophosphamide, vincristine, prednisone, and bleomycin regimen with or without rituximab and mediastinal radiotherapy: Results from a monoinstitutional cohort analysis of long‐term survivors. Hematol Oncol. 2017; 35(4): 554–60. DOI: 10.1002/hon.2377.
19. Chen H., Pan T., He Y., et al. Primary mediastinal B-cell lymphoma: Novel precision therapies and future directions. Front Oncol. 2021; 11: 654854. DOI: 10.3389/fonc.2021.654854.
20. Feuerhake F., Kutok J.L., Monti S., et al. NFκB activity, function, and targetgene signatures in primary mediastinal large B-cell lymphoma and diffuse large B-cell lymphoma subtypes. Blood. 2005; 106(4): 1392–9. DOI: 10.1182/ blood-2004-12-4901.
21. Mansouri L., Noerenberg D., Young E., et al. Frequent NFKBIE deletions are associated with poor outcome in primary mediastinal B-cell lymphoma. Blood. 2016; 128(23): 2666–70. DOI: 10.1182/blood-2016-03-704528.
22. Aoki T., Izutsu K., Suzuki R., et al. Prognostic significance of pleural or pericardial effusion and the implication of optimal treatment in primary mediastinal large B-cell lymphoma: A multicenter retrospective study in Japan. Haematologica. 2014; 99(12): 1817–25. DOI: 10.3324/haematol.2014.111203.
23. Dubois S., Viailly P.J., Mareschal S., et al. Next-generation sequencing in diffuse large B-cell lymphoma highlights molecular divergence and therapeutic opportunities: A LYSA study. Clin Cancer Res. 2016; 22(12): 2919–28. DOI: 10.1158/1078-0432.CCR-15-2305.
24. Scarpa A., Moore P.S., Rigaud G., et al. Molecular features of primary mediastinal B-cell lymphoma: Involvement of p16(INK4A), p53 and c-myc. Br J Haematol. 1999; 107(1): 106–13. DOI: 10.1046/j.1365-2141.1999.01678.x.
25. Melani C., Advani R., Roschewski M., et al. End-of-treatment and serial PET imaging in primary mediastinal B-cell lymphoma following dose-adjusted EPOCH-R: A paradigm shift in clinical decision making. Haematologica. 2018; 103(8): 1337–44. DOI: 10.3324/haematol.2018.192492.
26. Pinnix C.C., Ng A.K., Dabaja B.S., et al. Positron emission tomography– computed tomography predictors of progression after DA-R-EPOCH for PMBCL. Blood Adv. 2018; 2(11): 1334–43. DOI: 10.1182/bloodadvances.2018017681.
27. Lazarovici J., Terroir M., Arfi-Rouche J., et al. Poor predictive value of positive interim FDG-PET/CT in primary mediastinal large B-cell lymphoma. Eur J Nucl Med Mol Imaging. 2017; 44(12): 2018–24. DOI: 10.1007/s00259-017-3758-5.
28. Qin W., Jiang X., You J., et al. Deauville score evaluation of interim PET/CT in primary mediastinal large B-cell lymphoma. Eur J Nucl Med Mol Imaging. 2021; 48(11): 3347–50. DOI: 10.1007/s00259-021-05310-6.
29. Lv L., Liu Y. Clinical application of liquid biopsy in non-Hodgkin lymphoma. Front Oncol. 2021; 11: 658234. DOI: 10.3389/fonc.2021.658234.
30. Rossi D., Kurtz D.M., Roschewski M., et al. The development of liquid biopsy for research and clinical practice in lymphomas: Report of the 15-ICML workshop on ctDNA. Hematol Oncol. 2020; 38(1): 34–7. DOI: 10.1002/hon.2704.
31. Cirillo M., Craig A.F.M., Borchmann S., et al. Liquid biopsy in lymphoma: Molecular methods and clinical applications. Cancer Treat Rev. 2020; 91: 102106. DOI: 10.1016/j.ctrv.2020.102106.
32. Huet S., Salles G. Potential of circulating tumor DNA for the management of patients with lymphoma. JCO Oncol Pract. 2020; 16(9): 561–8. DOI: 10.1200/ jop.19.00691.
33. Roschewski M., Dunleavy K., Pittaluga S., et al. Circulating tumour DNA and CT monitoring in patients with untreated diff use large B-cell lymphoma: A correlative biomarker study. Lancet Oncol. 2015; 16(5): 541–9. DOI: 10.1016/S14702045(15)70106-3.
34. Программное лечение заболеваний системы крови: сборник алгоритмов диагностики и протоколов лечения заболеваний системы крови. Под ред. В.Г. Савченко. М.: Практика; 2018.
35. Swerdlow S.H., Campo E., Harris N.L., et al. World Health Organization classification of tumours of the haematopoietic and lymphoid tissues. Eds. S.H. Swerdlow, E. Campo, N.L. Harris, E.S. Jaffa, S.A. Pileri, H. Stein, J. Thiele. 4th ed. Postgraduate Haematology. 2017: 986–8.
36. Pavlova S., Smardova J., Tom N., et al. Detection and functional analysis of TP53 mutations in CLL. Methods Mol Biol. 2019; 1881: 63–81. DOI: 10.1007/978-1-4939-8876-1_6.
37. https://p53.iarc.fr/TP53GeneVariations.aspx
38. http://vps338341.ovh.net/
39. Cancer Therapy Evaluation Program (CTEP). Common Terminology Criteria for Adverse Events (CTCAE). v.5.0 [5x7]. Cancer Ther Eval Progr. 2017: 155.
40. Barrington S.F., Mikhaeel N.G., Kostakoglu L., et al. Role of imaging in the staging and response assessment of lymphoma: Consensus of the international conference on malignant lymphomas imaging working group. J Clin Oncol. 2014; 32(27): 3048–58. DOI: 10.1200/JCO.2013.53.5229.
41. Shipp M.A. Prognostic factors in aggressive non-Hodgkin’s lymphoma: Who has “high-risk” disease? Blood. 1994; 83(5): 1165–73.
42. International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med. 1993; 329(14): 987–94. DOI: 10.1056/NEJM199309303291402.
43. Oken M.M., Creech R.H., Davis T.E. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5(6): 649–55.
44. Swerdlow S.H., Campo E., Pileri S.A., et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016; 127(20): 2375–90. DOI: 10.1182/blood-2016-01-643569.
45. Zhou J., Wang H.Y. Primary mediastinal large B-cell lymphoma: Diagnostic challenges and recent advances. J Clin Transl Pathol. 2021; 1(1): 21–7. DOI: 10.14218/JCTP.2021.00008.
46. Leithäuser F., Bäuerle M., Huynh M.Q., et al. Isotype-switched immunoglobulin genes with a high load of somatic hypermutation and lack of ongoing mutational activity are prevalent in mediastinal B-cell lymphoma. Blood. 2001; 98(9): 2762–70. DOI: 10.1182/blood.V98.9.2762.
47. Lees C., Keane C., Gandhi M.K., et al. Biology and therapy of primary mediastinal B-cell lymphoma: current status and future directions. Br J Haematol. 2019; 185(1): 25–41. DOI: 10.1111/bjh.15778.
48. Fietz T., Knauf W.U., Hänel M., et al. Treatment of primary mediastinal large B cell lymphoma with an alternating chemotherapy regimen based on high-dose methotrexate. Ann Hematol. 2009; 88(5): 433–9. DOI: 10.1007/s00277-0080625-2.
49. Pohlen M., Gerth H.U., Liersch R., et al. Efficacy and toxicity of a rituximab and methotrexate based regimen (GMALL B-ALL/NHL 2002 protocol) in Burkitt’s and primary mediastinal large B-cell lymphoma. Am J Hematol. 2011; 86(12): 61–76. DOI: 10.1002/ajh.22165.
50. Wehde N., Borte G., Liebmann A., et al. Primary mediastinal large B cell lymphoma: Frontline treatment with an alternating chemotherapy regimen based on high dose methotrexate – A single institution experience. J Med Soc. 2017; 31(1): 8–13. DOI: 10.4103/0972-4958.198427.
51. Knörr F., Zimmermann M., Attarbaschi A., et al. Dose-adjusted EPOCH-rituximab or intensified B-NHL therapy for pediatric primary mediastinal large B-cell lymphoma. Haematologica. 2021; 106(12): 3232–5. DOI: 10.3324/haematol.2021.278971.
52. Giulino-Roth L., O’Donohue T., Chen Z., et al. Outcomes of adults and children with primary mediastinal B-cell lymphoma treated with dose-adjusted EPOCH-R. Br J Haematol. 2017; 179(5): 739–47. DOI: 10.1111/bjh.14951.
53. Мангасарова Я.К., Магомедова А.У., Кравченко С.К. и др. Восьмилетний опыт лечения агрессивных В-крупноклеточных лимфом средостения. Терапевтический архив. 2013; 85(7); 50–6.
54. Jiao C., Zvonkov E., Lai X., et al. 4SCAR2.0: A multi-CAR-T therapy regimen for the treatment of relapsed/refractory B cell lymphomas. Blood Cancer J. 2021; 11(3): 59. DOI: 10.1038/s41408-021-00455-x.
55. Zhang R., Li Y., Tu S., et al. Improved safety and efficacy of a multi-target chimeric antigen receptor modified T cell therapy (4SCAR2.0) against relapsed or refractory lymphomas. Blood. 2020; 136(Suppl 1): 47. DOI: 10.1182/ blood-2020-141515.
56. Wilson W.H., Grossbard M.L., Pittaluga S., et al. Dose-adjusted EPOCH chemotherapy for untreated large B-cell lymphomas: A pharmacodynamic approach with high efficacy. Blood. 2002; 99(8): 2685–93. DOI: 10.1182/blood. v99.8.2685.
57. Ackland S.P., Ratain M.J., Vogelzang N.J., et al. Pharmacokinetics and pharmacodynamics of long-term continuous-infusion doxorubicin. Clin Pharmacol Ther. 1989; 45(4): 340–7. DOI: 10.1038/clpt.1989.39.
58. Martelli M., Zucca E., Botto B., et al. Impact of different induction regimens on the outcome of primary mediastinal B-cell lymphoma in the prospective IELSG 37 trial. Hematol Oncol. 2021; 39(S2): 90–2. DOI: 10.1002/hon.49_2879.
59. Kim S.J., Yoon D.H., Kang H.J., et al. Ruxolitinib shows activity against Hodgkin lymphoma but not primary mediastinal large B-cell lymphoma. BMC Cancer. 2019; 19(1): 1080. DOI: 10.1186/s12885-019-6303-z.
60. Fakhri B, Ai W. Current and emerging treatment options in primary mediastinal B-cell lymphoma. Ther Adv Hematol. 2021; 12: 20406207211048959. DOI: 10.1177/20406207211048959.
61. Chapuy B., Stewart C., Dunford A., et al. Comprehensive genomic analysis of primary mediastinal B-cell lymphoma. Blood. 2018; 132(S1): 1564. DOI: 10.1182/blood-2018-99-118135.
62. Кузнецова С.А., Сурин В.Л., Мангасарова Я.К. и др. Характеристика цитогенетических и молекулярно-генетических нарушений гена CIITA у пациентов с первичной медиастинальной (тимической) В-крупноклеточной лимфомой. Клиническая онкогематология. 2021; 14(2): 173–8. DOI: 10.21320/2500-2139-2021-14-2-173-178.
63. Bonneville R., Krook M.A., Kautto E.A., et al. Landscape of microsatellite instability across 39 cancer types. JCO Precis Oncol. 2017; 2017: PO.17.00073. DOI: 10.1200/PO.17.00073.
64. Mottok A., Woolcock B., Chan F.C., et al. Genomic alterations in CIITA are frequent in primary mediastinal large B cell lymphoma and are associated with diminished MHC class II expression. Cell Rep. 2015; 13(7): 1418–31. DOI: 10.1016/j.celrep.2015.10.008.
65. Mottok A., Steidl C. Genomic alterations underlying immune privilege in malignant lymphomas. Curr Opin Hematol. 2015; 22(4): 343–54. DOI: 10.1097/ MOH.0000000000000155.
66. Lam L.T., Davis R.E., Pierce J., et al. Small molecule inhibitors of IκB kinase are selectively toxic for subgroups of diffuse large B-cell lymphoma defined by gene expression profiling. Clin Cancer Res. 2005; 11(1): 28–40. DOI: 10.1158/10780432.28.11.1.
67. Schmitz R., Hansmann M.L., Bohle V., et al. TNFAIP3 (A20) is a tumor suppressor gene in Hodgkin lymphoma and primary mediastinal B cell lymphoma. J Exp Med. 2009; 206(5): 981–9. DOI: 10.1084/jem.20090528.
68. Nowakowski G.S., LaPlant B., Macon W.R., et al. Lenalidomide combined with R-CHOP overcomes negative prognostic impact of non-germinal center B-cell phenotype in newly diagnosed diffuse large B-cell lymphoma: A phase II study. J Clin Oncol. 2015; 33(3): 251–7. DOI: 10.1200/JCO.2014.55.5714.
69. Габеева Н.Г., Королева Д.А., Смольянинова А.К. и др. Химиотерапия по программе R-mNHL-BFM-90 в комбинации с леналидомидом как терапия первой линии у больных MUM1-позитивной диффузной В-крупноклеточной лимфомой и фолликулярной лимфомой 3В цитологического типа. Гематология и трансфузиология. 2019; 64(2): 52–66. DOI: 10.35754/0234-5730-2019-64-2-52-66.
70. Andritsos L.A., Johnson A.J., Lozanski G., et al. Higher doses of lenalidomide are associated with unacceptable toxicity including life-threatening tumor flare in patients with chronic lymphocytic leukemia. J Clin Oncol. 2008; 26(15): 2519– 25. DOI: 10.1200/JCO.2007.13.9709.
71. Eve H.E., Rule S.A.J. Lenalidomide-induced tumour flare reaction in mantle cell lymphoma. Br J Haematol. 2010; 151(4): 410–2. DOI: 10.1111/j.13652141.2010.08376.x.
72. Ruan J., Martin P., Christos P., et al. Five-year follow-up of lenalidomide plus rituximab as initial treatment of mantle cell lymphoma. Blood. 2018; 132(19): 2016–25. DOI: 10.1182/blood-2018-07-859769.
73. Martelli M., Finolezzi E. Fluorodeoxyglucose positron emission tomography predicts survival after chemoimmunotherapy for primary mediastinal large B-cell lymphoma: Results of the International Extranodal Lymphoma Study Group IELSG-26 Study. J Clin Oncol. 2014; 32(17): 1769–75. DOI: 10.1200/ JCO.2013.51.7524.
74. Oliveira K.C.S., Ramos I.B., Silva J.M.C., et al. Current perspectives on circulating tumor DNA, precision medicine, and personalized clinical management of cancer. Mol Cancer Res. 2020; 18(4): 517–28. DOI: 10.1158/1541-7786. MCR-19-0768.
75. Kurtz D.M., Scherer F., Jin M.C., et al. Circulating tumor DNA measurements as early outcome predictors in diffuse large B-cell lymphoma. J Clin Oncol. 2018; 36(28): 2845–53. DOI: 10.1200/JCO.2018.78.5246.
Об авторах
Н. Г. ГабееваРоссия
Габеева Нелли Георгиевна, кандидат медицинских наук, старший научный сотрудник, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Д. А. Королева
Россия
Королева Дарья Александровна, кандидат медицинских наук, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
С. А. Татарникова
Россия
Татарникова Светлана Андреевна, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
А. К. Смольянинова
Россия
Смольянинова Анна Константиновна, кандидат медицинских наук, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Д. С. Бадмажапова
Россия
Бадмажапова Дарима Сэмункоевна, кандидат медицинских наук, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
С. Ю. Смирнова
Россия
Смирнова Светлана Юрьевна, кандидат медицинских наук, научный сотрудник лаборатории молекулярной гематологии
125167, Москва
Е. Е. Никулина
Россия
Никулина Елена Евгеньевна, научный сотрудник лаборатории молекулярной гематологии
125167, Москва
А. В. Беляева
Россия
Беляева Анастасия Валерьевна, гематолог отделения гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Э. Г. Гемджян
Россия
Гемджян Эдуард Георгиевич, научный сотрудник лаборатории по изучению психических и неврологических расстройств при заболеваниях системы крови
125167, Москва
В. А. Лапин
Россия
Лапин Валерий Альбертович, главный внештатный специалист-гематолог Департамента здравоохранения и фармации Ярославской области, гематолог
150062, Ярославль
Э. Р. Москалец
Россия
Москалец Элина Рашитовна, радиолог
129090, Москва
И. Э. Костина
Россия
Костина Ирина Эдуардовна, кандидат медицинских наук, заведующая рентгеновским отделением
125167, Москва
Я. К. Мангасарова
Россия
Мангасарова Яна Константиновна, кандидат медицинских наук, заведующая отделением химиотерапии лимфатических опухолей с блоком трансплантации костного мозга и гемопоэтических стволовых клеток с дневным стационаром
125167, Москва
С. А. Шутов
Россия
Шутов Сергей Александрович, доктор медицинских наук, ведущий научный сотрудник отделения хирургии
125167, Москва
Б. В. Бидерман
Россия
Бидерман Белла Вениаминовна, кандидат биологических наук, старший научный сотрудник лаборатории молекулярной гематологии
125167, Москва
А. Б. Судариков
Россия
Судариков Андрей Борисович, доктор биологических наук, заведующий лабораторией молекулярной гематологии
125167, Москва
Т. Н. Обухова
Россия
Обухова Татьяна Никифоровна, кандидат медицинских наук, заведующая лабораторией кариологии
125167, Москва
А. М. Ковригина
Россия
Ковригина Алла Михайловна, доктор биологических наук, заведующая патологоанатомическим отделением
125167, Москва
Г. М. Галстян
Россия
Галстян Геннадий Мартинович, доктор медицинских наук, заведующий отделом реанимации и интенсивной терапии
125167, Москва
Е. Е. Звонков
Россия
Евгений Евгеньевич Звонков, доктор медицинских наук, заведующий отделением гематологии и химиотерапии лимфом с блоком трансплантации костного мозга и гемопоэтических стволовых клеток
125167, Москва
Рецензия
Для цитирования:
Габеева Н.Г., Королева Д.А., Татарникова С.А., Смольянинова А.К., Бадмажапова Д.С., Смирнова С.Ю., Никулина Е.Е., Беляева А.В., Гемджян Э.Г., Лапин В.А., Москалец Э.Р., Костина И.Э., Мангасарова Я.К., Шутов С.А., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Ковригина А.М., Галстян Г.М., Звонков Е.Е. Промежуточные результаты терапии первичной медиастинальной В-крупноклеточной лимфомы по протоколам «ПМЛ-16» и «ПМЛ-19». Гематология и трансфузиология. 2022;67(3):328-350. https://doi.org/10.35754/0234-5730-2022-67-3-328-350
For citation:
Gabeeva N.G., Koroleva D.A., Tatarnikova S.A., Smolianinova A.K., Badmazhapova D.S., Smirnova S.Yu., Nikulina E.E., Belyaeva A.V., Gemdzhian E.G., Lapin V.A., Moskalets E.R., Kostina I.E., Mangasarova Y.K., Shutov S.A., Biderman B.V., Sudarikov A.B., Obukhova T.N., Kovrigina A.M., Galstyan G.M., Zvonkov E.E. Interim results of the PML-16, PML-19 protocols for primary mediastinal large B-cell lymphoma therapy. Russian journal of hematology and transfusiology. 2022;67(3):328-350. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-3-328-350











































