Перейти к:
Обинутузумаб в сочетании с хлорамбуцилом в первой линии терапии пожилых больных ХЛЛ
https://doi.org/10.35754/0234-5730-2022-67-4-478-490
Аннотация
Введение. Оптимальная терапия пожилых больных хроническим лимфолейкозом (ХЛЛ) – предмет интенсивных исследований.
Цель – изучение безопасности обинутузумаба, а также подбор оптимальной схемы его использования у больных ХЛЛ, осложненным сахарным диабетом, почечной недостаточностью, кардиальной патологией.
Материалы и методы. В исследование включены больные впервые диагностированным ХЛЛ, имевшие показания к терапии. Порядок включения в исследование: кумулятивный индекс коморбидности (Cumulative Illness Rating Scale, CIRS) > 7 и/или скорость клубочковой фильтрации (СКФ) < 70 мл/мин, нижний порог СКФ не был ограничен. Целенаправленно включали больных ХЛЛ с сахарным диабетом, почечной недостаточностью и значимой кардиальной патологией. Не включали больных с декомпенсированными органными недостаточностями, с синдромом Рихтера, поражением ЦНС, вирусным гепатитом B, а также с делецией 17p. В первом цикле обинутузумаб вводили в дозе 100 или 25 мг в первый день и 900 или 975 мг – во второй день, затем – в дозе 1000 мг на 8-й и 15-й дни. На всех последующих циклах обинутузумаб вводили в дозе 1000 мг в 1-й день. Хлорамбуцил назначали в дозе 10 мг/м2 с 1-го по 7-й день. Циклы терапии в суммарном количестве 6 повторяли каждые 28 дней.
Результаты. В исследование включены 90 больных (49 мужчин и 41 женщина). Медиана возраста – 73,5 года, разброс – 60–89 лет. Стадию С имели 24 (27 %) больных, вариант ХЛЛ без мутаций IGHV-генов выявлен у 76 % больных. Медиана СКФ составила 48,6 мл/мин (разброс – 25–110 мл/мин). Медиана CIRS составила 3 (разброс – 1–14). У 31 (34 %) больного были серьезные сердечно-сосудистые заболевания (перенесенный ранее инфаркт миокарда, стентирование или шунтирование коронарных артерий, хроническая сердечная недостаточность ≥ II NYHA, заболевание периферических артерий), а также гемодинамически значимые пороки клапанов. У 15 (17 %) больных был сахарный диабет, у 71 (79 %) больного – СКФ < 70 мл/мин. Реакции на обинутузумаб ≥ II степени были зарегистрированы у 29 (32 %) больных. Госпитализация в день введения или на следующие сутки после первого введения потребовалась в 5 (5,5 %) случаях. Шесть циклов не удалось провести у 27 (30 %) больных. Наибольшее число больных (14 чел., 15,5 %) прекратили лечение после 1-го курса. Из них у 4 больных лечение было прекращено из-за развития затяжных цитопений, 3 больных имели реакции IV степени на обинутузумаб, 2 отказались от дальнейшего введения, 2 умерли от инфекционных осложнений, у 1 больного был тяжелый синдром лизиса опухоли, у 1 – острый панкреатит, 1 больная была переведена на другую программу из-за развития токсикодермии, вызванной хлорамбуцилом. CIRS статистически значимо предсказывал общую выживаемость (ОВ) с дискриминирующей границей от 3 до 6 (максимальное дискриминирующее значение при CIRS = 3, p = 0,013). С ОВ ассоциировалась СКФ < 50 мл/мин (отношение рисков (ОР) = 0,5, 95%-ный доверительный интервал (95% ДИ): 0,24–1,04, p = 0,03). По крайней мере 1 эпизод нейтропении III–IV степени наблюдался у 41 % больных. С развитием нейтропении III–IV степени ассоциировались СКФ < 60 мл/мин (p = 0,05), исходное количество нейтрофилов < 2 × 109/л (p = 0,0001), исходное количество моноцитов < 0,3 × 109/л (p = 0,007) и возраст > 70 лет (p = 0,01). Эффективность лечения оценивали у больных, получивших, по крайней мере, 3 цикла терапии. Полная ремиссия достигнута у 26 (35 %) больных, частичная ремиссия – у 41 (54 %), стабилизация – у 4 (5 %), прогрессия наблюдалась у 3 (4 %). Оценка эффекта была невозможна у 16 (18 %) больных. Минимальная остаточная болезнь (МОБ) в костном мозге < 0,01 % констатирована у 17 (19 %) больных, в пределах 0,01–0,9 % – у 25 (28 %) больных. Медиана срока наблюдения за больными от даты начала терапии составила 39,7 мес. (разброс – 0,6–72 мес.). Медиана безрецидивной выживаемости (БРВ) не достигнута, а 2- и 3-летняя выживаемость составила 81 и 62 % соответственно. Худшая БРВ коррелировала с вариантом ХЛЛ без мутаций IGHV (ОР = 2,4, 95% ДИ: 1,12–5,0, p = 0,02) и частичной ремиссией (по сравнению с полной; ОР = 3,35, 95% ДИ: 1,45–7,7, p = 0,03).
Заключение. Несмотря на то что комбинация обинутузумаба с хлорамбуцилом утрачивает свое значение в терапии ХЛЛ, обинутузумаб интегрируется в современные схемы терапии. Инфузионные реакции создают высокий риск развития осложнений у пожилых больных. Доза обинутузумаба в первый день введения у пожилых больных должна составлять не более 25 мг. Режим «G-Clb» может быть не оптимален у больных старше 75 лет из-за непредсказуемого риска осложнений. Больным с высоким риском нейтропении целесообразно предусмотреть ее первичную профилактику.
Для цитирования:
Маркова Е.E., Никитин Е.А., Дмитриева Е.А., Майорова С.Ю., Кочкарева Ю.Б., Наумова Е.В., Луговская С.А., Почтарь М.Е., Петренко А.А., Кислова М.И., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Птушкин В.В. Обинутузумаб в сочетании с хлорамбуцилом в первой линии терапии пожилых больных ХЛЛ. Гематология и трансфузиология. 2022;67(4):478-490. https://doi.org/10.35754/0234-5730-2022-67-4-478-490
For citation:
Markova E.E., Nikitin E.A., Dmitrieva E.A., Mayorоva S.Yu., Kochkareva Yu.B., Naumova E.V., Lugovskaya S.A., Pochtar M.E., Petrenko А.А., Kislova М.I., Biderman B.V., Sudarikov А.B., Obukhova Т.N., Ptushkin V.V. Obinutuzumab in combination with chlorambucil in first line treatment of elderly patients with chronic lymphocytic leukemia. Russian journal of hematology and transfusiology. 2022;67(4):478-490. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-478-490
Введение
Медиана возраста на момент начала терапии у больных хроническим лимфолейкозом (ХЛЛ) в России составляет около 65 лет. Больше половины больных ХЛЛ — пожилые люди со значимой коморбидностью, которая препятствует проведению терапии, направленной на достижение ремиссии с неопределяемой минимальной остаточной болезнью (МОБ). При значимом увеличении продолжительности жизни молодых больных ХЛЛ успехи терапии у пожилых существенно менее выражены [1–7]. Неудивительно, что исследование таргетных препаратов в первой линии терапии ХЛЛ было ориентировано прежде всего на пожилых больных. Существенным шагом вперед стало немецкое исследование «CLL11» [8], в котором показано, что добавление обинутузумаба к хлорамбуцилу («G-Clb») значительно повыcило качество ремиссий и увеличило беспрогрессивную выживаемость (БПВ) и общую выживаемость (ОВ) по сравнению с хлорамбуцилом, назначавшимся в монорежиме или в комбинации с ритуксимабом у больных ХЛЛ с сопутствующими заболеваниями, имевших более 6 баллов по кумулятивной шкале коморбидности (cumulative illness rating scale, CIRS) и/или скорость клубочковой фильтрации (СКФ) от 30 до 69 мл/мин. При этом токсичность нового режима не существенно превосходила другие режимы. На какое-то время режим «обинутузумаб + хлорамбуцил» стал наиболее рекомендуемой схемой лечения пожилых больных ХЛЛ. Более того, больные, получавшие терапию этой комбинацией, послужили группой сравнения в двух последующих исследованиях у пожилых. В исследовании «CLL14» показано значительное превосходство фиксированной по длительности комбинации венетоклакса иобинутузумаба и режима «G-Clb» у больных с теми же критериями включения, что и в «CLL11» [9]. В исследовании «iLLUMINATE» комбинация обинутузумаба с ибрутинибом превзошла режим «G-Clb» в отношении выживаемости безпрогрессии (ВБП), но не продемонстрировала преимущества в отношении ОВ [10]. В исследовании «CLL13» (GAIA), в которое были включены молодые больные, комбинация обинутузумаба и венетоклакса («G-Ven») превзошла «FCR», и в настоящее время многие расценивают «G-Ven» как новую, менее токсичную и более эффективную альтернативу «FCR» [11]. Таким образом, обинутузумаб с его уникальными особенностями, становится одним из краеугольных камней терапии ХЛЛ.
Большая часть информации о препарате получена из клинических исследований с жесткими критериями отбора. Его переносимость у пожилых больных ХЛЛ со значительной коморбидностью изучена мало, потому что таких больных не включали в клинические исследования.
Цель настоящего исследования — изучение безопасности обинутузумаба, а также подбор оптимальной схемы его использования у больных ХЛЛ с сахарным диабетом, почечной недостаточностью, кардиальной патологией.
Материалы и методы
В постмаркетинговое исследование включали больных впервые диагностированным ХЛЛ и имевших показания к терапии. Диагноз ХЛЛ устанавливали в соответствии с рекомендациями Международной рабочей группы [12]. Порядок включения соответствовал модели, предложенной в исследовании «CLL11» немецкой группы по изучению ХЛЛ [8]. Ключевое внимание уделяли значимой коморбидности, оцененной по шкале CIRS как 7 и более баллов и/или СКФ < 69 мл/мин по формуле Кокрофта—Голта [13]. В отличие от исследования «CLL11», в настоящей работе нижнего порога концентрации креатинина не было. Целенаправленно включали больных ХЛЛ с сахарным диабетом, почечной недостаточностью и кардиальной патологией. Не включали больных ХЛЛ с декомпенсированными органными дисфункциями, больных с синдромом Рихтера, поражением ЦНС, вирусным гепатитом B, неконтролируемыми инфекциями или другими сопутствующими заболеваниями, а также больных с делецией 17p.
В рамках первичного исследования выполняли компьютерную томографию (КТ) грудной клетки и брюшной полости, биопсию костного мозга и миелограмму, определяли сывороточные концентрации иммуноглобулинов, бета-2-микроглобулина, выполняли флуоресцентную гибридизацию in situ для выявления del17, del11q, del13q, +12, иммунофенотипирование по стандартным методикам, исследовали мутационный статус IGHV-генов. Промежуточную оценку после 3 циклов проводили с помощью ультразвукового исследования, оценки физикальных данных и анализа крови. Финальную оценку проводили с использованием КТ грудной клетки и брюшной полости, выполняли также оценку МОБ в крови, при отрицательном результате — в костном мозге. В первом цикле обинутузумаб вводили в дозе 100 или 25 мг в первый день и 900 или 975 мг во второй день, затем в дозе 1000 мг в 8-й и 15-й дни. Во время всех последующих циклов обинутузумаб вводили в дозе 1000 мг в 1-й день. Введения проводили в условиях дневного стационара. Перед каждым введением обинутузумаба в качестве премедикации назначали дексаметазон в дозе 20 мг внутривенно, клемастин 2 мг внутривенно и парацетамол в дозе 500 мг внутрь. Хлорамбуцил назначали в дозе 10 мг/м2 с 1-го по 7-й день. Мониторинг синдрома лизиса опухоли (СЛО) и сывороточных маркеров острой воспалительной реакции осуществляли до введения обинутузумаба, на2, 3 и 8-е сут. В панели СЛО оценивали концентрации кальция, калия, фосфора, креатинина и мочевой кислоты. Мониторинг гематологических осложнений выполняли с помощью анализов крови, которые проводили трехкратно в межкурсовых промежутках. Нежелательные явления оценивали при каждом визите перед началом следующего цикла или по необходимости. Побочные явления оценивали с помощью общих терминологических критериев по нежелательным явлениям Национального института рака США (CTCAE, версия 4). Ответ на лечение оценивали по критериям IWCLL 2008 [12]. Планируемое количество проводимых курсов — 6. Больных исключали из протокола, если задержка со следующим курсом составляла более 2 мес. При наблюдении состояние болезни оценивали каждые 2 мес. с помощью физикальной оценки, анализов крови до прогрессии. Исследование было одобрено локальным этическим комитетом городской клинической больницы им. С.П. Боткина.
Ставились задачи: оценка частоты и тяжести инфузионных реакций, оценка гематологических и негематологических осложнений, оценка частоты ремиссий, МОБ, БПВ и ОВ.
Статистический анализ. Исследование проводили в формате «по намерению лечить». Для анализа и сравнения качественных и количественных данных использовали методы описательной статистики (медианы, стандартные отклонения, Xи-квадрат, критерий Стьюдента). Для анализа корреляции использовали метод Спирмена. Кривые выживаемости строили по методу Каплан—Мейера, а различие между ними оценивали с помощью лог-ранк теста. Для анализа взаимосвязей между различными коморбидностями и токсичностью терапии использовали программный пакет «Circos». В безрецидивной выживаемости (БРВ) учитывали прогрессию во время лечения, рецидив после ремиссии и назначение нового варианта лечения. Смерти от других причин не включались, поскольку 29 % от всех летальных исходов были по причине коронавирусной инфекции. В этих условиях сопоставление результатов с историческим контролем невозможно.
Результаты
Характеристика больных
В исследование включено 90 больных: 49 (54 %) мужчин и 41 (46 %) женщина. Медиана возраста составила 73,5 года, разброс — 60–89 лет. Двадцать четыре (26 %) больных имели стадию С по J.L. Binet [14], делеция 17p не выявлена ни у одного из больных (табл. 1). Вариант ХЛЛ без мутаций IGHV-генов выявлен у 76 % больных. Большая масса опухоли, констатируемая по факту выявления лимфатических узлов размером более 6 см и селезенки > 6 cм ниже края реберной дуги, обнаружена у 15 % больных. Дефицит, по крайней мере, 1 класса иммуноглобулинов имели 83 % больных. Из сопутствующих заболеваний чаще всего обнаруживали гипертоническую болезнь (57 % больных). Патология со стороны сердца была у31 (34 %) больного. Под значимой кардиальной коморбидностью понимали: перенесенный в прошлом инфаркт миокарда, стентирование или шунтирование коронарных артерий, гемодинамически значимый порок сердца, недостаточность кровообращения ≥ II степени по NYHA. Патология сосудов (облитерирующий атеросклероз, аневризма, цереброваскулярная болезнь) выявлена у 10 (11 %) больных, сахарный диабет и гипотиреоз имели 17 и 12 % больных соответственно. Медиана СКФ составила 48,6 мл/мин (разброс — 25–110). Медиана CIRS — 3 (разброс от 1 до 14).
Таблица 1. Характеристика больных, медиана (разброс)
Table 1. Patients’ characteristics, median (range)
Показатели больных ХЛЛ | Медиана (разброс) |
Возраст, годы / Age, years | 73,5 (60–89) |
Бета-2-микроглобулин, мг/л / Beta-2-microglobulin, mg/L | 4,72 (2,3–15,1) |
ЛДГ, ед./л / LDH, U/L | 248 (126–1050) |
Гемоглобин, г/л / Haemoglobin, g/L | 113 (64–155) |
Тромбоциты, ×109/л / Platelets, ×109/L | 138 (9–492) |
Лимфоциты, ×109/л / Lymphocyte count, ×109/L | 79 (8,4–550) |
Нейтрофилы, ×109/л / Neutrophil count, ×109/L | 4,25 (0,48–12,43) |
Моноциты, ×109/л / Monocyte count, ×109/L | 0,49 (0,08–1,5) |
Исходные концентрации иммуноглобулинов, г/л / Initial immunoglobulin concentrations, g/L | |
IgG | 8,68 (2–19,4) |
IgA | 1,2 (0,07–4,3) |
IgM | 0,4 (0,1–1,8) |
Креатинин сыворотки, мкмоль/л / Serum creatinine, µmol/L | 112 (69–211) |
СКФ, мл/мин / GFR, mL/min | 48,6 (25–110) |
CIRS, баллы / CIRS, points | 3 (1–14) |
Характеристики больных | n (%) |
Стадии по Binet / Binet stage | |
A | 1 (1) |
B | 65 (72) |
C | 24 (27) |
del17p | 0 |
Вариант ХЛЛ без мутаций IGHV-генов / Unmutated IGHV status of CLL | 36/47 (76) |
Большая опухолевая масса* / Bulky disease* | 14 (16) |
ECOG > 2 | 32 (36) |
Дефицит по крайней мере 1 класса иммуноглобулинов | 75 (83) |
Артериальная гипертензия / Arterial hypertension | 51 (57) |
Патология сосудов / Vascular pathology | 10 (11) |
Значимая кардиальная патология** / Significant heart disease** | 31 (34) |
Сахарный диабет / Diabetes mellitus | 15 (17) |
Гипотиреоз / Hypothyroidism | 11 (12) |
ХОБЛ/астма / COPD/asthma | 9 (10) |
Примечание. * — лимфатическим узлы > 6 cм, селезенка > 6 cм, ** — перенесенный в прошлом инфаркт миокарда, стентирование или шунтирование коронарных артерий, гемодинамически значимый порок сердца, недостаточность кровообращения ≥ II степени NYHA; ЛДГ — лактатдегидрогеназа, СКФ — скорость клубочковой фильтрации, CIRS — cumulative illness rating scale.
Note. * — lymph nodes > 6 cm, spleen > 6 cm, ** — previous myocardial infarction, coronary artery stenting or bypass, hemodynamically significant heart disease, circulatory failure ≥ II degree NYHA; LDH — lactate dehydrogenase, GFR — glomerular filtration rate, COPD — chronic obstructive pulmonary disease, CIRS — cumulative illness rating scale.
Инфузионные реакции и СЛО
Первое введение обинутузумаба сопровождалось быстрым уменьшением количества лейкоцитов. Медиана количества лейкоцитов до начала терапии составила 79 × 109/л ((7,3–525) × 109/л), после первого курса терапии — 7,5 × 109/л ((2,4–38) × 109/л). Реакции на обинутузумаб ≥ II степени были зарегистрированы у 29 (31 %) больных. Госпитализация в день введения или на следующие сутки после первого введения потребовалась в 5 случаях. У 3 больных имелась лихорадка и нестабильность гемодинамики, у 1 больного, кроме этих явлений, был СЛО, у 1 — тяжелый бронхоспазм. Введение обинутузумаба в рамках протокола осуществляли по схеме производителя, в соответствии с которой препарат вводили в 1-й день в дозе 100 мг (10 % запланированной дозы). В этом режиме тяжелые реакции на введение развились у 3 из первых 4 больных, причем в 2 случаях больные были госпитализированы на 2-е сутки с подозрением на пневмонию и септический шок. После этого протокол был модифицирован так, что в первый день препарат вводили в дозе 25 мг (2,5 % от запланированной дозы). У одного больного 71 лет на 3-и сутки после введения обинутузумаба развилась мерцательная аритмия с последующим инсультом, повлекшим за собой его смерть. Клинически СЛО развился у 3 больных, несмотря на профилактику аллопуринолом и адекватную гидратацию. Во всех случаях осложнение было купировано без последствий, но лечение продолжили 2 больных.
Выполнимость программы лечения, коморбидность и смертность
Шесть циклов не удалось провести у 27 (30 %) больных. Наибольшее число больных (14 или 15,5 %) прекратили лечение после 1 курса. Из них у 4 больных лечение было прекращено из-за развития затяжных цитопений (в том числе у 1 — из-за аутоиммунной гемолитической анемии), 3 больных имели реакции IV степени на обинутузумаб, 2 отказались от дальнейшего введения, 2 больных умерли от инфекционных осложнений, у 1 больного был тяжелый СЛО, у 1 — острый панкреатит, 1 больная была переведена на другую программу из-за развития токсикодермии, вызванной хлорамбуцилом. Начиная со второго цикла ведущей причиной преждевременного прекращения терапии была нейтропения (n = 7, 8 %). Один больной отказался от терапии, у 1 прекращена терапия из-за токсикодермии, 1 — из-за токсического гепатита, 1 умер от пневмонии, и только у 3 больных была прогрессия ХЛЛ.
Зависимость между коморбидностью и исполнимостью программы лечения представлена на рисунке 1. Более высокое значение CIRS статистически значимо коррелировало с меньшим количеством циклов (r = –0,265, p = 0,013). CIRS статистически значимо предсказывал ОВ с дискриминирующей границей от 3 до 6 (максимальное дискриминирующее значение при CIRS = 3, рис. 2A, p = 0,013). Статистически значимой ассоциации между CIRS и БРВ не было. С ОВ также статистически значимо ассоциировались СКФ < 50 мл/мин (рис. 2B) (отношение рисков (ОР) 0,5, 95%-ный доверительный интервал (95% ДИ): 0,24–1,04, p = 0,03). Других ассоциаций, в том числе с возрастом, не выявлено. СКФ < 50 мл/мин также была статистически значимым предиктором БРВ (рис. 2C) (ОР = 0,32, 95% ДИ: 0,17–0,7, p = 0,01).
Ассоциация между коморбидностью и незавершенностью терапии, смертностью в течение 2 лет, нейтропенией и инфекциями показана на рисунке 3. Наиболее значимым параметром была совокупная коморбидность, оцененная по CIRS (более 3 баллов). Она была связана с незавершенностью терапии, нейтропенией, инфекциями и смертностью. СКФ < 50 мл/мин ассоциировалась с незавершенностью терапии и нейтропенией. Сахарный диабет и кардиальная патология были более всего связаны с преждевременным завершением терапии.
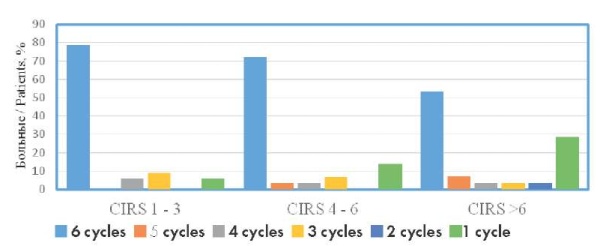
Рисунок 1. Связь между коморбидностью по шкале CIRS и количеством циклов терапии
Figure 1. Relationship between comorbidity according to CIRS and the number of therapy cycles
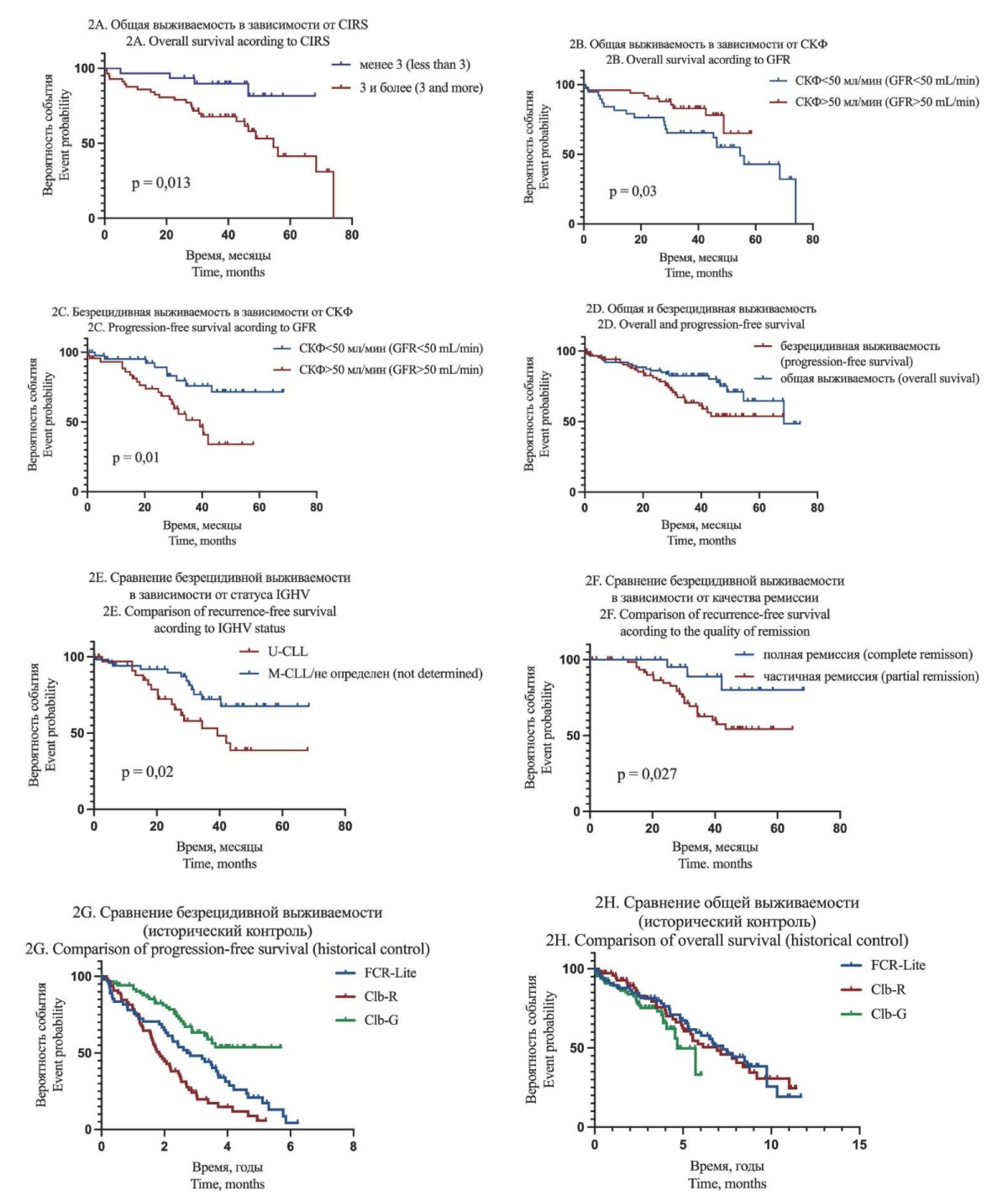
Рисунок 2. ОВ и БРВ для групп больных. Смерти от коронавирусной инфекции процензурированы. На рис. 2G и 2H показано сравнение режима «Clb-G» с историческим контролем (московский протокол)
Figure 2. Overall and progression-free survival for groups of patients. Deaths due to the coronavirus infection are censored. A comparison of Clb-G regimen with historical control (Moscow protocol) is shown in the figure 2G and 2H
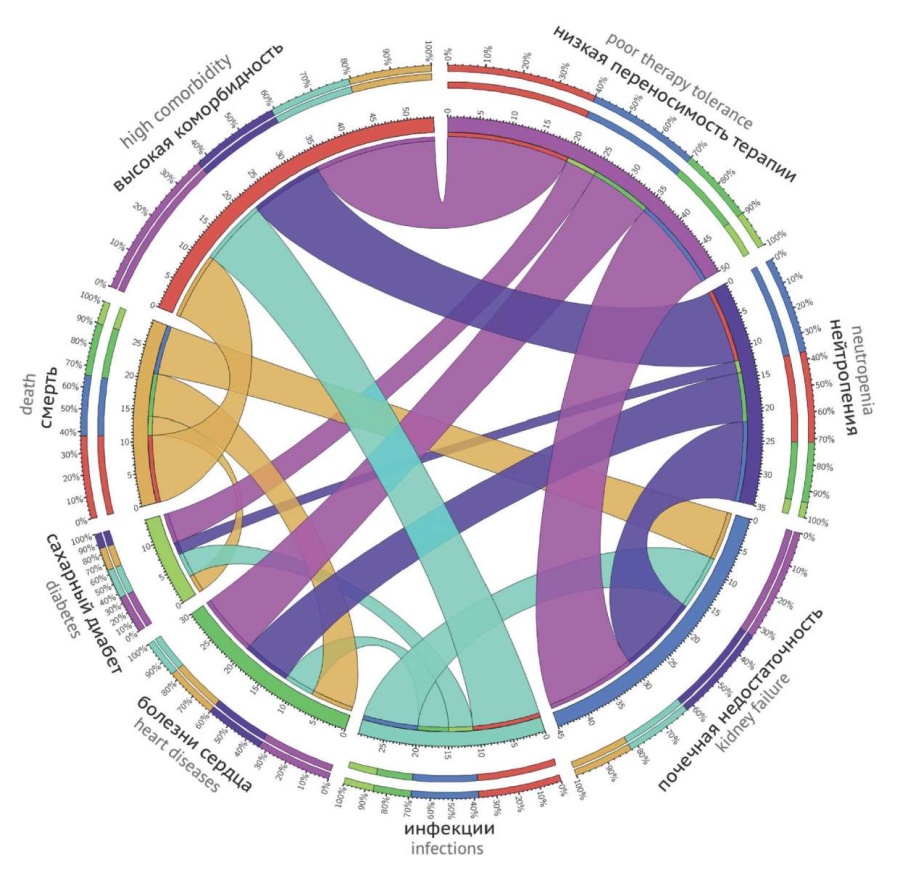
Рисунок 3. Хордовая диаграмма ассоциации коморбидностей с низкой переносимостью терапии, нейтропенией, инфекциями и смертностью
Примечание. Высокая коморбидность — CIRS > 3 баллов; низкая переносимость терапии — проведено < 4 циклов терапии; нейтропения — развитие нейтропении IV степени в ходе терапии; почечная недостаточность — СКФ < 50 мл/мин; инфекции — развитие пневмонии, не связанной с COVID-19 при проведении лечения; болезни сердца — перенесенный в прошлом инфаркт миокарда, стентирование или шунтирование коронарных артерий, гемодинамически значимый порок сердца, недостаточность кровообращения ≥ II степени NYHA; сахарный диабет — сахарный диабет 2-го типа; смерть — смерть в течение 24 мес. от начала терапии. Ассоциация в % показана во внешних кругах.
Figure 3. Chord diagram of the association of comorbidities with poor therapy tolerance, neutropenia, infections, and mortality
Note. High comorbidity — CIRS > 3 points; poor therapy tolerance — < 4 therapy cycles; neutropenia — Grade IV neutropenia during therapy; renal failure — GFR < 50 mL/min; infections — pneumonia not associated with COVID-19 during treatment; heart disease — past myocardial infarction, stenting or bypass coronary arteries, hemodynamically significant heart disease, circulatory failure ≥ II degree NYHA; diabetes — type II diabetes mellitus; death — death within 24 months from the start of therapy. The percentage association is shown in the outer circles.
Нейтропения, инфекции и другие осложнения
Гематологические осложнения, оцененные в соответствии с критериями IWCLL2008 [12], представлены в таблице 2. Снижения концентрации гемоглобина > 50 % от исходных значений не было ни у одного больного. Пять (5,5 %) больных имели анемию II степени, 22 (24 %) — анемию I степени. Уменьшение количества тромбоцитов от 10 до 25 % от исходных значений произошло у 20 (22 %) больных, от 25 до 49 % — у 20 (22 %) больных, и 16 (18 %) больных имели тромбоцитопению III–IV степени (табл. 2).
Таблица 2. Гематологические и инфекционные осложнения III–IV степени
Table 2. Hematological and infectious complications of III–IV stages
Осложнения | Все осложнения III–IV, (n, %) | III (n, %) | IV (n, %) |
Нейтропения / Neutropenia | 37 (41) | 17 (18) | 20 (22) |
Тромбоцитопения / Thrombocytopenia | 16 (18) | 11 (60) | 5 (10) |
Пневмония / Pneumonia | 11 (12) | 8 (9) | 3 (3) |
Фебрильная нейтропения / Febrile neutropenia | 3 (3) | 3 (3) | |
Herpes zoster | 3 (3) | 3 (3) |
По крайней мере 1 эпизод нейтропении III–IV степени наблюдался у 41 % больных. Персистирующая нейтропения, начиная с первого цикла, была ведущей причиной увеличения межкурсовых промежутков, уменьшения дозы хлорамбуцила исоответствующего снижения относительной дозовой интенсивности. Были проанализированы исходные параметры, которые могли ассоциироваться с нейтропенией. В анализ включены: возраст, пол, стадия, масса опухоли, сопутствующие заболевания (диабет и гипотиреоз), СКФ, исходное количество нейтрофилов и моноцитов. С развитием нейтропении III–IV степени статистически значимо ассоциировались СКФ < 60 мл/мин (p = 0,05), исходное количество нейтрофилов < 2 × 109/л (p = 0,0001), исходное количество моноцитов < 0,3 × 109/л (p = 0,007) и возраст > 70 лет (p = 0,01). Модель множественной логистической регрессии с этими параметрами (табл. 3) дала отрицательное предсказующее значение 69 %, положительное предсказующее значение 72 %. У больных с сочетанием этих факторов следует предусмотреть назначение гранулоцитарного колониестимулирующего фактора для профилактики нейтропении.
Таблица 3. Модель множественной логистической регрессии параметров, ассоциированных с нейтропенией
Table 3. Multiple logistic regression model for parameters associated with neutropenia
Параметр / Parameter | ОР / HR | 95% ДИ / 95% CI |
Возраст (> 70 лет) / Age (> 70 years) | 2,685 | 0,9229–8,201 |
Количество моноцитов исходно < 0,3 × 109/л Initial monocyte count < 0,3 × 109/L | 1,839 | 0,4585–7,093 |
Количество нейтрофилов исходно < 0,2 × 109/л Initial neutrophil count < 0,2 × 109/L | 4,648 | 1,085–23,54 |
СКФ < 60 мл/мин | 1,403 | 0,4424–4,566 |
Из инфекционных осложнений, произошедших во время терапии, было зарегистрировано 11 случаев пневмоний, 3 случая герпетической инфекции, 6 случаев фебрильной нейтропении. Кроме нейтропении значимой корреляции инфекции с другим факторами, в том числе сывороточной концентрацией иммуноглобулинов, не было. Нарушения ритма сердца в виде фибрилляции предсердий развились у 3 больных, кожные сыпи, повлекшие модификацию терапии — у 3 больных. В отдаленном периоде развился один случай гемофагоцитарного синдрома, ассоциированного с инфекцией, вызванной вирусом Эпштейна—Барр, один случай — геморрагического васкулита.
Эффективность
Эффективность лечения оценивали только у больных, у которых были проведены по крайней мере 3 цикла терапии. Полная ремиссия достигнута у 26 больных (35 %), частичная ремиссия — у 41 (54 %), стабилизация — у 4 (5 %), прогрессия —у 3 (4 %). Оценка эффекта была невозможна у 16 (18 %) больных. МОБ в костном мозге < 0,01 % констатирована у 17 (19 %) больных, в пределах 0,01–0,9 % — у 25 (28 %) больных.
Медиана срока наблюдения за больными от даты начала терапии составила 39,7 мес. (разброс — 0,6–72 мес.). В БРВ — 30 событий, из них только 3 случились во время терапии и еще 11 — в течение первых 2 лет. Медиана не достигнута, а 2- и 3-летняя выживаемость составила 81 и 62 % соответственно (рис. 2D). Худшая БРВ статистически значимо коррелировала с вариантом ХЛЛ без мутаций IGHV (ОР = 2,4, 95% ДИ: 1,12–5,0, p = 0,02), (рис. 2E) и частичной ремиссией (по сравнению с полной; ОР = 3,35, 95% ДИ: 1,45–7,7, p = 0,03) (рис. 2F). Лечение по поводу рецидива назначено 21 больному. Из них 12 больных получили ибрутиниб, 6 — режим «BR», 1 — бендамустин, 2 — «G-Ven» (обинутузумаб и венетоклакс).
Причинами смерти 31 умершего больного были: в 9 случаях (29 %) — коронавирусная инфекция, в 9 случаях (29 %) — тяжелые инфекции (пневмонии, сепсис, абсцесс легкого, менингит), в 5 случаях (16 %) — нарушения мозгового кровообращения, в 2 случаях — другие опухоли, в 1 — тромбоэмболия легочной артерии, в 2 случаях — комплексные причины. У 3 больных причину смерти достоверно установить не удалось. Прогрессия как фактор танатогенеза имелась только у 2 больных, а непосредственной причиной смерти была пневмония. Таким образом, структура смертности у больных характеризовалась значительным преобладанием инфекций (рис. 2D).
Полученные данные были сопоставлены с историческим контролем — пожилыми больными, получавшими лечение по режимам «FCR-Lite» и «Clb-R» в рамках московского протокола (рис. 2G и 2H) [15]. Больные из группы исторического контроля были сопоставимы по возрасту (медиана — 71 год) и коморбидности (медиана CIRS = 3, разброс — 1–7), больные с делецией 17p были исключены. Сравнение с историческим контролем показало значимое превосходство режима «Clb-G»над обоими режимами («Clb-R» и «FCR-Lite») по БРВ. Различий в ОВ не было.
Обсуждение
Настоящее исследование посвящено изучению эффективности, переносимости, а также оптимизации применения режима «G-Clb» у пожилых больных, у которых ХЛЛ был осложнен значимой коморбидностью. Прежде всего изучали сочетание ХЛЛ с сопутствующими заболеваниями, ассоциированными с неблагоприятным прогнозом, — почечной недостаточностью, сахарным диабетом и кардиальной патологией.
Применение режима «G-Clb» в долгосрочной перспективе показало высокую эффективность в этой группе больных. При среднем сроке наблюдения более 3 лет медиана БРВ до сих пор не достигнута. Это значительно превосходит результаты московского протокола [15] и сопоставимо с данными исследований «CLL11» (медиана — 26,7 мес.), «CLL14» (медиана — 35,6 мес.) [8][9]. Терапию второй линии получили только 23 % больных. В этом смысле режим «G-Clb» представляет собой несомненный шаг вперед в терапии ХЛЛ. Высокоэффективное антитело к CD20, добавляемое к традиционно малотоксичному хлорамбуцилу, позволяет значительно увеличить число ремиссий, в том числе с неопределяемостью МОБ, что реализуется существенным увеличением БРВ. Для значительной части больных старше 70 лет «G-Clb» становится единственным лечением, способным достичь контроля над ХЛЛ. Различий в ОВ по сравнению с историческим контролем не было найдено, но периоды сравнения несопоставимы из-за пандемии коронавирусной инфекции.
При этом применять обинутузумаб у пожилых больных непросто. Значительная часть больных не смогли продолжить лечение уже после первого курса. Сокращение количества циклов происходило преимущественно по двум причинам: тяжелые инфузионные реакции и нейтропения.
В начале протокола, в соответствии с инструкцией производителя, обинутузумаб вводили в дозе 100 мг в 1-й день. Введение препарата у первых 5 больных в этой дозе сопровождалось серьезными инфузионными реакциями. В типичном виде реакция в момент введения не носила тяжелого характера (максимально II степень во время введения), что, по-видимому, обусловлено эффективной премедикацией. Проблему представлял собой период, когда действие препаратов, использовавшихся в премедикации, заканчивалось. У первых 5 больных реакции развивались вечером и ночью и выражались в гипертермии, нарушении сознания в 1 случае. Первые 2 больных были госпитализированы на 2-е сутки после введения с подозрением на пневмонию и септический шок. В дальнейшем эти осложнения не были подтверждены. С учетом этих особенностей протокол был оптимизирован, и обинутузумаб стали вводить в объеме 2,5 % от запланированной дозы (25 мг). Это привело к значимому уменьшению количества и тяжести инфузионных реакций. Премедикация должна обязательно включать 20 мг дексаметазона накануне. По-видимому, предпочтительно использовать пролонгированные стероидные гормоны.
Второй проблемой явилась нейтропения. Ее природа не до конца ясна, но более высокая частота нейтропении при использовании обинутузумаба (35 %) зарегистрирована и в исследовании «CLL11» [8]. Небольшое число больных в настоящей работе не позволило надежно идентифицировать предикторы нейтропении. Тем не менее найденные факторы (возраст, сниженная функция почек, низкое количество нейтрофилов и моноцитов) исходно могут служить ориентиром для определения тактики. Используемые в совокупности, эти параметры позволяют предсказать нейтропению III–IV степени тяжести с вероятностью 70 %.
Несмотря на то что комбинация обинутузумаба и хлорамбуцила уже утрачивает свое значение в терапии ХЛЛ, результаты настоящего исследования имеют практическое значение, поскольку обинутузумаб активно интегрируется в современные схемы терапии. Информация о течении и способах предупреждения инфузионных реакций имеет большое значение. Настоящее исследование позволило сделать несколько выводов. Инфузионные реакции создают высокий риск развития осложнений у пожилых больных. Доза обинутузумаба в 1-й день введения у пожилых больных не должна превышать 25 мг. Режим «G-Clb» может быть не оптимален у больных старше 75 лет из-за непредсказуемого риска осложнений. Больным с высоким риском нейтропении может быть целесообразно предусматривать ее первичную профилактику.
Благодарности: авторы выражают благодарность Наталье Денисовой, инициировавшей это исследование.
Список литературы
1. Hallek M., Fischer K., Fingerle-Rowson G., et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial. Lancet. 2010; 376(9747): 1164–74. DOI: 10.1016/S0140-6736(10)61381-5.
2. Fischer K., Cramer P., Busch R., et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2012; 30(26): 3209–16. DOI: 10.1200/JCO.2011.39.2688.
3. Fischer K., Bahlo J., Fink A.M., et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: Updated results of the CLL8 trial. Blood. 2016; 127(2): 208–15. DOI: 10.1182/blood-2015-06-651125.
4. Thompson P.A., Tam C.S., O’Brien S.M., et al. Fludarabine, cyclophosphamide, and rituximab treatment achieves long-term disease-free survival in IGHV-mutated chronic lymphocytic leukemia. Blood. 2016; 127(3): 303–9. DOI: 10.1182/blood-2015-09-667675.
5. Rossi D., Terzi-di-Bergamo L., De Paoli L., et al. Molecular prediction of durable remission after first-line fludarabine-cyclophosphamide-rituximab in chronic lymphocytic leukemia. Blood. 2015; 126(16): 1921–4. DOI: 10.1182/blood-2015-05-647925.
6. Shvidel L., Shtalrid M., Bairey O., et al. Conventional dose fludarabine-based regimens are effective but have excessive toxicity in elderly patients with refractory chronic lymphocytic leukemia. Leuk Lymphoma. 2003; 44(11): 1947–50. DOI: 10.1080/1042819031000110991.
7. Marotta G., Bigazzi C., Lenoci M., et al. Low-dose fludarabine and cyclophosphamide in elderly patients with B-cell chronic lymphocytic leukemia refractory to conventional therapy. Haematologica. 2000; 85(12): 1268–70.
8. Goede V., Fischer K., Busch R., et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014; 370(12): 1101–10. DOI: 10.1056/NEJMoa1313984.
9. Al-Sawaf O., Zhang C., Tandon M., et al. Venetoclax plus obinutuzumab versus chlorambucil plus obinutuzumab for previously untreated chronic lymphocytic leukaemia (CLL14): Follow-up results from a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21(9): 1188-200. DOI: 10.1016/S1470-2045(20)30443-5.
10. Moreno C., Greil R., Demirkan F., et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): A multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20(1): 43–56. DOI: 10.1016/S1470-2045(18)30788-5.
11. Eichhorst B., Niemann C., Kater A.P., et al. A randomized phase III study of venetoclax-based time-limited combination treatments (RVe, GVe, GIVe) vs standard chemoimmunotherapy (CIT: FCR/BR) in frontline chronic lymphocytic leukemia (CLL) of fit patients: first co-primary endpoint analysis of the international intergroup GAIA (CLL13) trial. Blood. 2021; 138(Suppl 1): 71. DOI: 10.1182/blood-2021-146161.
12. Hallek M., Cheson B.D., Catovsky D., et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: A report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood. 2008; 111(12): 5446–56. DOI: 10.1182/blood-2007-06-093906.
13. Parmelee P.A., Thuras P.D., Katz I.R., Lawton M.P. Validation of the Cumulative Illness Rating Scale in a geriatric residential population. J Am Geriatr Soc. 1995; 43(2): 130–7. DOI: 10.1111/j.1532-5415.1995.tb06377.x.
14. Binet J.L., Auquier A., Dighiero G., et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer. 1981; 48(1): 198–206. DOI: 10.1002/1097-0142(19810701)48:1<198::aid-cncr2820480131>3.0.co;2-v.
15. Nikitin E., Kisilichina D., Zakharov O., et al. Randomised comparison of FCR-lite and ClbR (chlorambucil plus rituximab) regimens in elderly patients with chronic lymphocytic leukemia. Hematologica. 2013; 98(s1): 473, abstr NS1147.
Об авторах
Е. E. МарковаРоссия
Маркова Елена Евгеньевна, гематолог
125284, Москва
Е. А. Никитин
Россия
Никитин Евгений Александрович, доктор медицинских наук, профессор, заведующий дневным стационаром гематологии, онкологии и химиотерапии городского гематологического центра; заведующий кафедрой гематологии и трансфузиологии им. акад. И.А. Кассирского и А.И. Воробьева
125284, Москва;
125993, Москва
Е. А. Дмитриева
Россия
Дмитриева Елена Александровна, врач-гематолог
125284, Москва;
125993, Москва
С. Ю. Майорова
Россия
Майорова Светлана Юрьевна, гематолог
125284, Москва
Ю. Б. Кочкарева
Россия
Кочкарева Юлия Борисовна, кандидат медицинских наук, гематолог
125284, Москва
Е. В. Наумова
Россия
Наумова Елена Владимировна, кандидат медицинских наук, врач лабораторной диагностики, кафедра клинической лабораторной диагностики
125993, Москва
С. А. Луговская
Россия
Луговская Светлана Александровна, доктор медицинских наук, профессор, кафедра клинической лабораторной диагностики
125993, Москва
М. Е. Почтарь
Россия
Почтарь Маргарита Евгеньевна, кандидат медицинских наук, врач клинической лабораторной диагностики, кафедра клинической лабораторной диагностики
125993, Москва
А. А. Петренко
Россия
Петренко Андрей Анатольевич, гематолог
125284, Москва;
125993, Москва
М. И. Кислова
Россия
Кислова Мария Игоревна
125284, Москва
Б. В. Бидерман
Россия
Бидерман Белла Вениаминовна, кандидат биологических наук, старший научный сотрудник лаборатории молекулярной гематологии
1125167, Москва
А. Б. Судариков
Россия
Судариков Андрей Борисович, доктор биологических наук, заведующий лабораторией молекулярной гематологии
1125167, Москва
Т. Н. Обухова
Россия
Обухова Татьяна Никифоровна, кандидат медицинских наук, заведующая лабораторией кариологии
1125167, Москва
В. В. Птушкин
Россия
Птушкин Вадим Вадимович, доктор медицинских наук, профессор, заместитель главного врача по медицинской части (по гематологии); профессор кафедры гематологии и трансфузиологии им. акад. И.А. Кассирского и А.И. Воробьева
125284, Москва;
125993, Москва
Рецензия
Для цитирования:
Маркова Е.E., Никитин Е.А., Дмитриева Е.А., Майорова С.Ю., Кочкарева Ю.Б., Наумова Е.В., Луговская С.А., Почтарь М.Е., Петренко А.А., Кислова М.И., Бидерман Б.В., Судариков А.Б., Обухова Т.Н., Птушкин В.В. Обинутузумаб в сочетании с хлорамбуцилом в первой линии терапии пожилых больных ХЛЛ. Гематология и трансфузиология. 2022;67(4):478-490. https://doi.org/10.35754/0234-5730-2022-67-4-478-490
For citation:
Markova E.E., Nikitin E.A., Dmitrieva E.A., Mayorоva S.Yu., Kochkareva Yu.B., Naumova E.V., Lugovskaya S.A., Pochtar M.E., Petrenko А.А., Kislova М.I., Biderman B.V., Sudarikov А.B., Obukhova Т.N., Ptushkin V.V. Obinutuzumab in combination with chlorambucil in first line treatment of elderly patients with chronic lymphocytic leukemia. Russian journal of hematology and transfusiology. 2022;67(4):478-490. (In Russ.) https://doi.org/10.35754/0234-5730-2022-67-4-478-490











































