Перейти к:
Сравнение заболеваемости и результатов лечения хронического миелолейкоза в Новосибирске и Новосибирской области
https://doi.org/10.35754/0234-5730-2023-68-1-35-49
Аннотация
Введение. В последнее десятилетие достигнуты значительные успехи в терапии больных хроническим миелолейкозом (ХМЛ), у большинства больных удается получить большой молекулярный ответ (БМО) и максимально повысить общую выживаемость (ОВ). Однако в регионах России в условиях реальной клинической практики остается ряд
нерешенных проблем, которые приводят к ухудшению результатов терапии: низкая приверженность больных к лечению, отсутствие должного контроля со стороны врачей первичного амбулаторного звена поликлиник за приемом лекарственных препаратов и течением заболевания.
Цель — сравнить заболеваемость и результаты терапии больных ХМЛ в г. Новосибирске и Новосибирской области (НСО).
Материалы и методы. Проанализированы результаты лечения 333 больных ХМЛ, изучена заболеваемость, распространенность ХМЛ, проведена оценка 5-летней ОВ и расчетной 10-летней ОВ. Оценены 5-летняя и 10-летняя прогнозируемая бессобытийная выживаемость (БСВ). Изучены результаты терапии ХМЛ у 214 больных, принимавших иматиниб 18 мес. и более. Оценена приверженность больных к проводимой терапии.
Результаты. Заболеваемость с 2004 г. по 2020 гг. составила 0,62 на 100 тыс. населения в год, распространенность ХМЛ в г Новосибирске за последние 15 лет выросла свыросла c 3,27 до 10,89 случая на 100 тыс. населения, в НСО — с 1,83 до 5,55 случая на 100 тыс. Медиана ОВ не достигнута, 5-летняя ОВ в г. Новосибирске составила 85,7 %, расчетная 10-летняя ОВ — 72,5 %. В НСО 5-летняя ОВ составила 80,5 %, расчетная 10-летняя ОВ — 72,3 %. В г. Новосибирске 5-летняя БСВ составила 55,8 %, в НСО — 34,9 %, прогнозируемая 10-летняя БСВ в Новосибирске — 40,8 %, в НСО — 18,7 % (p = 0,02882). Медиана БСВ в г. Новосибирске составила 6,8 года, в НСО — 2,7 года. В г. Новосибирске у 134 (95,7 %) больных достигнут полный клинико-гематологический ответ (ПГО), у 124 (88,5 %) — полный цитогенетический ответ (ПЦО), у 95 (67,8 %) больных — БМО. У 45 больных отмечена неудача терапии (у 45 не достигнут БМО и у 16 (35,5 %) из них не получен еще и ПЦО). Ингибиторы тирозинкиназы (ИТК) 2-го поколения назначены 18 больным, резистентным к иматинибу. У 17 (94,4 %) из 18 больных сохраняется ПГО, у 14 (77,7 %) — достигнут ПЦО и у 12 (66,7 %) больных достигнут БМО. В НСО ПГО получен у 72 (97,3 %) из 74 больных, ПЦО — у 50 (67,6 %) больных, БМО — у 13 (17,6 %) больных. Не удалось получить БМО у 61 больного (82,4 %), из них у 17 (22,9 %) больных не получен и ПЦО. У 7 из 61 больного были назначены ИТК 2-го поколения, у 6 (85,7 %) из 7 больных сохраняется ПГО, у 5 (71,4 %) — достигнут ПЦО, у 1 больного (14,3 %) удалось получить БМО. Приверженность к терапии иматинибом была достоверно ниже в группе больных с неудачей терапии, чем у больных с оптимальным ответом как в г. Новосибирске (р < 0,00001), так и в НСО (р = 0,000002).
Заключение. Выявлено увеличение распространенности ХМЛ в г. Новосибирске и НСО. Проблемами лечения являются недостаточный контроль за больными, живущими в НСО, со стороны участковых терапевтов первичного амбулаторного звена, низкая приверженность к лечению.
Ключевые слова
Для цитирования:
Лямкина А.C., Нечунаева И.Н., Воронцова Е.В., Таирова С.А., Александрова Т.Н., Науменко О.В., Поспелова Т.И. Сравнение заболеваемости и результатов лечения хронического миелолейкоза в Новосибирске и Новосибирской области. Гематология и трансфузиология. 2023;68(1):35-49. https://doi.org/10.35754/0234-5730-2023-68-1-35-49
For citation:
Lyamkina A.S., Nechunaeva I.N., Vorontsova E.V., Tairova S.A., Alexandrova T.N., Naumenko O.V., Pospelova T.I. Comparison of morbidity and results of chronic myeloid leukemia treatment in Novosibirsk and the Novosibirsk region. Russian journal of hematology and transfusiology. 2023;68(1):35-49. (In Russ.) https://doi.org/10.35754/0234-5730-2023-68-1-35-49
Введение
В XXI в. средняя продолжительность жизни больного вновь диагностированным BCR::ABL-позитивным хроническим миелолейкозом (ХМЛ) в странах с развитой системой здравоохранения при условии достижения оптимального ответа на терапию практически не отличается от продолжительности жизни в общей популяции людей аналогичной возрастной группы [1–5]. В XX в. основной задачей лечения больных ХМЛ было достижение полного клинико-гематологического ответа (ПГО) и увеличение 5-летней выживаемости. После появления современной таргетной терапии ингибиторами тирозинкиназы (ИТК) цели изменились: в результате терапии стали добиваться достижения полного цитогенетического ответа (ПЦО, Ph+ = 0 %) и большого молекулярного ответа (БМО, МО > 3, BCR::ABL < 0,1 %). На сегодняшний день ставится максимальная цель — достижение 100%-ной общей выживаемости (ОВ). Международная Европейская рабочая группа по борьбе с лейкозами (European LeukemiaNet) в 2020 г. выпустила новые рекомендации, из которых следует, что сегодня задача лечения ХМЛ состоит в получении максимально возможного уровня минимальной резидуальной болезни (МРБ), максимального глубокого молекулярного ответа (ГМО, МО ≥ 4,0–5,0), при этом достижение БМО рекомендовано уже к концу первого года терапии [6].
Существует группа современных таргетных препаратов ИТК: иматиниб, нилотиниб, дазатиниб, бозутиниб, понатиниб, асциминиб; проходят клинические и предрегистрационные исследования препараты третьего и четвертого поколения. Выбор терапии для каждого отдельного больного определяется согласно национальным клиническим рекомендациям и стандартам, эффективности, с учетом переносимости, ранней и поздней токсичности, а также стоимости медикаментов. Значительное внимание уделяется качеству жизни больного и предотвращению долгосрочного токсичного воздействия на организм, а также определяются пути для максимально возможного отказа от терапии ИТК (STOP-терапия), что приводит к «ремиссии без лечения» (РБЛ). Однако в странах с ограниченными ресурсами доступность эффективных лекарств и необходимого мониторинга может быть ограничена, а целью лечения и сегодня остается только продление жизни [7].
Цель — сравнить заболеваемость и результаты терапии больных ХМЛ в г. Новосибирске и Новосибирской области (НСО).
Материал и методы
Для достижения поставленной цели были сформулированы несколько задач исследования: 1) оценить заболеваемость и распространенность ХМЛ в регионе; 2) проанализировать ОВ и бессобытийную выживаемость (БСВ) больных ХМЛ в регионе; 3) оценить результаты таргетной терапии в г. Новосибирске и НСО; 4) провести анализ приверженности к терапии больных с оптимальным ответом и неудачей терапии в регионе.
На диспансерном учете в период с 2004 по 2020 гг. у гематологов городского гематологического центра (ГБУЗ НСО «Городская клиническая больница № 2» г. Новосибирска) и консультативно-диагностического поликлинического отделения ГБУЗ НСО «Новосибирская областная клиническая больница» находились 333 больных ХМЛ. У 304 больных при диагностике выявлена хроническая фаза заболевания, у 18 — фаза акселерации (ФА), у 11 — бластный криз (БК).
Проанализированы результаты лечения больных ХМЛ: 158 (47,5 %) мужчин и 175 (52,5 %) женщин в возрасте от 10 до 91 года (медиана [Q1; Q3] — 59 [ 42; 67] лет; стандартная ошибка (СО) = 0,881), 95 (28,53 %) больных были моложе 40 лет. Исследование проводили в условиях реальной клинической практики. Срок наблюдения за больными составил от 1 мес. до 180 мес. (60 [ 25,0; 100,0] мес.; СО = 2,721).
В соответствии со шкалой оценки риска по шкале прогноза долгосрочной выживаемости больных ХМЛ (EUTOS long-term survival, ELTS) [8][9], 75,7 % больных относились к группе низкого риска, 15,3 % — к промежуточного и 9 % — высокого риска. Также проведена оценка прогноза согласно прогностическим шкалам Sokal [10] (прогноз прогрессии в ФА и БК) и EUTOS [11] (прогноз достижения полного цитогенетического ответа (ПЦО) к 18 месяцам терапии иматинибом). Согласно шкале Sokal, к группе низкого риска отнесены 50,5 % больных, промежуточного — 30,6 % и высокого — 18,9 %. При оценке шкалы изучения результатов лечения ХМЛ (European Treatment and Outcome Study, EUTOS) в группу низкого риска вошли 71,8 % больных и высокого — 28,2 %.
При диагностике ХМЛ у всех больных проведено стандартное клинико-лабораторное обследование, цитогенетическое исследование костного мозга для выявления филадельфийской хромосомы, при недостаточном количестве метафаз проводили флуоресцентную in situ гибридизацию, помогающую выявить транслокацию t(9;22)(q34;q11). Молекулярно-генетический анализ периферической крови при диагностике заболевания до 2014 г. проводили только при отсутствии стандартной филадельфийской хромосомы, но с 2014 г. стали проводить всем больным. Общая характеристика группы больных представлена в таблице 1.
Таблица 1. Характеристика больных ХМЛ
Table 1. Characteristics of patients with chronic myeloid leukemia
Всего больных / Total patients, n = 333 | |||||||||
мужчины / males | женщины / females | ||||||||
158 | 175 | ||||||||
Возраст больных (59 [ 42; 67] лет; СО = 0,881) / Age of the patients (59 [ 42; 67] years; SE = 0,881) | |||||||||
лет / years | больных / patients | % | |||||||
0–9 | 0 | 0,0 | |||||||
10–19 | 4 | 1,20 | |||||||
20–29 | 21 | 6,31 | |||||||
30–39 | 37 | 11,11 | |||||||
40–49 | 67 | 20,12 | |||||||
50–59 | 52 | 15,62 | |||||||
60–69 | 102 | 30,63 | |||||||
70–79 | 33 | 9,91 | |||||||
80–89 | 15 | 4,50 | |||||||
≥ 90 | 2 | 0,60 | |||||||
Умершие больные, n / Patients who have died, n | 72 | 21,62 % | |||||||
Больные, по которым нет данных о жизненном статусе более года от даты проведения анализа, n / Patients with no vital status data for more than a year from the date of analysis, n | 12 | 3,6 % | |||||||
Хроническая фаза, n / Chronic phase, n | Фаза акселерации, n / Acceleration phase, n | Бластный криз, n / Blast crisis, n | |||||||
304 | 18 | 11 | |||||||
Группы риска у больных с хронической фазой ХМЛ / Risk score in patients with chronic phase of CML | |||||||||
Sokal | EUTOS | ELTS | |||||||
Низкий риск / Low risk n (%) | 168 (50,5) | Низкий риск / Low risk n (%) | 239 (71,8) | Низкий риск / Low risk n (%) | 252 (75,7) | ||||
Промежуточный риск / Intermediate risk n (%) | 102 (30,6) | – | – | Промежуточный риск / Intermediate risk n (%) | 51 (15,3) | ||||
Высокий риск / High risk n (%) | 63 (18,9) | Высокий риск / High risk n (%) | 94 (28,2) | Высокий риск / High risk n (%) | 30 (9,0) | ||||
Терапия / Therapy | |||||||||
1 линия ИТК, n / 1 TKI line, n | 2 линии ИТК, n / 2 TKI lines, n | 3 линии ИТК, n / 3 TKI lines, n | алло-ТГСК, n / allo-HSCT, n | ||||||
305 | 19 | 4 | 2 | ||||||
Новосибирск / Novosibirsk | Новосибирская область / Novosibirsk region | ||||||||
Всего больных, n / Total patients, n | Всего больных, n / Total patients, n | ||||||||
192 | 141 | ||||||||
Терапия ИТК < 18 мес., n / TKI therapy < 18 months, n | Терапия ИТК ≥ 18 мес., n / TKI therapy ≥ 18 months, n | Терапия ИТК < 18 мес., n / TKI therapy < 18 months, n | Терапия ИТК ≥ 18 мес., n / TKI therapy ≥ 18 months, n | ||||||
52 | 140 | 67 | 74 | ||||||
Примечание. ИТК — ингибиторы тирозинкиназы; алло-ТГСК — трансплантация аллогенных гемопоэтических стволовых клеток.
Note. TKI — tyrosine kinase inhibitors; allo-HSCT — allogeneic hematopoietic stem cell transplantation.
За заболеваемость ХМЛ в регионе была принята совокупность всех нозологических единиц с впервые установленным диагнозом ежегодно в пересчете на 100 тыс. населения. Оценка распространенности ХМЛ в регионе — совокупности первично устанавливаемых диагнозов в данном отчетном году и заболеваний, которые были установлены в предыдущих годах и по поводу которых больные обратились в данном отчетном году, в пересчете на 100 тыс. населения.
Проведен анализ ОВ и БСВ больных ХМЛ в г. Новосибирске и НСО. Выживаемость оценивали с применением методик подсчета кумулятивной доли выживших (метод Каплана – Мейера, сравнительный анализ проведен с применением лог-рангового критерия, при p < 0,05 результат принимали за статистически достоверный). Учтены все больные с подтвержденным диагнозом, зарегистрированные в регистре (333 больных). Расчет времени жизни проведен как в период от известной даты постановки диагноза ХМЛ до смерти больного от любой причины или до известной даты последнего визита больного. Показатель БСВ рассчитан от известной даты постановки диагноза до любого известного неблагоприятного события или до последней известной даты визита больного, если неблагоприятное событие не зафиксировано. Под неблагоприятным событием понимали: опухолевую прогрессию больного; зафиксированную неудачу лечения ИТК 1-й линии (недостижение БМО); любые нежелательные явления терапии, из-за которых пришлось отменить препарат; рецидив (потерю любого ранее достигнутого ответа); летальный исход от любой причины; развитие второй опухоли (молочной железы, желудка, простаты, толстого кишечника) или любого позднего осложнения терапии (развитие серозных выпотов, прогрессирующей сердечно-сосудистой, почечной, печеночной недостаточности, сахарного диабета, нарушений сердечного ритма, гиперхолестеринемии), которое могло угрожать жизни больного.
Проведена оценка кумулятивной частоты вторичной резистентности к терапии иматинибом методом событийного анализа утраты ранее достигнутого БМО.
Оценка приверженности больных к терапии проведена с помощью косвенного метода учета выписанных рецептов и опроса больных в группах оптимального ответа и неудачи терапии. Учет выписанных рецептов оценивали по формуле: (реальное количество выписанных больному рецептов за период лечения иматинибом / должное количество выписанных больному рецептов за период лечения иматинибом) × 100 %.
В качестве первой линии терапии всем больным из группы низкого риска назначали терапию ИТК иматинибом в дозе 400 мг/сут., больным из групп промежуточного и высокого риска (Sokal, ELTS) — 600 мг/сут. Если у больного была исходно диагностирована ФА, иматиниб назначали в дозе 600–800 мг/сут., при выявлении первичного БК — 800 мг/сут.
Для анализа результатов терапии ИТК 1-й и 2-й линий использовали метод событийного анализа (расчет кумулятивной частоты достижения ответа). Результаты терапии оценивали в условиях реальной клинической практики, когда не всем больным выполнялись рекомендуемые молекулярные и цитогенетические обследования в рекомендуемые сроки из-за отсутствия возможности обследования. Медиана срока оценки терапии от начала лечения у жителей Новосибирска составила 75 [ 39; 131] мес. (СО = 39,687), у больных в НСО — 66 [ 39; 109] мес. (СО = 37,083).
Анализ результатов таргетной терапии 1-й линии выполнен у 214 (64,3 %) больных из 333 больных, получавших регулярную терапию ИТК более 18 мес. к 1 января 2021 г., из них 140 больных — жители г. Новосибирска и 74 больных — жители НСО. Эффективность терапии оценивали согласно рекомендациям 2005–2013 гг. и критериям, существовавшим в национальных клинических рекомендациях по диагностике и лечению ХМЛ 2014 г., 2016 г., 2018 г., а также согласно рекомендациям Европейской гематологической рабочей группы по лечению лейкозов (European LeukemiaNet) 2009, 2013 и 2020 гг. [6][12–19]. Срок терапии 18 мес. был выбран для оценки с учетом того, что в условиях реальной клинической практики в регионе у большой части больных до 2015 г. молекулярный ответ был оценен через 18 мес. после начала таргетной терапии, и на более ранних этапах оценка результатов не представлялась возможной. Анализировали имеющиеся результаты цитогенетического и молекулярного исследований на дату 31 декабря 2020 г. в динамике (от первого результата до последнего известного). Оптимальный ответ на терапию 1-й линии (иматинибом) констатировали при достижении и сохранении БМО (уровень гена BCR::ABL < 0,1 % по международной шкале (IS) [20]) на 31 декабря 2020 г. Также анализировали кумулятивную частоту стабильного ГМО, отсутствие экспрессии BCR::ABL при чувствительности метода МО4,0–МО5,0) в течение 2 и более лет.
У части больных ХМЛ не удается добиться оптимального ответа на терапию 1-й линии из-за развития резистентности к лечению [19]. Критерии гематологического, цитогенетического и молекулярного ответов представлены в таблице 2.
Таблица 2. Критерии ответов на терапию иматинибом
Table 2. Criteria for response to imatinib therapy
ПГО / СHR | селезенка не пальпируется / the spleen is not palpable бластные клетки в костном мозге < 5 % / blast cells in the bone marrow < 5 % количество лейкоцитов не выше 10 × 109/л, в формуле крови отсутствуют миелоциты, промиелоциты, миелобласты / the leukocyte count is not higher than 10 × 109/L, there are no myelocytes, promyelocytes, myeloblasts in the blood formula количество тромбоцитов менее 450 × 109/л / platelet count less than 450 × 109/L |
ПЦО / CCyR | 0 % Ph'+-клеток / 0 % Ph'+-cells |
ЧЦО / PCyR | 1–35 % Ph'+-клеток / 1–35 % Ph'+-cells |
МЦО / SCyR | 36–65 % Ph'+-клеток / 36–65 % Ph'+-cells |
МинЦО / MinCyR | 66–95 % Ph'+-клеток / 66–95 % Ph'+-cells |
БМО / MMR | < 0,1 % BCR::ABL/ABL по международной шкале (IS) [20] / < 0,1 % BCR::ABL/ABL according international scale (IS) [20] |
Примечание. ПГО — полный гематологический ответ; ПЦО — полный цитогенетический ответ; ЧЦО — частичный цитогенетический ответ; МЦО — малый цитогенетический ответ; МинЦО — минимальный цитогенетический ответ; БМО — большой молекулярный ответ.
Note. CHR — complete hematological response; CCyR — complete cytogenetic response; PCyR — partial cytogenetic response; SCyR — small cytogenetic response; MinCyR — minimal cytogenetic response; MMR — major molecular response.
Если у больного выявляли критерии неудачи терапии ИТК 1-й линии, в качестве терапии 2-й линии назначали ИТК 2-го поколения: нилотиниб в дозе 800 мг/сут., дазатиниб в дозе 100–140 мг/сут. или бозутиниб в дозе 500 мг/сут. Проводили анализ кумулятивной частоты оптимального ответа на терапию 2-й линии.
Статистический анализ. При проведении статистического анализа результатов применили пакет программ Statistica 10,0 (StatSoft Inc., США) и электронных таблиц Exсel 2010 (Microsoft Corp., США). Для проверки подчинения распределения признаков нормальному закону применили критерии Колмогорова – Смирнова. При соответствии признака нормальному распределению применяли однофакторный дисперсионный анализ, при отсутствии нормального распределения — U-тест Манна – Уитни для двух независимых выборок. Данные представлены как медиана и межквартильный интервал (Me [Q1; Q3]) и стандартная ошибка (СО).
Результаты
Эпидемиологические характеристики: заболеваемость и распространенность в регионе
Заболеваемость ХМЛ с 2004 г. по 2020 г. в среднем была равна 0,62 на 100 тыс. населения региона в год. Проведен подробный анализ в различные промежутки этого периода. В первые 14 лет, с 2004–2017 гг., этот показатель был равен в среднем 0,55 на 100 тыс. населения в год, а с 2018 по 2020 г. замечен значительный прирост случаев впервые выявленного заболевания больных (заболеваемость 0,94 на 100 тыс. населения в год) (рис. 1).

Рисунок 1. Заболеваемость ХМЛ в г. Новосибирске и НСО в период с 2004 г. по 2020 г. (число новых случаев ХМЛ на 100 тыс. жителей в год)
Figure 1. Incidence of CML in Novosibirsk and Novosibirsk region in the period from 2004 to 2020 (number of new cases of CML per 100,000 inhabitants per year)
Распространенность ХМЛ за исследуемый период постоянно увеличивалась (рис. 2). В г. Новосибирске распространенность в 2004 г. была 3,27 на 100 тыс. населения, в 2013 г. — 6,2, в 2018 г. этот показатель равнялся 9,12, а в 2020 г. составил 10,89 на 100 тыс. населения. В НСО тоже постоянно увеличивается число больных ХМЛ — с 1,83 на 100 тыс. населения в 2004 г. до 5,55 в 2020 г.
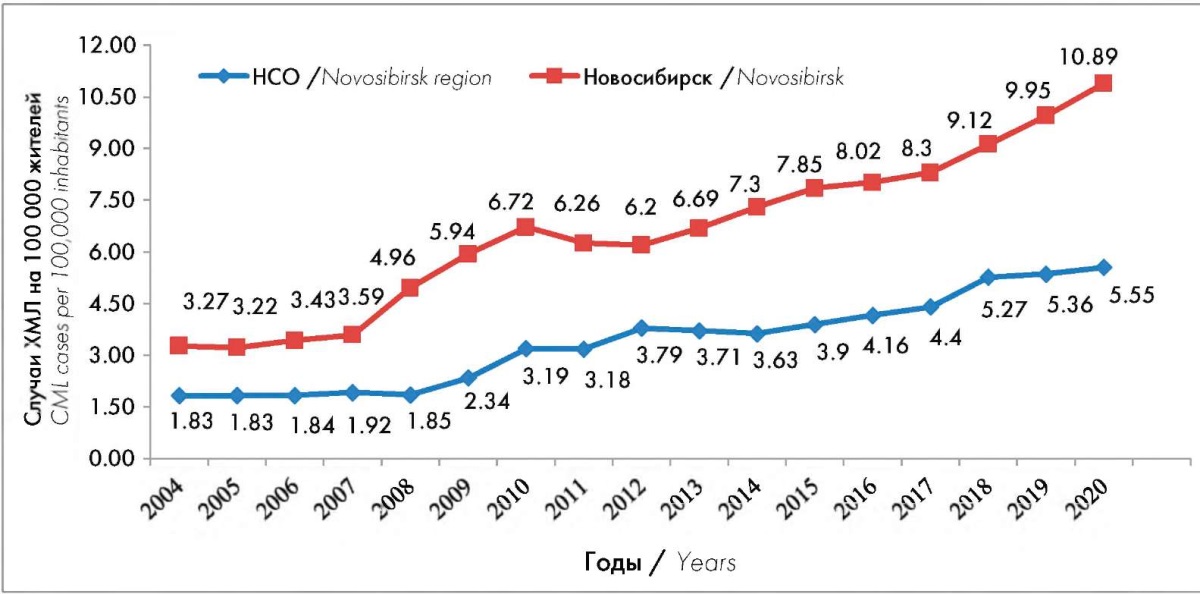
Рисунок 2. Распространенность случаев ХМЛ в Новосибирске и НСО в период с 2004 г. по 2020 г. (всего случаев ХМЛ на 100 тыс. жителей региона в год)
Figure 2. Prevalence of CML cases in Novosibirsk and Novosibirsk region in the period from 2004 to 2020 (total CML cases per 100,000 inhabitants of the region per year)
Ответ на терапию ИТК
Анализ результатов таргетной терапии проведен у 140 больных г. Новосибирска и 74 больных НСО, получивших терапию ИТК более 18 мес. (всего 214 из 333 больных, состоявших на учете). В г. Новосибирске и НСО получены отличающиеся результаты (табл. 3), поэтому данные приведены отдельно. Возможные причины полученных различий рассмотрены ниже в обсуждении результатов.
Оптимальный ответ на терапию 1-й линии препаратами ИТК по критериям European LeukemiaNet 2009–2020 гг. [6][18][19] в г. Новосибирске получен у 67,8 % больных: 95 больных достигли БМО через 12–18 мес. постоянной терапии ИТК, в том числе у 48 (34,2 %) больных определялся стабильный ГМО в течение 2 и более лет.
Таблица 3. Результаты терапии ИТК в течение 18 мес. и более в г. Новосибирске и НСО
Table 3. Results of therapy with TKI for 18 months or more in Novosibirsk and the Novosibirsk region
Новосибирск (2004–2020 гг.) / Novosibirsk (2004–2020) | НСО (2004–2020 гг.) / Novosibirsk region (2004–2020) | |
Всего больных (n¹ = 333) / Total patients (n¹ = 333) | 219 | 114 |
Больные, получавшие терапию ИТК ≥ 18 мес. (n² = 214), n (%) / Patients, who received TKI therapy ≥ 18 months (n² = 214), n (%) | 140 (100) | 74 (100) |
ПГО / CHR, n (%) | 134 (95,7) | 72 (97,3) |
ПЦО / CCyR, n (%) | 124 (88,5) | 50 (67,6) |
БМО / MMR, n (%) | 95 (67,8) | 13 (17,6) |
ГМО / DMR, n (%) | 48 (34,2) | 10 (13,5) |
Неудача терапии / Therapy failure, n (%) | 45 (32,2) | 61 (82,4) |
Отсутствие ПЦО / No CCyR, n (%) | 16 (11,4) | 17 (22,9) |
Примечание. ИТК — ингибиторы тирозинкиназы; ПГО — полный клинико-гематологический ответ; ПЦО — полный цитогенетический ответ; БМО — большой молекулярный ответ; ГМО — глубокий молекулярный ответ; n¹ — всего больных хроническим миелоидным лейкозом в г. Новосибирске и в НСО; n² — больных хроническим миелоидным лейкозом в г. Новосибирске и в НСО, получивших терапию ИТК ≥ 18 месяцев.
Note. TKI — tyrosine kinase inhibitors; CHR — complete clinical and hematological response; CCyR — complete cytogenetic response; MMR — major molecular response; DMR — deep molecular response; n¹ — the total number of patients with chronic myeloid leukemia in Novosibirsk and the Novosibirsk region; n² — patients with chronic myeloid leukemia in Novosibirsk and the Novosibirsk region who received TKI therapy for ≥ 18 months.
Неудача терапии (недостижение БМО) констатирована у 45 больных, при этом у 16 больных не был получен и ПЦО. Мутации гена BCR::ABL выявлены у 3 из 45 больных: у одного — E255K, E275K и Y253H, у второго — M244T/731, у третьего — T315I.
При неудаче терапии ИТК 1-й линии 18 из 45 больных были назначены ИТК 2-го поколения: дазатиниб в дозе 100–140 мг/сут. — 9 больным, нилотиниб в дозе 800 мг/сут. — 7 больным, бозутиниб в дозе 500 мг/сут. — 1 больной. Терапия препаратами ИТК 2-го поколения показала хорошие результаты: 17 (94,4 %) из 18 больных сохраняют ПГО в течение 5 лет, у 14 (77,7 %) больных удалось получить ПЦО, у 12 (66,7 %) больных достигнут БМО. Одному больному во второй хронической фазе (после ФА) на фоне достижения БМО проведена трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК), после которой у больного сохраняется ГМО более 24 мес. Одному больному в фазе БК, после достижения ПГО с помощью терапии дазатинибом, проведена алло-ТГСК, в результате которой у больного достигнуты ПЦО и ГМО (экспрессия BCR::ABL не определялась), эффект сохраняется более 18 мес. Двое больных были переведены после терапии 2-й линии на терапию 3-й линии — один на терапию дазатинибом после нилотиниба, второй больной с мутацией в гене BCR::ABL T315I был переведен на новый, незарегистрированный в то время, препарат асциминиб в рамках протокола клинического исследования. У обоих больных получены БМО и стабильный ГМО, сохраняющиеся более 2 лет.
В НСО результаты терапии менее успешны, только у 13 (17,6 %) больных подтвержден оптимальный ответ. Стабильный ГМО достигнут и сохранен только у 10 (13,5 %) больных (табл. 3). У 50 (67,6 %) больных наилучший подтвержденный ответ — ПЦО. Неудача терапии (отсутствие БМО) констатирована у 61 (82,4 %) больного, из них у 17 (23 %) больных не был получен даже ПЦО.
У одного больного выявлена двойная мутация в гене BCR::ABL — G250E и T315I. Семи (11,5 %) из 61 больного были назначены ИТК 2-го поколения: 4 больных получали дазатиниб в дозе 100 мг/сут., 3 больных — нилотиниб в дозе 800 мг/сут. После перевода на препараты ИТК 2-го поколения у 6 (85,7 %) из 7 больных сохранялся ПГО, у 5 (71,4 %) больных получен ПЦО, у 1 (14,3 %) больного достигнут БМО. Двое больных после 2-й линии были переведены на третью линию ИТК, у одного из них достигнут БМО, у второго сохранялся ПГО.
Оценка комплаентности больных ХМЛ
Приверженность к терапии иматинибом была достоверно ниже в группе больных с неудачей терапии, чем у больных с оптимальным ответом как в Новосибирске (р < 00000,1), так и в НСО (р = 0,000002) (рис. 3).

Рисунок 3. Оценка приверженности к терапии иматинибом в г. Новосибирске и НСО (БМО+ — большой молекулярный ответ достигнут, удача терапии; БМО- — большой молекулярный ответ не достигнут, неудача терапии)
Figure 3. Assessment of compliance with imatinib therapy in Novosibirsk and the Novosibirsk region (MMR+ — major molecular response have received, therapy was successful; MMR- — major molecular response have not received, therapy failed).
Выживаемость больных, получавших терапию ИТК
Медиана ОВ не была достигнута у больных в г. Новосибирске и у больных в НСО. В г. Новосибирске 5-летняя ОВ была 85,7 %, расчетная 10-летняя — 72,5 % (в НСО 5-тилетняя ОВ — 80,5 %, расчетная 10-летняя ОВ — 72,3 %). Прогнозируемая 15-летняя ОВ в г. Новосибирске составила 72,5 %, а в НСО — 67,4 % (рис. 4).
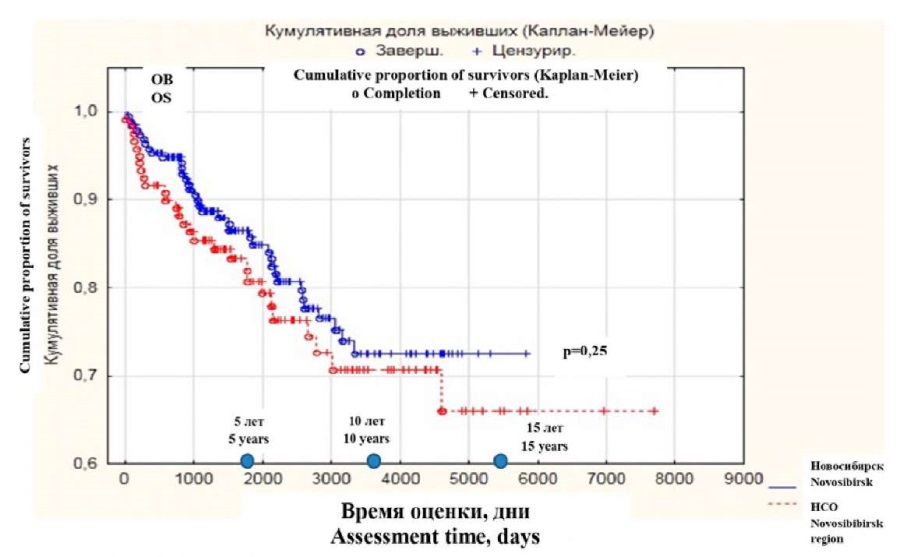
Рисунок 4. Анализ ОВ в г. Новосибирске и НСО
Figure 4. Overall survival analysis in Novosibirsk and Novosibirsk region
В г. Новосибирске 5-летняя БСВ составила 55,8 %, в НСО — 34,9 %, прогнозируемая 10-летняя БСВ в Новосибирске — 40,8 %, в НСО — 18,7 %; p = 0,02882 (рис. 5). Медиана БСВ в г. Новосибирске составила 6,8 года, в НСО — 2,7 года.
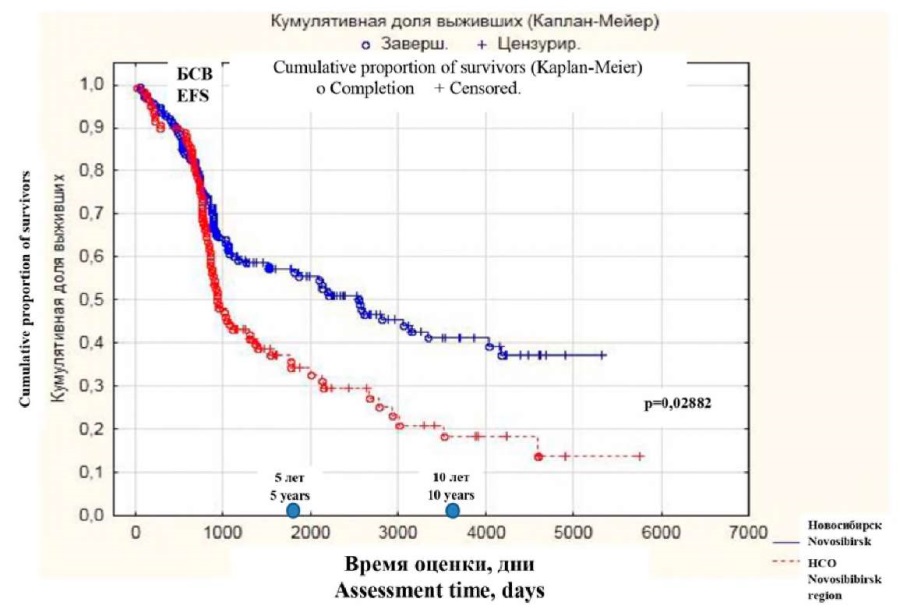
Рисунок 5. Сравнительный анализ 5-летней и прогнозируемой 10-летней БСВ в г. Новосибирске и НСО (кумулятивная доля выживших, %; p = 0,02882); 72 (21,62 %) из 333 наблюдений за больными, умершими не от прогрессирования ХМЛ, также считали законченным случаем
Figure 5. Comparative analysis of 5-year and predicted 10-year event-free survival in Novosibirsk and the Novosibirsk region (cumulative proportion of survivors, %; p = 0.02882); 72 (21.62 %) of 333 observations of patients who died not from progression of CML were also considered to be completed cases
Суммарно в Новосибирске и НСО за период с 2004 г. по 2020 г. умерли 72 (21,6 %) из 333 больных, доли умерших больных в городе и области существенно не отличались: в г. Новосибирске — 41 (21,35 %) из 192 больных и в НСО — 31 (22,0 %) из 141 больного. У 37 (51,4 %) из 72 умерших больных смерть была обусловлена опухолевой прогрессией ХМЛ на фоне развития вторичной резистентности к проводимой терапии, вероятно из-за плохой приверженности к терапии, частого нарушения больными рекомендаций гематолога и режима приема ИТК. У 20 (27,8 %) больных смерть наступила после достижения БМО из-за сопутствующей патологии: вторые опухоли — 3 больных (солидные опухоли молочной железы, толстого кишечника, простаты), патология сердечно-сосудистой системы — 12 больных, новая коронавирусная инфекция COVID-19 в 2020 г. — 5 больных. Только 15 (20,8 %) из 72 больных умерли в связи с опухолевой прогрессией ХМЛ при первичной резистентности к ИТК 1–2-й линий.
Обсуждение
Полученные в настоящей работе данные свидетельствуют о значительном увеличении распространенности ХМЛ. В 2013 г. распространенность в Новосибирске и НСО была выше, чем по данным Российского регистра ХМЛ (4,76 на 100 тыс. населения) [21], но соответствовала результатам международных исследований [22–24]. Это связано с рядом факторов: увеличением заболеваемости гемобластозом, совершенствованием диагностики, возможностью достижения путем современной таргетной терапии длительных стойких полных ответов: цитогенетической и молекулярной ремиссии, включая достижение ГМО, что позволяет добиться значительного повышения продолжительности и качества жизни больных.
Показатель заболеваемости в регионе за период 2018–2020 гг. на 72 % выше, чем в предыдущие годы, а также на 35 % выше результата, представленного в популяционном российском исследовании (0,7–0,8 на 100 тыс. населения в год) [21] и в других отечественных работах (0,82 на 100 тыс. населения в год в республике Башкортостан [25]), но соответствует исследованию, проведенному ранее в Алтайском крае [26] (1,02–1,24 на 100 тыс. населения в год) и результатам многих международных исследований (1–2 на 100 тыс. населения в год) [22–24][26]. Уровень заболеваемости в последние 3 года, значительно отличающийся от результатов предыдущих 14 лет и данных отечественной литературы, возможно, являются следствием совершенствования первичной диагностики хронических миелопролиферативных заболеваний участковыми врачами-терапевтами. Сотрудники кафедры терапии, гематологии и трансфузиологии ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России проводят регулярную работу с врачами первичного амбулаторного звена в НСО, в том числе обучающие мероприятия — семинарские занятия, лекции, круглые столы, разборы клинических случаев.
Несмотря на близкую численность населения г. Новосибирска и НСО (общая численность населения в г. Новосибирске в 2020 г. — 1 625 631 чел., в НСО — 1 172 539 чел. [27]) имеется большая разница между показателями распространенности ХМЛ в НСО и в г. Новосибирске, что можно объяснить несколькими причинами. Во-первых, лучшей экологической обстановкой в НСО по сравнению с крупным промышленным индустриальным областным центром. Во-вторых, лучшей доступностью гематологической помощи и диагностикой, диспансерным наблюдением за больными в г. Новосибирске по сравнению с НСО. Площадь территории НСО — 177,76 тыс. км2. Протяженность области с запада на восток — 642 км, с севера на юг — 444 км [28]. Основная гематологическая помощь сконцентрирована в г. Новосибирске, в регионах НСО нет врачей гематологов, в связи с чем за своевременную диагностику и качественное последующее наблюдение отвечает только участковая терапевтическая служба. В-третьих, существует естественная миграция жителей НСО с установленным диагнозом ХМЛ в г. Новосибирск, в связи с большей доступностью гематологической помощи в областном центре.
К сожалению, данных по результатам терапии ИТК для прямого сопоставления с данными из литературных источников не получено, но результаты терапии согласуются с данными, приведенными в исследованиях аналогичных российских и зарубежных клиник. В исследовании Голенкова А.К. и соавт. [29] ПГО достигнут у 93,2 % больных, БЦО — у 70,5 % больных. В работе Туркиной А.Г. и соавт. [30], посвященной оценке данных регистра больных ХМЛ в Российской Федерации, приведены данные, свидетельствующие о достижении БМО у 58 % больных, ГМО — у 25 % больных. По оценке данных Российской части международного многоцентрового популяционного исследования EUTOS, представленной Туркиной А.Г. и соавт. [23], ПЦО удалось получить у 93 % больных, БМО — у 65 %. В исследовании Alsobhi E. и соавт. [31] ПГО, ПЦО и БМО были достигнуты у 93,1, 83,2 и 61,4 % больных соответственно. В работе Nakamae H. и соавт. [32] ПЦО был получен у 87 % больных и БМО — у 74 %. В литературе имеются также сведения о результатах лечения ХМЛ в педиатрической популяции больных. В исследовании Smeding C. и соавт [33] ПГО получен у 100 % больных, ПЦО — у 92,8 % и БМО — у 64,3 %.
Полученные в регионе результаты ОВ существенно не отличаются от работ других авторов [34]. В работе Абдулкадырова К.М. и соавт. [35] отмечено, что 5-летняя ОВ больных при терапии иматинибом была 86,4 %, 10-летняя ОВ — 67,5 %. По данным Немецкой рабочей группы по изучению ХМЛ, 5-летняя ОВ при терапии иматинибом составила 90 %, а 10-летняя ОВ — 84 % [36].
В то же время в регионе остается и целый ряд нерешенных проблем: недостаточный контроль за больными, живущими в НСО, со стороны участковых терапевтов первичного амбулаторного звена; в ряде случаев низкая приверженность больных к лечению; отсутствие должного контроля за приемом лекарственных препаратов. Это приводит к снижению эффективности проводимой терапии, повышению частоты вторичной резистентности к ИТК 1-й линии, повышению потребности в назначении ИТК 2-й линии. Перечисленные факторы приводят к значительно худшим результатам достижения БМО в НСО по сравнению с г. Новосибирском.
При анализе причин неудачи лечения в г. Новосибирске установлено, что у 35 (77,8 %) из 45 больных имелась первичная резистентность к иматинибу, а у 10 (22,2 %) — устойчивость носила вторичный характер. По результатам проведенного анализа приверженности больных к терапии выявлено, что все больные, у которых возникла вторичная резистентность к иматинибу, и половина больных с первичной резистентностью (суммарно 27 (60 %) из 45 больных) не соблюдали рекомендуемую дозировку и режим приема иматиниба, что сказалось на эффективности лечения. Известно, что на снижение эффективности лечения влияет и наличие различных мутаций гена BCR::ABL [37]. Однако среди обследованных в настоящем исследовании данные мутации выявлены только у 3 (6,6 %) из 45 больных.
В НСО из всех больных с неудачей терапии препаратами ИТК 1-й линии первично-резистентными являлись 19 (31,1 %) больных, а вторичная резистентность наблюдалась у 42 (68,9 %) больных. Таким образом, в НСО, по сравнению с г. Новосибирском, значительно преобладала именно вторичная резистентность к лечению, что можно объяснить географическими особенностями и проблемами маршрутизации и наблюдения больных в НСО, которые косвенно могут оказывать влияние на итоговые результаты терапии.
Все больные, состоящие на диспансерном учете, наблюдаются у гематолога в поликлиническом отделении областной клинической больницы г. Новосибирска, в районах НСО гематологов нет. Удаленность районов НСО, а также недооценка участковыми терапевтами состояния больных, значения своевременного обеспечения таргетными препаратами, важности своевременного обследования приводят к ухудшению диагностики, контроля за терапией и результатами лечения.
В 2020 г. значительную роль в снижении результатов сыграла пандемия COVID-19, так как доступ больных из диспансерных групп к медицинской помощи первичного амбулаторного звена был существенно ограничен.
Кроме того, в НСО имеется еще одна серьезная проблема — это низкая комплаентность больных. Низкая приверженность больных к лечению является одним из важных факторов неудачи терапии и развития вторичной резистентности [38].
Диспансерное наблюдение и лечение больных ХМЛ необходимо проводить, строго следуя российским клиническим рекомендациям по диагностике и терапии ХМЛ [39]. Кроме того, необходимо следовать рекомендациям European LeukemiaNet [40], т. к. они суммируют опыт мировых лидеров по изучению и терапии ХМЛ и данные доказательной медицины. При этом более чем у половины больных первичная и вторичная резистентность к проводимой терапии ИТК 1-го и 2-го поколения, прогрессия ХМЛ в ФА и БК развиваются на фоне плохой приверженности больных к лечению. Огромную роль играет и хорошая доступность специализированной гематологической помощи, продуманная маршрутизация больных с гемобластозами, качественный диспансерный учет больных, приверженность больных к лечению и соблюдение рекомендаций гематолога.
Список литературы
1. Bower H., Björkholm M., Dickman P.W., et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol. 2016; 34(24): 2851–7. DOI: 10.1200/JCO.2015.66.2866.
2. Hehlmann R., Lauseker M., Saußele S., et al. Assessment of imatinib as first-line treatment of chronic myeloid leukemia: 10-year survival results of the randomized CML study IV and impact of non-CML determinants. Leukemia. 2017; 31(11): 2398–406. DOI: 10.1038/leu.2017.253.
3. Sasaki K., Strom S.S., O’Brien S., et al. Relative survival in patients with chronic-phase chronic myeloid leukaemia in the tyrosine-kinase inhibitor era: Analysis of patient data from six prospective clinical trials. Lancet Haematol. 2015; 2(5): e186–93. DOI: 10.1016/S2352-3026(15)00048-4.
4. Thielen N., Visser O., Ossenkoppele G., Janssen J. Chronic myeloid leukemia in the Netherlands: A population-based study on incidence, treatment, and survival in 3585 patients from 1989 to 2012. Eur J Haematol. 2016; 97(2): 145–54. DOI: 10.1111/ejh.12695.
5. Welch H.G., Kramer B.S., Black W.C. Epidemiologic signatures in cancer. N Engl J Med. 2019; 381(14): 1378–86. DOI: 10.1056/NEJMsr1905447.
6. Hochhaus A., Baccarani M., Silver R.T., et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966–84. DOI: 10.1038/s41375-020-0776-2.
7. Malhotra H., Radich J., Garcia-Gonzalez P. Meeting the needs of CML patients in resource-poor countries. Hematol Am Soc Hematol Educ Program. 2019; 2019(1): 433–42. DOI: 10.1182/hematology.2019000050.
8. Pfirrmann M., Baccarani M., Saussele S., et al. Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia. Leukemia. 2016; 30(1): 48–56. DOI: 10.1038/leu.2015.261.
9. Pfirrmann M, Clark RE, Prejzner W, et al. The EUTOS long-term survival (ELTS) score is superior to the Sokal score for predicting survival in chronic myeloid leukemia. Leukemia. 2020; 34(8): 2138–49. DOI: 10.1038/s41375-020-0931-9.
10. Sokal J.E., Cox E.B., Baccarani M., et al. Prognostic discrimination in “good-risk” chronic granulocytic leukemia. Blood. 1984; 63(4): 789–99. DOI: 10.1182/blood.V63.4.789.789.
11. Hasford J., Baccarani M., Hoffmann V., et al. Predicting complete cytogenetic response and subsequent progression-free survival in 2060 patients with CML on imatinib treatment: The EUTOS score. Blood. 2011; 118(3): 686–92. DOI: 10.1182/blood-2010-12-319038.
12. Абдулкадыров К.М., Абдуллаев А.О., Авдеева Л.Б. и др. Федеральные клинические рекомендации по диагностике и терапии хронического миелолейкоза. Вестник гематологии. 2013; 9(3): 4–41.
13. Абдулкадыров К.М., Туркина А.Г., Зарицкий А.Ю. и др. Клинические рекомендации по диагностике и лечению хронического миелолейкоза. Вторая редакция на основании консенсуса специалистов от 5 ноября 2014 г. URL: https://blood.ru/documents/clinical%20guidelines/01.%20rekomendacii-xml_2015.pdf.
14. Туркина А.Г., Зарицкий А.Ю., Шуваев В.А. и др. Клинические рекомендации по диагностике и лечению хронического миелолейкоза. Клиническая онкогематология. 2017; 10(3): 294–316. DOI: 10.21320/2500-2139-2017-10-3-294-316.
15. Туркина А.Г., Зарицкий А.Ю., Шуваев В.А. и др. Клинические рекомендации по диагностике и лечению хронического миелолейкоза, 4-я ред., 2018. URL: https://npngo.ru/uploads/media_document/278/f173f164-2927-4bfd-85cf-45fda23453fb.pdf.
16. Туркина А.Г., Хорошко Н.Д., Дружкова Г.А. и др. Практические рекомендации по лечению больных хроническим миелолейкозом. М. – Тверь: Триада; 2005.
17. Baccarani M., Saglio G., Goldman J., et al. Evolving concepts in the management of chronic myeloid leukemia: Recommendations from an expert panel on behalf of the European LeukemiaNet. Blood. 2006; 108(6): 1809–20. DOI: 10.1182/blood-2006-02-005686.
18. Baccarani M., Cortes J., Pane F., et al. Chronic myeloid leukemia: An update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol. 2009; 27(35): 6041–51. DOI: 10.1200/JCO.2009.25.0779.
19. Baccarani M., Deininger M.W., Rosti G., et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia. Blood. 2013; 122(6): 872–84. DOI: 10.1182/blood-2013-05-501569.
20. Аксенова Е.В., Крутов А.А., Солдатова И.Н. и др. Стандартизация молекулярной диагностики хронического миелолейкоза. Клиническая онкогематология. 2010; 3(2): 160–5.
21. Куликов С.М., Виноградова О.Ю., Челышева Е.Ю. и др. Заболеваемость хроническим миелолейкозом в 6 регионах России по данным популяционного исследования 2009–2012 гг. Терапевтический архив. 2014; 86(7): 24–30.
22. Лазарева О.В., Туркина А.Г., Челышева Е.Ю. и др. Клиническая и гематологическая характеристика больных хроническим миелолейкозом в современных условиях: результаты российской части международного многоцентрового проспективного популяционного исследования EUTOS Population-based CML Study. Клиническая онкогематология. 2017; 10(1): 65–74. DOI: 10.21320/2500-2139-2017-10-1-65-74.
23. Туркина А.Г., Лазарева О.В., Челышева Е.Ю. и др. Результаты терапии больных хроническим миелолейкозом по данным российской части международного многоцентрового популяционного исследования EUTOS Population-Based Study (EUTOS-PBS). Гематология и трансфузиология. 2019; 64(2): 106–21. DOI: 10.35754/0234-5730-2019-64-2-106-121.
24. Hoffmann V.S., Baccarani M., Hasford J., et al. The EUTOS population-based registry: incidence and clinical characteristics of 2904 CML patients in 20 European countries. Leukemia. 2015; 29(6): 1336–43. DOI: 10.1038/leu.2015.73.
25. Рябчикова Н.Р., Сафуанова Г.Ш., Бакиров А.Б., Никуличева В.И. Эпидемиология хронического миелолейкоза в Республике Башкортостан и организация терапии. Медицинский вестник Башкортостана. 2017; 12(69): 141–5.
26. Ефремова О.В., Мамаев А.Н., Елыкомов В.А. Особенности заболеваемости хроническим миелолейкозом в Алтайском крае. Сибирский научный медицинский журнал. 2019; 39(2): 99–103. DOI: 10.15372/ssmj20190214.
27. Численность населения Российской Федерации по муниципальным образованиям на 1 января 2020 года. Федеральная служба государственной статистики. Информационно-аналитические материалы. URL: https://rosstat.gov.ru/compendium/document/13282.
28. Территория и административно-территориальное деление субъектов Российской Федерации. Российский статистический ежегодник. 2010. URL: https://www.gks.ru/bgd/regl/b09_13/IssWWW.exe/Stg/html1/02-01.htm.
29. Голенков А.К., Высоцкая Л.Л., Трифонова Е.В. и др. Эффективность лечения больных хроническим миелолейкозом иматинибом в широкой клинической практике. Онкогематология. 2012; 7(3): 17–22.
30. Туркина А.Г., Новицкая Н.В., Голенков А.К. и др. Регистр больных хроническим миелолейкозом в Российской Федерации: от наблюдательного исследования к оценке эффективности терапии в клинической практике. Клиническая онкогематология. 2017; 10(3): 390–401. DOI: 10.21320/2500-2139-2017-10-3-390-401.
31. Alsobhi E., Abrar M.B., Abdelaal M., et al. Response to imatinib therapy in adult patients with chronic myeloid leukemia in Saudi population: A single-center study. Leuk Lymphoma. 2015; 56(4): 882–6. DOI: 10.3109/10428194.2014.935365.
32. Nakamae H., Fujisawa S., Ogura M., et al. Dasatinib versus imatinib in Japanese patients with newly diagnosed chronic phase chronic myeloid leukemia: A subanalysis of the DASISION 5-year final report. Int J Hematol. 2017; 105(6): 792–804. DOI: 10.1007/s12185-017-2208-2.
33. Smeding C., Szydło A., Pieluszczak K., et al. Efficacy and safety of imatinib in paediatric CML — a single centre study. In Vivo. 2019; 33(3): 869–75. DOI: 10.21873/invivo.11552.
34. Туркина А.Г., Хельманн Р., Поспелова Т.И. и др. Практические аспекты терапии хронического миелолейкоза в хронической фазе (по материалам выступлений на Конгрессе гематологов. Москва, 3 июля 2012 г.). Онкогематология. 2012; 7(3): 8–17.
35. Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. и др. Хронический миелолейкоз: многолетний опыт таргетной терапии. Клиническая онкогематология. 2016; 9(1): 54–60.
36. Hehlmann R., Saußele S. Current best options for first line treatment of chronic phase chronic myeloid leukemia. Клиническая онкогематология. 2014; 7(1): 9–15.
37. Челышева Е.Ю., Шухов О.А., Лазарева О.В., Туркина А.Г. Мутации киназного домена гена BCR::ABL при хроническом миелолейкозе. Клиническая онкогематология. 2012; 5(1): 13–21.
38. Hehlmann R. Innovation in hematology. Perspectives: CML 2016. Haematologica. 2016; 101(6): 657–9. DOI: 10.3324/haematol.2016.142877.
39. Аль-Ради Л.С., Виноградова О.Ю., Кузьмина Л.А. и др. Хронический миелоидный лейкоз. Клинические рекомендации. 2022. URL: https://npngo.ru/biblioteka/klinicheskie_rekomendatsii__2022_god_?page=2.
40. Hochhaus A., Baccarani M., Silver R.T., et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia. 2020; 34(4): 966–84. DOI: 10.1038/s41375-020-0776-2.
Об авторах
А. C. ЛямкинаРоссия
Анна Сергеевна Лямкина, кандидат медицинских наук, доцент, гематолог
кафедра терапии, гематологии и трансфузиологии ФПК и ППВ
630091
отделение гематологии
630051
Новосибирск
И. Н. Нечунаева
Россия
Ирина Николаевна Нечунаева, кандидат медицинских наук, заведующая
отделением
отделение гематологии
630051
Новосибирск
Е. В. Воронцова
Россия
Екатерина Валерьевна Воронцова, заведующая отделением
отделение гематологии
630087
Новосибирск
С. А. Таирова
Россия
София Александровна Таирова, цитогенетик
630051
Новосибирск
Т. Н. Александрова
Россия
Туйара Никоновна Александрова, аспирант
кафедра терапии, гематологии и трансфузиологии ФПК и ППВ
630091
Новосибирск
О. В. Науменко
Россия
Олеся Владимировна Науменко, заместитель главного врача по организационному развитию и внебольничной помощи, начальник службы
служба консультативно-диагностической поликлиники
630087
Новосибирск
Т. И. Поспелова
Россия
Татьяна Ивановна Поспелова, доктор медицинских наук, профессор, проректор по научной работе, заведующая кафедрой, руководитель центра
630091
кафедра терапии, гематологии и трансфузиологии ФПК и ППВ
630051
городской гематологический центр
Новосибирск
Рецензия
Для цитирования:
Лямкина А.C., Нечунаева И.Н., Воронцова Е.В., Таирова С.А., Александрова Т.Н., Науменко О.В., Поспелова Т.И. Сравнение заболеваемости и результатов лечения хронического миелолейкоза в Новосибирске и Новосибирской области. Гематология и трансфузиология. 2023;68(1):35-49. https://doi.org/10.35754/0234-5730-2023-68-1-35-49
For citation:
Lyamkina A.S., Nechunaeva I.N., Vorontsova E.V., Tairova S.A., Alexandrova T.N., Naumenko O.V., Pospelova T.I. Comparison of morbidity and results of chronic myeloid leukemia treatment in Novosibirsk and the Novosibirsk region. Russian journal of hematology and transfusiology. 2023;68(1):35-49. (In Russ.) https://doi.org/10.35754/0234-5730-2023-68-1-35-49











































